达芬奇机器人手术系统应用于1142例宫颈癌患者的肿瘤结局分析
2023-06-22吕小慧,翟梁好,董健,周福兴,荆茹,陈必良
吕小慧,翟梁好,董健,周福兴,荆茹,陈必良

编者按 宫颈癌是女性中最常见的恶性肿瘤之一,严重威胁患者身心健康。随着发病趋势年轻化,患者保留生育功能的需求越发迫切。这要求术者在根除病变部位的基础上,最大程度保留患者子宫及血供,对手术精度提出了更高的要求。机器人手术系统具有精确性更高、临床操控性更好、术野更清晰等优势,更利于在狭窄解剖空间内进行精密操作,能够达到较为理想的手术治疗效果。然而2018年两项高级别研究结果显示,对于早期宫颈癌患者,开腹手术相较于微创手术拥有更高的无病生存率和总生存率,其后各国的多项研究均得到了相似的结果。NCCN、ESGO等各项指南随之更新,一致推荐将开腹手术作为早期宫颈癌的标准术式。这引发了学术界的激烈讨论,并为机器人辅助手术的发展提出挑战。
达芬奇手术机器人拥有目前最先进的机器人手术系统,一经批准就被广泛应用于妇科良恶性疾病手术治疗中,稳定度高,手术创伤小,可有效减少术中出血量、缩短住院时间、减轻术后疼痛、减少并发症、增加美容效果,使患者更快恢复日常生活。因此,机器人辅助手术等微创手术所带来的益处是不容忽视的,我们不应全盘否认微创手术,而应探究这一现象背后的深层原因,改进相应措施,细化手术入路,寻找适合的适应证。故本刊邀请知名妇科机器人辅助手术专家陈必良教授作为专栏主编,同时邀请国内多家知名三甲医院妇科肿瘤专家共同策划并开设1~2期“机器人辅助腹腔镜下宫颈癌手术专栏”,旨在通过多中心的病例及文献回顾,对不同术式治疗早期宫颈癌的安全性、可行性及临床价值进行探讨,分析影响术后并发症发生的危险因素及影响癌症生存期的可能因素,并思考膜解剖理念和无瘤原则在机器人辅助手术中的应用,希望为广大妇科同仁对宫颈癌的临床研究与实践提供参考,为微创手术的发展寻找出路。
摘 要 目的:探讨达芬奇机器人手术系统应用于宫颈癌患者手术治疗后对其肿瘤结局的影响。方法:选取2013年3月—2018年3月在空军军医大学西京医院妇产科行达芬奇机器人辅助腹腔镜下宫颈癌根治术的1142例患者临床资料。回顾性分析临床病理资料、术后辅助治疗、复发率,并用Kaplan-Meier计算患者的无病生存期(Disease-free Survival,DFS)及总生存期(Overall Survival,OS)。結果:本研究共纳入1142例患者,早期患者(ⅠA2~ⅠB1期)691例,晚期患者(ⅠB2~ⅡB期)451例,中位随访时间70.9个月,失访72例(6.30%),随访率为93.70%。早期患者中,复发78例(11.29%),死亡59例(8.54%),3年OS 96.7%,DFS 93.2%;5年OS 95.3%,DFS 91.9%。晚期患者中,复发135例(29.93%),死亡120例(26.61%),3年OS 85.1%,DFS 79.2%;5年OS 82.3%,DFS 77.2%。结论:本次单中心、回顾性研究结果表明,达芬奇机器人手术系统可有选择性地应用于早期宫颈癌患者,但需要改善手术相关措施,进一步评估其对肿瘤结局的影响。
关键词 宫颈癌;广泛性全子宫切除术;机器人手术系统;微创手术
中图分类号 R737.33 文献标识码 A 文章编号 2096-7721(2023)05-0389-08
Oncology outcomes of Da Vinci robot-assisted radical hysterectomy for 1142 cases of cervical cancer
LYU Xiaohui, ZHAI Lianghao, DONG Jian, ZHOU Fuxing, JING Ru, CHEN Biliang
(Department of Obstetrics and Gynecology, Xijing Hospital, Air Force Medical University, Xian 710032, China)
Abstract Objective: To investigate the clinical efficacy of Da Vinci robotic surgical system in treating patients with cervical cancer. Methods: The clinical data of patients who underwent Da Vinci robot-assisted radical hysterectomy in Xijing Hospital of Air Force Military Medical University from March 2013 to March 2018 were selected. The pathological data, postoperative adjuvant therapy and recurrence rate were analyzed retrospectively. The disease-free survival (DFS) and overall survival (OS) of patients were calculated by Kaplan-Meier. Results: A total of 1142 patients were selected into this study, including 691 patients in early stage
(ⅠA2-ⅠB1) and 451 patients in advanced stage (ⅠB2-ⅡB). The median follow-up time was 70.9 months, and 72 patients (6.30%) were
lost to follow-up, with a follow-up rate of 93.70%. In early stage of cervical cancer, 78 cases (11.29%) relapsed, 59 cases (8.54%) died with the 3-year OS of 96.7%, 3-year DFS of 93.2%, 5-year OS of 95.3%, and 5-year DFS of 91.9%. Among the patients with advanced cervical cancer, 135 cases (29.93%) relapsed, 120 cases (26.61%) died, with the 3-year OS of 85.1%, 3-year DFS of 79.2%, 5-year OS of 82.3%, and 5-year DFS of 77.2%. Conclusion: This single-center, retrospective observational study found that the Da Vinci robotic surgical system could be selectively applied to early cervical cancer. However, its effect on the outcome of cervical cancer should be further evaluated by improving surgical measures.
Key words Cervical cancer; Radical hysterectomy; Robotic surgical system; Minimally invasive surgery
广泛性全子宫切除术是治疗早期宫颈癌的主要方式,5年无病生存率超过90%[1]。近25年来,传统腹腔镜和机器人辅助微创手术作为早期宫颈癌的标准治疗方法,在临床获得了广泛认可[2]。但是,2018 年《新英格兰医学杂志》(NEJM)同期刊出 2 篇重磅研究,研究表明腹腔镜(包括机器人辅助手术)宫颈癌根治术后复发率高于开腹手术,其无病生存期(Disease-free Survival,DFS)、总生存期(Overall Survival,OS)短于开腹手术[3-4]。那么宫颈癌的微创治疗尤其是机器人辅助腹腔镜下宫颈癌根治术该何去何从?笔者总结本中心2013年3月—2018年3月行达芬奇机器人辅助腹腔镜下宫颈癌根治术的1142例患者的临床病例资料及复发、生存情况,进而对机器人辅助宫颈癌根治术的安全性、可行性及临床应用价值进行探讨。
1 资料与方法
1.1 一般资料
回顾性分析2013年3月—2018年3月空军军医大学西京医院妇产科收治的1142例行达芬奇机器人辅助腹腔镜下宫颈癌根治术的患者临床病例资料,年龄20~75岁,平均45岁。临床分期按FIGO(2009版)分期,早期宫颈癌(ⅠA2~ⅠB1期)患者691例,局部晚期宫颈癌(ⅠB2~ⅡB期)患者451例,均通过病理检查确诊,病例资料完整。
1.2 手术方法
1142例宫颈癌根治术均在达芬奇机器人Si手术系统辅助下完成,术者均为高级职称,腹腔镜操作经验丰富,并已获得达芬奇机器人手术系统操作资格证。完善术前准备。手术方法:患者取膀胱截石位,常规消毒铺巾,采用气管插管全身麻醉,头低足高倾斜30°,建立气腹,压力维持在11~13 mmHg(1 mmHg=0.133 kPa)。
再次消毒阴道,进行举宫操作。镜孔位置:脐上4横指左旁开2 cm,横切口约12 mm,置入Trocar及机器人腹腔镜,于进镜孔两侧角15°并距离进镜孔左侧8 cm、右侧12 cm处各开2个8 mm穿刺孔,推机器人机车至患者两腿之间或患者侧方连接机器人2号臂和1号臂,于1号臂穿刺孔的上、下方各打1个5 mm和12 mm的辅助孔,顺利进腹后进行广泛性全子宫+双附件切除/输卵管切除(保留卵巢)+盆腔伴成不伴腹主动脉旁淋巴结清扫术。从圆韧带下方弧形打开侧盆壁腹膜、腹主动脉表面腹膜,充分暴露侧盆壁、髂外动静脉、腹主动脉及下腔静脉,依次从腹股沟深动脉、髂外动脉、髂内动脉、闭孔动脉、髂总动脉、骶前动脉、腹主动脉旁等区域各清扫1组淋巴结,置入标本袋。接着处理骨盆漏斗韧带,下推膀胱及膀胱角,游离输尿管、切断子宫动脉、暴露宫旁组织,打开输尿管隧道。进一步下推膀胱,彻底解剖、游离子宫骶主韧带、宫旁组织及阴道旁组织,于子宫颈外口下合适水平处切除子宫,连续缝合阴道残端,蒸馏水冲洗盆腔,留置盆腔引流管,全层缝合腹部切口,手术结束。
1.3 观察指标
主要观察指标为DFS、OS以及复发率。次要观察指标包括患者围手术期指标,如临床分期、手术时间、术中出血量、住院时间。术后病理结果包括宫颈浸润深度、脉管转移、淋巴转移、术后是否行辅助放化疗等情况。
1.4 统计学方法
本研究通过SPSS 20.0软件对所有数据进行分析。计量资料以均数±标准差(x±s)表示,计数资料采用频数和百分比表示。用Kaplan-Meier计算患者的DFS及OS。
2 结果
2.1 患者临床资料及围手术期资料
共纳入1142例宫颈癌患者,年龄(47.85±9.79)岁,BMI(18.4±9.72)kg/m2,临床分期采用FIGO(2009版),其中ⅠA2~ⅠB1期691例,ⅠB2~ⅡB期451例,所有手术均采用达芬奇机器人手术系统顺利完成,无一例中转开腹,手术时间、术中出血量、住院时间等详细资料见表1。
2.2 术后病理及辅助治疗资料
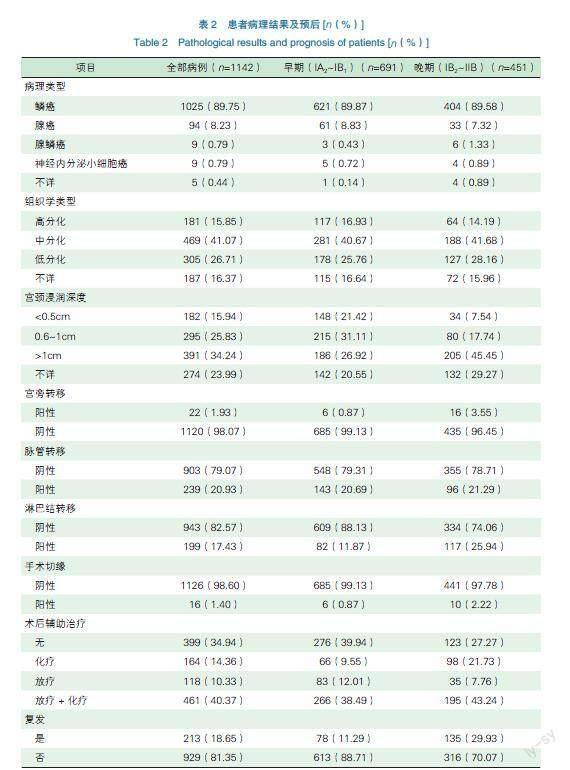
患者病理类型以鳞状细胞癌为主,共1025例(89.75%),另有腺癌94例(8.23%)、腺鳞癌9例(0.79%)、神经内分泌小细胞癌9例(0.79%)、不详5例(0.44%)。病理组织学分级分别为:高分化181例(15.85%),中分化469例(41.07%),低分化305例(26.71%),不详187例(16.37%)。病理高危因素如淋巴结转移、宫颈浸润深度、脉管转移、切缘阳性等具体资料见表2。
2.3 肿瘤结局
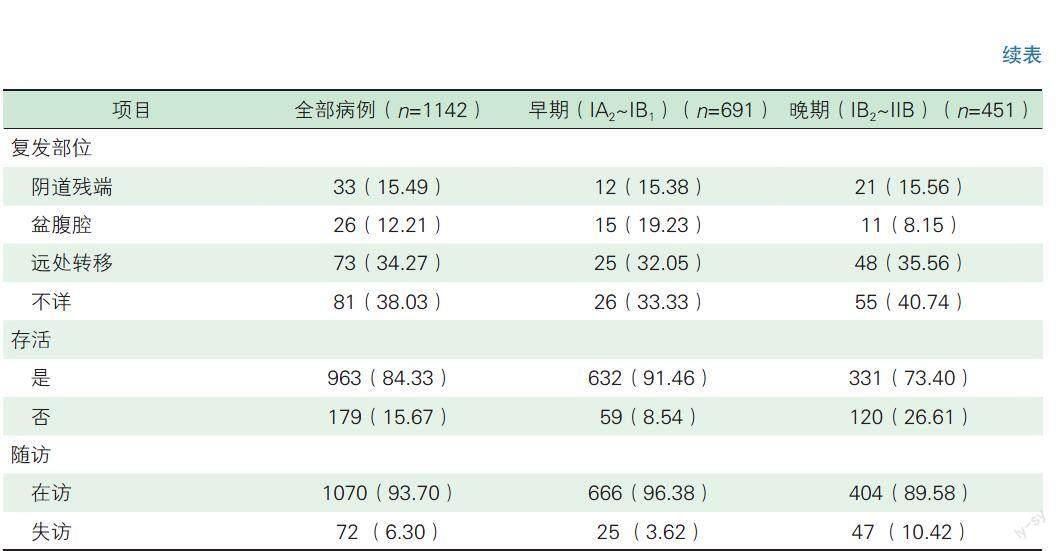
随访时间40~105个月,中位随访时间70.9个月,失访72例。全部病例1142例,复发213例(18.65%),死亡179例(15.67%),生存患者占90%。早期宫颈癌患者(ⅠA2~ⅠB1期)中,复发78例(11.29%),死亡59例(8.54%),3年OS 96.7%,DFS 93.2%;5年OS 95.3%,DFS 91.9%(如图1)。晚期宫颈癌患者(ⅠB2~ⅡB期)中,复发135例(29.93%),死亡120例(26.61%),3年OS 85.1%,DFS 79.2%;5年OS 82.3%,DFS 77.2%(如图2)。
3 讨论
宫颈癌是致死率居第2位的妇科恶性肿瘤,严重威胁妇女健康。根治性全子宫切除术是早期宫颈癌的主要治疗方式,5年无病生存率超过90%[1]。一个多世纪以来,根治性子宫切除术主要通过开腹手术进行[5-6]。1992 年,国外已引入腹腔镜根治性子宫切除术[7]。近十年,机器人手术因其独特优势,如高清三维视野、360°可转腕操作臂、人手除颤系统和人工力学设计等可以降低手术操作过程中非技术性失误发生的概率,更有利于医生在盆腔这种狭窄解剖空间内进行手术操作,目前已在宫颈癌根治术中得到广泛应用[8]。本中心于2012年12月31日引进中国西北地区首台达芬奇机器人手术系统,至今已完成机器人辅助妇科手术近3000例[9-10],其中2013年3月—2018年3月行机器人辅助宫颈癌根治术1142例。正如陈必良教授所言:“达芬奇机器人手术系统让我重新认识了盆腔解剖”。2018年前,NCCN指南及欧洲妇科肿瘤学会均推薦早期宫颈癌(ⅠA2~ⅡA)的标准治疗手术是开腹或微创根治性子宫切除术,手术路径选择开腹或微创(传统腹腔镜或机器人辅助腹腔镜)[11-12]。相关回顾性研究表明,机器人辅助根治性子宫切除术较开腹手术围手术期并发症的发生率明显降低,且复发率和生存率无显著差异[13-14]。但是,宫颈癌手术治疗路径的选择对肿瘤结局的影响仍缺乏足够有力的、高质量的前瞻性随机对照研究。
美国安德森癌症中心就不同的手术路径方式对早期宫颈癌肿瘤预后的影响进行了非常严谨的系列研究。首先,Melamed A等人[3]对2000 —2010年美国公共数据库中行宫颈癌根治术患者的流行病学资料进行中断时间序列分析,发现在2006年以后宫颈癌患者的相对生存率以每年0.8%的比率下降,而美国正是于2006年开始采用腹腔镜宫颈癌根治术。随后,该团队选取2010—2013年宫颈癌ⅠA2~ⅠB1期2461例患者病例资料进行回顾性队列研究,结果显示微创组(机器人手术占79.8%)4年死亡率为9.1%,相较開腹组4年死亡率5.3%,生存期缩短。此外,Ramirez P T等人[4]选取2008—2017年宫颈癌ⅠA1~ⅠB1期的631例患者病例资料进行前瞻性随机对照研究,即著名的LACC(Laparoscopic Approach to Cervical Cancer)试验,全球共有33个中心参加,原计划纳入740例患者,但因患者临床数据与安全委员会监测到的两组间死亡率不平衡,该研究被提前叫停。结果显示,微创组(机器人手术占15.6%)4.5年DFS为86%,开腹组DFS 96.5%,微创组与高复发、高死亡风险相关。2018年,上述研究在《新英格兰医学杂志》上同期重磅刊出,引起国内外妇瘤界的震动。因参加临床试验的人群只占到5%,而且像LACC这样的随机对照研究不能完全概括临床中常规患者的治疗,所以观察性研究虽然有偏倚,但更接近于临床事实,能在评估干预措施的有效性方面发挥重要作用。2020年,安德森癌症中心Ramirez P T和Melamed A团队纳入15项研究共9499例宫颈癌ⅠA2~ⅡA期患者,进行了一项高质量非随机队列研究的系统回顾性分析与Meta分析[15],以评估现有的临床事实。研究显示,微创组(机器人手术占57%)较开腹组死亡风险高56%,该结论与LACC一致,但该研究中微创组与死亡风险之间的相关性较LACC研究结果明显降低。国内学者也发出了中国之声,2020年,妇瘤界权威教授陈必良、陈春林等人选取2004—2016年宫颈癌ⅠA~ⅡA期患者10 314例进行多中心、回顾性队列研究,经过配对分层分析发现,对于宫颈癌ⅠA1期(脉管侵犯)患者,机器人组较开腹组3年肿瘤结局较差;对于宫颈癌ⅠB1期病灶大小<2 cm患者,两组3年肿瘤结局无差异。2020年由郎景和、陈春林教授牵头的中国妇瘤专家共同制定的《子宫颈癌腹腔镜手术治疗的中国专家共识》明确指出,在中国,腹腔镜手术适用于FIGO(2009版)分期为ⅠB1期且肿瘤直径≤2 cm的宫颈癌患者[16-18]。
因此,对于符合此纳入标准的病例,仍可选择达芬奇机器人手术系统进行治疗。
本研究为一项单中心、回顾性观察研究,对2013年3月—2018年4月(LACC发表之前)达芬奇机器人手术系统进行的所有期别宫颈癌患者的肿瘤结局进行了分析。国际抗癌联盟(UICC)要求恶性肿瘤随访率达到90%以上,本组患者随访率为93.7%,临床病理及预后资料齐全,期望为后续宫颈癌微创研究提供参考价值。本研究结果中,早期宫颈癌3年OS 96.7%,DFS 93.2%;5年OS 95.3%,DFS 91.9%。3年OS和DFS均高于LACC中的微创组(96.7% Vs 93.8%;93.2% Vs 91.2%),但均低于LACC研究中的开腹组。本组患者中晚期宫颈癌(ⅠB2~ⅡB期)患者3年OS 85.1%,DFS 79.2%;5年OS 82.3%,DFS 77.2%,均高于文献报道的生存时间,文献中不管是新辅助化疗后手术,还是同步放化疗,5年OS仅为65%~70%,复发率达40%[19],本研究中宫颈癌晚期患者复发率为29.93%(135/451)。本研究中,早期和局部晚期患者均行机器人微创手术,生存情况明显高于其他研究,但患者术后需行辅助治疗的比例较其他研究明显升高(65% Vs 35%)[3-4],宫颈癌患者术后辅助治疗指征、方法等仍存在争议,需要进一步探讨。
对于LACC等高质量研究的结果,国内外专家学者的质疑之声已慢慢平息,更多的学者在寻找某些特例以寻求微创的出路[19]。笔者团队认为,关于宫颈癌患者手术对预后的影响,无论何种手术路径,更重要的是对于手术指征、手术范围、手术质量的把控。开腹手术对子宫有更大的牵引,骶主韧带切除范围更广,微创手术尤其是传统腹腔镜手术能达到的切除程度是有限的,微创组手术切缘距肿瘤较近的情况更多见,此外举宫器、CO2气腹也易引起肿瘤播散等。针对这些问题,本团队通过重视盆腔解剖和手术规范化,进行宫颈癌根治术的手术质控。同时,在进行免举宫、免缝式宫颈闭合器环扎阴道后离断/经阴道离断、蒸馏水冲洗盆腔等措施时遵守“无瘤原则”[20-22]。期待相关临床试验进一步证实这些措施能否降低微创手术的复发率。
综上所述,对于早期宫颈癌手术路径的选择,不同路径各有利弊,开腹手术无疑是正确的选择,但也不能彻底否定微创手术,尤其是机器人手术系统辅助下的微创手术,通过改进相应措施,亦可在复发病例的高危因素分析中逐步建立疾病评分系统,以细化手术路径的适应证。本研究为单中心、回顾性观察性研究,存在一定偏倚和局限性,仍需进一步回顾性及前瞻性临床对照试验来评估其安全性及肿瘤结局。
参考文献
[1] Sedlis A, Bundy B N, Rotman M Z, et al. A randomized trial of pelvic radiation therapy versus no further therapy in selected patients with stageⅠB carcinoma of the cervix after radical hysterectomy and pelvic lymphadenectomy: a gynecologic oncology group study[J]. Gynecol Oncol, 1999, 73(2): 177-183.
[2] Uppal S, Liu J R, Reynolds R K, et al. Trends and comparative effectiveness of inpatient radical hysterectomy for cervical cancer in the United States (2012-2015) [J]. Gynecol Oncol, 2019, 152(1): 133-138.
[3] Melamed A, Margul D J, Chen L, et al. Survival after minimally invasive radical hysterectomy for early-stage cervical cancer[J]. N Engl J Med, 2018, 379 (20): 1905-1914.
[4] Ramirez P T, Frumovitz M, Pareja R, et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer[J]. N Engl J Med, 2018, 379(20): 1895-1904.
[5] Clark J G. A more radical method of performing hysterectomy for cancer of the uterus[J]. Bull Johns Hopkins Hosp, 1895, 6: 120-124.
[6] Ries E. The operative treatment of cancer of the cervix uteri [J]. JAMA, 1906, XLVII(23): 1869-1872.
[7] Nezhat C R, Burrell M O, Nezhat F R, et al. Laparoscopic radical hysterectomy with paraaortic and pelvic node dissection[J]. Am J Obstet Gynecol, 1992, 166(3): 864-865.
[8] Sert M B, Abeler V. Robot-assisted laparoscopic radical hysterectomy: comparison with total laparoscopic hysterectomy and abdominal radical hysterectomy: one surgeons experience at the Norwegian Radium Hospital[J]. Gynecol Oncol, 2011, 121(3): 600-604.
[9] 呂艳红, 马向东, 刘淑娟, 等.机器人早期宫颈癌单中心经验与思考[J].中华腔镜外科杂志(电子版), 2019, 12(4) : 231-235.
[10] 吕小慧, 陈必良.达芬奇机器人手术系统在妇科手术中的应用[J]. 机器人外科学杂志(中英文), 2020, 1(1) : 57-60.
[11] Cibula D, P?tter R, Planchamp F, et al. The European society of gynaecological oncology/European society for radiotherapy and oncology/European society of pathology guidelines for the management of patients with cervical cancer[J]. Int J Gynecol Cancer, 2018, 28(4): 641-655.
[12] Benson A B, Venook A P, Al-Hawary M M, et al. Rectal Cancer, version 2. 2018, NCCN Clinical practice guidelines in oncology [J]. J Natl Compr Canc Netw, 2018, 16(7): 874-901.
[13] Cantrell L A, Mendivil A, Gehrig P A, et al. Survival outcomes for women undergoing type III robotic radical hysterectomy for cervical cancer: a 3-year experience[J]. Gynecol Oncol, 2010, 117(2): 260-265.
[14] Alfonzo E, Wallin E, Ekdahl L, et al. No survival difference between robotic and open radical hysterectomy for women with early-stage cervical cancer: results from a nationwide population-based cohort study[J]. Eur J Cancer, 2019. DOI: 10.1016/j.ejca.2019.05.016.
[15] Nitecki R, Ramirez P T, Frumovitz M, et al. Survival after minimally invasive vs open radical hysterectomy for early-Stage cervical cancer: a systematic review and Meta-analysis[J]. JAMA Oncol, 2020, 6(7): 1019-1027.
[16] CHEN B L, JI M, LI P F, et al. Comparison between robot-assisted radical hysterectomy and abdominal radical hysterectomy for cervical cancer: a multicentre retrospective study[J]. Gynecol Oncol, 2020, 157(2): 429-436.
[17] 陈春林, 郎景和. 中国专家“关于宫颈癌腹腔镜手术相关问题”的几点意见[J].中国实用妇科与产科杂志, 2019, 35(2): 188-193.
[18] 陈春林, 郎景和, 向阳, 等. 子宫颈癌腹腔镜手术治疗的中国专家共识[J].中华妇产科杂志, 2020, 55(9): 579-585.
[19] Gennigens C, Cuypere M D, Hermesse J, et al. Optimal treatment in locally advanced cervical cancer[J]. Expert Review of Anticancer Therapy, 2021, 21(6): 657-671.
[20] 刘佳琪, 李朋飞, 纪妹, 等. 基于中国子宫颈癌临床诊疗大数据的子宫颈癌诊疗规范化调查分析[J].中国实用妇科与产科杂志, 2021, 37(1): 82-86.
[21] 罗恒, 陈必良, 张若涵, 等. 免缝式宫颈闭合器的设计及其在宫颈癌手术中的应用[J]. 局解手术学杂志, 2021, 30(11): 943-946.
[22] 郭琳, 赵宏喜, 李艳红, 等.宫底悬吊免举宫技术辅助应用于早期宫颈癌达芬奇机器人系统手术效果[J]. 中国计划生育学杂志, 2021, 29(12): 2696-2699.
