仑伐替尼联合阿替利珠单抗序贯TACE治疗乙型肝炎合并晚期肝癌患者的效果评价
2023-06-21刘春华刘玲陶昌明贺玉凯聊城市人民医院感染科聊城5000聊城市中医医院肿瘤科聊城5000
刘春华 刘玲 陶昌明 贺玉凯聊城市人民医院感染科,聊城 5000;聊城市中医医院肿瘤科,聊城 5000
肝癌男性发病率高于女性,病死率较高[1]。据恶性肿瘤发生情况、死亡情况调查显示,在我国,肝癌发生率居恶性肿瘤第4 位,而病死率居第2 位,是威胁居民健康最严重的恶性肿瘤之一[2]。肝癌发病隐匿、进展迅速,70%的肝癌患者确诊时已进展至中晚期,丧失根治机会。目前,经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是晚期肝癌常用治疗术式,但在阻断肿瘤细胞血供的同时,也会增加肿瘤血管侧支循环形成风险[3]。仑伐替尼是小分子多激酶抑制剂,可通过多种机制抑制肿瘤血管生长而发挥抗肿瘤作用[4]。而阿替利珠单抗是程序性死亡受体1 及其配体抑制剂,通过增强肿瘤微环境免疫效应,达到治疗目的[5]。TACE、仑伐替尼、阿替利珠单抗是晚期肝癌主要治疗方式,其抗肿瘤机制不同,理论上三者联合能相互弥补不足,发挥协同抗瘤效果,起到减瘤增效作用。但关于三者联合尚缺乏循证医学证据的支持。本研究旨在从多方面分析三者联合治疗的应用优势,为患者治疗提供理论依据,现报道如下。
资料与方法
1.一般资料
本研究为随机对照试验。研究对象为聊城市人民医院2019年1月10日至2022年9月10日收治的乙型肝炎合并晚期肝癌患者96 例,按随机数字表法分为观察组和对照组,各48 例。两组年龄、性别、体质量指数、TNM 分期、乙型肝炎病程、肝硬化及饮酒史等基线资料比较差异均无统计学意义(均P>0.05)(表1)。
表1 两组乙型肝炎合并晚期肝癌患者基线资料比较(±s)

表1 两组乙型肝炎合并晚期肝癌患者基线资料比较(±s)
注:对照组给予常规经导管动脉化疗栓塞术(TACE)治疗,观察组给予仑伐替尼联合阿替利珠单抗序贯TACE治疗
组别例数年龄(岁,images/BZ_60_2026_1043_2050_1094.png±s)53.74±6.55(35~69)54.52±7.13(38~71)t=0.5580.578性别[例(%)]男28(58.33)25(52.08)χ2=0.3790.538女体质量指数(kg/m2,images/BZ_60_2026_1043_2050_1094.png±s)乙型肝炎病程(年,images/BZ_60_2026_1043_2050_1094.png±s)观察组48对照组统计值P值4820(41.67)23(47.92)23.27±1.55(19.5~26.8)23.58±1.49(20.3~27.2)t=0.9990.320 TNM分期[例(%)]Ⅲ期30(62.50)29(60.42)χ2=0.0440.834Ⅳ期18(37.50)19(39.58)12.87±1.72(9~17)13.35±1.59(10~18)t=1.4200.159组别肿瘤长径(cm,images/BZ_60_2026_1043_2050_1094.png±s)病理分化程度[例(%)]低分化11(22.92)12(25.00)u=0.3760.707结节数量[例(%)]单发22(45.83)21(42.75)χ2=0.0420.837中分化17(35.42)18(37.50)高分化20(41.67)18(37.50)否饮酒史[例(%)]观察组32(68.75)对照组统计值P值7.86±0.74(6.8~9.2)8.01±0.65(7.0~9.5)t=1.0550.294多发26(54.17)27(56.25)肝硬化[例(%)]是32(66.67)35(72.92)χ2=0.4450.50516(33.33)13(27.08)35(77.08)χ2=0.8440.358
本研究经聊城市人民医院伦理委员会审批通过(2020010);该研究符合《赫尔辛基宣言》[6]中人体医学实验相关伦理原则,患者及家属签署知情同意书。
2.诊断标准
肝癌参照《原发性肝癌诊疗规范(2017年版)》[7]中相关诊断,且经临床症状及体征结合影像检查、实验室检查确诊;临床症状:食欲减退、黄疸、上消化道出血、肝性脑病;体征:肝脏肿大、血管杂音、门静脉高压等;实验室检查:甲胎蛋白水平显著升高;影像检查:明确病灶占位。
3.选择标准
(1)纳入标准:符合上述原发性肝癌诊断标准,并经病理检查确认癌细胞分化程度;TNM 分期为Ⅲ~Ⅳ期;生存期>6 个月;符合TACE 治疗指征;参与本研究前未接受其他相关治疗。(2)排除标准:弥漫性肝癌;癌细胞出现肝外转移;生存期≥6个月;严重心肝肾功能障碍;肝部既往手术史;本研究相关药物过敏;合并其他恶性肿瘤。
4.方法
(1)术前准备:①与患者沟通,消除患者焦虑情绪;②术前检查:肝脏磁共振成像(MRI)或CT、胸片检查、心电图、胸片检查、血常规、凝血功能、电解质水平、肿瘤标志物、肝肾功能等;③术前禁食禁水,持续监测心电,建立静脉输液通道;④预防性使用格拉司琼及地塞米松。(2)对照组给予常规TACE 治疗,具体操作严格依从《中国肝细胞癌经动脉化疗栓塞治疗(TACE)临床实践指南》[8],患者平卧,利多卡因(四川国瑞药业有限责任公司,规格:10 ml∶0.2 g,国药准字H20055048)实施局部麻醉,常规铺巾消毒;X 射线明确肿瘤血管及供血动脉,Seldinger 技术进行肝动脉穿刺,穿刺成功置入导管鞘,注入适量肝素盐水预防血栓;导丝引导下置入导管进行肝动脉造影,明确肿瘤位置;经导管注入吡柔比星(瀚晖制药有限公司,规格:10 mg,国药准字H20045983)20 mg/m2、顺铂(齐鲁制药有限公司,规格:30 mg,国药准字H37021356)30 mg/m2、五氟尿嘧啶(远大医药黄石飞云制药有限公司,规格:0.5 g,国药准字H20051138)500 mg/m2,栓塞剂采用碘化油,用量根据肿瘤血管造影确定;以embosphere 颗粒栓塞供血动脉,直至供血动脉血流停滞或减慢;复查肿瘤染色情况,观察患者有无不适反应,术毕拔管,压迫止血,穿刺点行加压包扎;术后患者给予补液、止吐、抑酸等对症干预。(3)观察组给予仑伐替尼(日本Eisai Co.,Ltd.,规格:4 mg,注册证号H20180052)联合阿替利珠单抗序贯TACE 治疗,具体操作:患者入组后口服仑伐替尼,体质量<60 kg 起始剂量为8 mg,体质量≥60 kg 起始剂量为12 mg,1次/d;用药1~2周后,停药3 d同对照组进行第1 次TACE,治疗后3 d 继续口服仑伐替尼;TACE 治疗后1~2 周后,静脉滴注阿替利珠单抗1200 mg。两组均给予1个治疗周期。
5.实验室检测方法
采集患者治疗前后空腹静脉血5 ml,室温静置,医用高速离心机进行离心,分离上层血清冷藏待检查。采用AU480 型全自动生化分析仪(品牌:Beckman Coulter,Inc.,注册证编号:国械注进20172221043)检测血清天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBIL);以CyFlow® Counter 流式细胞仪(厂家:Sysmex Partec GmbH,注册证编号:国械注进20162224393)检测淋巴细胞CD3+、CD4+、CD8+水平,并计算CD4+/CD8+;采用酶联免疫吸附法测定血清血管内皮生长因子(vascular epithelial growth factor,VEGF)、磷脂酰肌醇蛋白聚糖-3(glypican-3,GPC-3),试剂盒购自上海科华生物工程股份有限公司,均由本院同一高年资检验医生依照试剂盒及操作仪器相关要求完成检测。
6.观察指标
(1)疾病缓解率、疾病控制率:阿替利珠单抗治疗后1个月参照mRECIST实体瘤疗效标准进行评估[9],完全缓解(CR):治疗靶区无活性癌细胞且肿瘤标志物水平正常;部分缓解(PR):治疗靶区增肿瘤长径减小≥30%;疾病稳定(SD):治疗靶区肿瘤长径减小或增加均<20%;疾病进展(PD):出现新发病灶或治疗靶区长径增加≥20%。疾病缓解率=(CR+PR)/总例数×100%;疾病控制率=(CR+PR+SD)/总例数×100%。(2)肝功能指标:AST、ALT、TBIL。(3)细胞免疫功能指标:CD3+、CD4+、CD8+、CD4+/CD8+。(4)浸润转移指标:VEGF、GPC-3。(5)不良事件发生情况:高血压、腹痛腹泻、消化道出血、细菌性腹膜炎、血小板减少。
7.统计学分析
采用SPSS 25.0 版统计学软件进行数据分析,计量资料进行Kolmogorov-Smirnov 正态性检验与Bartlett 方差齐性检验,均服从正态分布且具备方差齐性,以均数±标准差(±s)表示,组内比较采用配对t检验,组间比较采用独立样本t检验;计数资料以百分率(%)描述,采用χ2检验,等级资料采用Ridit检验,P<0.05表示差异有统计学意义。
结果
1.疾病缓解率、疾病控制率(表2)

表2 两组乙型肝炎合并晚期肝癌患者疾病缓解、疾病控制情况比较[例(%)]
观察组疾病缓解率、疾病控制率均高于对照组,差异均有统计学意义(χ2=4.444,P=0.035;χ2=6.544,P=0.010)。
2.肝功能指标(表3)
表3 两组乙型肝炎合并晚期肝癌患者治疗前后肝功能指标比较(±s)
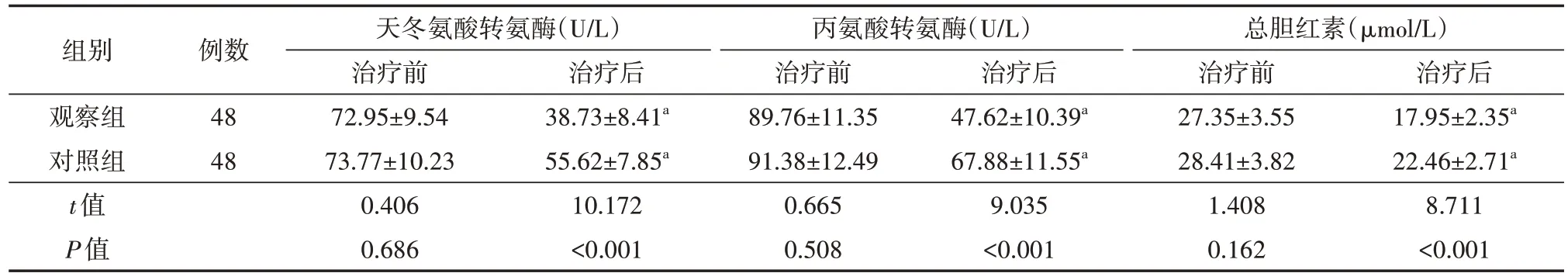
表3 两组乙型肝炎合并晚期肝癌患者治疗前后肝功能指标比较(±s)
注:对照组给予常规经导管动脉化疗栓塞术(TACE)治疗,观察组给予仑伐替尼联合阿替利珠单抗序贯TACE 治疗;与同组治疗前比较,aP<0.05
组别观察组对照组t值P值例数4848天冬氨酸转氨酶(U/L)治疗前72.95±9.5473.77±10.230.4060.686治疗后38.73±8.41a 55.62±7.85a 10.172<0.001丙氨酸转氨酶(U/L)治疗前89.76±11.3591.38±12.490.6650.508治疗后47.62±10.39a 67.88±11.55a 9.035<0.001总胆红素(μmol/L)治疗前27.35±3.5528.41±3.821.4080.162治疗后17.95±2.35a 22.46±2.71a 8.711<0.001
治疗后,两组AST、ALT、TBIL 均低于同组治疗前,且观察组均低于对照组,差异均有统计学意义(均P<0.05)。
3.细胞免疫功能指标(表4)
表4 两组乙型肝炎合并晚期肝癌患者治疗前后细胞免疫功能指标比较(±s)

表4 两组乙型肝炎合并晚期肝癌患者治疗前后细胞免疫功能指标比较(±s)
注:对照组给予常规经导管动脉化疗栓塞术(TACE)治疗,观察组给予仑伐替尼联合阿替利珠单抗序贯TACE 治疗;CD3+、CD4+、CD8+为淋巴细胞;与同组治疗前比较,aP<0.05
+组别观察组对照组t值P值例数4848 CD3+(%)CD4+(%)+(%)CD8 CD4+/CD8治疗后1.28±0.23a 1.03±0.19a 5.806<0.001治疗前51.55±3.8550.36±4.131.4600.147治疗后64.28±5.35a 58.92±5.13a 15.010<0.001治疗前27.31±2.2526.84±2.341.0030.318治疗后33.52±2.81a 28.75±2.63a 8.587<0.001治疗前29.68±2.6430.52±2.431.6220.108治疗后26.19±2.04a 27.91±2.13a 4.040<0.001治疗前0.92±0.120.88±0.141.5030.136
治疗后,两组CD3+、CD4+、CD4+/CD8+均高于同组治疗前,观察组均高于对照组(均P<0.05);CD8+均低于同组治疗前,观察组低于对照组(均P<0.05)。
4.浸润转移指标(表5)
表5 两组乙型肝炎合并晚期肝癌患者治疗前后浸润转移指标比较(±s)
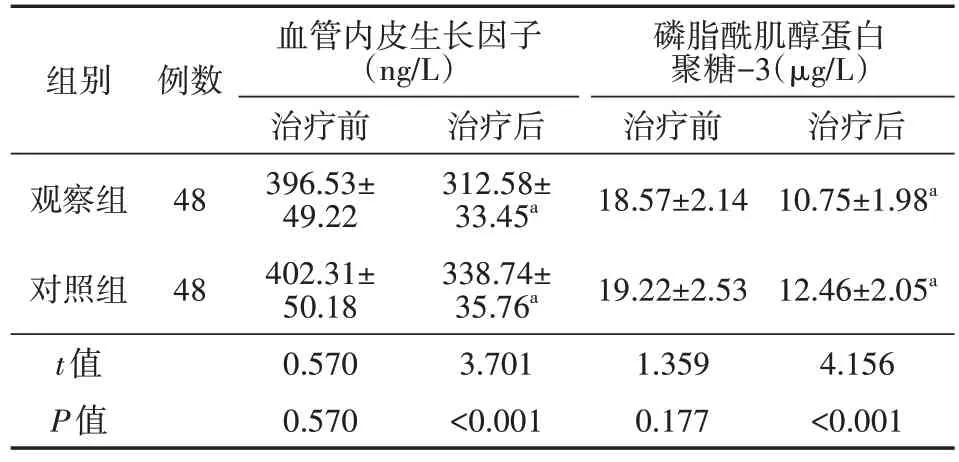
表5 两组乙型肝炎合并晚期肝癌患者治疗前后浸润转移指标比较(±s)
注:对照组给予常规经导管动脉化疗栓塞术(TACE)治疗,观察组给予仑伐替尼联合阿替利珠单抗序贯TACE治疗;与同组治疗前比较,aP<0.05
组别例数血管内皮生长因子(ng/L)治疗前396.53±49.22402.31±50.180.5700.570治疗后312.58±33.45a 338.74±35.76a 3.701<0.001观察组对照组t值P值4848磷脂酰肌醇蛋白聚糖-3(μg/L)治疗前18.57±2.1419.22±2.531.3590.177治疗后10.75±1.98a 12.46±2.05a 4.156<0.001
治疗后,两组VEGF、GPC-3水平均低于同组治疗前,且观察组均低于对照组(均P<0.05)。
5.不良事件(表6)

表6 两组乙型肝炎合并晚期肝癌患者不良事件发生情况比较[例(%)]
观察组不良事件总发生率与对照组比较差异无统计学意义(χ2=0.464,P=0.496)。
讨论
肝癌为常见消化道恶性肿瘤,发生机制尚未明确,但认为与肝炎、肝硬化、遗传等因素相关[10-11]。肝癌主要治疗原则是彻底切除病灶,延长患者生存期。而肝癌晚期丧失根治机会患者,临床主张通过减瘤获得根治机会。TACE是姑息性减瘤方法之一,虽能阻断肿瘤血供,但不能杀灭肿瘤细胞,栓塞后低氧环境会促使新血管形成,诱导肿瘤转移,促使免疫抑制因子呈高表达状态,抑制机体抗肿瘤作用[4,12]。
随着临床研究深入,靶向疗法与程序性死亡受体1(PD-1)免疫疗法在晚期肝癌的临床治疗中起着越来越重要的作用,尤其是仑伐替尼与PD-1抑制剂联合成为晚期不可切除肝癌黄金治疗方案[13]。临床实践中,全身治疗与姑息性治疗联合能增强肿瘤控制效果。丁晓鹏等[14]研究表明,TACE联合抗血管生成药、程序性死亡受体配体1(PD-L1)抑制剂能明显提高患者生存期,且不良事件风险可控。而张晓赟等[15]将TACE+仑伐替尼+PD-1单抗用于中晚期不可切除肝癌转化切除中,结果表明转化切除成功率较高,且安全性较好。本研究显示,观察组疾病缓解率、疾病控制率均高于对照组,治疗后观察组AST、ALT、TBIL 水平均低于对照组,提示联合治疗能增强临床疗效,在减轻肝功能损伤方面具有显著作用,分析认为,三者作用机制不同,联合治疗可从不同方向抑制肿瘤细胞增殖,减缓肿瘤细胞对肝脏组织的侵袭,从而改善肝功能。而两组不良事件发生率间无显著差异,说明联合治疗具有较高的安全性。
机体免疫系统能影响肿瘤组织增长,而肿瘤细胞可凭借多种方式逃逸免疫监视呈无限增殖状态。淋巴细胞亚群是细胞免疫的重要组分,在预防肿瘤细胞增殖过程中具有重要作用[16-17]。其中CD3+是成熟淋巴细胞的标志,其降低表示成熟淋巴细胞水平降低,会导致免疫功能下降[18];CD4+具有较强的免疫记忆功能,可对第1 次侵袭癌细胞产生记忆力,辅助机体完成抗肿瘤免疫[19];而CD8+则与CD4+作用相反,其能抑制正常免疫应答,是导致细胞免疫损害的基础;CD4+/CD8+则处于平衡状态,两者相互制约,当平衡被打破可导致免疫功能发生紊乱,降低抗肿瘤能力[20]。肿瘤生长及发育需要足够血液供给,而血管生长是肿瘤细胞增殖的重要因素[21]。VEGF是促血管生成因子,其表达可诱发肿瘤侵袭,是众多恶性肿瘤的诱导因子。且有研究表明,VEGF 是促进肝癌细胞恶性增殖、分化、转移的强效因子[22]。GPC-3 属于硫酸乙酰肝素蛋白聚糖家族,主要在肝癌细胞表达,正常组织中无表达,与肝癌发生及进展密切相关[23]。研究显示,干预GPC-3基因转录能有效抑制肝癌细胞活力、增殖迁徙能力及侵袭能力[24]。本研究显示,治疗后观察组CD3+、CD4+、CD4+/CD8+均高于对照组,CD8+、VEGF、GPC-3 均低于对照组,提示联合治疗能减轻免疫功能抑制,可有效降低肝癌细胞转移风险,分析认为联合治疗可抑制血管新生,降低肿瘤细胞血供,促使肿瘤细胞萎缩凋亡,抑制肿瘤细胞对正常组织侵袭,从而改善免疫功能。
综上所述,仑伐替尼联合阿替利珠单抗序贯TACE治疗乙型肝炎合并晚期肝癌效果显著,能有效预防肿瘤细胞转移,减轻免疫功能抑制,改善患者肝功能,且安全性较高。但本研究存在局限性,如仅对短期疗效进行分析,远期疗效尚未明确,仍需延长随访时间,做进一步分析。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明刘春华:酝酿和设计试验,实施研究,采集数据,分析/解释数据,文章撰写,统计分析;刘玲:采集数据,行政、技术或材料支持;陶昌明、贺玉凯:实施研究,采集数据
