不同运动模式缓解衰老性骨骼肌萎缩的研究进展
2023-06-21龚丽景潘秀清付鹏宇
龚丽景 潘秀清 付鹏宇
摘 要: 随着老龄化社会的到来,衰老性肌萎缩严重威胁着人类健康,运动作为积极有效的防治方式,其作用机制近年来成为研究热点。从衰老性肌萎缩发生的本质和对不同类型肌纤维的作用差异入手,探讨有氧运动、抗阻训练、高强度间歇运动和自主转轮等不同方式运动改善肌萎缩的可能分子机制。其中,mTOR、TGF-β/Smad信号通路和内质网应激途径等参与骨骼肌蛋白质的合成抑制过程,泛素-蛋白酶体系统、自噬-溶酶体系统、细胞凋亡、细胞焦亡/炎症、氧化应激/铁死亡等途径参与骨骼肌蛋白质分解的促进过程。运动可通过上述信号通路调节蛋白质的合成分解代谢,从而缓解衰老性肌萎缩的进程,为运动缓解衰老性肌萎缩提供更多的理论依据。
关键词: 衰老性肌萎缩;肌纤维类型;骨骼肌蛋白质代谢;运动模式
中图分类号:G804.2 文献标识码:A 文章编号:1006-2076(2023)02-0084-08
Research Progress of Different Modes of Exercise Alleviating Age-related Skeletal Muscle Atrophy/Sarcopenia
GONG Lijing 1,2,PAN Xiuqing 3,FU Pengyu 4*
1. China Institute of Sport and Health Science, Beijing Sport University, Beijing 100084, China; 2. Key Laboratory of Physical Fitness and Exercise, Ministry of Education, Beijing Sport University, Beijing 100084, China; 3. College of Health Sciences, Xian P.E. University, Xian 710068, Shaanxi, China; 4. Dept. of P.E., Northwestern Polytechnical University, Xian 710072, Shaanxi, China
Abstract: With the coming of aging society, aging muscular atrophy is a serious threat to human health. As an active and effective prevention and treatment method, exercise has become a research hotspot in recent years. From the essence of aging muscular atrophy and the difference of its effects on different types of muscle fibers, we discuss the possible molecular mechanisms of different types of exercise to attenuate muscular atrophy, such as aerobic exercise, resistance training, high-intensity intermittent exercise, and autonomous wheel exercise. The mTOR, TGF-β/Smad and endoplasmic reticulum stress pathways participate in the inhibition of skeletal muscle protein synthesis in sarcopenia, and ubiquitin-proteasome system, autophagy-lysosome system, cell apoptosis, pyroptosis /inflammation, oxidative stress/erroptosis and other pathways are involved in the promotion of protein decomposition. Exercise could regulate the process of protein synthesis and decomposition through the above signaling pathways, so as to alleviate the process of sarcopenia.
Key words: age-related muscle atrophy/sarcopenia; muscle fiber types; skeletal muscle protein metabolism; exercise
當今社会人口老龄化问题加剧。据预计,2050年,全球老年人的数目将在历史上首次超过年轻人数目 [1]。到2035年,我国60岁及以上老年人口将突破4亿,占总人口的比例将超过30 ,进入重度老龄化阶段。如何提高老年人的生活质量,提高其健康水平正受到公众的高度关注。作为人体最大的器官,骨骼肌在维持身体姿势、运动、呼吸、能量储存和代谢、体温维持和调节及内分泌等方面都发挥着极其重要的作用 [2]。衰老所诱发的骨骼肌萎缩加剧慢病进程、增加健康风险。多年来,如何有效减少衰老带来的不良反应一直是研究的热点,其中,运动作为促进老年人健康的有效手段,被证明为非药物干预方式预防或减缓衰老性肌萎缩的发病进程的方法之一 [3]。本研究从分子生物学水平综述不同类型运动缓解衰老性肌萎缩的可能机制,以期为运动促进老龄人口健康的研究提供参考。
1 衰老性肌萎缩概述
1.1 衰老性肌萎缩的概念及判定
机体随着年龄增长,会出现运动系统功能下降、胃肠功能减弱所致的营养吸收减弱、神经系统对肌肉的控制能力下降,进而导致肌肉质量丢失和功能降低,这一现象被称为衰老性肌萎缩(Sarcopenia),最早由学者Rosenberg提出,特指与衰老相关的进行性的肌纤维横截面积(fiber cross sectional area,FCSA)缩小、肌纤维类型转变、肌肉力量和耐力下降的生理过程 [4]。
衰老性肌萎缩伴随年龄增长而自然出现,广泛存在于老年人群中,在80岁以上人群的发生率达50 以上,这大大降低了老年人的生活质量。首先,表现在运动能力受损,肌肉拉伤、骨折和跌倒的风险增加。其中,跌倒作为我国65岁老人伤害死亡的首要原因,直接威胁着老年人的生命安全。其次,老年人群慢性代谢性疾病的发病率增加。而骨骼肌作为葡萄糖和蛋白质代谢的重要器官,其质量的丢失和功能的下降反过来加剧Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)和胰岛素抵抗(insulin resistance,IR)等的发病进程,降低患者的运动能力,从而加重病情。
临床研究中,常采用双能X线吸收测定法(dualenergy X-ray absorptiometry,DEXA)测试肌肉含量并配合握力测试的方式来诊断肌萎缩。以四肢骨骼肌肌量指数(四肢骨骼肌肌量/身高 2)(appendicular skeletal muscle index,ASMI)男性小于7.26 kg/m 2、女性小于5.45 kg/m 2,且同时要求握力男性小于26 kg、女性小于18 kg为判断标准 [5-6]。为了探究肌萎缩的发病机制,研究中常采用衰老大、小鼠模型作为研究对象。实验动物尚没有明确标准,常用骨骼肌质量指数(骨骼肌肌量/体重)(skeletal muscle index,SMI)、肌肉湿重、FCSA和抓力与对照组相比的方式来判断肌萎缩。
1.2 衰老性肌萎缩与肌纤维类型
骨骼肌由具有不同代谢和收缩特性的纤维类型组成。慢肌纤维为主的肌肉特点是线粒体、肌红蛋白含量高,毛细血管密度高;快肌纤维为主的肌肉氧化能力较低,毛细血管密度低 [7]。衰老过程中,慢肌和快肌纤维均会发生适应代谢和蛋白质质量调控的改变,表现为肌纤维线粒体含量和氧化磷酸化水平随年龄增长而降低,但快肌纤维更加敏感,其肌纤维的丢失速度快于慢肌纤维,且在慢肌中糖酵解酶的活性增加,表现为慢肌向快肌转变 [8]。通过单肌纤维蛋白质组学分析可知,慢肌纤维对维持蛋白质的合成有重要的作用,但由于衰老机体对食物中氨基酸的吸收减弱,蛋白质的合成来源减少,所以抑制快肌的质量损失可部分减少衰老机体的肌肉丢失 [9]。从对肌纤维功能的分析发现,快肌纤维主要参与肌肉的活动能力,而慢肌纤维主要参与姿势的维持,因此,在衰老机体中优先表现为快肌质量的丢失和功能的降低 [10]。
2 衰老性肌萎缩与骨骼肌蛋白质代谢失衡
2.1 衰老与骨骼肌蛋白质合成相关代谢通路
2.1.1 mTOR信号通路
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种非典型丝氨酸/苏氨酸蛋白激酶,能够促进肌肉肥大,从而预防骨骼肌萎缩 [11]。主要通过调控其下游的真核启动因子4E结合蛋白1(eukaryotic initiation factor 4E binding protein 1,4EBP1)和核糖体蛋白S6激酶β-1(ribosomal protein S6 kinase beta-1,p70S6K1)以促进蛋白质合成。然而衰老骨骼肌中氧化應激(oxidative stress,OS)水平增加和一些micro RNAs(如miR-1、miR-133a、miR-199a等 [12])表达的改变,可通过抑制胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)/磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/ Akt)通路以降低mTOR通路中相关蛋白的表达,抑制骨骼肌蛋白质的合成,从而导致肌萎缩。因此,通过提高mTOR通路相关蛋白表达方法,如,给老年人补充睾酮、生长激素等激素疗法,可延缓肌萎缩的发生发展 [13]。总之,激活或促进mTOR通路相关基因的转录和蛋白表达,可以增加骨骼肌蛋白质合成率,维持衰老机体的肌肉结构和功能。
2.1.2 TGF-β/Smad信号通路
转化生长因子-β(transforming growth factor-β,TGF-β)及其受体底物Smads(mothers against decapentaplegic homologs)蛋白家族,可调控细胞的增殖,在骨骼肌生长发育过程中发挥重要作用 [14]。其中肌肉生长负调节因子—肌肉生长抑制素(myostatin/MSTN),又称为生长分化因子8(growth differentiation factor 8,GDF-8),是TGF-β家族的一员,可抑制肌肉的生长,使之分化为肌成纤维细胞,导致骨骼肌纤维化。抑制TGF-β1/Smad3通路可以上调肌原调节蛋白1(MyoD1)和miR-206 mRNA表达,以促进肌卫星细胞分化 [15]和肌肉生长;且单独抑制myostatin,同样具有预防肌萎缩的效果。研究发现,myostatin基因敲除或抑制可促进小鼠体重增加30 ,临床研究也证实该基因丢失或功能突变会导致肌肉重量增加 [16]。伴随着衰老而加重的肌肉纤维化,其实质是细胞外基质过度集聚,进而阻碍细胞迁移和融合,干扰肌纤维再生 [17]。TGF-β是重要的促纤维化形成的细胞因子,衰老进程可通过抑制TGF-β/Smad通路而发挥抑制肌纤维增长的作用 [18]。所以,针对TGF-β/Smad通路抑制肌肉生长的机制,可开发相应的阻断剂,减少肌纤维化,促进肌卫星细胞的分化、肌纤维再生,从而增加肌肉重量,是一种有效的延缓衰老性肌萎缩的方法。
2.1.3 内质网应激途径
细胞内钙离子信号紊乱、蛋白质折叠障碍可导致内质网应激(endoplasmic reticulum stress,ERS)的产生,表现为内质网的功能紊乱,导致未折叠或折叠错误的蛋白聚集,从而激活内质网未折叠蛋白反应(endoplasmic reticulum unfolded protein response,UPRER) [19],通过调控相关信号通路抑制真核细胞翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)的磷酸化,从而抑制蛋白质合成和增强蛋白质降解 [20]。研究发现,内质网氧化还原酶1α(endoplasmic reticulum oxidoreductin1α,ERO1α)是ERS途径中调控内质网蛋白质合成和折叠的关键基因,可参与新生肽链的正确折叠,其DNA的高甲基化可抑制该基因的表达,与6月龄成年大鼠相比,18月龄老年大鼠的骨骼肌ERO1高度甲基化,导致内质网应激蛋白表达增加 [21]。此外,衰老所致的机体OS水平增加和内质网相关分子伴侣的表达降低可导致内质网功能的紊乱,从而抑制 PI3K/Akt通路及mTOR复合物1(mTOR complex 1,mTORC1)的表达,使衰老大鼠骨骼肌处于蛋白质合成抑制状态,减轻蛋白质折叠效应和降低蛋白质翻译。相反,UPRER过度激活,使细胞凋亡增加和抑制mTORC1等蛋白质合成通路蛋白的表达,会使衰老进程加剧 [22-23]。因此,衰老使机体内质网关键基因的表达或修饰异常,使内质网应激增加,会导致蛋白质合成通路相关蛋白受到抑制,细胞凋亡加剧,是衰老肌萎缩发生的机制之一。
2.2 衰老与骨骼肌蛋白质分解代谢相关通路
2.2.1 泛素—蛋白酶体途径
泛素—蛋白酶体系统(ubiquitinproteasome system,UPS)是细胞内蛋白质分解代谢的主要方式,主要是降解错误折叠或未折叠蛋白。该系统由泛素、泛素活化酶E1、泛素结合酶E2、泛素蛋白连接酶E3、26S蛋白酶体和泛素解离酶等组成。常用编码泛素的转录物上调(如泛素蛋白连接酶E3)来判断肌萎缩的发生 [24]。肌肉特异性环指蛋白1(muscle-specific ring finger 1,MuRF1)和肌萎缩F-box蛋白(muscle-specific F-box protein,MAFbx/Atrogin-1)能调节泛素介导的骨骼肌蛋白质降解,又被称为萎缩相关(atrophy-related)基因或萎缩基因(Atrogenes) [25]。其中,Atrogin-1可促进eIF3降解,抑制骨骼肌蛋白质合成。MuRF1可促进肌球蛋白重链(myosin heavy chain,MHC)、肌动蛋白等肌肉结构蛋白降解,导致骨骼肌肌肉质量下降。MuRF1和Atrogin-1受控于转录因子叉头框蛋白O(Forkhead box protein O,FoxOs)以促进肌萎缩的发生,衰老机体中均伴随MuRF1和Atrogin-1的表达增加 [26- 27]。因此,衰老机体泛素—蛋白酶体系统激活后,泛素相关基因转录增加,促萎缩相关基因表达活跃,使骨骼肌蛋白质合成减少,降解增加,总体表现为蛋白质累积量下降,是衰老性肌萎缩发生的机制之一。
2.2.2 自噬—溶酶体途径
自噬—溶酶体途径(autophagy-lysosomal pathway,ALP)是普遍存在于真核细胞内的一种蛋白质分解过程,涉及溶酶体的大量降解,对于维持骨骼肌内环境稳态起着相当重要的作用。自噬增加会导致细胞质和细胞器内蛋白质丢失,进而导致肌肉丢失;而自噬不足反过来导致骨骼肌中吞噬体和线粒体异常,引起肌肉疾病 [28]。衰老性肌萎缩主要表现为自噬水平降低,导致骨骼肌细胞中代谢废物的积累,以导致肌肉减少症的发生,而保持自噬通量可使细胞器恢复活力,并防止功能异常的线粒体和内质网(endoplasmic reticulum,ER)膜积聚,阻止蛋白质过度分解 [29]。研究发现,骨骼肌特异性缺失自噬相关蛋白7(autophagy related protein 7,Atg7)可表现出肌萎缩症状;而自然衰老(10月龄)和快速老化小鼠(senescence accelerated mice P8,SAMP8)出现明显的肌萎缩,会伴随着自噬相关蛋白Beclin1和微管相关蛋白1轻链3-II/I(microtubular associated protein1 light chain 3-II/I,LC3-II/I)显著下降,而自噬底物蛋白Sequestosome 1(SQSTM1/p62)表达量显著上升 [30]。因此,自噬过强或者不足都会造成骨骼肌异常,发生肌萎缩;而衰老可降低骨骼肌自噬水平,使细胞代谢物不能快速清除,反而造成肌肉丢失导致肌萎缩的发生。
2.2.3 细胞凋亡途径
细胞凋亡(Apoptosis)是细胞自主和程序性死亡的方式之一,包括外源性(死亡受体途径)、内源性(线粒体途径)以及穿孔素/顆粒酶依赖性途径,3种途径均可启动半胱天冬氨酸蛋白酶(Caspases)级联反应,最终导致细胞凋亡 [31]。细胞凋亡主要由肿瘤坏死因子(tumor necrosis factor,TNF)、细胞色素C、Caspase 3、Caspase 9和抗凋亡蛋白(如B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2))及促凋亡蛋白(如Bcl-2相关X蛋白(Bcl2-associated X protein,Bax))等介导 [32]。衰老骨骼肌中肌纤维肌核和卫星细胞核的凋亡,是引起肌萎缩的诱因之一。衰老骨骼肌增加了促凋亡蛋白Bax和Caspases的表达及DNA断裂,同时减少了抗凋亡蛋白Bcl-2的表达。研究发现,8月龄SAMP8小鼠骨骼肌中Bcl-2显著下调,而Bax显著上调,导致Bcl-2/Bax比率显著下调,提示衰老可导致寡聚体大量形成并转位至线粒体膜,通过与线粒体膜上的孔蛋白相互作用,进而增加膜的通透性,导致细胞色素C从线粒体释放,促进骨骼肌细胞凋亡 [33]。因此,衰老可通过内外源性途径,启动Caspases级联反应,增加肌纤维和肌卫星细胞核基因的凋亡或增加线粒体膜通透性等,使骨骼肌细胞凋亡水平增加,促使骨骼肌萎缩程度加剧。
2.2.4 细胞焦亡/炎症途径
细胞焦亡(Pyroptosis)是依赖于半胱氨酸蛋白酶(cysteinyl aspartate-specific,caspases)家族活性的一种细胞炎性死亡途径,该过程中细胞不断胀大发生细胞膜的破裂,导致细胞内容物和炎性介质释放,诱发炎症反应。炎症与衰老密切相关,被认为是衰老性疾病的重要诱因,称为炎性衰老,以机体循环血中白细胞介素-6(interleukin-6,IL-6)、C-反应蛋白(C-reactive protein,CRP)等促炎因子明显升高为特征。核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎性小体,包含NLRP3、凋亡相关斑点样蛋白(apoptosis speck-like protein containing a caspase recruitment domain,ASC)和Caspase-1前体(pro-Caspase-1),是调节细胞焦亡的重要蛋白复合体,能够调节Caspase-1的活化,进而在天然防御过程中促进细胞因子前体pro-IL-1β和pro-IL-18的成熟和分泌。研究發现,脂多糖(lipopolysaccharide,LPS)可作为诱导细胞炎性衰老的模型 [34], LPS可诱导小鼠骨骼肌细胞C2C12细胞焦亡并导致分化后肌管萎缩 [35]。NLRP3的缺失,可降低肌营养不良小鼠骨骼肌中IL-1β水平,改善骨骼肌功能。这可能与NLRP3炎症小体介导肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-6、CRP等炎症标志物表达升高有关,随之促进骨骼肌蛋白质分解,且TNF-α及IL-1β水平升高能抑制生长激素和IGF-1的表达和PI3K/Akt/mTOR信号通路,从而抑制蛋白质的合成。所以,衰老使细胞焦亡相关蛋白表达增加,炎症标志物水平升高,促进蛋白质分解,抑制蛋白质合成相关通路,从而使骨骼肌发生萎缩。
2.2.5 氧化应激/铁死亡途径
OS参与多种疾病的发生和发展,在衰老机体中,生成的氧化产物超过抗氧化系统的清除能力,导致活性氧(reactive oxygen species,ROS)的积累,会给生理结构带来不可逆的损伤。研究证实,超氧阴离子和过氧化氢等可作为信号分子改变骨骼肌的机能。衰老性的铁积累则有助于增加OS,反之,ROS的积累也会进一步诱导铁死亡(Ferroptosis) [36]。研究发现,老年小鼠股直肌和腓肠肌质量明显下降,并伴随着骨骼肌中丙二醛(malondialdehyde,MDA)含量和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性升高,而抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性明显下降 [37]。GPX4是一种调控铁死亡的关键酶, 小鼠神经元中敲除GPX4可出现肌萎缩侧索硬化症状,表现为严重的肌肉萎缩 [38]。此外,铁死亡参与多种衰老相关疾病的发生和发展,可能是诱导增龄性肌萎缩的重要诱因 [39]。因此,衰老使氧化应激/铁死亡途径激活程度上升,导致抗氧化能力下降,氧化产物积聚,骨骼肌质量下降,加剧肌萎缩程度。
3 不同类型运动缓解衰老性肌萎缩机制
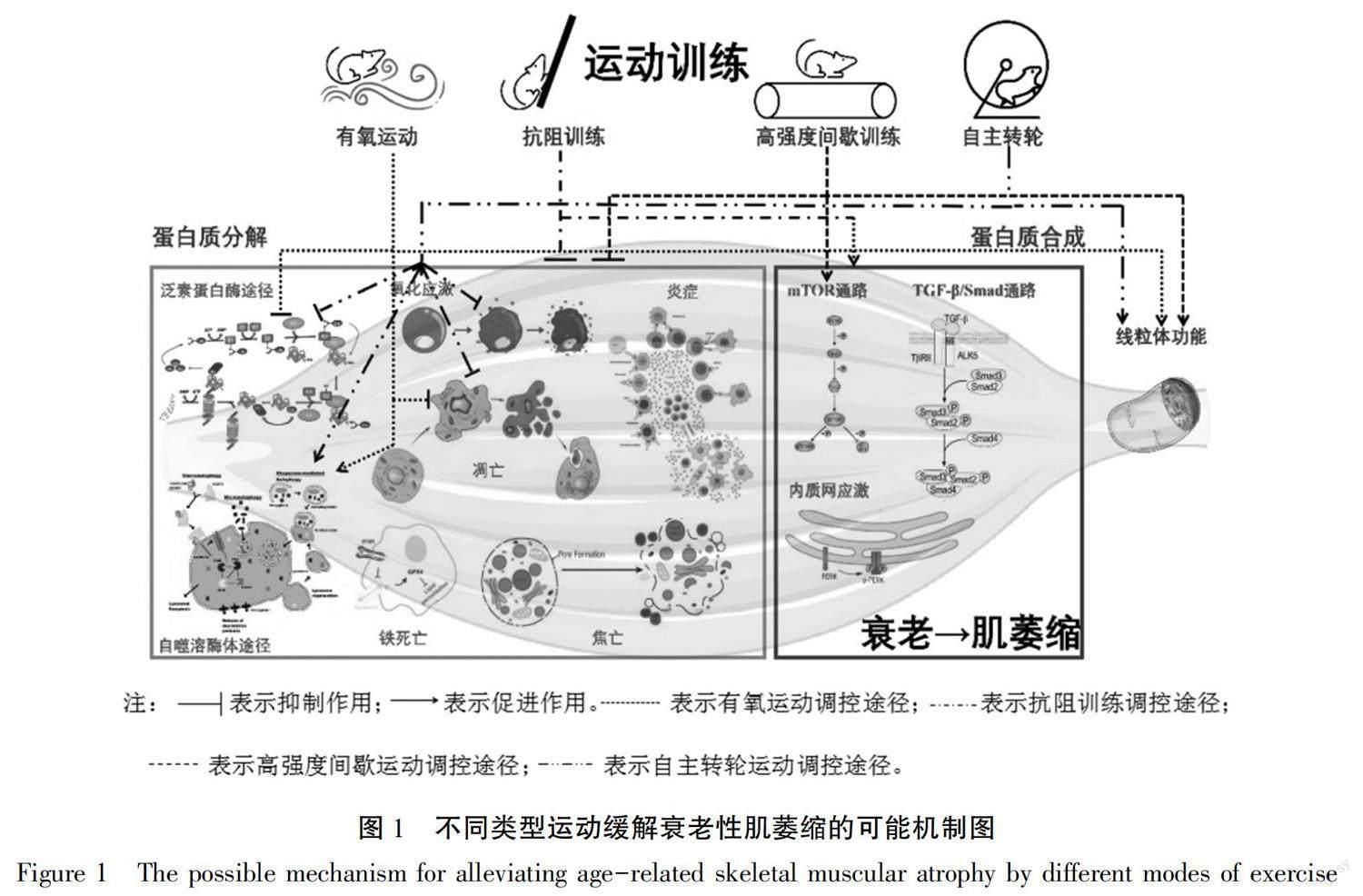
研究认为,运动是保持肌肉整体机能最有效的方法,也被认为是有效防治衰老性肌萎缩的康复手段 [40]。运动可能通过不同的调节途径作用于衰老机体的骨骼肌,从而发挥缓解肌萎缩的作用。
3.1 有氧运动缓解衰老性肌萎缩机制
提高衰老机体骨骼肌的有氧能力,是改善肌肉功能的重要策略。有氧运动可通过增加线粒体的适应能力、提高心血管功能和增加骨骼肌中毛细血管密度,来缓解衰老所致的肌肉减少症 [41]。有氧运动对雄性和雌性衰老大、小鼠的骨骼肌萎缩均具有积极缓解作用。此外,有氧训练对抵抗衰老所致的肌肉减少性肥胖症也有着积极的治疗作用 [42]。研究发现,6~22周有氧运动后,老龄大小鼠的腓肠肌或比目鱼肌湿重/体重显著升高,肌纤维横截面积(FCSA)明显增大;腓肠肌自噬相关蛋白p62表达下降,Beclin1表达升高,LC3-II/I升高,自噬水平下降 [43];Atrogin1和MuRF1表达下降,即泛素-蛋白酶体途径功能下降 [18, 44-45];细胞凋亡蛋白Bcl-2表达升高,Bax下降,Bcl-2/Bax比值下降等 [43],说明细胞凋亡水平下降。同时,有氧运动后,骨骼肌组织AMPK及其磷酸化、PGC-1α、Sirt1、Akt及其磷酸化表达升高,以及线粒体PINK1和Parkin表达升高 [43],TGF-β/Smad通路蛋白下降 [18]等, 说明蛋白质合成增加。因此,有氧运动改善衰老性肌萎缩的作用机制主要与改善骨骼肌线粒体功能(PINK1、Parkin、PGC-1α等)和抑制蛋白质分解(增加衰老细胞自噬、抑制UPS和细胞凋亡等)有关。有关有氧运动缓解衰老性肌萎缩的研究对象,多以大小鼠的混合型肌和慢肌为主,这可能与有氧运动是发展慢肌的运动方式有关。
3.2 抗阻运动缓解衰老性肌萎缩机制
抗阻训练目前被认为是促进肌肉肥大最为有效的运动方式。对49项研究的荟萃分析,共纳入1 328名50岁及以上的受试者,在经过平均20.5 w、2~3次/w抗阻训练可平均增加骨骼肌质量1.1 kg [46];另一项荟萃分析也发现,17.6 w抗阻训练可显著使中老年人的肌肉力量提高33 [47],以上提示抗阻训练对增加中老人肌肉质量和功能具有积极作用。
抗阻训练缓解衰老性肌萎缩的效果在动物中均得到证实,且不存在性别的差异。动物实验中关于抗阻训练的研究多采用爬梯训练的方式,该训练模式被认为是与人类抗阻训练最为接近的运动方式 [48],但由于存在运动强度难以定量的问题,也有研究采用负重跑的方式来模拟抗阻训练 [49]。研究发现,8~32周爬梯后,大鼠、小鼠腓肠肌或比目鱼肌湿重/体重比显著升高,骨骼肌AMPK-PGC-1α、Akt-FoxO通路激活 [50],自噬通路蛋白下调 [43, 51],细胞凋亡率下降,氧化应激水平下降 [52],UPS相关蛋白下降 [45]等。人体实验多采用混合训练的模式 [53],机制包括内质网应激的磷酸化蛋白激酶R样内质网激酶(protein kinase R like ER kinase,PERK)、磷酸化肌醇需求酶1(Inositol-requiring enzyme 1,p-IRE1)、转录激活因子4(activating transcription factor 4,ATF4)和X框结合蛋白1(X-box-binding protein 1,Xbp1)水平增加 [54],炎症反应因子NF-κB、Akt-FoxO通路的FoxO1和ALP通路LC3b下降等 [55],肌纤维维度增加,大腿肌肉质量和体积增加,上下肢等长收缩力量上升,瘦体重增加,肌肉功能得到恢复。抗阻训练缓解衰老性肌萎缩的研究对象多以大小鼠混合型肌为主,快肌和慢肌中也具有提升作用 [56]。综上,抗阻训练促进衰老机体骨骼肌蛋白质合成、抑制蛋白质分解(包括增加ALP,抑制OS、UPS、细胞凋亡、炎症反应等)是其延缓肌萎缩的主要原因。
3.3 高强度间歇运动缓解衰老性肌萎缩机制
高强度间歇训练(high intensity interval training,HIIT)是指短时间内进行多次高强度的运动训练,且在训练中间穿插低强度训练或完全休息的间歇期,目的是让机体不能得到完全恢复,其特点是:运动强度大、运动时间短、训练者更容易接受 [57]。研究发现,HIIT对循环系统代谢具有较好的作用。由于HIIT较其他形式的运动更能使运动者获得愉悦感,目前也广泛地应用在群众体育中。研究发现,长期规律的HIIT可以提高老年人的肌肉含量和力量、身体活动能力和平衡能力。由于HIIT运动强度较高,考虑到中老人的安全性,此运动模式的人体研究有限。研究发现,8~12周的HIIT可使衰老大小鼠的股四头肌、比目鱼肌和腓肠肌等组织PI3K、AMPK等蛋白质合成相关mTOR通路激活,细胞凋亡途径、泛素—蛋白酶途径、氧化应激等分解相关系统下调 [58-60],表现为蛋白质合成率升高,蛋白质总量、肌原纤维与肌浆蛋白质含量升高,线粒体数量也随之上升。有研究显示,HIIT对快肌(趾长伸肌)的作用主要表现为促进蛋白质的合成,而对慢肌(比目鱼肌)为抑制UPS和促进ALP,表现出肌纤维特异性。同时HIIT对快肌蛋白质合成的促进作用效果更为明显 [61]。综上,HIIT缓解衰老性肌萎缩的可能机制在于促进骨骼肌蛋白质合成(mTOR通路)和抑制骨骼肌蛋白质分解(UPS、OS、ALP、炎症反应、细胞凋亡),并改善线粒体功能(Complex Ⅱ、Ⅲ和Ⅴ)。
3.4 自主转轮运动缓解衰老性肌萎缩机制
动物在自由状态下进行转轮运动, 用于模拟动物以及人类在自由状态下进行运动的效应。虽然这种运动方式没有固定的运动强度和运动时间,但已有研究报道转轮运动对健康的益处,如,抑制骨关节炎、改善学习记忆能力、维持心肌健康等,但有关自主转轮运动缓解衰老性肌萎缩的报道还较少。研究发现,8~12周自主转轮运动后,大鼠和小鼠骨骼肌组织AMPK-PGC-1α通路激活,泛素-蛋白酶途径、氧化应激、细胞凋亡和自噬水平等均下降,腓肠肌湿重/体重比、FCSA均上升,肌纤维结构变得清晰、肌丝排列整齐致密,线粒体排列正常 [43-44, 52]。相关研究均以混合肌腓肠肌为研究对象,因此,有关该运动的肌纤维选择性还有待进一步的研究。自主转轮运动被认为是有氧运动的一种,其对衰老性肌萎缩的缓解作用主要表现在对骨骼肌蛋白质分解(抑制UP、OS、凋亡,促进ALP)的抑制作用。这些研究结果提示,即便是非固定强度的低强度运动对促进衰老性肌萎缩的防治也具有积极作用。
综上分析,不同方式的运动类型各具特点,可能通过不同的分子途径调节衰老性肌萎缩的进程,总体抑制了骨骼肌蛋白质的分解,促进了蛋白质的合成,具体调控途径见图1。但各类型运动研究在实施上皆存在一些不足,如有氧运动主要通过调控能量代谢、线粒体功能和改善细胞凋亡缓解衰老所致的肌萎缩进程,但需较长的干预时间。抗阻训练是缓解肌萎缩应用最多的运动方式,动物实验常采用抗阻爬梯的运动方式,但存在动物需要进行适应性运动和攀爬时间难以控制的问题;人体力量训练的动作较为复杂,且需要专门的器械。HIIT对骨骼肌蛋白的合成和分解均具有调控作用,且可采取的运动形式多样,但运动方案设计较为复杂。有关自主转轮运动缓解衰老肌萎缩的研究较少,该运动主要通过抑制蛋白质分解发挥作用,缺点在于研究重复性较差。
4 结论与展望
因衰老过程中骨骼肌蛋白质代谢失衡所致的肌萎缩,不同运动可通过不同的调控机制来改善此现象,上述研究从分子层面证实了无论是规律的有氧运动、抗阻训练、HIIT还是非固定强度的自主转轮运动,对于缓解衰老性肌萎缩的进程均具有益处。但总体来说,皆是通过促进蛋白质合成、抑制蛋白质分解相关的途径来实现的。但研究还存在一些不足,建议未来开展以下方面的研究:(1)目前的研究多采用混合型肌肉或用单一类型的肌肉为研究对象,而不同类型的运动对发展不同类型肌纤维的力量和功能可能具有选择性,可通过对比不同类型肌肉对同一类型运动的不同量效反应差异,进而指导选择更加合适的运动类型;(2)探讨组合型运动对防治衰老性肌萎缩的分子机制,以期为得到更全面的健康益处提供分子靶点。
参考文献:
[ 1 ] 穆光宗,張团.我国人口老龄化的发展趋势及其战略应对[J].华中师范大学学报(人文社会科学版),2011,50(5):29-36.
[ 2 ] KUPR B,SCHNYDER S,HANDSCHIN C.Role of nuclear receptors in exercise-induced muscle adaptations[J].Cold Spring Harb Perspect Med,2017,7(6):a029835.
[ 3 ] ABBOTT R D,PETROVITCH H,WHITE L R,et al.Frequency of bowel movements and the future risk of Parkinson's disease[J].Neurology,2001,57(3):456-462.
[ 4 ] ROSENBERG I H.Sarcopenia:origins and clinical relevance[J].Clin Geriatr Med,2011,27(3):337-339.
[ 5 ] BAUMGARTNER R N,KOEHLER K M,GALLAGHER D,et al.Epidemiology of sarcopenia among the elderly in New Mexico[J].Am J epidemiol,1998,147(8):755-763.
[ 6 ] CHEN L K,LEE W J,PENG L N,et al.Recent advances in sarcopenia research in Asia: 2016 update from the Asian working group for sarcopenia[J].J Am Med Dir Assoc,2016,17(8):767.e1-767.e7.
[ 7 ] PETTE D,STARON R S.Myosin isoforms, muscle fiber types, and transitions[J].Microsc ResTech,2000,50(6):500-509.
[ 8 ] LARSSON L,DEGENS H,LI M,et al.Sarcopenia:aging-related loss of muscle mass and function[J].Physiol Rev,2019,99(1):427-511.
[ 9 ] KORHONEN M T,CRISTEA A,ALEN M,et al.Aging,muscle fiber type,and contractile function in sprint-trained athletes[J].J Appl Physiol,2006,101(3):906-917.
[10] MURGIA M,TONIOLO L,NAGARAJ N,et al.Single muscle fiber proteomics reveals fiber-type-specific features of human muscle aging[J].Cell Rep,2017,19(11):2396-2409.
[11] YOON M S.mTOR as a key regulator in maintaining skeletal muscle mass[J].Front Physiot,2017(8):788
[12] DRUMMOND M J,MCCARTHY J J,FRY C S,et al.Aging differentially affects human skeletal muscle microRNA expression at rest and after an anabolic stimulus of resistance exercise and essential amino acids[J].Am J physiol Endocrinol Metab,2008,295(6):E1333-1340.
[13] JOHNSON S C,RABINOVITCH P S,KAEBERLEIN M.mTOR is a key modulator of ageing and age-related disease[J].Nature,2013,493(7432):338-345.
[14] MARIMUTHU K,MURTON A J,GREENHAFF P L.Mechanisms regulating muscle mass during disuse atrophy and rehabilitation in humans[J].J Appl Physiol(1985),2011,110(2):555-560.
[15] SOARES R J,CAGNIN S,CHEMELLO F,et al.Involvement of microRNAs in the regulation of muscle wasting during catabolic conditions[J].J Biol Chem,2014,289(32):21909-21925.
[16] RODRIGUEZ J,VERNUS B,CHELH I,et al.Myostatin and the skeletal muscle atrophy and hypertrophy signaling pathways[J].Cell Mol Life Sci,2014,71(22):4361-4371.
[17] LIEBER R L,WARD S R.Cellular mechanisms of tissue fibrosis.4.Structural and functional consequences of skeletal muscle fibrosis[J].Am J Physiol Cell Physiol,2013,305(3):C241-252.
[18] 虎力,溫佩彤,高原,等.运动对增龄性大鼠骨骼肌TGF-β/Smad信号通路的作用[J].中国老年学杂志,2018,38(7):1681-1684.
[19] 蔡梦昕,齐文溥,徐祖杰,等.Trx1抑制内质网应激参与运动改善心梗后骨骼肌质量减少[J].体育科学,2020,40(11):73-83.
[20] 柯志飞,尚画雨,王瑞元,等.运动调节内质网未折叠蛋白反应改善衰老性肌萎缩的研究进展[J].体育科学,2021,41(5):73-9,97.
[21] 熊建团,杨松昊,张辉,等.衰老对大鼠骨骼肌组织内质网氧化还原酶-1αDNA甲基化的影响[J].宁夏医科大学学报,2019,41(5):440-445.
[22] SONG Q,HAN C C,XIONG X P,et al.PI3K-Akt-mTOR signal inhibition affects expression of genes related to endoplasmic reticulum stress[J].Genet Mol Res,2016,15(3):gmr.15037868.
[23] DELDICQUE L.Endoplasmic reticulum stress in human skeletal muscle:any contribution to sarcopenia?[J].Front Physiol,2013(4):236.
[24] BONALDO P,SANDRI M.Cellular and molecular mechanisms of muscle atrophy[J].Dis Model Mech,2013,6(1):25-39.
[25] SACHECK J M,HYATT J P,RAFFAELLO A,et al.Rapid disuse and denervation atrophy involve transcriptional changes similar to those of muscle wasting during systemic diseases[J].Faseb J,2007,21(1):140-155.
[26] MARZETTI E,CALVANI R,TOSATO M,et al.Sarcopenia:an overview[J].Aging Clin Exp Res,2017,29(1):11-17.
[27] 汪敏加,齊梓伊,朱玮华,等.肌肉萎缩机制及临床研究进展:基于第65届美国运动医学学会年会的思考[J].中国组织工程研究,2019,23(15):2421-2426.
[28] XIA Q,HUANG X,HUANG J,et al.The role of autophagy in skeletal muscle diseases[J].Front Physiol,2021(12):291.
[29] NEEL B A,LIN Y,PESSIN J E.Skeletal muscle autophagy:a new metabolic regulator[J].Trends Endocrinol Metab,2013,24(12):635-643.
[30] TRIOLO M,HOOD D A.Manifestations of age on autophagy,mitophagy and lysosomes in skeletal muscle[J].Cells,2021,10(5):1054.
[31] DIRKS A,LEEUWENBURGH C.Apoptosis in skeletal muscle with aging[J].Am J PhysiolRegul Integr Comp Physiol,2002,282(2):R519-R527.
[32] WANG H,LISTRAT A,MEUNIER B,et al.Apoptosis in capillary endothelial cells in ageing skeletal muscle[J].Aging cell,2014,13(2):254-262.
[33] CHEEMA N,HERBST A,MCHKENZIE D,et al.Apoptosis and necrosis mediate skeletal muscle fiber loss in age-induced mitochondrial enzymatic abnormalities[J].Aging cell,2015,14(6):1085-1093.
[34] 何丹,赵亚楠,陈丹,等.白藜芦醇对脂多糖诱导细胞炎性衰老的抑制作用及机制[J].华西药学杂志,2019,34(4):352-355.
[35] 李玫,李霜,胡健,等.GSDMD介导的细胞焦亡对小鼠骨骼肌肌肉萎缩的影响及机制研究[J].第三军医大学学报,2021,43(15):1486-1492.
[36] ALVES F M,KYSENIUS K,CALDOW M K,et al.Iron accumulation in skeletal muscles of old mice is associated with impaired regeneration after ischaemia-reperfusion damage[J].J Cachexia Sarcopenia Muscle,2021,12(2):476-492.
[37] HUANG Y,WU B,SHEN D,et al.Ferroptosis in a sarcopenia model of senescence accelerated mouse prone 8 (SAMP8)[J].Int JBiol Sci,2021,17(1):151-162.
[38] HAMBRIGHT W S,FONSECA R S,CHEN L,et al.Ablation of ferroptosis regulator glutathione peroxidase 4 in forebrain neurons promotes cognitive impairment and neurodegeneration[J]. Redox biol,2017(12):8-17.
[39] 赵田禾,李欣洋,孙东雷,等.铁离子与铁死亡:衰老研究领域的新大陆[J].现代预防医学,2018,45(23):4392-4395.
[40] VLIETSTRA L,HENDRICKX W,WATERS D L.Exercise interventions in healthy older adults with sarcopenia:a systematic review and meta-analysis[J].Australas J Ageing,2018,37(3):169-183.
[41] TROUWBORST I,VERREIJEN A,MEMELINK R,et al.Exercise and nutrition strategies to counteract sarcopenic obesity[J].Nutrients,2018,10(5):605.
[42] SAWYER B J,BHAMMAR D M,ANGADI S S,et al.Predictors of fat mass changes in response to aerobic exercise training in women[J].J Strength Cond Res,2015,29(2):297-304.
[43] 曾正中.细胞自噬在运动干预延缓衰老性肌萎缩中的作用及机制研究[D].武汉:武汉体育学院,2021.
[44] 徐磊.不同运动方式对SAMP8衰老小鼠骨骼肌自噬和凋亡的影响[D].武汉:武汉体育学院,2019.
[45] 孟繁博.运动联合枸杞多糖延缓衰老小鼠骨骼肌萎缩的机制研究[D].武汉:武汉体育学院,2020.
[46] PETERSON M D,RHEA M R,SEN A,et al.Resistance exercise for muscular strength in older adults:a meta-analysis[J].Ageing Res Rev,2010,9(3):226-237.
[47] PETERSON M D,SEN A,GORDON P M. Influence of resistance exercise on lean body mass in aging adults:a meta-analysis[J].Med Sci Sports Exerc,2011,43(2):249-258.
[48] HELLYER N J,NOKLEBY J J,THICKE B M,et al.Reduced ribosomal protein s6 phosphorylation after progressive resistance exercise in growing adolescent rats[J].J Strength Cond Res,2012,26(6):1657-1666.
[49] SU H,WEN T,LIU D,et al.Effect of 32-weeks high-intensity interval training and resistance training on delaying sarcopenia:focus on endogenous apoptosis[J].Front Physiol,2022(13):811369.
[50] RIBEIRO M B T,GUZZONI V,HORD J M,et al.Resistance training regulates gene expression of molecules associated with intramyocellular lipids,glucose signaling and fiber size in old rats[J].Sci Rep,2017,7(1):8593.
[51] 莫夏.抗阻运动和antagomir-494延缓衰老性肌萎缩症的分子机制[D].武汉:武汉体育学院,2022.
[52] 杨晓棋.运动干预通过调控蛋白质降解通路改善衰老性肌萎缩的分子机制[D].武汉:武汉体育学院,2017.
[53] BURTSCHER J,TICINESI A,MILLET G P,et al.Exercise–microbiota interactions in aging-related sarcopenia[J].J Cachexia Sarcopenia Muscle,2022,13(2):775-780.
[54] BRISAMAR E,OSVALDO C M,MAR A,et al.Effects of a resistance-training programme on endoplasmic reticulum unfolded protein response and mitochondrial functions in PBMCs from elderly subjects[J].Eur J Sport Sci,2019,19(7):931-940.
[55] DALLE S,VAN R E,HIROUX C,et al.Omega3 supplementation improves isometric strength but not muscle anabolic and catabolic signaling in response to resistance exercise in healthy older adults[J].J Gerontol A Biol Sci Med Sci,2021,76(3):406-414.
[56] HURST C,ROBINSON S M,WITHAM M D,et al. Resistance exercise as a treatment for sarcopenia: prescription and delivery[J].Age Ageing,2022,51(2):afac003.
[57] BARTLETT J D,CLOSE G L,MACLAREN D P,et al.High-intensity interval running is perceived to be more enjoyable than moderate-intensity continuous exercise:implications for exercise adherence[J].J Sports Sci,2011,29(6):547-53.
[58] 邱富泉.HIIT对SAMP8小鼠骨骼肌蛋白质代谢影响的研究[D].长沙:湖南师范大学,2020.
[59] 胡帅.高强度间歇训练对中年小鼠骨骼肌自噬信号通路及线粒体复合物的影响[D].苏州:苏州大学,2019.
[60] 尤莉蓉,赵艷,夏志.高强度间歇游泳训练对衰老小鼠骨骼肌蛋白质合成的影响研究[J].中国康复医学杂志,2019,34(1):27-33.
[61] CUI X,ZHANG Y,WANG Z,et al.High-intensity interval training changes the expression of muscle RING-finger protein-1 and muscle atrophy F-box proteins and proteins involved in the mechanistic target of rapamycin pathway and autophagy in rat skeletal muscle[J].Exp physiol,2019,104(10):1505-1517.
