氰烯菌酯胶体金免疫层析方法的建立与验证
2023-06-20孙晨晨胡荣荣宋明姝刘鹏琰张存政
蒋 岚, 孙晨晨, 胡荣荣, 宋明姝, 刘鹏琰,卞 军, 丁 宁*,, 张存政*,,,
(1.南京农业大学 植物保护学院,南京 210095;2.江苏省农业科学院 农产品质量安全与营养研究所,南京 210014;3.安徽科技学院,安徽 凤阳 233100;4.南昌大学 食品学院,南昌 214122;5.宿迁市宿豫区农产品质量检验检测中心,江苏 宿迁 223801)
氰烯菌酯 (phenamacril) 是1998 年由江苏省农药研究所自主研发的2-氰基丙烯酸酯类杀菌剂,结构式见图式1,其可抑制禾谷镰孢菌Fusarium graminearum菌丝生长[1-3],对由镰刀菌引起的小麦赤霉病、水稻恶苗病等具有良好的保护和治疗作用[4-6],对于抗多菌灵的耐药菌株也有良好的防治效果,可作为替代药剂使用[7],同时对小麦、水稻等作物生长安全[8]。毒理学试验表明,氰烯菌酯对小鼠骨髓细胞微核、小鼠睾丸细胞染色体等未有致突变作用,但对鱼、蜜蜂、鸟、家蚕等生物具有毒害作用[9]。我国规定其在谷物中的最大残留限量 (MRL) 为0.05 mg/kg[10]。

图式1 氰烯菌酯的化学结构式Scheme 1 Chemical structure of phenamacril
目前,氰烯菌酯的残留检测方法主要为高效液相色谱法和气相色谱法等。王金菊等采用反相高效液相色谱法对氰烯菌酯进行含量分析,平均回收率为99.3%,标准偏差为0.501,变异系数为0.505%[11]。结合QuEChERS前处理方法,分别建立超高效液相色谱-串联质谱法和气相色谱-质谱方法,测定粮谷中氰烯菌酯残留量,平均回收率在82%~108%,相对标准偏差为1.1%~10%,定量限分别为0.5 和5 ng/g[12-13]。然而,基于仪器的检测方法虽检测限较低,但需要专业的实验室操作人员、复杂的前处理和精密的实验室仪器,从而限制了它们在现场快速筛查中的应用。因此,建立一种快速、通用性强、灵敏度高的现场检测方法将助力于保障食品安全。
免疫分析技术作为仪器方法的补充,具有高效、快速、成本低廉等优点,适用于现场定性分析[14],例如酶联免疫吸附分析 (ELISA)、化学发光免疫分析 (CLIA)、胶体金免疫分析 (GICA) 等,其中酶联免疫吸附分析技术及胶体金免疫技术等在农药残留检测中应用较广[15]。许俊丽等[16]建立了胶体金免疫层析试纸条法检测农作物中戊唑醇残留,检出限为6.25 ng/mL;Guo 等[17]建立的胶体金免疫分析方法,对于鸡胸肉中的卡巴多克斯裸眼检出限可达8 ng/g。目前对氰烯菌酯的免疫分析技术研究国内外未见报道,本研究根据氰烯菌酯的化学结构,设计、合成了半抗原,制备了对氰烯菌酯具有特异性的单克隆抗体,进一步建立了胶体金免疫层析试纸条分析方法。氰烯菌酯半抗原的合成路线见图式2。选取结构类似物杀菌剂嘧菌酯、吡唑醚菌酯、氟醚菌酰胺和啶氧菌酯,用于交叉反应试验,以验证其特异性。各化合物结构式见图式3。

图式2 氰烯菌酯半抗原合成路线图Scheme 2 Synthetic route of phenamacril hapten

图式3 嘧菌酯、吡唑醚菌酯、氟醚菌酰胺和啶氧菌酯的结构式Scheme 3 Structural formula of azoxystrobin, pyraclostrobin, fluopimomide and picoxystrobin
1 材料与方法
1.1 仪器与试剂
XYZ3050TM 胶体金喷膜机 (Bio-Dot 公司);ZQ2000 微电脑自动斩切机 (上海金标生物科技有限公司);Lambda25UV/VIS spectrometer 双光束紫外可见分光光度计 (PerkinElmer 公司);Multiscan ascent 酶标仪 (Thermo 公司);硝酸纤维素膜(NC 膜)、金标结合垫和吸水垫 (Millipore 公司);聚氯乙烯 (PVC) 底板和样品垫 (上海金标科技生物有限公司);DNP-9082 电热恒温鼓风干燥箱 (上海精宏仪器设备有限公司);Water ProPS 超纯水净化仪 (美国LabConco 公司);LC-MS/MS-8030 液相色谱-串联质谱联用仪 (Shimadzu Corporation,Japan)。
1000 μg/mL 氰烯菌酯 (phenamacril) 标准品母液 (江苏省农药研究所股份有限公司);100 μg/mL嘧菌酯、100 μg/mL 吡唑醚菌酯、100 μg/mL 氟醚菌酰胺和100 μg/mL 啶氧菌酯标准品母液 (Dr.Ehrenstorfer);抗原及单克隆抗体由江苏省农业科学院农产品质量安全与营养研究所实验室制备;兔抗鼠IgG (伊佰新生物技术有限公司);牛血清蛋白 (BSA)、卵清蛋白 (OVA)、氯金酸 (HAuCl4• 3H2O)和二水合柠檬酸三钠 (C6H5Na3O7• 2H2O) (Sigma公司);其他试剂均为分析纯 (西陇化工股份有限公司)。Balb/c 小白鼠 (扬州大学比较医学中心)。供试9 个面粉样品分别购于盒马超市、苏果超市和当地菜市场,经质谱检测均未含氰烯菌酯。
1.2 抗原的制备
1.2.1 半抗原的合成
1.2.1.1 苯甲亚胺酸乙酯盐酸盐 (1) 以及中间体(2) 的合成 将苯甲腈 (30 g,0.3 mol)、无水乙醇(17.0 g,0.36 mol) 和60 g 二氯乙烷加入反应瓶中,搅拌冷却。将160 g 浓盐酸缓慢滴入200 g 浓硫酸中,产生的氯化氢气体经干燥后通入反应瓶中,持续通气8 h 后搅拌反应24 h。反应完毕后转移至冰水浴中搅拌8 h,有固体析出,过滤烘干,得苯甲亚胺酸乙酯盐酸盐 (1)。取化合物1 (15.02 g,81.1 mmol) 溶于100 mL 水中,加入碳酸氢钠(6.812 g,81.1 mmol) 使pH 值为8.0,依次用200、100、50 mL 乙酸乙酯萃取,无水硫酸镁干燥过夜后过滤,浓缩得中间体2。
1.2.1.2 4-羟基丁酸叔丁酯 (3) 的合成 向20 mL四氢呋喃 (THF) 中加入丁二酸单叔丁酯 (2.12 g,12.2 mmol),冷却至0°C,缓慢滴入2 mol/L 溶于THF 的硼烷二甲硫醚 (BH3• Me2S) 共6.6 mL。加入100 mL 乙酸乙酯和70 mL 质量分数为2%的碳酸钠,静置。水层用50 mL 乙酸乙酯萃取2 次,合并有机相,用氯化钠饱和溶液洗涤2 次,加入无水硫酸镁干燥过夜。过滤,浓缩,得 1.17 g 化合物3。
1.2.1.3 4- (2-氰基乙酰氧基) 丁酸叔丁酯 (4) 合成
将氰乙酸 (1.48 g,17.4 mmol)、化合物3 (1.856 g,11.6 mmol) 和二甲氨基吡啶 (DMAP) (0.71 g,5.8 mmol) 溶于30 mL 二氯甲烷中,降温至0 °C,加入二环己基碳二亚胺 (DCC) (6.13 g,23.2 mmol),搅拌过夜。过滤,将滤液蒸干,加入100 mL 乙酸乙酯,有固体析出,过滤。再分别用50 mL 和30 mL质量分数为5%的碳酸氢钠以及50 mL 和30 mL质量分数为5%的硫酸氢钠洗涤,然后用氯化钠饱和溶液洗涤2 次,有机相中加入无水硫酸镁干燥过夜。过滤,浓缩,得2.90 g 化合物4。
1.2.1.4 (E)-4-((3-氨基-2-氰基-3-苯基丙烯酰基) 氧基) 丁酸叔丁酯 (5) 合成 将中间产物2 (2.7 g,18.12 mmol)、化合物4 (2.63 g,11.6 mmol) 和咪唑 (IMI) (0.394 g,5.8 mmol) 溶于60 mL 甲苯中,转入100 ℃油浴,反应24 h,加入50 mL 水和50 mL乙酸乙酯,用50 mL 质量分数为5%的硫酸氢钠洗涤2 次,再用50 mL 质量分数为5%的碳酸氢钠洗涤,加入无水硫酸镁干燥过夜。过滤,浓缩。用乙酸乙酯和正己烷重结晶,得1.03 g 化合物5 。
1.2.1.5 氰烯菊酯半抗原 (6) 合成 参考文献方法[18]将化合物5 (0.68 g,2.06 mmol) 溶于6 mL 二氯甲烷中,加入4 mL 三氟乙酸 (TFA),室温搅拌过夜。加入8 mL甲苯,减压浓缩后干燥,得黄色黏稠物。用乙酸乙酯和正己烷重结晶。过滤得固体即为氰烯菊酯半抗原 (hapten,6)。结构见图式2。
1.2.2 抗原制备 采用碳二亚胺法[19]并稍作修改。将氰烯菌酯半抗原分别与BSA、OVA 偶联制备免疫原及包被原。取2.2 mg 半抗原、2.3 mgN-乙基-N′-(3-二甲基氨丙基)碳二亚胺 (EDC)、1 mgN-羟基琥珀酰亚胺 (NHS) 溶解于0.5 mLN,N二甲基甲酰胺 (DMF) 中,室温下搅拌过夜。称取载体蛋白BSA 13.3 mg 和OVA 9.1 mg,分别溶解于1 mL 0.05 mol/L pH=9.6 的碳酸盐缓冲液 (CBS)中,然后各自缓慢加入过夜的反应溶液中,搅拌反应9 h。反应结束后,将所得溶液用0.1 mol/L pH = 7.4 的磷酸盐缓冲液 (PBS) 透析3 d,即得到所需完全抗原,于 -20℃保存,备用。
1.3 单克隆抗体的制备
1.3.1 动物免疫 选取6~8 周龄的Balb/c 小白鼠10 只,饲养7 d 使其适应环境,同时进行尾部采血获得阴性血清。首次免疫时取1 mg/mL 的免疫原50 μL 与氟氏完全佐剂等体积混合进行乳化,对小鼠进行皮下多点注射。间隔21 d 后进行3 次加强免疫,每次免疫间隔14 d,加强免疫时采用氟氏不完全佐剂代替氟氏完全佐剂,对每只小鼠腹腔注射含有50 μg 抗原的混合液100 μL。每次加强免疫7 d 后对小鼠进行尾部采血,于4 ℃下静置过夜,次日于4 ℃、10 000 r/min 下离心8 min,取上清液,即为所需多抗血清,以此进行免疫效果监测。于3 次加强免疫后的第15 天进行末次冲击免疫。
1.3.2 细胞融合及单克隆抗体制备 选择免疫应答效果最好且血清效价较高的小鼠,摘取脾脏,按SP2/0 : 脾细胞数量比值为1 : 5 的比例进行细胞融合。杂交瘤细胞制备方法参照吴建祥等[20]的方法。细胞融合后,定期用ELISA 法检测融合后细胞上清的抗体效价及对氰烯菌酯识别情况。经若干次亚克隆后,获得由单个细胞分裂生长形成的杂交瘤细胞株。
对筛选获得的杂交瘤细胞株进行扩大培养后,注入石蜡脱敏的Balb/c 小鼠体内制备腹水。获得的腹水经Protein G 柱纯化后,进行SDS-PAGE 凝胶电泳,鉴定抗体纯化效果。
1.4 胶体金纳米材料的制备与鉴定
采用柠檬酸三钠法制备胶体金[21]并稍作修改。向250 mL 锥形瓶中依次加入200 mL 蒸馏水、1 mL质量分数为1%的HAuCl4溶液,轻轻晃动至混合均匀后置于微波炉中加热5 min 至沸腾。取出锥形瓶,迅速顺时针晃动,并快速加入4.8 mL 经0.22 μm 滤膜过滤的质量分数为1%的柠檬酸三钠溶液,继续沿顺时针方向轻轻晃动锥形瓶,混合均匀后再次置于微波炉中加热5 min,得酒红色液体即为胶体金溶液。室温下避光冷却后,加入去离子水定容至200 mL,混匀后于4 ℃避光保存。用紫外分光光度计测定所得胶体金的最大吸收峰,透射电镜鉴定胶体金颗粒的粒径大小。
1.5 胶体金标记抗体检测探针的制备
1.5.1 标记反应最佳pH 值以及抗体用量优化取10 个2 mL 离心管,分别加入1 mL 胶体金溶液后依次加入0、1、2、3、4、5、6、7、8 和9 μL 0.1 mol/L 的K2CO3调节pH 值,混匀后,向各离心管中加入20 μL 氰烯菌酯单克隆抗体 (0.97 mg/mL),轻轻晃动至混合均匀,室温下静置反应2 h。选取未出现沉淀的溶液,测定其在400~600 nm 处的紫外吸收光谱,吸光值最大的胶体金溶液所对应的pH 值即为最佳pH 标记值。
取8 个2 mL 离心管,分别加入1 mL 胶体金溶液,再加入适量的0.1 mol/L 的K2CO3调节溶液pH 值至上述筛选出的最佳pH 值,然后依次加入0、10、15、20、25、30、35 和40 μL 氰烯菌酯单克隆抗体 (0.97 mg/mL),混匀后室温下静置5 min,向各离心管中分别加入100 μL 质量分数为10%的NaCl 溶液,静置5 min 后观察各管溶液的颜色变化。当溶液颜色随抗体用量的增加未出现明显变化时,将氰烯菌酯单克隆抗体的最小用量判断为最佳抗体标记量。
1.5.2 胶体金标记抗体探针的制备 取5 mL 胶体金溶液,加入适量的0.1 mol/L 的K2CO3调节至上述筛选出的最佳pH 值,边搅拌边缓慢加入适量的氰烯菌酯单克隆抗体 (即1.5.1 节中筛选出的抗体浓度),室温下搅拌30 min。加入10% BSA溶液至BSA 的质量浓度为10 mg/mL,继续搅拌30 min。反应结束后于1500 r/min 下离心30 min。弃上清液,加入0.5 mL 洗涤保存液 (0.01% 硼酸,0.2% PEG 20000 和0.02% NaN3) 重悬沉淀,得胶体金标记氰烯菌酯单克隆抗体探针溶液,于4℃避光保存。
1.6 胶体金免疫层析试纸条的制备
1.6.1 试纸条的组装 胶体金免疫层析试纸条主要由PVC 底板、吸水垫、NC 膜、质控线 (C 线)、检测线 (T 线)、金标结合垫和样品垫7 个部分构成(图1)。组装步骤:用喷膜仪在NC 膜上喷涂兔抗鼠抗体作为C 线、氰烯菌酯包被原作为T 线,两者间隔4 mm,将NC 膜贴在PVC 底板的中间位置,将金标氰烯菌酯单抗喷涂在金标结合垫上。于37 ℃干燥6 h 后,将吸水垫、金标结合垫和样品垫依次贴在PVC 底板上,其中吸水垫、金标结合垫与NC 膜重合1 mm,样品垫与金标结合垫重合1 mm。组装完成后,用自动切割仪切割为3.5 mm × 60.0 mm 的试纸条,于干燥条件下保存,备用。

图1 胶体金免疫层析试纸条构成截面图Fig.1 Cross-section illustration of colloidal gold immunochromatographic strip
1.6.2 胶体金免疫层析试纸条检测结果的判定将100 μL 待测样品或体积分数为10% 的甲醇-PBS 稀释的氰烯菌酯标准品溶液滴加在样品垫上,15 min 后观察检测结果。1) 当样品液中不含氰烯菌酯或含量极少时,部分金标抗体与固定在T 线上的包被原结合,过量的金标抗体与固定在C 线上的兔抗鼠抗体结合,形成肉眼可见的红色条带。此时C 线和T 线均为红色条带,结果判定为阴性。2) 当样品液中含有氰烯菌酯的质量浓度高于50 ng/mL时,部分金标抗体与样品液中的氰烯菌酯结合,T 线较C 线颜色明显变浅或不显色,C 线仍为红色,结果判定为阳性。3) 当C 线未显现红色条带时,无论T 线是否显色,均视为无效结果[22]。
1.7 胶体金免疫层析试纸条的交叉反应
选取结构类似物杀菌剂嘧菌酯、吡唑醚菌酯、氟醚菌酰胺和啶氧菌酯,用于交叉反应试验。用体积分数为10%的甲醇-PBS 溶液将上述标准品稀释至质量浓度为1.0 μg/mL,分别用于试纸条检测,观察结果并判断交叉反应情况。
1.8 样品处理及提取溶剂的选择
称取5 g 面粉至50 mL 离心管中,加入氰烯菌酯标准品溶液,配制成31.25、50、62.5、125和250 ng/mg 的系列添加样品。加入10 mL 超纯水,涡旋1 min 后,分别以25 mL 体积分数为10%的甲醇-PBS、乙腈、甲醇和丙酮作为溶剂,振荡提取15 min。随后除10%甲醇-PBS 的样品外,其他样品中分别加入3 g NaCl,振荡30 min 后于4000 r/min 下离心5 min,静置。吸取上层有机相,采用液相色谱-串联质谱 (LC-MS/MS) 方法[23]测定各溶剂的提取效果。同时,分别吸取1 mL 上层有机相溶液,氮气吹干后,用10%的甲醇-PBS 复溶,并依据基质干扰情况进行系列梯度稀释,用于试纸条检测。
1.9 方法验证及实际样品测定
利用构建的试纸条方法和仪器LC-MS/MS 参比方法,测定供试9 个面粉样品中氰烯菌酯含量。
采用人工添加氰烯菌酯,对上述购买阴性面粉样品 (如样品1) 进行添加回收试验,添加水平分别为15.63、31.25、50 和62.5 ng/mg,对应的编号为1-1、1-2、1-3 和1-4。分别采用胶体金免疫层析试纸条与LC-MS/MS 方法对上述4 个药物添加面粉样品进行测定。
2 结果与分析
2.1 氰烯菌酯半抗原和完全抗原的鉴定
氰烯菌酯半抗原分子式为C14H14N2O4,相对分子质量为274,检测结果274.2,结合核磁氢谱结果:1H NMR (400 MHz, DMSO-d6)δ12.18 (s,1H, -COOH), 9.23 (s, 1H, -NH), 8.97 (s, 1H, -NH),7.64-7.46 (m, 5H, Ar-H), 4.15 (t,J= 6.5 Hz, 2H,-OCH2-, 2.32 (t,J= 7.4 Hz, 2H, -CH2CO-), 1.85(p,J= 6.9 Hz, 2H, -CH2),表明半抗原合成成功。
用全波长紫外分光光度计在220~400 nm 范围内进行氰烯菌酯半抗原、载体蛋白、偶联物的最大吸收峰扫描,由紫外吸收光谱 (图2) 可知,偶联抗原出现了明显的吸收峰偏移,由此判断偶联成功。经质谱鉴定 (MALDI-TOF),半抗原与BSA和OVA 载体蛋白的偶联比分别为33 : 1 和26 : 1。
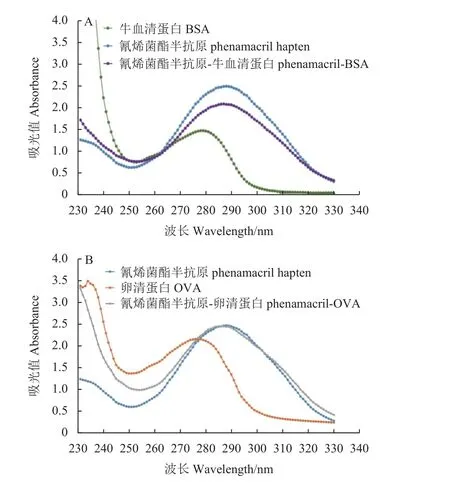
图2 (A) 氰烯菌酯半抗原、BSA 和免疫原紫外光谱图;(B) 氰烯菌酯半抗原、OVA 和包被原紫外光谱图Fig.2 UV-vis spectra of (A) phenamacril hapten, BSA,phenamacril-BSA; (B) phenamacril hapten, OVA,phenamacril-OVA
2.2 抗体纯化与性能鉴定
将获得的腹水单克隆抗体进行G 蛋白柱纯化后,经由SDS-PAGE 凝胶电泳进行鉴定,结果如图3 所示,有明显的轻链 (25 kD)、重链 (50 kD)条带,且无其他杂带,由此判断抗体纯化效果良好。纯化所获得抗体经考马斯亮蓝法测定其质量浓度为0.98 mg/mL。

图3 SDS-PAGE 鉴定单克隆抗体的纯化效果Fig.3 Identification of purified monoclonal antibody by SDS-PAGE
ELISA 方法鉴定单克隆抗体对氰烯菌酯的抑制关系曲线如图4 所示,线性范围为质量浓度38.72~438.01 ng/mL,线性方程为y= -0.168 ln(x) +1.2954,IC50= 108.42 ng/mL。

图4 氰烯菌酯单克隆抗体对氰烯菌酯标准品的抑制曲线Fig.4 Inhibitory curve of mAb against phenamacril
通过间接竞争ELISA 方法测定氰烯菌酯单克隆抗体对结构类似物杀菌剂的识别效果。检测结果表明,嘧菌酯、吡唑醚菌酯、氟醚菌酰胺和啶氧菌酯的IC50均大于5000 ng/mL,交叉反应率小于0.01%,几乎未见交叉反应,说明本研究所制备的氰烯菌酯单克隆抗体对氰烯菌酯的特异性较高。
2.3 胶体金纳米颗粒的鉴定
用紫外分光光度计在400~600 nm 波长范围内测定胶体金溶液的吸收光谱,如图5A 所示:所制备的胶体金溶液的最大吸收波长在517 nm 处,最大吸光值为0.7296。透射电镜结果 (图5B) 显示,制备的胶体金纳米颗粒分散均匀、无聚集现象,粒径约为15 nm。

图5 胶体金溶液吸收光谱(A)和透射电镜图(B)Fig.5 Absorption spectrum (A) and TEM image (B) of colloidal gold solution
2.4 胶体金标记抗体探针最佳pH 值以及抗体用量优化
将氰烯菌酯单克隆抗体加入到含有不同体积0.1 mol/L K2CO3的胶体金溶液中,静置2 h 后观察。如图6 所示,除加入7 μL 0.1 mol/L K2CO3的胶体金溶液外,其余均出现了不同程度的聚沉,由此选择加入7 μL 0.1 mol/L K2CO3,即pH =6.48 为最佳标记pH 值。

图6 胶体金标记氰烯菌酯单克隆抗体的最佳 pH 值Fig.6 The optimal pH value for preparation of colloidal gold-labeled mAb
加入质量分数为10%的NaCl 后,游离的胶体金颗粒由于盐离子作用发生聚沉,使得胶体金溶液由酒红色变为灰蓝色,而与抗体结合的胶体金颗粒仍能保持较好的分散性,胶体金溶液仍保持酒红色。通过观察溶液颜色可知 (图7),当加入抗体量为0~15 μL,即质量浓度为0~14.7 μg/mL时,溶液呈现灰蓝色;当加入抗体量15~25 μL,即质量浓度为14.7~24.5 μg/mL 时,溶液呈现紫红色;当加入抗体量30 μL 即质量浓度为29.4 μg/mL时,溶液呈现酒红色,此后增加抗体含量至35 μL和40 μL,溶液颜色依然为酒红色,未出现明显变化。由此确定,氰烯菌酯单克隆抗体的最小标记质量浓度为为29.4 μg/mL。

图7 胶体金标记氰烯菌酯单克隆抗体的最小浓度Fig.7 The minimum mAb concentration labeled with colloidal gold
2.5 试纸条质控线与检测线的设置与优化
优化NC 膜上质控线 (C) 和检测线 (T) 的喷涂浓度。固定C 线喷涂兔抗鼠IgG 浓度为1 mg/mL,改变T 线包被原喷涂质量浓度分别为0.2、0.3、0.4、0.5 和0.6 mg/mL。如图8 所示,当T 线喷涂包被原的浓度为0.3 mg/mL 时,C 线与T 线均能显现清晰的红色条带,且颜色最为相近。由此选择最优C 线兔抗鼠IgG 的质量浓度为1 mg/mL,T 线包被原的质量浓度为0.3 mg/mL。

图8 试纸条质控线与检测线的优化Fig.8 Optimization of quality control line and detection line of the test strip
2.6 试纸条检测灵敏度与特异性验证
以裸眼观察试纸条T 线红色条带明显减弱时的最低氰烯菌酯的质量浓度作为试纸条裸眼观察检出限 (LOD)。用体积质量分数为10%的甲醇-PBS 溶液配制31.25~125 ng/mL 系列梯度的氰烯菌酯标准品溶液进行检测。如图9 所示,随着氰烯菌酯质量浓度的升高,T 线的红色条带逐渐变淡,当氰烯菌酯质量浓度达到50 ng/mL 时,T 线明显变弱,而C 线的红色条带无明显变化。因此本次研制的胶体金试纸条的检出限为50 ng/mL。
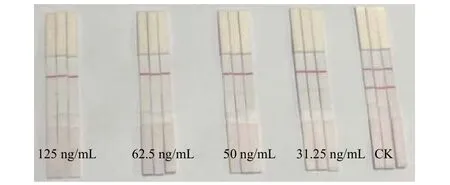
图9 试纸条测定氰烯菌酯的检出限Fig.9 The limit of detection (LOD) of phenamacril measured by the test strip
与嘧菌酯、啶氧菌酯、氟醚菌酯和吡唑醚菌酯的交叉反应结果如图10 所示,除氰烯菌酯外,检测其他药剂的试纸条T 线均未有变化,保持红色条带,表明此胶体金试纸条对氰烯菌酯具有良好的特异性。

图10 试纸条与嘧菌酯、啶氧菌酯、氟醚菌酰胺、吡唑醚菌酯的交叉反应 (1 μg/mL)Fig.10 Cross reactivity of lateral flow test strip for the detection of azoxystrobin, picoxystrobin, fluopimomide,and pyaclostrobin(1 μg/mL)
2.7 不同提取溶剂对氰烯菌酯提取效果的比较
向面粉样品中分别添加15.63、31.25、50 和62.5 ng/mg 的氰烯菌酯,分别经10% 的甲醇-PBS、乙腈、甲醇和丙酮对氰烯菌酯进行提取后,采用LC-MS/MS 方法测定各溶剂的提取效果。如表1所示,提取效果为乙腈 > 丙酮 > 甲醇 > 10%甲醇-PBS,由此,选取乙腈作为提取溶剂。

表1 采用LC-MS/MS 方法测定不同溶剂对氰烯菌酯的提取效果Table 1 Extraction efficiency of different solvents determined by LC-MS/MS
2.8 基质干扰
面粉样品经乙腈提取,将提取液用10%甲醇-PBS 稀释10 倍后直接用于试纸条检测,未出现基质干扰。结果如图11 所示,在稀释10 倍后,样品基质对试纸条基本无影响,裸眼观测灵敏度为50 ng/mg。

图11 添加样品中氰烯菌酯的试纸条检测结果Fig.11 Results of test strip for phenamacril in spiked samples
2.9 方法验证及其应用
如表2 所示,盒马超市购买的氰烯菌酯阴性面粉样品中,当氰烯菌酯添加水平≥50 ng/mg时,胶体金免疫层析试纸条检测结果呈强阳性;当添加水平为15.63~50 ng/mg 时,结果呈弱阳性;当添加水平 < 15.63 ng/mg 时,检测结果为阴性。所有检测结果均一致,试验重复性较好。将胶体金免疫层析试纸条检测结果与LC-MS/MS 检测结果进行对比,两种方法的检测结果均一致。

表2 胶体金免疫层析试纸条法与LC-MS/MS 法检测面粉样品的结果比较Table 2 Comparison of the detection results of flour samples between GICA and LC-MS/MS
采用胶体金免疫层析试纸条检测盒马超市、苏果超市和菜市场购买的9 个面粉样品中氰烯菌酯。结果 (表2) 表明:9 份样品均为氰烯菌酯阴性,且LC-MS/MS 参比方法未检测到氰烯菌酯残留。上述结果表明当前市售面粉中氰烯菌酯残留风险较小。
3 结论
本研究制备并获得了对氰烯菌酯具有高灵敏度及强特异性的单克隆抗体,并以此单克隆抗体作为核心试剂研发了胶体金免疫层析试纸条检测方法。所制备的试纸条对氰烯菌酯的裸眼检出限为50 ng/mL,与嘧菌酯、啶氧菌酯、氟醚菌酰胺和吡唑醚菌酯等结构类似的农药无明显交叉反应。向小麦面粉基质中添加氰烯菌酯标准品,样品经乙腈提取后,采用本研究所建立的胶体金免疫层析试纸条法进行检测,同时用LC-MS/MS方法进行验证。结果表明,该试纸条检测灵敏度满足国家规定的谷物小麦中的MRL 值0.05 mg/kg的检测要求。该方法易于操作,简单快速,准确度高,弥补了传统仪器法操作繁琐、耗时、不便携等缺点,适用于面粉中氰烯菌酯的快速定性和半定量检测,具有较好的应用潜力。可为其他粮谷类样品中氰烯菌酯残留的快速检测提供参考。
