灌浆期郑麦1860旗叶的光合速率及叶绿体超微结构分析
2023-06-20宋宇航张孟寒周瑞祥陈新宜齐学礼汪月霞
宋宇航,张孟寒,周瑞祥, 陈新宜,华 夏,齐学礼,汪月霞,李 艳
(1.河南农业大学生命科学学院,河南郑州 450002; 2.河南省农业科学院作物分子育种研究院,河南郑州 450002)
小麦产量的90%~95%来自光合作用[1],其中30%~50%来自于旗叶的光合作用,因而,旗叶光合能力的强弱与小麦产量密切相关[2]。小麦灌浆前中期是旗叶捕获光能进行光合作用以及积累光合产物最高效、快速的时期[3]。因此,探索调控小麦灌浆前中期旗叶光合效率的机制,对于揭示小麦产量相关性状的形成以及选育高产品种至关重要。
叶绿素是植物进行光合作用的主要色素,高叶绿素含量是保证高光合速率以及累积更多光合产物的前提[4]。Sperdouli 等[5]研究表明,叶绿素、ATP和NADPH酶的含量及其活性在很大程度上反映了小麦将光能转化为化学能的能力。小麦在进行光合作用时,叶绿体作为光合细胞器将光能转化为同化力( ATP和NADPH),进而参与后续碳同化过程[6]。叶绿体光合作用所固定的大部分碳以淀粉的形式储存在叶片中,在夜间降解后主要以蔗糖的形式转移至籽粒[7]。叶片中贮存的淀粉以淀粉粒的形式存在,但淀粉粒在叶片中过度积累会导致叶绿体变形,破坏其结构[8]。利用透射电镜可以直观地看到叶绿体的各种亚细胞结构,包括类囊体、淀粉粒以及反映叶绿体受损程度的嗜锇颗粒[9],随着叶片衰老,叶绿体结构发生明显变化,嗜锇颗粒明显增多[10],叶绿体结构的破坏进一步导致光合性能发生紊乱[11]。前人对小麦叶片的光合特性和叶绿体结构变化研究的比较深入,而对灌浆期叶片衰老过程中的光合特性及其与叶绿体结构间的相关性尚不明确。
本研究以河南省农业科学院分子育种团队最新培育的绿色超高产小麦新品种郑麦1860为主要研究对象[12],同时选取河南省已经大面积种植的品种百农207和周麦18为对照,这两个小麦品种与郑麦1860成熟期相当,具备产量高、抗逆性强等特点[13],通过对比不同小麦品种间叶绿体的超微结构、光合作用过程中的关键酶活性及光合产物含量等差异,探究小麦籽粒灌浆过程中旗叶叶绿体结构与光合速率及产物含量之间的相关性,以期为高产小麦品种的培育提供理论基础。
1 材料与方法
1.1 试验材料及处理
供试材料为小麦品种郑麦1860、百农207和周麦18,于2020年10月21日在河南省农业科学院人工气候室进行。选用底部带孔的塑料盆 (46 cm×34 cm×15 cm),每盆填充8 kg的土壤 (营养土∶蛭石=3∶1),土壤含碱解氮51 mg·kg-1、速效磷140 mg·kg-1和速效钾240 mg·kg-1。每个小麦品种每盆定苗30株 (分3列,每列10株),每个品种种植10盆。生长期间保持土壤最大持水量的70%以上,并于分蘖期施肥1次,拔节期、孕穗期和灌浆期每2个星期施肥1次,每次每盆施肥15 g,肥料包含氯化钾 (含K2O 60% )、尿素 (含N 46%) 和磷酸二铵 (含P2O546%,N 18% )。小麦抽穗开花期温室设置参数:白天20 ℃/晚上18 ℃,光照14 h/黑暗10 h,光照强度1 000 μmol·m-2·s-1,相对湿度40%;花后灌浆期温室设置参数:白天23 ℃/晚上20 ℃ ,光照14 h/黑暗10 h ,光照强度1 200 μmol·m-2·s-1,相对湿度40%。
1.2 测定项目与方法
于小麦开花期,选择同一天开花(开花率达到50%以上)且长势一致的3个小麦品种进行挂牌标记并记录开花日期[14]。
1.2.1 旗叶光合参数测定
于花后15~21 d每天上午9:00-11:00,用CIRAS-3 光合测定仪(PP Systems,美国)测定标记小麦旗叶的净光合速率(Pn) 、气孔导度(Gs)和细胞间隙CO2浓度 (Ci),固定光照强度设置为1 200 μmol·m-2·s-1。
1.2.2 旗叶叶绿素含量测定
取花后15~21 d的旗叶100 mg左右,剪成大小均匀的碎片后,按照李合生[15]的方法,将样品浸泡于10 mL丙酮乙醇混合提取液(乙醇∶丙酮∶水的体积比=4.5∶4.5∶1)中黑暗处理18 h,分别在663 nm和645 nm波长下测定吸光度(A663和A645),根据以下公式计算叶绿素含量:
Ca=9.874×A663-0.990×A645;
Cb=21.426×A645-4.650×A663;
CT= (Ca+Cb)×10/M
其中,Ca、Cb分别为叶绿素a和b的含量;CT为叶绿素总量,是叶绿素a和b的含量之和;M为旗叶鲜重。
1.2.3 旗叶叶绿素相对含量(SPAD值)测定
选取花后15~21 d的旗叶叶中部位,避开叶中脉,使用叶绿素SPAD 502 PLUS仪器( Konica Minolta,日本) 测定旗叶叶绿素相对含量。
1.2.4 旗叶ATP酶活性测定
取花后15和21 d的新鲜旗叶0.1 g,置于预冷的研钵中,用液氮彻底研磨至白色粉末,4 ℃ 8 000 g离心10 min后取上清,按照ATP酶活性检测试剂盒 (索莱宝,北京)说明书的方法测定吸光度,并计算ATP酶活性。
1.2.5 旗叶NADPH酶含量测定
取花后15和21 d的新鲜旗叶约0.1 g,冰浴研磨后于95 ℃水浴5 min。然后于4 ℃ 10 000 g离心10 min后取上清液,按照辅酶II NADP (H) 含量测定试剂盒 (科铭,苏州) 说明书的方法测定吸光度,并计算NADPH酶含量。
1.2.6 旗叶蔗糖和淀粉含量测定
取花后15和21 d的新鲜旗叶约0.1 g,用间苯二酚比色法[16]测定小麦旗叶蔗糖含量,用蒽酮比色法[17]测定小麦旗叶淀粉含量。
1.3 总RNA的提取和基因转录表达水平的测定
取花后15和21 d的新鲜旗叶,用KK Fast Plant Total RNA Kit (离心柱型) 试剂盒(庄盟国际,北京)提取小麦旗叶总RNA,用核酸蛋白检测仪(赛默飞,美国) 检测总RNA浓度和纯度,用HiScript II Q RT SuperMix for qPCR试剂盒 (诺唯赞,南京) 合成cDNA第一条链。参照NCBI数据库提供的TaSS、TaFBA和TaSSSⅡ基因的保守区域片段,用Primer 5.0设计引物 (表1),并由尚亚生物技术公司合成。按照SYBR Green Pro Taq HS预混型qPCR试剂盒(艾科瑞,长沙)说明书的反应体系和反应程序,在Bio-Rad iQTm5实时荧光定量PCR仪(伯乐,美国)上进行实时荧光定量PCR。每个处理3次生物学重复,以β-actin[20]为内参基因,采用2-△△Ct法[18]计算各基因的相对表达量。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences for quantitative real-time PCR
1.4 叶绿体超微结构观察
取花后15和21 d的小麦新鲜旗叶,将其切成小块(约1 mm×3 mm),浸泡于3%的戊二醛固定液中进行预固定,冰置;然后用1%的四氧化锇 (哈灵,上海)进行再固定,分别用30%、50%、70%、90%、100% ( 100%重复两次)的丙酮进行逐级梯度脱水,每次进行12 min,采用Epon 812包埋。利用半薄切片光学定位后,进行超薄切片,用枸橼酸铅及醋酸铀双重染色,用HITACHI HT7700型透射电镜 ( 日立,日本)进行观察[19]。
1.5 数据分析
用Excel 2013 进行数据分析和处理,数值以3个生物学重复的平均值±标准误表示,用DPS通过Duncan新复极差法检验差异显著性 (α<0.05),用Origin 2021绘制图表。
2 结果与分析
2.1 三个小麦品种旗叶光合参数的比较
测定结果(表2)表明,花后15~21 d,郑麦1860的旗叶净光合速率(Pn) 、细胞间隙CO2浓度(Ci)和气孔导度(Gs) 波动相对平缓。在绝大多数时间点,百农207和周麦18的Pn、Ci和Gs均显著低于郑麦1860,只有少数时间点例外。如,花后16 d,百农207的Pn与郑麦1860无显著差异;花后17 d,百农207的Gs显著高于郑麦1860,周麦18的Gs与郑麦1860无显著差异,百农207和周麦18的Ci均显著高于郑麦1860。这表明郑麦1860旗叶光合能力相对较高。

表2 灌浆期三个小麦品种的旗叶光合参数Table 2 Photosynthetic parameters of flag leaves of the three wheat varieties during grain filling stage
2.2 三个小麦品种旗叶叶绿素含量的比较
花后15~21 d,郑麦1860、百农207和周麦18的旗叶叶绿素ɑ、叶绿素b、叶绿素总含量和SPAD值之间波动趋势相似,且较为稳定(表3)。对于叶绿素ɑ含量,郑麦1860在花后16 d和19 d显著高于周麦18,在花后17、18和21 d显著高于百农207和周麦18,而在花后15 d三个品种间无显著差异;对于叶绿素b含量,郑麦1860在花后16 d显著高于周麦18,在花后18 d显著高于百农207和周麦18,而在其他时间点三个品种间无显著差异;对于叶绿素总含量,郑麦1860在花后15 d显著高于百农207,在花后16 d和21 d显著高于周麦18,在花后18 d显著高于百农207和周麦18,而在花后17 d三个品种间无显著差异;对于SPAD值,郑麦1860在花后18~21 d显著高于周麦18,而在花后15 d郑麦1860与百农207和周麦18间均无显著差异,在花后16 d和17 d三个品种间均无显著差异。这说明相对于其他两个品种,郑麦1860能够保持较高的叶绿素含量,有利于在灌浆前中期捕获更多的光能。

表3 灌浆期三个小麦品种的旗叶叶绿素含量和SPAD值Table 3 Chlorophyll contents and SPAD values in flag leaves of the three wheat varieties during grain filling stage
2.3 三个小麦品种旗叶ATP酶活性和NADPH酶含量的比较
对三个小麦品种花后15 d和21 d的ATP酶活性和NADPH酶含量进行测定,从表4可以看出,对于ATP酶活性,花后15 d三个品种间无显著差异;花后21 d郑麦1860显著高于百农207和周麦18;与花后15 d相比,花后21 d百农207和周麦18显著降低了62.77%和48.70%,但郑麦1860仅降低了15.44%,且差异不显著。对于NADPH酶含量,花后15 d和21 d郑麦1860与百农207均无显著差异,但显著低于周麦18;与花后15 d相比,花后21 d郑麦1860和百农207分别显著降低了24.04%和33.33%,而周麦18仅降低了9.27%,且差异不显著。说明相对于其他两个品种,郑麦1860能保持较高的ATP酶活性。

表4 灌浆期不同小麦品种的旗叶ATP酶活性和NADPH酶含量Table 4 ATPase activities and NADPH contents in flag leaves of the three wheat varieties during grain filling stage
2.4 三个小麦品种旗叶蔗糖和淀粉含量的比较
通过对三个品种花后15 d和21 d旗叶中蔗糖和淀粉的含量进行比较,结果(表5)显示,对于蔗糖含量,花后15 d郑麦1860显著低于百农207,但与周麦18无显著差异;花后21 d郑麦1860显著高于百农207和周麦18;与花后15 d相比,花后21 d郑麦1860显著提高了21.19%,而百农207和周麦18分别显著降低了23.97%和33.41%。对于淀粉含量,花后15 d郑麦1860显著高于百农207和周麦18;花后21 d郑麦1860显著低于百农207和周麦18;与花后15 d相比,花后21 d周麦18显著提高了80.57%,百农207略有降低,但差异不显著,而郑麦1860显著降低了41.81%。这说明郑麦1860旗叶中具有较高的光合产物积累速度,进而为灌浆后期形成更多的淀粉提供能量及糖类原料物质。

表5 灌浆期三个小麦品种的旗叶蔗糖和淀粉含量Table 5 Sucrose and starch contents in flag leaves of the three wheat varieties during grain filling stage
2.5 三个小麦品种旗叶蔗糖与淀粉合成相关基因的表达量变化
利用实时荧光定量PCR对旗叶中蔗糖和淀粉合成相关基因的表达量进行测定,结果(表6)显示,花后15 d,TaFBA基因在郑麦1860中的表达量与百农207无显著差异,但显著高于周麦18;TaSS基因在三个品种间的表达量均无显著差异;TaSSSⅡ基因在郑麦1860中的表达量显著高于百农207和周麦18。花后21 d,TaFBA基因在郑麦1860的表达量显著低于百农207,但显著高于周麦18;TaSS基因在郑麦1860中的表达量与百农207无显著差异,但显著高于周麦18;TaSSSⅡ基因在郑麦1860中的表达量显著高于百农207,但与周麦18无显著差异。表明灌浆期郑麦1860和百农207旗叶中蔗糖合成相关基因保持较高的表达水平;但与郑麦1860和周麦18相比,百农207的淀粉合成相关基因表达水平相对较低。

表6 灌浆期三个小麦品种旗叶蔗糖和淀粉合成相关基因的相对表达量Table 6 Relative expression levels of sucrose and starch synthesis-related genes in flag leaves of the three wheat varieties during grain filling stage
2.6 三个小麦品种旗叶叶绿体超微结构的比较
利用透射电镜对叶绿体的超微结构进行观察,结果发现,花后15 d,周麦18和百农207旗叶的叶绿体中沉积了较多的嗜锇颗粒,且有较大的淀粉粒出现,周麦18的叶绿体中类囊体片层排列重复疏松,而百农207的叶绿体中类囊体片层排列相对紧密;相较于周麦18和百农207,郑麦1860的叶绿体中类囊体片层排列清晰有序,堆砌紧密,其内部淀粉粒更大更饱满,而且只有少量嗜锇颗粒出现(图1A、B、C)。 花后21 d,周麦18和百农207的叶绿体中类囊体片层较花后15 d排列更为紧密,但是界限变得模糊,且周麦18出现了大量的嗜锇颗粒,未能观察到淀粉粒,而百农207嗜锇颗粒变少,淀粉粒较大;相较于周麦18和百农207,郑麦1860的叶绿体中类囊体片层依然排列清晰有序,并且堆砌紧密,嗜锇颗粒较少,也未观察到淀粉粒(图1D、E、F) 。这表明与其他两个品种相比,郑麦1860在灌浆期间能更持久地保持叶绿体结构的完整性,为后期光合作用提供良好的场所。
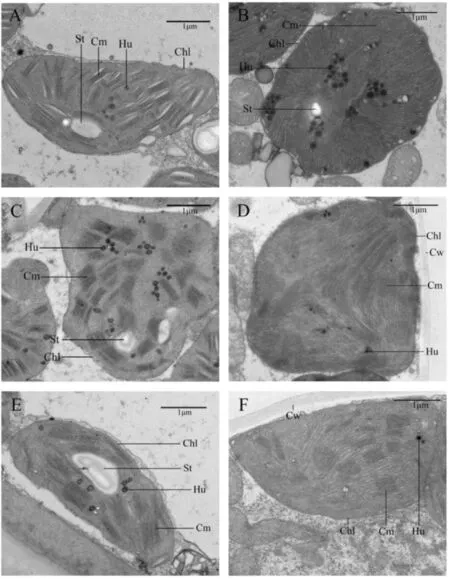
A、B和C分别为花后15 d的周麦18、百农207和郑麦1860,D、E和F分别为花后21 d的周麦18、百农207和郑麦1860。 Chl:叶绿体;Cm:类囊体;Hu:嗜锇颗粒;St:淀粉粒。A, B and C: Zhoumai 18, Bainong 207 and Zhengmai 1860 at 15 days after anthesis; D, E and F: Zhoumai 18, Bainong 207 and Zhengmai 1860 at 21 days after anthesis; Chl: Chloroplast; Cm: Thylakoid; Hu: Hungry particles; St: Starch granules.图 1 灌浆期三个小麦品种旗叶叶绿体的超微结构Fig.1 Chloroplast ultrastructure in flag leaves of the three wheat varieties during grain filling stage
3 讨论
旗叶是小麦灌浆前中期 (花后15~21 d) 进行光合作用且为籽粒提供干物质的重要器官[11]。本研究发现,花后15~21 d,郑麦1860旗叶的Pn、Gs和Ci变化趋势较为稳定,同时ATP酶活性以及叶绿素含量、NADPH酶含量、蔗糖含量(花后21 d)和淀粉含量(花后15 d)均保持较高水平,且蔗糖合成相关基因(TaSS、TaFBA)的相对表达量也较高,这些结果表明,郑麦1860在花后15~21 d能捕获和吸收更多光能,并产生较多的ATP和NADPH,这个过程需要吸收更多的CO2来参与,最终导致小麦叶片Gs增大,气体交换速率、Ci和Pn提高,这与Ravi等[21]在甘薯中的研究结果一致。
蔗糖作为植物从源到库的主要碳水化合物,高水平的蔗糖含量能进一步提高光合产物积累的速度[22]。本研究结果表明,花后21 d郑麦1860的旗叶仍能维持较高的蔗糖含量,表明该品种具有较快的光合产物积累速度,有利于为籽粒灌浆提供更多的糖类原料物质。
TaSS和TaFBA作为蔗糖合成关键酶的相关基因,在光合作用中也发挥着重要作用,其中TaFBA基因参与植物的碳循环,是控制光合速率的关键酶之一[23]。本研究发现,花后21 d郑麦1860的旗叶TaSS和TaFBA基因的相对表达量均显著高于周麦18,这可能是郑麦1860旗叶蔗糖含量较高的重要原因。旗叶淀粉含量测定结果表明,花后15 d郑麦1860的旗叶淀粉含量虽显著高于另外两个品种,但在花后21 d却最低,表明在灌浆前期三个品种都在大量积累光合产物,并暂时储存在旗叶中[3],随着灌浆的进行,旗叶中的光合产物往籽粒中运输[24],推测郑麦1860旗叶光合产物的运输速率高于其他两个品种。TaSSSⅡ是淀粉合成过程中的关键基因之一,其表达水平表明,花后21 d郑麦1860仍具有较高的表达量,但旗叶中光合产物淀粉的含量相对最低,推测与淀粉向籽粒的转运有关[14],这可能是郑麦1860产量相对其他两个品种较高的重要原因。同时,相对于郑麦1860,花后21 d百农207具有较高的TaFBA基因表达量,但TaSSSⅡ基因的相对表达量却相对较低,因此制约了其旗叶蔗糖和淀粉的合成及向籽粒转运的进程。Wang等[11]研究发现,与低光效品种相比,高光效品种可以更加及时的将光合产物运输到籽粒中,有助于维持其较高的光合速率。
类囊体膜作为植物光合作用能量转换的“车间”,其类囊体片层完整和有序排列是叶绿体正常进行光合作用的基础[25]。小麦籽粒灌浆过程与旗叶衰老密切相关,旗叶衰老过程中,叶绿体中嗜锇颗粒会逐渐累积[9],进而影响叶绿体类囊体膜的稳定性,导致光合机构发生分解[26]。本研究通过对三个小麦品种旗叶叶绿体的超微结构进行分析,发现花后21 d郑麦1860叶绿体的类囊体片层仍排列清晰有序且堆砌紧密,几乎没有嗜锇颗粒,表明该品种可以维持完整的叶绿体结构,在灌浆中期仍能捕获更多光能[27],进一步将光反应中心转化的电能转换为活跃的化学能,并最终促进籽粒中淀粉的形成[5]。
4 结论
郑麦1860具有较高的ATP酶活性以及叶绿素和NADPH酶含量,保证了高效的光能吸收和转化利用效率;另外,郑麦1860具有较为稳定的叶绿体结构,使其在灌浆中期仍能捕获更多的光能,维持较高的光合速率和光合产物转运速度,最终促进籽粒中淀粉的形成。
