泰它西普治疗IgA肾病的有效性及安全性分析
2023-06-19董寅迪李冠华
董寅迪, 吴 歌, 李冠华
(郑州大学第一附属医院 肾内科, 河南 郑州, 450052)
IgA肾病(IgAN)指免疫病理显示以IgA为主的免疫球蛋白在肾小球系膜区沉积的自身免疫性疾病。IgAN是导致终末期肾病的原因之一, 20%~40%的IgAN患者在出现首次临床表现后的10~20年内发生终末期肾病(ESRD)[1]。IgAN临床表现及病理均多种、多样,其致病机制较复杂,其中B细胞的异常活化发挥了重要作用。早期CD20+B细胞产生少量抗体[半乳糖缺陷型IgA 1(GD-IgA1)], 而CD38+浆细胞既能产生GD-IgA1, 又能产生大量自身抗体(抗GD-IgA1)[2]。抗体和自身抗体形成免疫复合物,在肾小球系膜区沉积并积累,通过激活补体进而诱发炎症,最终导致肾功能丧失和ESRD[3-4]。新的治疗方法通过抑制B细胞或CD38+浆细胞活化或促进其耗竭靶向治疗IgAN。
泰它西普是将钙调亲环素配体相互作用分子(TACI)胞外特定的可溶部分与人IgG1 Fc段相融合的重组蛋白[5], 能够结合B淋巴细胞刺激因子(BLys/BAFF)和增殖诱导配体(APRIL), 从而多靶点抑制B细胞成熟分化和浆细胞抗体产生,抑制Gd-IgA1产生,发挥免疫抑制作用[6]。目前,临床将该药用于治疗B细胞介导的自身免疫性疾病,如系统性红斑狼疮[7]。泰它西普治疗类风湿性关节炎[8]和多发性硬化症的研究尚处于临床研究中。本研究旨在评估泰它西普在单中心临床实践中治疗IgAN的有效性和安全性。
1 资料与方法
1.1 一般资料
回顾性选取郑州大学第一附属医院2022年2—10月使用泰它西普治疗的IgAN患者9例,其每周皮下注射泰它西普160 mg,随访时间不短于12周。
纳入标准: ① 肾穿刺病理活检证实为IgAN者; ② 年龄不小于18周岁且不大于65周岁者; ③ 估算肾小球滤过率(eGFR)≥35 mL/(min·1.73 m2)(使用CKD-EPI公式); ④ 经过3个月血管紧张素转化酶抑制剂(ACEI)/血管紧张素受体阻滞剂(ARB)等优化治疗后,尿蛋白与肌酐比值(UPCR)不小于0.5 g/g者。排除标准: ① 继发性IgAN者,如紫癜性肾炎、慢性肝病肾损害等; ② 克罗恩病、溃疡性结肠炎、乳糜泻等胃肠道疾病者; ③ 自身免疫性疾病免疫者,如系统性红斑狼疮、类风湿关节炎、干燥综合征等疾病; ④ 感染性疾病者,如慢性病毒感染(乙肝病毒、丙肝病毒)、慢性黏膜感染等疾病; ⑤ 肿瘤性疾病者,如骨髓瘤、淋巴瘤等疾病。
本研究符合人体试验伦理学标准,并通过郑州大学第一附属医院科研和临床试验伦理委员会审核,临床试验注明编号2022-KY-1397。
1.2 方法
本研究为回顾性分析,对于所有疗效分析的基线标准定义为第1次给药之前的最后1次评估。主要观察终点为随访期间UPCR、eGFR较基线的变化。次要观察终点为血清白蛋白、免疫球蛋白在随访期间的变化。① 随访12周前后指标比较: 比较随访12周前后患者血压、尿红细胞计数、UPCR、血清肌酐、eGFR指标变化。② 次要指标比较: 比较治疗前后血清白蛋白、血清尿酸、总胆固醇、甘油三酯等变化。疗效评价情况: ① 完全缓解(CR), UPCR≤0.3 g/g, 且肾功能稳定(eGFR波动≤30%); ② 部分缓解(PR), UPCR减少≥50%, 且肾功能稳定,但未达到完全缓解; ③ 无效,未达到完全缓解和部分缓解的标准。蛋白尿分级标准(根据UPCR): 轻度蛋白尿, >0.15 g/g且<1.0 g/g, 中度蛋白尿, ≥1.0 g/g且<3.5 g/g, 大量蛋白尿, ≥3.5 g/g。
1.3 观察指标
临床资料包括疾病病程、年龄、性别、体质量指数及目前用药、高血压病史、收缩压等。实验室检查指标: 尿红细胞计数、UPCR、血尿素氮、血清肌酐、血清尿酸、eGFR、血清白蛋白、总胆固醇、甘油三酯、血白细胞、血红蛋白、血小板、免疫球蛋白(IgA、IgG、IgM)、补体C3和补体C4等。每4周收集1次上述指标。
病理资料: 病理结果按IgAN牛津病理分型标准,收集肾小球硬化、新月体、系膜增生、毛细血管内增生、间质纤维化等肾活检结果。① 系膜细胞增殖(M): PSA染色下, ≥50%的肾小球系膜区内可见>3个系膜细胞则为M1, 否则为M0; ② 毛细血管内增生(E): 肾小球毛细血管袢内细胞增生导致管腔狭窄,若存在则为E1, 否则为E0; ③ 肾小球节段硬化(S): 存在肾小球节段硬化或粘连则为S1, 否则为S0; ④ 肾小管萎缩/间质纤维化(T): 皮质区细胞外基质增多导致管腔狭窄,根据受累面积百分比分别为T0(≤25%)、T1(>25%~50%)、T2(>50%); ⑤ 细胞或混合性新月体(C): 根据占肾小球总数的百分比分别为C0(无)、C1(<25%)、C2(≥25%)。
记录随访过程中的不良事件(AE)。AE: 即用药后对机体可能产生的不良影响,包括非感染性、感染性及超敏反应。感染性AE指皮肤、呼吸道、消化道、泌尿道等部位感染,非感染性AE指注射部位局部瘙痒、疼痛、硬结形成等不适。超敏反应定义为与泰它西普相关的AE, 在给药后6~48 h内发生,与泰它西普的关系由医生判断确定。
1.4 统计学分析

2 结 果
2.1 一般资料
共纳入9例患者,男7例(77.78%), 女2例(22.22%); 基线年龄(41.89±12.63)岁,中位病程1.42(0.88, 5.00)年。纳入的9例IgAN患者均表现为持续性蛋白尿, 1例合并间断性肉眼血尿(11.11%), 4例合并肾功能不全(44.44%), 5例合并高血压(55.56%)。基线中位UPCR为0.91(0.59, 1.83) g/g, 尿红细胞为4.00 (1.00, 34.00)个/HP, 血清肌酐(120.11±39.58) μmol/L, 血清尿酸为(385.56±130.80)μmol/L, eGFR为(67.33±25.11) mL/(min·1.73 m2), 血清白蛋白为(41.34±5.66) g/L, 血清免疫球蛋白IgA(3.26±0.86) g/L。基线合并用药情况: 3例(33.33%)服用他克莫司、6例(66.67%)使用ACEI/ARB类药物, 4例(44.44%)服用抗疟药, 3例(33.33%)服用降脂药, 7例(77.78%)服用百令胶囊, 6例(66.67%)服用贝前列素钠, 4例(44.44%)服用非布司他,合并用药在12周研究过程中未有调整,见表1。
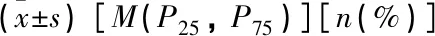
表1 IgAN患者基线临床特点
2.2 治疗12周临床指标变化情况
用药12周后,中位UPCR由治疗前0.91(0.59, 1.83) g/g下降至0.54(0.35, 0.59) g/g, 差异有统计学意义(P=0.008)。中位血清肌酐治疗前为106.00(88.50, 139.50) μmol/L, 治疗后为112.00(99.00, 135.50) μmol/L, 差异无统计学意义。
(P=0.605)。eGFR均值治疗前为(67.33±25.11) mL/(min·1.73 m2), 治疗后为(63.72±18.30) mL/(min·1.73 m2), 差异无统计学意义(P=0.069)。随访12周, 9例IgAN患者治疗前后血红蛋白、血糖、血脂、血清尿酸、血清白蛋白比较,差异无统计学意义(P>0.05), 见表2。

表2 9例IgAN患者泰它西普治疗12周后临床指标与基线比较
2.3 泰它西普治疗前后随访情况
治疗第4、8、12周时UPCR均数小于基线,差异有统计学意义(F=10.032,P=0.008)。治疗第4、8、12周时血清尿酸均数与基线比较,差异无统计学意义(F=1.121,P=0.329)。治疗第4、8、12周时eGFR均数与基线比较,差异无统计学意义(F=2.046,P=0.134)。9例患者未规律随访B淋巴细胞计数,其降低统计意义有限,未对该指标进行统计学分析。见表3。
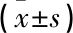
表3 9例IgAN患者泰它西普治疗前后随访情况
2.4 临床疗效和不良事件发生情况
9例患者治疗12周,其中6例患者获得临床缓解,缓解率为66.67%。1例发生不良事件,为皮肤感染。随访期间无严重不良事件、输液反应和非感染性事件发生。
3 讨 论
本研究评估了泰它西普在IgAN患者治疗中的疗效及安全性,结果显示, 9例患者治疗12周,其中6例患者获得临床缓解。总不良事件发生1例,在治疗第12周出现皮肤感染,总体耐受性良好。本研究中, 1例青年IgAN患者,病程7年,持续性轻中度蛋白尿,既往分别接受糖皮质激素、环孢素、吗替麦考酚酯、他克莫司治疗,病情易反复,治疗效果欠佳。基线已使用ACEI及羟氯喹3月余,尿蛋白未见改善,在合并使用泰它西普治疗后,蛋白尿逐步下降,治疗12周尿蛋白较基线下降59.39%, 肾功能持续维持稳定。
本研究中, 4例患者表现为肾炎综合征合并肾功能不全,基线均为中度蛋白尿。1例初诊IgAN患者,病程3个月,病理提示局灶增生性IgAN, 缺血性肾损伤。1例病程9个月的IgAN复发患者,病理表现局灶增生性IgAN, 重度缺血性肾损伤,既往应用羟氯喹及吗替麦考酚酯。1例难治性IgAN, 病程7年,病理提示局灶增生性IgAN, 既往应用激素联合免疫抑制剂治疗。1例病史2年,病理提示局灶增生坏死性IgAN。经过12周治疗,上述患者尿蛋白明显下降,达到临床部分缓解水平(均小于0.7 g/g), 肾功能维持稳定,无不良反应事件发生。一项泰它西普Ⅱ期临床研究[9]显示,泰它西普可显著减少IgAN患者蛋白尿。本研究提示,对于中度蛋白尿合并肾功能不全的IgAN患者,泰它西普具有较好的疗效及安全性。
本研究中, 3例IgAN患者合并使用免疫抑制剂(他克莫司),病程分别为1、1、5年,基线尿蛋白为0.69、0.60、0.91 g/g, 病理分别为局灶增生性IgAN、轻度系膜增生性IgAN、局灶增生性IgAN伴缺血性肾损伤,基线肾功能未见异常。经12周治疗后,尿蛋白水平持续稳定下降,但差异无统计学意义,提示对于合并使用免疫抑制剂的轻度蛋白尿患者,联合泰它西普治疗效果不显著,其原因可能是由于患者体内长期免疫抑制状态, B淋巴细胞长期低水平,泰它西普未能发挥相应疗效。此外,目前,他克莫司治疗IgAN的疗效尚不明确。相关研究[10]中,对他克莫司治疗IgAN的疗效评估显示,经6个月治疗,他克莫司组完全缓解率仅为35%。本研究显示,对于轻度蛋白尿IgAN患者,泰它西普联合免疫抑制剂治疗效果不显著。本研究中, 9例IgAN患者经过泰它西普160 mg治疗12周的蛋白尿水平较基线显著降低(P<0.05), 且肾功能保持稳定。但有关泰它西普Ⅱ期临床研究[9]显示, 14例IgAN患者经过泰它西普240 mg治疗24周,平均尿蛋白水平较基线降低49%; 16例IgAN患者经过泰它西普160 mg治疗,尿蛋白较基线降低25%。该研究结果与本研究不一致,考虑可能与纳入标本量较少,纳入患者病理活动度不同有关。上述结果初步提示,泰它西普对IgAN具有较好的疗效,可为治疗IgAN提供一种新的治疗方案,但具体治疗有效剂量有待进一步探讨。
IgAN一般给予支持治疗、激素和/或免疫抑制剂。免疫抑制剂被建议用于有进展高风险的IgAN患者[11]。虽然这类药物普遍具有良好的耐受性,但也可引起致命感染、肝肾毒性等。相关研究[12]比较了利妥昔单抗联合标准治疗与标准治疗对IgAN的疗效,结果提示,利妥昔单抗对IgAN缺乏疗效。与阿塞西普相比,泰它西普生物学活性更强[13]。
本研究中, 1例患者在治疗第12周时出现皮肤感染。一项泰它西普联合常规药物治疗中重度活动性系统性红斑狼疮患者的研究[14]表明,泰它西普在总体不良事件发生率上与安慰剂无显著差异。泰它西普治疗IgAN Ⅱ期研究[9]提示,泰它西普组与安慰剂组用药后不良反应发生情况比较无显著差异,均为轻、中度不良反应,无重度不良反应事件。相关研究[15-16]显示,使用泰它西普治疗自身免疫系统疾病疗效尚可,安全性高。
本研究存在局限性,本研究缺乏对照人群,同时纳入样本量较小及观察时间较短,仍需扩大样本量、延长观察时间,以进一步评估泰它西普对于IgAN患者的疗效及安全性。此外,研究未能连续监测到B细胞亚群浓度。
