人接头蛋白LNK对非小细胞肺癌细胞增殖和侵袭能力的影响
2023-06-19宋吉欣吴吟秋
王 杰, 谷 婷, 宋吉欣, 吴吟秋, 戴 春, 戴 华
(1. 扬州大学医学院, 江苏 扬州, 225001; 2. 江苏省非编码RNA基础与临床转化重点实验室, 江苏 扬州, 225001; 3. 江苏省扬中市人民医院 普外科, 江苏 扬中, 212200)
肺癌是人类常见的恶性肿瘤, 其是最主要的癌症死亡原因[1-2], 且肺癌呈现逐年攀升的趋势,并成为危害人类卫生健康的重大疾病。肺癌分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC), 其中NSCLC是肺癌最主要的病理类型,占80%~85%。由于大多数NSCLC患者初次诊断即为晚期局部侵袭或远处转移,患者的5年生存率仅为4%~17%[3]。随着癌症筛查和治疗手段的改进, NSCLC患者的2年生存率有所提高,提示深入研究NSCLC发生发展的分子生物学机制,发掘新的肿瘤早期诊断和药物干预靶点,采取更具针对性的干预措施来降低肺癌致死率及改善患者预后,具有积极的临床意义。
淋巴细胞接头蛋白LNK(SH2B3)由12号染色体上的SH2B3基因编码,高表达于淋巴细胞,负性调节JAK2-STAT3等信号通路来抑制造血干细胞的自我更新能力[4-5], 敲除LNK会导致造血干细胞增生失控、造血干细胞池的稳态失衡[6-7]。研究[8]发现, LNK过表达与间变性甲状腺癌的不良预后显著相关,高级别卵巢癌临床样本中也发现LNK存在高表达现象,并促进卵巢癌细胞的增殖和转移。此外,有研究[9]发现在几种有LNK基因基础表达的实体瘤细胞,如前列腺、脑组织细胞中强制过表达LNK基因,细胞增殖水平并无改变。课题组采用生物信息学分析发现LNK在肺癌组织中显著低表达,提示LNK在实体瘤中的生物学功能较为复杂。目前, LNK与肺癌发生发展之间的关系尚缺乏研究,为进一步明确LNK在实体肿瘤中的作用机制,本研究以NSCLC细胞株为模型,开展人接头蛋白LNK(hLNK)与肺癌发生的相关性研究,为发掘肺癌新的作用靶点及临床治疗新措施提供理论依据,也为丰富LNK生物学功能提供依据。
1 材料和方法
1.1 细胞株及质粒
人NSCLC细胞株NCI-H1299(H1299)购自中国科学院细胞库,慢病毒载体pCDH-CMV-MCS-EF1A-GFP-T2A-Puro(pCDH)由江苏大学于峰博士课题组馈赠,重组质粒 pCDH-hLNK由本实验室构建,过表达hLNK的病毒液由本实验室制备、保存。
1.2 主要试剂
胎牛血清(新西兰VIVACELL)、1640培养基(南京凯基生物)、抗hLNK多克隆抗体(美国R&D公司)、辣根过氧化物酶(HRP)标记羊抗鼠IgG(H&L, 中国金斯瑞公司)、HRP标记羊抗兔IgG(H&L, 上海捷瑞生物公司)、Lipo 8000TM转染试剂(上海碧云天生物)、ECL发光液(合肥Biosharp生物公司)、基质胶(美国Coring公司)。
1.3 方法
1.3.1 生物信息学分析hLNK在NSCLC组织中的差异表达: 采用生物信息学技术,运用GEPIA2数据库中的信息分析hLNK在肺癌组织及其癌旁对照组织中的表达。
1.3.2 过表达hLNK的NSCLC细胞株的构建: 取对数生长期的人NSCLC细胞株H1299, 胰酶消化后计数,铺24孔板, 3×105个/孔,加入转染增强剂polybrene及慢病毒液,轻轻混匀, 37 ℃培养箱孵育60 min, 每20 min轻弹管壁2~3次; 第2天,吸取上层培养基,用预热好的磷酸盐缓冲液(PBS)洗涤,更换新鲜完全培养基。转染3 d后,用工作浓度的嘌呤霉素筛选,阳性细胞命名为H1299-hLNK, 对照细胞命名为H1299-pCDH。
1.3.3 Western blot分析hLNK蛋白的表达水平: 将处于对数生长期的细胞株按1.3.2的方法处理,铺6孔板, 2×106个/孔,待其贴壁12 h后滴加预冷的PBS, 洗涤3次; 滴加含1%苯甲基磺酰氟(PMSF)的蛋白裂解液,冰上静置10 min, 收集细胞裂解液, 4 ℃, 12 000转/min离心15 min, 蛋白定量调整至20 mg/mL左右,分装, 20 ℃保存。将蛋白样本变性处理后,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE), 转印至聚偏二氟乙烯(PVDF)膜, 3 h; 5 %脱脂牛奶室温封闭, 1 h; 抗hLNK的抗体孵育, 4 ℃过夜; 随后洗膜缓冲液(TBST)洗3次, HRP标记的二抗室温孵育, 30 min; 同上洗涤后, ECL显色液显色,发光仪发光、拍照。
1.3.4 平板克隆实验分析hLNK对NSCLC细胞增殖能力的影响: 按1.3.2的方法处理过表达hLNK细胞H1299-hLNK及对照H1299-pCDH细胞,接种至含有10 mL完全培养基的培养皿中, 1 000个细胞/皿,每组设3复皿,轻轻摇动使细胞分布均匀,置于37 ℃、5% CO2的细胞培养箱,静置培养2周。弃培养基, PBS洗涤3次; 0.1%结晶紫染色, 10 min, 缓慢流水冲洗,自然风干,观察、拍照。
1.3.5 划痕实验分析hLNK对NSCLC细胞迁移能力的影响: 同上处理细胞,铺6孔板,待细胞生长至70 %~80 %融合度,用白枪头轻划培养皿得3条平行细线,分别于0、12、24小时在显微镜下观察固定地点划痕宽度,拍照记录并用软件分析差异。
1.3.6 Transwell实验分析hLNK对NSCLC细胞侵袭能力的影响: 将处于对数生长期的细胞经PBS洗涤,添加无血清培养基,饥饿培养2 h; 随后胰酶消化、重悬计数,无血清培养基水化底膜30 min; 预冷的matrigel稀释至30 μg/mL, 滴加至下层小室, 600 μL/室,置4 ℃冰箱30 min, 随后吸净下层matrigel, 滴加完全培养基, 600 μL/室; 上层小室滴加matrigel (100 μg/mL), 100 μL/室,待matrigel凝固后滴加细胞悬液至上层小室,继续培养过夜; 取出Transwell小室, PBS轻柔洗涤2次,并用棉签小心擦去上层残留, 4%多聚甲醛固定20 min, PBS洗涤,同1.3.5方法染色,观察、拍照。
1.3.7 Western blot分析NSCLC细胞中上皮间质转化(EMT)相关标志蛋白水平: 将对数生长期的NSCLC细胞按1.3.3的方法处理细胞,提取细胞总蛋白,电泳、转膜、封闭。随后使用EMT 相关标志蛋白E-Cadherin、N-Cadherin和Vimentin的特异性抗体及其相应二抗,依次孵育, ECL发光显影,检测过表达hLNK细胞H1299-hLNK及对照H1299-pCDH细胞中上述蛋白的表达。
1.4 统计学处理
采用SPSS 16.0软件对实验数据进行统计分析,数据组间比较行卡方检验,P<0.05为差异有统计学意义,采用GraphPad软件做图。
2 结 果
2.1 hLNK在NSCLC组织中的差异表达分析
采用生物信息学方法分析hLNK在NSCLC组织及其正常对照中的差异表达情况,结果表明,肺鳞癌组织、肺腺癌组织中hLNK的表达低于癌旁组织,差异有统计学意义(P<0.05), 见图1。

红色为肿瘤组织,黑色为癌旁组织。与癌旁组织比较, ∗P<0.05。图1 肺腺癌和肺鳞癌(均为NSCLC)中hLNK的表达水平分析
2.2 NSCLC稳转细胞株的构建
H1299经慢病毒感染后按常规方法裂解细胞, Western blot分析各细胞株中hLNK蛋白的表达水平。结果显示, H1299-hLNK细胞中hLNK表达水平高于对照细胞1299-pCDH, 差异有统计学意义(P<0.05), 见图2。说明过表达hLNK的NSCLC稳转细胞株H1299-hLNK构建成功,不同浓度的病毒感染后, hLNK的表达具有差异,相较于H1299-hLNK1, 细胞株H1299-hLNK2.5的hLNK表达量更高一些,后期选择H1299-hLNK2.5(下文简称为H1299-hLNK)进行后续实验。

图2 Western blot分析各细胞株中hLNK的表达水平
2.3 hLNK蛋白水平的变化对NSCLC细胞系增殖的影响
如1.3.3处理过表达hLNK细胞H1299-hLNK及对照H1299-pCDH细胞, 15 d后分析各培养皿中克隆增殖的情况。结果显示,过表达hLNK后NSCLC细胞株H1299-hLNK的增殖能力受到抑制(P<0.05), 见图3, 提示hLNK可能在NSCLC中发挥着抑癌的作用。
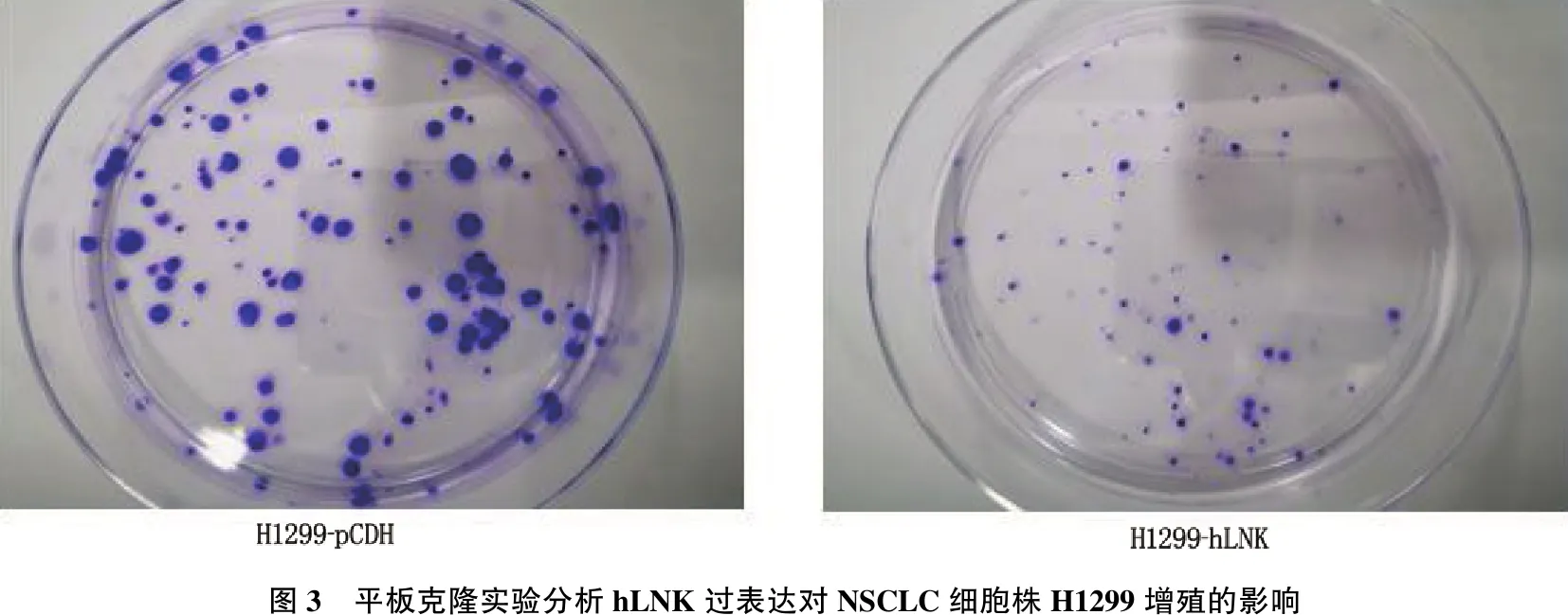
图3 平板克隆实验分析hLNK过表达对NSCLC细胞株H1299增殖的影响
2.4 hLNK蛋白水平的变化对NSCLC细胞系迁移的影响
将hLNK过表达的细胞株及其对照细胞(H1299-pCDH)处理后,采用划痕实验分析hLNK表达水平改变后对NSCLC细胞迁移的影响。结果显示,hLNK过表达后,H1299-hLNK的迁移能力受到抑制(P<0.05), 见图4, 提示在NSCLC中hLNK的低表达可能对NSCLC的进展具有促进作用。

A: H1299-pCDH和H1299-hLNK代表性划痕实验图; B: 结果统计图。与H1299-pCDH比较, ∗P<0.05。图4 划痕实验分析hLNK过表达对非小细胞肺癌细胞H1299迁移的影响
2.5 hLNK对NSCLC细胞的上皮间质转移能力的影响
将上述构建的稳转细胞株H1299-hLNK及其对照细胞(H1299-pCDH)处理后,进行Western blot分析。结果表明, hLNK过表达后,细胞中上皮细胞标志物E-Cadherin的表达显著上调(P<0.05), 而间质细胞标志物N-Cadhrein、Vimentin的表达显著下调,表明hLNK过表达对NSCLC的EMT具有显著的抑制作用。见图5。
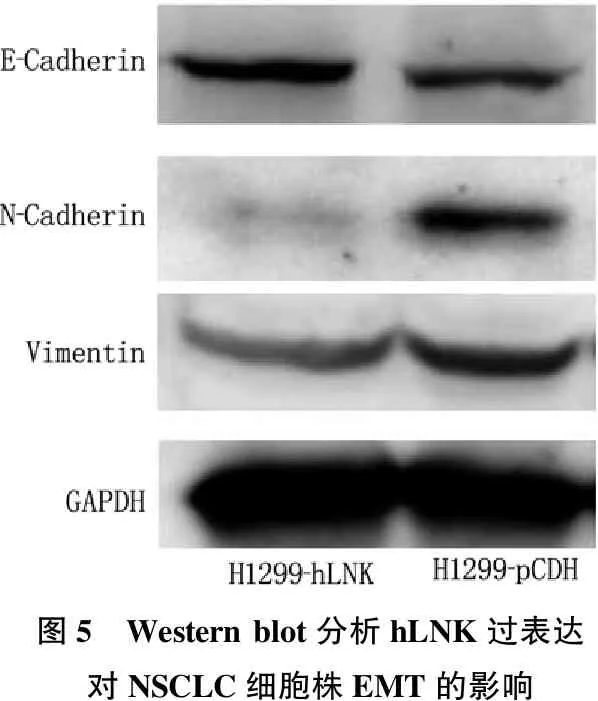
图5 Western blot分析hLNK过表达对NSCLC细胞株EMT的影响
3 讨 论
在中国,肺癌的发病率和致死率依然高居不下,而肿瘤的异质性和预后差是导致肺癌患者病死率高的重要原因[10]。深入探索NSCLC发生发展的分子机制,优化肺癌亚型的诊断和治疗策略依然是临床所急需关注的问题。
LNK作为接头蛋白SH2B3家族中的重要一员,已明确其高表达在造血祖细胞及其前体细胞中并发挥负性调控作用,对稳定造血干细胞池具有重要意义[11-13]。LNK是一种重要的筛查因子,既往研究[14]表明,LNK突变会导致多种血液病和血管炎症,沉默LNK会激活CD34+造血干细胞中的JAK-STAT信号通路,从而显著促进多系血细胞增殖。淋巴细胞中LNK通过增强STAT4磷酸化,促进γ-干扰素生成,从而抑制人高血压和高血压慢性肾损伤的进展[15]。但有研究[8, 13]发现, LNK在实体肿瘤,如黑素瘤、低分化甲状腺癌中高表达确促进了该类肿瘤的发生发展; 在高级别卵巢癌中, LNK高表达主要通过抑制肿瘤细胞的体积和迁移能力,增强细胞黏附来提高其侵袭能力[9]。上述研究表明, LNK的功能未被完全阐释清楚。本研究发现,肺癌中LNK处于显著低表达水平,平板克隆及CCK8实验均表明,过表达LNK的NSCLC细胞的克隆增殖以及迁移能力被显著抑制,初步表明在NSCLC中LNK具有抑癌作用, LNK的低表达可能促进了肺癌进展。随后,通过分析EMT标志性蛋白的差异表达水平,发现过表达LNK的H1299细胞中E-Cadherin显著增强,而N-Cadherin和Vimentin显著下调,说明LNK过表达抑制了NSCLC细胞向EMT方向的转变。上述分析进一步表明, LNK在NSCLC组织中低表达促进了肿瘤的增殖和侵袭,与其不良预后密切相关。
研究[16]表明,高表达环状RNA(circRNA),如circ-CPA4可促进N-Cadhrein、Vimentin的表达,在NSCLC细胞的进展、耐药和肿瘤免疫微环境调控具有重要作用; 此外,经典的JAK/STAT3信号通路联合PD-L1轴同样在NSCLC的进展及耐药中发挥着重要作用[17]。研究[18]发现, E-Cadherin负调节蛋白SNAIL通过促进肿瘤源性CXCL2分泌诱导M2巨噬细胞活化浸润,从而导致患者肺转移和预后不良。上述均引起作者对以下方面进行思考: 在实体瘤,尤其是NSCLC中, LNK与EMT蛋白之间的结合关系; LNK通过其哪个结构域发挥主要作用,是否还具有EMT之外的通路,如通过JAK-STAT轴,影响NSCLC增殖和迁移。本研究将进一步实验以探讨上述思考点。
综上所述,本研究以NSCLC为研究对象,发现LNK在其发生发展过程中发挥着抑癌基因的功能, LNK的缺失使得NSCLC细胞大量扩增,迁移加快, EMT进程加快。本研究为进一步分析NSCLC的临床治疗靶标提供了理论支持,也为完善LNK的生物学功能提供理论依据。
