乳腺癌组织miR-10a-5p、HOXB3水平对预后的预测价值*
2023-06-19张京力高建朝张志生李晓霞王展海冯志林周海丰梁晚平
张京力,高建朝,张志生,李晓霞,王展海,冯志林,周海丰,梁晚平
河北北方学院附属第一医院乳腺外科,河北张家口 075000
作为女性常见的恶性肿瘤,乳腺癌具有高转移率和死亡率的特点[1]。其治疗方法包括手术切除、放疗和化疗[2-3]。虽然取得了一定的疗效,但乳腺癌患者的复发和转移率仍然较高,导致患者普遍预后不良[4]。因此,寻找可靠的指标用来判断患者预后情况对乳腺癌具有重要意义。目前研究表明微小RNA(miRNA)参与乳腺癌的发生和进展,可作为乳腺癌诊断、预后及治疗的潜在生物标志物[5-6]。miR-10家族位于同源异型盒基因(HOX)簇内,miR-10a-5p是miR-10家族的成员,可以调节许多炎症相关疾病中的细胞增殖、凋亡和炎症因子[7]。有研究表明其在多种肿瘤中也存在异常表达,李妘等[8]发现miR-10a-5p在宫颈癌细胞中水平降低。HOXB3是HOXB家族成员,该家族主要调控细胞分化和增殖,参与胚胎的发生发育过程[9]。根据生物信息学分析结果显示,miR-10a-5p和HOXB3存在靶向结合关系[7]。但尚未见二者在乳腺癌中的表达关系研究。基于此,本研究拟通过检测乳腺癌组织中miR-10a-5p和HOXB3的表达情况,分析二者与患者预后的关系。现报道如下。
1 资料与方法
1.1一般资料 选取2016年1月至2017年5月于本院就诊的75例乳腺癌患者,均为女性,年龄38~69岁,平均(50.45±5.81)岁;绝经35例,未绝经40例;肿瘤部位:外上象限26例,其他象限49例;肿瘤分化程度:低分化32例,高、中分化43例;有淋巴结转移30例,无淋巴结转移45例;TNM分期[10]:Ⅰ+Ⅱ期47例,Ⅲ+Ⅳ期28例;分子分型:Luminal A 22例,Luminal B 22例,人表皮生长因子受体2(HER2)阳性13例,三阴性乳腺癌18例;肿瘤最大径:<2 cm 36例,≥2 cm 39例。收集术中患者的乳腺癌组织及癌旁正常组织。纳入标准:(1)符合乳腺癌诊断标准[10],经手术病理检查确诊为乳腺癌;(2)均为初诊患者;(3)所有患者均未接受过放疗、化疗或手术前的任何其他治疗。排除标准:(1)合并其他恶性肿瘤;(2)合并其他感染性疾病;(3)临床资料不完整。本研究经医院伦理委员会批准通过,所有标本采集均取得受试者知情同意。
1.2仪器与试剂 TRIzol试剂(批号BL10523)、兔源HOXB3单克隆抗体(批号BL19172)、β-actin抗体(批号BL19241)、羊抗兔二抗(批号BL14138)购自广州奥然科技有限公司;反转录酶(批号zk3924)、蛋白裂解液(批号zk3013)、PCR试剂盒(批号zk36127)购自深圳子科生物科技有限公司;荧光定量PCR仪(型号Cycler510)、显微镜(型号650TFL)、凝胶成像系统(型号EL-5200)购自上海金穗生物科技有限公司。
1.3方法
1.3.1实时荧光定量PCR(qPCR)检测乳腺癌组织及癌旁正常组织中miR-10a-5p水平 使用TRIzol试剂从乳腺癌组织及癌旁正常组织中提取总RNA,随后,反转录为cDNA,将cDNA作为RNA扩增的模板,使用qPCR试剂盒进行扩增。反应程序如下:95 ℃ 5 min,然后95 ℃ 15 s,60 ℃ 3 s,最后72 ℃ 30 s,37个循环。以U6作为内参,使用2-ΔΔCt方法对miR-10a-5p水平进行定量分析。miR-10a-5p及内参引物序列见表1。引物由深圳子科生物科技有限公司设计合成。

表1 引物序列
1.3.2免疫组织化学染色观察乳腺癌组织及癌旁正常组织中HOXB3表达 将乳腺癌组织及癌旁正常组织病理切片于60 ℃烘烤1 h,二甲苯脱蜡,使用梯度乙醇溶液洗脱。加入0.3%过氧化氢封闭,然后进行抗原修复,磷酸盐缓冲溶液洗涤3次。将切片与兔源HOXB3单克隆抗体(1∶150稀释)在37 ℃孵育12 h,随后加入羊抗兔二抗(1∶1 800稀释)孵育50 min,然后在PBS中洗涤3次,每次3 min。二氨基联苯胺染色,苏木精复染,脱水,透明,封片。
在光学显微镜下观察HOXB3表达,染色强度评分:0分(无)、1分(弱)、2分(中等)、3分(强)。阳性染色肿瘤细胞百分比评分:0分(0%~<6%)、1分(6%~<26%)、2分(26%~<51%)、3分(51%~<76%)、4分(76%~100%)。最终评分通过染色强度评分和阳性染色肿瘤细胞百分比评分相乘获得(0~12分)。当评分为0分时,HOXB3表达为阴性,当评分为1~12分时,HOXB3表达为阳性。0~4分判定为HOXB3低表达,5~12分判定为HOXB3高表达。
1.3.3蛋白质印迹法检测乳腺癌组织及癌旁正常组织中HOXB3水平 蛋白质裂解液提取乳腺癌组织及癌旁正常组织中总蛋白,将蛋白进行定量,取适量蛋白质样品电泳分离,然后转膜,膜用5%脱脂牛奶封闭2 h,并与兔源HOXB3单克隆抗体(1∶400稀释)和β-actin内参抗体(1∶1 000稀释)在4 ℃下孵育过夜。之后,去除一抗,再用TBST洗膜3次。最后,将膜与羊抗兔二抗(1∶1 800稀释)在室温下温育2 h。然后显色,目的蛋白/内参蛋白灰度值作为相对表达水平。
1.4预后随访 所有患者自术后开始门诊或者电话定期随访5年,观察患者生存情况,随访截止时间为2022年5月31日或患者5年内死亡日期。5年内乳腺癌患者生存59例(生存组)为预后良好,死亡16例(死亡组)为预后不良,无失访患者。
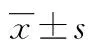
2 结 果
2.1乳腺癌组织和癌旁正常组织miR-10a-5p、HOXB3水平比较 乳腺癌组织miR-10a-5p水平低于癌旁正常组织,HOXB3高表达比例和HOXB3水平均高于癌旁正常组织(P<0.05),见图1、2,表2。
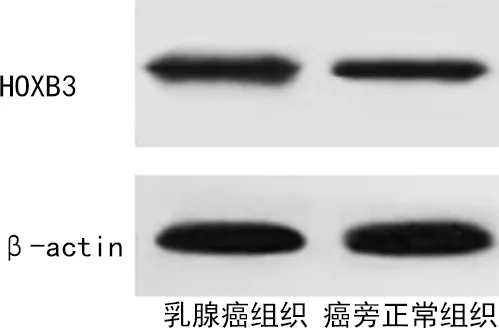
图2 乳腺癌组织和癌旁正常组织HOXB3水平蛋白质印迹图
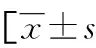
表2 乳腺癌组织和癌旁正常组织miR-10a-5p、HOXB3水平比较或n(%)]
2.2乳腺癌组织miR-10a-5p、HOXB3水平的相关性分析 乳腺癌组织miR-10a-5p水平与HOXB3呈负相关(r=-0.346,P<0.001),相关方程为Y=0.93-0.50×X,见图3。
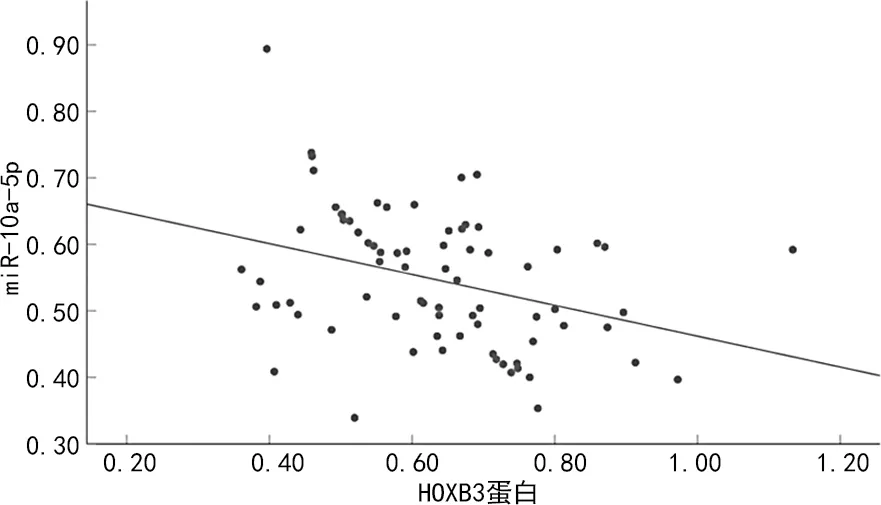
图3 乳腺癌组织miR-10a-5p、HOXB3水平相关性分析
2.3生存组和死亡组患者一般资料比较 生存组和死亡组年龄、是否绝经、肿瘤部位、分子分型、肿瘤最大径比较,差异无统计学意义(P>0.05);与生存组比较,死亡组低分化、淋巴结转移、TNM分期Ⅲ+Ⅳ期患者比例均较高(P<0.05)。见表3。
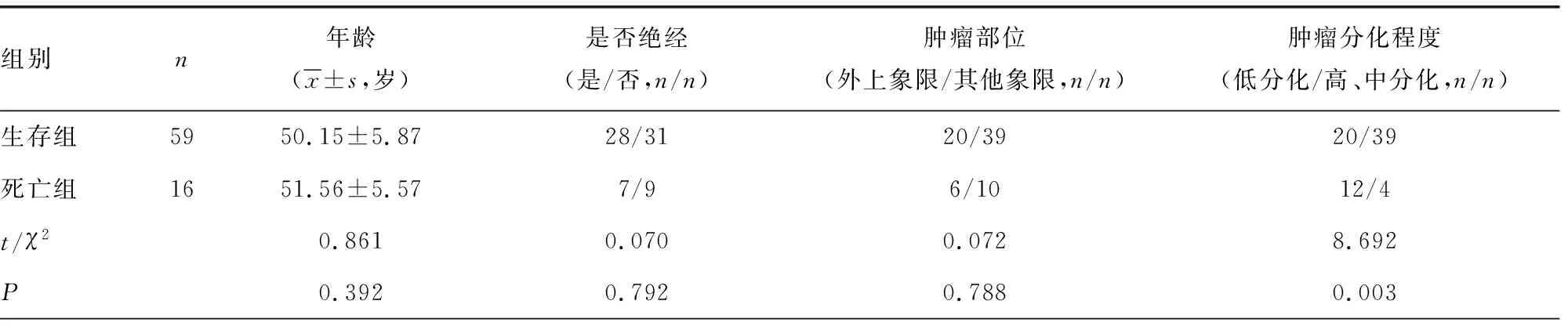
表3 生存组和死亡组患者一般资料比较
2.4生存组和死亡组乳腺癌组织miR-10a-5p、HOXB3水平比较 死亡组乳腺癌组织miR-10a-5p水平低于生存组,HOXB3高表达比例和HOXB3水平均高于生存组(P<0.05),见表4。
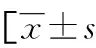
表4 生存组和死亡组乳腺癌组织miR-10a-5p、HOXB3水平比较或n(%)]
2.5乳腺癌组织miR-10a-5p、HOXB3水平对患者5年内死亡的预测价值 ROC曲线结果显示,乳腺癌组织miR-10a-5p、HOXB3、二者联合预测患者5年内死亡的AUC分别为0.881、0.836、0.948;二者联合检测的AUC优于miR-10a-5p、HOXB3单独检测的AUC(Z=2.064、2.052,P=0.039、0.040)。见表5。
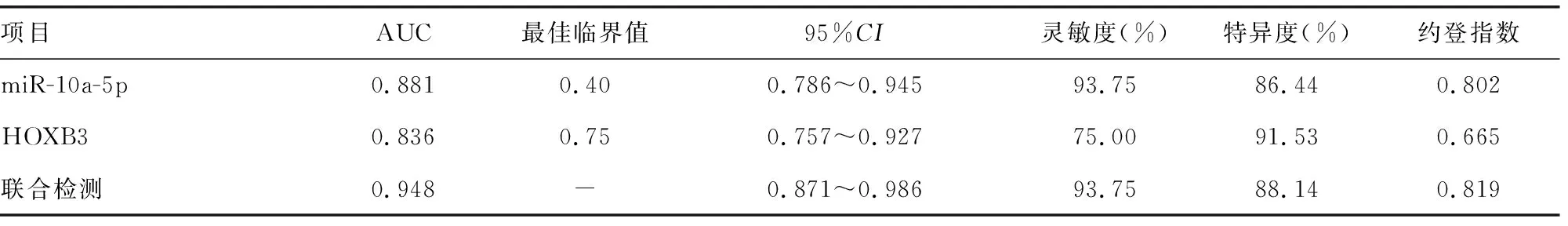
表5 乳腺癌组织miR-10a-5p、HOXB3水平对患者5年内死亡的预测价值
2.6影响乳腺癌患者5年内死亡的因素分析 单因素Logistic回归分析结果显示,肿瘤分化程度、淋巴结转移、TNM分期、miR-10a-5p、HOXB3均与乳腺癌患者5年内死亡有关(P<0.05)。以乳腺癌患者5年内是否死亡(死亡为1,存活为0)作为因变量,以肿瘤分化程度(低分化为1,高、中分化为0)、淋巴结转移(是为1,否为0)、TNM分期(Ⅲ+Ⅳ期为1,Ⅰ+Ⅱ期为0)、miR-10a-5p[miR-10a-5p低水平(<0.40)为1,miR-10a-5p高水平(≥0.40)为0]、HOXB3[HOXB3高水平(≥0.75)为1,HOXB3低水平(<0.75)为0]为自变量,进行多因素Logistic回归分析,结果显示肿瘤分化程度低分化、有淋巴结转移、TNM分期Ⅲ+Ⅳ期、miR-10a-5p低水平、HOXB3高水平均是影响乳腺癌患者5年内死亡的独立危险因素(P<0.05),见表6、7。
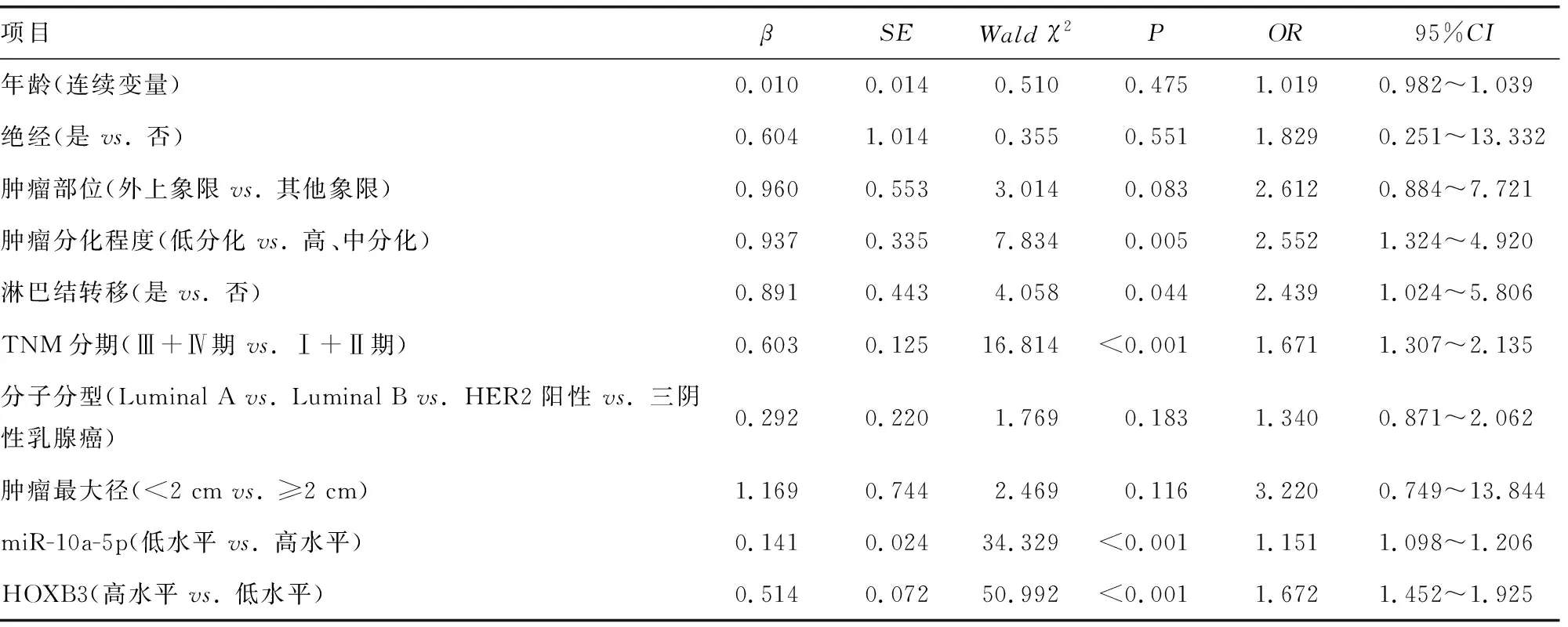
表6 影响乳腺癌患者5年内死亡的单因素分析
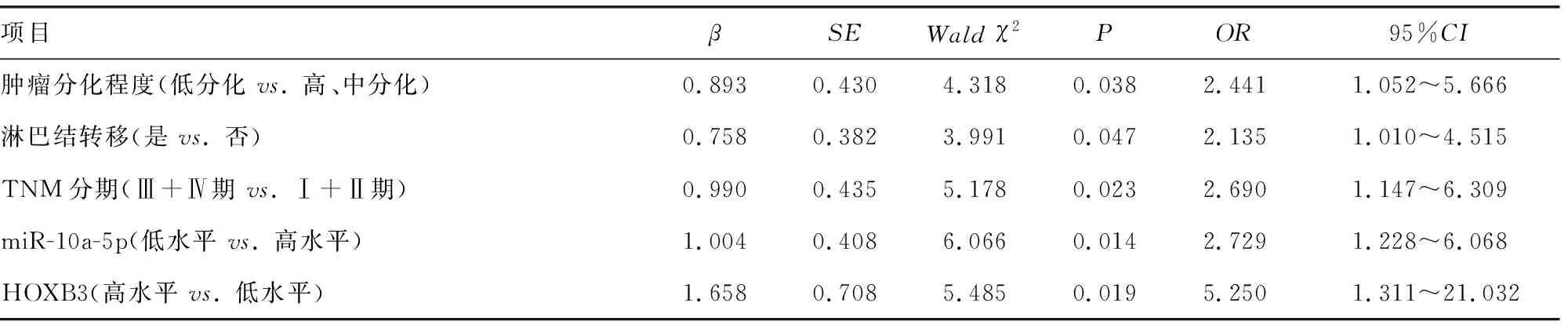
表7 影响乳腺癌患者5年内死亡的多因素分析
3 讨 论
在全球范围内,每年有多达140万例患者被诊断出患有乳腺癌[11-12]。目前,乳腺癌的治疗方法除化疗外还包括手术治疗、内分泌治疗、靶向治疗和联合治疗[13]。尽管乳腺癌的治疗取得了重大进展,但乳腺癌患者的临床预后仍然很差。因此,需要选择更加有效、可靠的指标评估乳腺癌预后。
乳腺癌的发生、局部侵袭或转移涉及多种基因的失调、突变和表观遗传机制。失调的基因包括编码RNA和非编码RNA,例如miRNA[14]。miRNA能够通过靶向mRNA的互补区域,抑制蛋白质翻译来沉默基因表达,这在正常和异常生物过程(包括癌症)中至关重要。目前已经在乳腺癌中观察到miRNA的失调,并且与肿瘤生长、耐药性和转移有关[15]。相关研究显示miR-10a-5p在多种肿瘤中异常表达,且在不同肿瘤类型中表达水平具有一定的肿瘤异质性[16-17]。有研究表明,miR-10a-5p在卵巢癌细胞中表达降低,上调miR-10a-5p表达可抑制卵巢癌细胞存活和侵袭[18]。在本研究中,乳腺癌组织中miR-10a-5p水平较癌旁正常组织降低,死亡组乳腺癌组织miR-10a-5p水平较生存组降低,提示miR-10a-5p可能参与调控乳腺癌的发生,有可能作为评估乳腺癌预后不良的潜在生物学指标;ROC曲线结果也进一步表明miR-10a-5p可作为预测乳腺癌患者预后不良的指标。
同源盒基因是在胚胎发生和正常发育过程中编码转录因子的调节基因,在这些基因中它们调节细胞分化和增殖[19]。其中HOX基因家族,由39个基因组成,这些基因被细分为4组:A、B、C和D。据报道,HOX基因与肿瘤进展有关[20]。已有研究证明HOXB3在乳腺癌细胞中过表达可以诱导乳腺癌干细胞表型形成[21]。在本研究中,乳腺癌组织HOXB3高表达比例和HOXB3水平与癌旁正常组织比较明显升高,提示HOXB3可能发挥了促癌基因的作用,参与了乳腺癌的发生发展。进一步研究发现死亡组乳腺癌组织HOXB3高表达比例和HOXB3水平较生存组高,提示HOXB3表达与乳腺癌患者预后不良密切相关;Spearman相关分析结果得到乳腺癌组织miR-10a-5p和HOXB3水平呈负相关,提示miR-10a-5p和HOXB3之间存在某种分子机制共同调控乳腺癌的发生发展。ROC曲线结果显示,乳腺癌组织miR-10a-5p、HOXB3联合预测乳腺癌患者5年内死亡的AUC优于miR-10a-5p、HOXB3单独预测的AUC,提示联合检测可作为预测乳腺癌患者预后不良的指标。本研究进一步发现肿瘤分化程度低分化、有淋巴结转移、TNM分期Ⅲ+Ⅳ期、miR-10a-5p低水平、HOXB3高水平均是影响乳腺癌患者5年内死亡的独立危险因素,提示乳腺癌组织中HOXB3高表达、miR-10a-5p低表达的患者,应该在术后给予更严密的随访观察,必要时给予辅助治疗,改善患者预后。
综上所述,miR-10a-5p在乳腺癌组织中表达下调,HOXB3表达上调,二者在乳腺癌组织中的表达呈负相关。miR-10a-5p和HOXB3均是影响乳腺癌生存状况的危险因素,联合检测可有效预测乳腺癌患者预后。
