番茄红素调节AMPK/SIRT1/NF-κB信号通路对过敏性结膜炎小鼠的治疗作用
2023-06-19潘英芬金延强刘艳雪倪丽丽
潘英芬,金延强,刘艳雪,倪丽丽,刘 斐
山东省泰安市妇幼保健院:1.眼科;2.中医科,山东泰安 271000
过敏性结膜炎(AC)是一种在成人和儿童间都流行的免疫性过敏疾病,可对患者视力造成不可逆的伤害[1]。AC在临床上主要表现为眼部瘙痒、红肿等症状,因个人免疫能力不同,每个人发病症状有所不同,严重者甚至导致角膜炎并发症的发生,影响人的视力[2]。番茄红素(LYC)是一种类胡萝卜素,具有抗氧化、抗炎、保护心脏、抗肿瘤、抗菌、免疫调节等活性[3-5]。腺苷酸活化蛋白激酶(AMPK)/沉默信息调节因子1(SIRT1)/核转录因子-κB(NF-κB)信号通路是调节炎症反应的关键通路,激活AMPK的磷酸化水平可以促进SIRT1表达,减轻过敏导致的气道炎症[6];AMPK/SIRT1通路的活化还可抑制NF-κB磷酸化,进而减轻脂多糖诱导的炎症反应[7]。研究发现,LYC减轻骨关节炎炎症反应的作用与抑制NF-κB炎症通路活化,同时降低促炎因子水平有关[8]。鉴于LYC的抗炎作用,本研究推测LYC可能通过调节AMPK/SIRT1/NF-κB信号通路减轻AC小鼠炎症反应,并建立AC小鼠模型进行探讨。
1 材料与方法
1.1材料 选用BALB/c小鼠(雄性),周龄6~8周,体重18~20 g,共60只,购自广东药康生物科技有限公司,许可证号:SCXK(粤)2020-0054。所有小鼠均饲养于本院的动物实验中心,国家标准饲料喂养,自由饮水,适应性饲养1周,观察无异常后用于后续实验。
1.2仪器与试剂 LYC购自上海麦克林生化科技有限公司;卵清蛋白(OVA)购自艾柏森(北京)生物科技有限公司;苏木精-伊红(HE)染色试剂盒购自北京索莱宝科技有限公司;肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-17、IL-10、转化生长因子(TGF)-β、免疫球蛋白(Ig)E和胸腺基质淋巴细胞生成素(TSLP)的酶联免疫吸附试验(ELISA)试剂盒购自上海酶联生物科技有限公司;磷酸化AMPK(p-AMPK)、AMPK、SIRT1、NF-κB p65抗体购自艾博抗(上海)贸易有限公司。
光学显微镜购自奥林巴斯(中国)有限公司;冷冻离心机购自美国贝克曼库尔特公司;多功能酶标仪购自美谷分子仪器(上海)有限公司。
1.3方法
1.3.1分组与造模 采用OVA致敏方式诱导AC小鼠模型建立[9]。造模开始第1天和第7天通过腹腔注射200 μL OVA与Al(OH)3佐剂比例为1∶50的混合溶液,第10~15天向小鼠每只眼睛滴加含有OVA 250 g的溶液激发致敏。造模后将小鼠分为模型组(AC组)、LYC低组(5 mg/kg)、LYC中组(10 mg/kg)、LYC高组(20 mg/kg)[10],LYC高+AMPK抑制剂(CC,0.2 mg/kg)[11]组,另设置未处理的小鼠作为正常组(NC组),每组10只。LYC低、中、高组按照对应剂量灌胃给药,LYC高+CC组给予对应剂量CC灌胃给药,AC组和NC组给予生理盐水灌胃,连续给药10 d。
1.3.2眼周情况观察 在最后一次施用OVA 20 min后,观察小鼠眼周是否出现眼睑水肿、结膜水肿及充血、溢泪等现象,出现上述情况视为造模成功。
1.3.3标本采集 小鼠麻醉处死后,将双眼结膜分离取出;腹主动脉取血,室温静置2 h,离心保留上清液备用;剪开腹部后,完整剥离脾脏备用。
1.3.4小鼠眼部结膜病理学变化观察 将1.3.3取得的左眼结膜进行固定、脱水、透明、浸蜡、包埋、切片等操作,HE染色后,显微镜下观察并拍照。
1.3.5流式细胞仪检测脾脏中Th17、Treg细胞比例 将1.3.3剥离的脾脏用PBS冲洗数次后,液氮研磨,匀浆后,离心弃上清液,加入红细胞裂解液,静置5 min后加入PBS,离心弃上清液,最后加入PBS重悬细胞,制备脾单细胞悬液。将脾单细胞悬液调整至1×107个,在37 ℃、CO2恒温培养4 h后,加入Anti-CD4-FITC,4 ℃培养30 min;加入Permeabilization buffer混匀,4 ℃培养30 min;加入Anti-IL-17A-PE,4 ℃避光孵育30 min;上机检测Th17细胞(CD4+IL-17A+)比例。另外,加入Anti-CD4-FITC、Anti-CD25-APC,4 ℃避光孵育20 min;加入Permeabilization buffer混匀,4 ℃避光孵育30 min;加入Anti-FOXP3-PE,4 ℃避光孵育30 min;上机检测Treg细胞(CD4+CD25+FOXP3+)比例。
1.3.6血清炎症因子水平检测 采用ELISA试剂盒检测血清中IL-17、IL-6、IL-10、TGF-β的水平,按照试剂盒说明书进行操作。
1.3.7小鼠血清中IgE和TSLP水平检测 采用ELISA试剂盒检测血清中IgE、TSLP水平,按照试剂盒说明书进行操作。
1.3.8小鼠结膜组织中p-AMPK、SIRT1、NF-κB p65蛋白检测 蛋白质印迹法(Western blot)检测右眼结膜组织中p-AMPK、SIRT1、NF-κB p65蛋白水平,将结膜组织液氮研磨匀浆后加入裂解液提取总蛋白,然后电泳、转膜、封闭后加入一抗p-AMPK(1∶1 000)、SIRT1(1∶1 000)、NF-κB p65(1∶1 000),内参β-actin(1∶1 000),4 ℃孵育12 h,PBS洗膜后加入二抗(1∶2 000),室温孵育2 h后,ECL显色,利用条带灰度值分析蛋白表达。
2 结 果
2.1小鼠造模指标观察 NC组小鼠结膜未出现明显充血、水肿,眼睑正常,无溢泪现象;AC组小鼠眼部周围分泌物增多,有溢泪,结膜充血、水肿现象明显,抓挠次数频繁;LYC低、中、高组小鼠随着LYC浓度增加,结膜水肿充血、分泌物多、溢泪现象逐渐减弱;LYC高+CC组小鼠眼周特征与AC组基本一致。见图1。

注:A、B、C、D、E、F分别为NC组、AC组、LYC低组、LYC中组、LYC高组、LYC高+CC组小鼠眼周情况。图1 小鼠眼周情况观察
2.2小鼠结膜组织病理学变化 NC组小鼠细胞排列整齐,无破裂和炎症细胞浸润;AC组小鼠结膜组织出现明显的炎症浸润,主要表现为嗜酸性粒细胞数量增多;LYC低、中、高组小鼠随着LYC浓度的增大,炎症细胞浸润逐渐减轻,嗜酸性粒细胞数量较AC组减少,细胞紊乱破裂减轻;LYC高+CC组小鼠病理学变化与AC组相近。见图2。
注:A、B、C、D、E、F分别为NC组、AC组、LYC低组、LYC中组、LYC高组、LYC高+CC组小鼠结膜组织染色情况。图2 小鼠结膜组织HE染色(×200)
2.3LYC对小鼠脾脏中Th17、Treg细胞比例的影响 与NC组比较,AC组小鼠脾脏中Th17细胞比例升高,Treg细胞比例降低(P<0.05);与AC组比较,LYC中、高组小鼠脾脏中Th17细胞比例降低,Treg细胞比例升高(P<0.05),LYC低组小鼠脾脏中Th17细胞、Treg细胞比例有所变化,但差异无统计学意义(P>0.05),LYC高+CC组小鼠脾脏Th17细胞、Treg细胞比例差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠脾脏中Th17、Treg细胞比例
2.4各组小鼠血清炎症因子水平比较 与NC组比较,AC组小鼠血清中IL-6、IL-17水平升高,IL-10、TGF-β水平降低(P<0.05)。与AC组比较,LYC中、高组小鼠血清中IL-6、IL-17水平降低,IL-10、TGF-β水平升高(P<0.05);LYC低组小鼠血清中IL-6、IL-17水平有所降低,IL-10、TGF-β水平有所升高,但差异无统计学意义(P>0.05);LYC高+CC组小鼠血清中上述炎症因子水平差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠血清炎症因子水平比较
2.5各组小鼠血清IgE、TSLP水平比较 与NC组比较,AC组小鼠血清中IgE、TSLP水平升高(P<0.05)。与AC组比较,LYC中、高组小鼠血清中IgE、TSLP水平降低(P<0.05),LYC低组、LYC高+CC组小鼠血清中IgE、TSLP水平差异无统计学意义(P>0.05)。见表3。
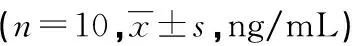
表3 各组小鼠血清IgE、TSLP水平比较
2.6各组小鼠结膜组织AMPK/SIRT1/NF-κB信号通路蛋白水平比较 与NC组比较,AC组小鼠结膜组织p-AMPK、核NF-κB p65蛋白水平升高,SIRT1水平降低(P<0.05)。与AC组比较,LYC中、高组小鼠结膜组织p-AMPK、SIRT1水平升高,核NF-κB p65水平降低(P<0.05);LYC低组小鼠结膜组织p-AMPK、SIRT1水平有所升高,核NF-κB p65水平有所降低,但差异无统计学意义(P>0.05);LYC高+CC组小鼠结膜组织p-AMPK、SIRT1、核NF-κB p65水平差异无统计学意义(P>0.05)。见图3、表4。
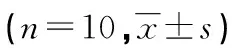
表4 各组小鼠结膜组织AMPK/SIRT1/NF-κB信号通路蛋白水平比较
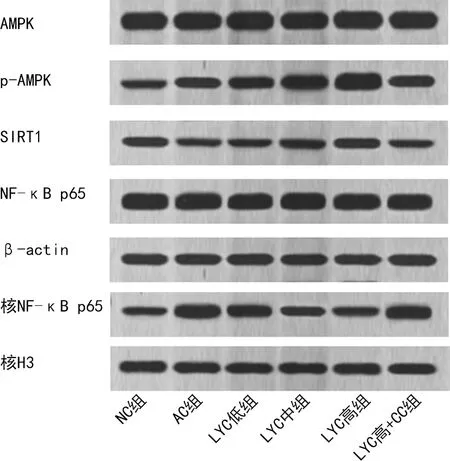
图3 各组小鼠结膜组织AMPK/SIRT1/NF-κB通路蛋白水平
3 讨 论
AC是临床常见的过敏性疾病之一,病程通常延长反复,影响患者正常生活,管理不当会引发视力不可逆受损[12]。嗜酸性粒细胞在AC等过敏性免疫疾病中发挥重要作用,其增多是过敏性疾病的标志表型[13];也是导致AC患者结膜组织受损的主要原因[14]。本研究采用OVA诱导建立AC小鼠模型,观察到AC组小鼠有眼部溢泪,结膜充血水肿,频繁抓挠等现象,且HE染色显示嗜酸性粒细胞增多,炎症细胞浸润明显,说明造模成功。LYC具有免疫调节、抗炎作用[5]。本研究中,LYC中、高组小鼠结膜肿胀、嗜酸性粒细胞增多等病变明显减轻,表明LYC对AC小鼠有治疗作用。
Th17/Treg平衡对人体免疫稳态至关重要,Th17/Treg失衡会导致免疫紊乱,引起炎症入侵[15]。Th17细胞可大量分泌与炎症疾病密切相关的促炎因子IL-17、IL-6;Treg细胞则分泌具有负向免疫调节作用的TGF-β和抑制性炎症细胞因子IL-10[16]。Th17/Treg在免疫表达中相互拮抗,维持机体免疫平衡[17]。IgE常常介导过敏性疾病的发生发展,IgE高表达会激活肥大细胞,引起组织肿胀[18]。TSLP是与过敏性疾病相关的关键调节因子,可响应蛋白酶过敏原刺激而合成,通常在过敏性疾病中高表达[19-20]。本研究中,与NC组比较,AC组小鼠脾脏中Th17细胞比例升高,Treg细胞比例降低,Th17/Treg平衡偏向Th17细胞;血清中IL-17、IL-6水平升高,TGF-β、IL-10水平降低,与Th17/Treg失衡一致;血清中IgE、TSLP水平均明显升高,这些变化均与小鼠响应OVA刺激致敏有关。经过LYC中、高剂量处理后,Th17/Treg趋向平衡,IL-17、IL-6、IgE、TSLP水平均降低,TGF-β、IL-10水平均升高,表明LYC可以调节Th17/Treg平衡,维持机体免疫内稳态,对于IgE和TSLP有负向调节作用,提示LYC的免疫调节、抗炎作用可能是其治疗AC小鼠的机制。
AMPK/SIRT1/NF-κB信号通路为炎症免疫相关通路之一,AMPK的磷酸化可促进SIRT1表达,进一步抑制NF-κB入核活化,减轻炎症反应[21]。研究发现,在预防Th17/Treg失衡中AMPK/SIRT1通路也发挥着重要作用,主要表现为通路的激活有利于维持Th17/Treg平衡[22]。AMPK/SIRT1通路的激活可以减轻胰腺炎的全身炎症反应[23];SIRT1高表达可以抑制因NF-κB活化引起的炎症因子的释放,减轻机体炎症反应[24]。在本研究中,AC组小鼠AMPK磷酸化以响应OVA刺激,SIRT1表达下调导致NF-κB p65入核增加,与Th17/Treg失衡和炎症因子高表达现象一致。经过LYC处理后AMPK磷酸化水平进一步提高,同时促进SIRT1高表达,进而抑制NF-κB入核活化,减少炎症因子释放,表明LYC可促进AC小鼠AMPK/SIRT1通路活化,抑制NF-κB通路活化。进一步采用CC处理后,研究显示,CC可抵消LYC对AC小鼠的上述保护作用。
综上所述,LYC可减轻AC小鼠的过敏和炎症反应,维护机体免疫平衡,可能与促进AMPK/SIRT1通路活化,抑制NF-κB通路活化有关。
