肝硬化伴肝癌患者动态增强MRI影像学特点及评估价值
2023-06-19蒋永磊李梦双杜建文
蒋永磊,李梦双,单 倩,杜建文,李 蕾
肝癌是全球癌症负担的主要来源,也是全球常见的致命恶性肿瘤,多数患者确诊时被诊断为晚期肝癌,是导致预后较差的重要原因[1-2]。肝细胞癌是肝癌主要病理类型,占全部肝癌的85%~90%[3]。研究显示,几乎所有的肝细胞癌都是以慢性肝损伤开始的,后逐渐发展为肝硬化,并最终在数年或数十年后发展为肝癌[4]。有证据表明,肝纤维化发展为肝硬化后能显著增加肝细胞癌的发生风险[5]。但肝硬化伴肝癌患者早期缺乏明显症状,难以通过观察症状及时发现,组织活检也存在一定的诊断局限性[6]。影像学技术具有无创、操作相对简便等优势,较CT、MRI诊断肝硬化伴肝癌的准确性和安全性高[7-8]。特别是动态增强MRI能对肿瘤血管渗透性特征进行定量分析,有助于提高恶性肿瘤诊断敏感度和准确度[9-10]。基于此,本研究重点探究肝硬化伴肝癌患者动态增强MRI影像学特点及评估价值。
1 资料与方法
1.1 一般资料
选取2021年8月—2022年8月连云港市第一人民医院收治的100例肝硬化伴肝癌作为研究组,另选取同期同年龄段100例肝硬化不伴肝癌作为对照组。2组性别、Child-Pugh分级[11]等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 病例选取标准
纳入标准:参照《肝硬化诊治指南》[12]确诊为肝硬化;研究组经病理检查确诊为肝癌[13],对照组无肝癌;入院后行动态增强MRI检查,影像学资料及临床资料完整。排除标准:有MRI检查禁忌证或MRI图像质量较差;存在认知、意识或心理障碍;伴严重心脑血管疾病、肺肾功能障碍;伴血液系统疾病;有肝脏手术史;合并其他脏器恶性肿瘤。
1.3 MRI检查方法
入院当日采用Achieva 3.0T MRI扫描系统(荷兰飞利浦公司)检查,8通道体部相控阵线圈。患者取仰卧位,对膈顶至肝右叶下缘进行扫描,先行常规T1WI扫描(TR 180 ms、TE 2 ms、层间距2 mm、层厚8 mm),T2WI扫描(TR 6 000 ms、TE 90 ms、层间距2 mm、层厚8 mm)。随后行动态增强MRI扫描,经肘静脉采用双管高压注射器注射0.1 mmol/kg钆塞酸二钠对比剂,注射速度2 mL/s,随后以相同速度团注生理盐水20 mL冲管。动脉期、门静脉期、平衡期分别在延迟19~22 s、55~60 s、180 s后进行扫描。测定病灶及其周围组织感兴趣区信号强度,并记录速率常数(Kep)、容积转移常数(Ktrans)、血管外细胞外间隙体积百分比(Ve)。
1.4 血清肿瘤标志物检测方法
入院当日采集患者外周静脉血3 mL,离心处理(半径8 cm、转速3 000 r/min、时间10 min)取血清,采用化学发光免疫分析法检测癌胚抗原(CEA)、甲胎蛋白(AFP)水平。
1.5 观察指标
1)2组动态增强MRI影像学特点及参数Kep、Ktrans、Ve和血清肿瘤标志物CEA、AFP水平;2)研究组不同病理特征患者动态增强MRI参数。
1.6 统计学方法
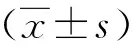
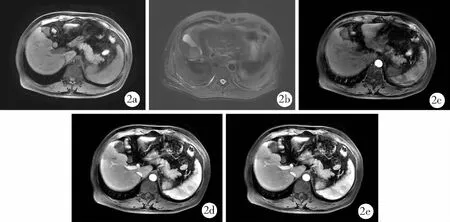
2 结果
2.1 2组动态增强MRI影像学特点比较
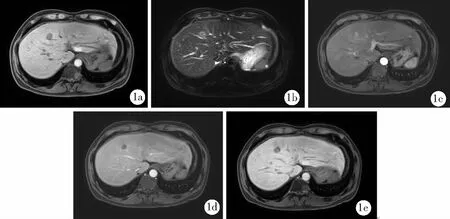
动态增强MRI扫描显示,研究组病灶直径为0.8~4.1(2.9±0.4)cm,对照组病灶直径为0.7~3.7(2.5±0.4)cm。研究组动脉期强化、门静脉期廓清及肝胆期低信号占比均较对照组高(P<0.01)。见表1。典型病例动态增强MRI图像见图1、2。
男,53岁,肝S4段小肝癌,病灶大小18 mm×16 mm;1a.T1WI扫描图像,呈低信号;1b.T2WI扫描图像,呈高信号;1c.动态增强MRI扫描动脉期图像,病灶明显强化;1d.动态增强MRI扫描门静脉期图像,显示病灶廓清;1e.动态增强MRI扫描肝胆期图像,呈低信号。图1 典型肝硬化伴肝癌病例动态增强MRI图像
男,60岁,病毒性肝炎肝硬化,肝纤维程度S4级,病灶大小31 mm×30 mm;2a.T1WI扫描图像,呈稍高信号;2b.T2WI扫描图像,病灶轻度强化;2c.动态增强MRI扫描动脉期图像,病灶轻度强化;2d.动态增强MRI扫描门静脉期图像,呈等信号;2e.动态增强MRI扫描肝胆期图像,呈稍高信号。图2 典型肝硬化不伴肝癌病例动态增强MRI图像

表1 肝硬化伴或不伴肝癌患者动态增强MRI影像学特点比较[例(%)]
2.2 2组动态增强MRI参数及血清CEA、AFP水平比较
研究组Kep、Ktrans、Ve及血清CEA、AFP水平均较对照组高(P<0.01),见表2。
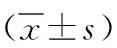
表2 肝硬化伴或不伴肝癌患者动态增强MRI参数及血清CEA、AFP水平比较
2.3 研究组动态增强MRI参数与血清CEA、AFP的相关性
肝硬化伴肝癌患者Kep、Ktrans、Ve与血清CEA、AFP水平呈正相关(r=0.430、0.496,P<0.01;r=0.512、0.584,P<0.01;r=0.411、0.453,P<0.01)。
2.4 动态增强MRI参数诊断肝硬化伴肝癌的价值
绘制Kep、Ktrans、Ve及血清CEA、AFP诊断肝硬化伴肝癌的ROC曲线,结果显示各指标单独诊断的AUC分别为0.765、0.722、0.747、0.705、0.756,而Kep、Ktrans、Ve联合诊断肝硬化伴肝癌的AUC大于血清CEA、AFP联合诊断的AUC(P<0.01)。见表3、图3。
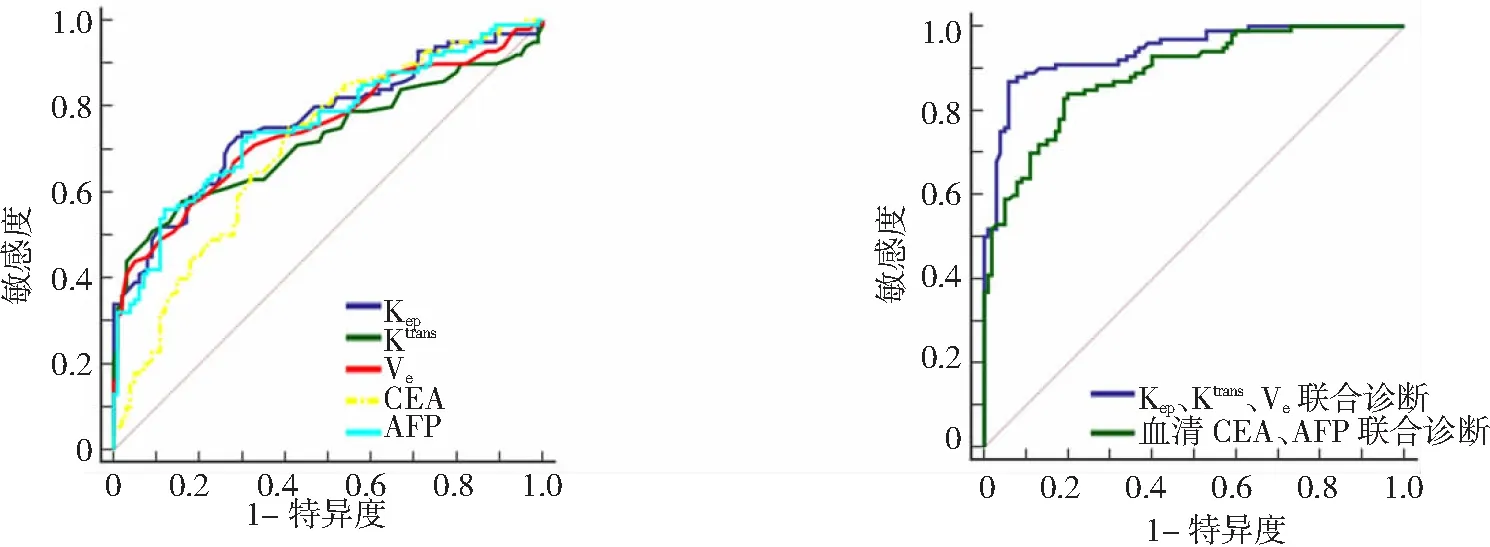
Kep为速率常数,Ktrans为容积转移常数,Ve为血管外细胞外间隙体积百分比,CEA为癌胚抗原,AFP为甲胎蛋白。图3 动态增强MRI参数诊断肝硬化伴肝癌的受试者工作特征曲线
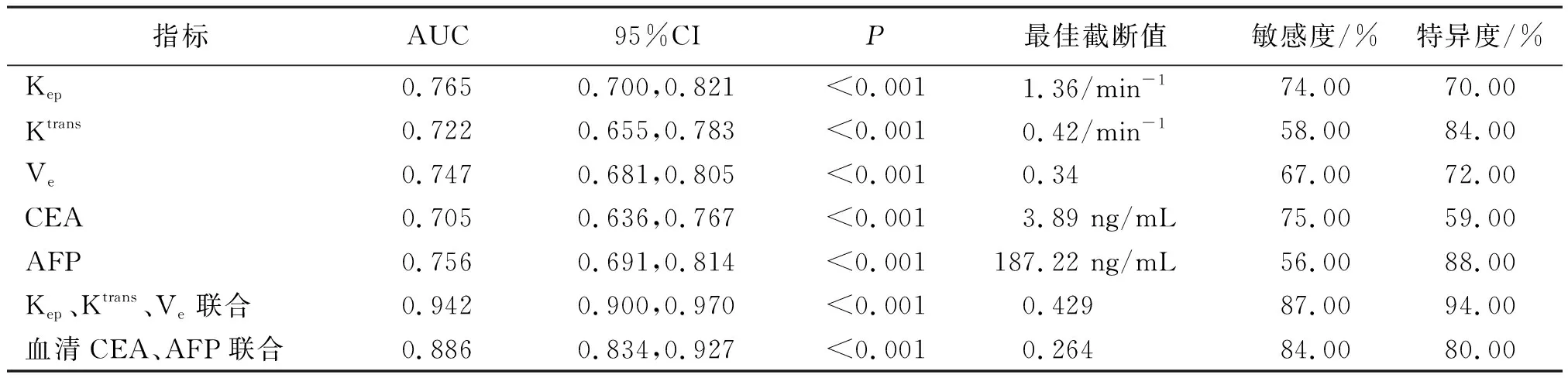
表3 动态增强MRI参数诊断肝硬化伴肝癌的价值
2.5 研究组不同病理特征患者动态增强MRI参数比较
研究组不同性别、年龄、体质量指数、病理类型、肿瘤直径、肿瘤数目、分化程度患者Kep、Ktrans、Ve比较差异无统计学意义(P>0.05);不同肿瘤分期、是否淋巴结转移患者Kep、Ktrans、Ve比较差异有统计学意义(P<0.01)。见表4。

表4 肝硬化伴肝癌不同病理特征患者动态增强MRI参数比较
2.6 动态增强MRI参数与肝硬化伴肝癌患者病理特征的相关性
相关性分析显示,Kep、Ktrans、Ve与肝硬化伴肝癌患者肿瘤分期、淋巴结转移情况呈正相关(r=0.392、0.350,P<0.01;r=0.457、0.394,P<0.01;r=0.373、0.332,P<0.01)。
3 讨论
肝硬化主要由乙型肝炎、丙型肝炎等病毒性肝炎发展形成,随着病情进展可引起门脉高压、肝损害等症状,导致多脏器受累,严重者可引起癌变[14]。
MRI是临床诊断肝癌的可靠影像学技术,相对于超声、CT等其他影像学方法具有软组织分辨率高、能多序列和多参数成像等优势[15-17]。动态增强MRI扫描能清晰显示肿瘤形态学变化,且能定量评估肿瘤形态改变前的肿瘤细胞密度、微循环状态及组织代谢情况,从而指导肝癌的早期诊断和治疗[18]。本研究结果显示,肝硬化伴肝癌患者动态增强MRI影像学特点以动脉期强化、门静脉期廓清及肝胆期低信号为主[19-20]。提示动态增强MRI影像学表现有助于鉴别诊断肝硬化伴或不伴肝癌。王宝锋等[21]研究指出,动脉期强化、肝胆期低信号在乙型肝炎肝硬化背景下对肝癌的早期诊断具有一定价值;但该研究显示门静脉期廓清表现无明显差异,本研究结果与其存在一定差异,可能与样本量、对比剂不同有关。
本研究进一步比较2组动态增强MRI定量参数,结果显示肝硬化伴肝癌患者Kep、Ktrans、Ve均明显高于肝硬化不伴肝癌患者。Kep是反映血流速度变化的参数,Ktrans主要体现病灶血流量和血管密度变化情况,Ve能反映细胞密度变化。上述结果提示肝硬化伴肝癌患者病灶内新生血管丰富,血管通透性增加,细胞密度增大。苗小变等[19]研究也发现肝硬化伴肝癌患者Kep、Ktrans、Ve明显增大,说明Kep、Ktrans、Ve可能作为肝硬化伴肝癌的诊断参数。本研究进一步通过相关性分析发现肝硬化伴肝癌患者Kep、Ktrans、Ve及血清CEA、AFP水平存在正相关关系。CEA、AFP是肝癌诊断的常规标志物,在肝癌患者血清中明显升高,二者水平升高提示患者存在较高的肝癌患病风险[20]。上述结果进一步说明Kep、Ktrans、Ve的异常变化与肝硬化背景下肝癌的发生密切相关,为本研究后续诊断结果奠定了基础。本研究ROC曲线显示,Kep、Ktrans、Ve诊断肝硬化伴肝癌的AUC均在0.7以上,说明各参数均具有一定诊断价值。特别是Kep、Ktrans、Ve联合诊断肝硬化伴肝癌的AUC提高至0.942,且高于血清CEA、AFP联合诊断的AUC。由此可见,Kep、Ktrans、Ve联合评估可为肝硬化背景下肝癌的早期诊断提供可靠的影像学依据。此外,肝癌患者临床特征的评估对临床医生明确病情、制定合理治疗方案具有重要的指导意义。本研究结果显示,Kep、Ktrans、Ve与肝硬化伴肝癌患者的肿瘤分期、淋巴结转移情况呈正相关,提示Kep、Ktrans、Ve能在一定程度上反映肝硬化伴肝癌患者肿瘤分期、淋巴结转移情况,可辅助评估患者病情,从而为临床治疗提供参考。
综上,肝硬化伴肝癌患者动态增强MRI影像学特点与肝硬化不伴肝癌患者有较大差异,其定量参数对肝硬化伴肝癌具有较高的诊断价值,且能评估肝癌肿瘤分期、淋巴结转移情况,可为肝硬化伴肝癌的诊疗提供重要影像学依据。
