红凉伞愈伤组织诱导及快繁技术体系建立
2023-06-19马明东毛美琴
路 艳, 马明东, 曹 慧, 毛美琴
(1.潍坊学院种子与设施农业工程学院, 山东 潍坊 261061;2.四川农业大学风景园林学院, 成都 611130)
红凉伞[ArdisiacrenataSims var.bicolor(Walker) C. Y. Wu et C. Chen]为紫金牛科(Myrsinaceae)植物朱砂根(A.crenataSims)的变种,叶背、花梗、花萼及花瓣均带紫红色,又名叶下红、紫背紫金牛、红八爪,是土家族、壮族、瑶族等少数民族地区常用的传统民间草药[1]。研究表明,红凉伞含有三萜皂苷类、香豆素类、黄酮类、酚类、挥发油、醌类、氨基酸、糖类等多种化合物,具有解毒消肿,活血止痛,祛风除湿的功效[2]。三萜皂苷是红凉伞重要的药理活性成分,能明显抑制癌细胞增殖、诱导癌细胞凋亡[3-4]。此外,红凉伞还具有抗病毒、消炎、提高免疫力、降低胆固醇、保肝等多种生物活性[5],独特的双色彩叶和累累红果也具有极高的观赏价值[6]。红凉伞的有效药用部位主要集中在根部,对红凉伞野生植株过度开采,导致种质资源数量急剧下降。如何有效保护红凉伞种质资源,满足红凉伞在制药产业中的高需求量,是亟待解决的基本问题。
组织培养技术能够快速繁殖种苗,保持优良品种的遗传特性,在新品种选育、珍稀植物种质保存、植物次生代谢物质生产等方面应用广泛[7-8]。利用组织培养和细胞工程技术生产次生代谢物质,是提高药用植物次生代谢产物含量的重要途径之一。Bhattacharyya等[9]研究发现,金钗石斛(DendrobiumnobileLindl.)组织培养再生植株的次级代谢产物,如酚类、生物碱、类黄酮等都有较高的活性水平。目前,红凉伞相关研究主要集中在药理作用及化学成分分析方面[10-11],关于红凉伞离体快繁技术体系的报道较少。本研究以红凉伞种子萌发的无菌苗为材料,探讨愈伤组织诱导的影响因素,并通过丛芽诱导途径建立红凉伞快繁技术体系,以期为红凉伞种质资源保存、工厂化育苗、次生代谢产物生物合成调控等方面提供研究基础。
1 材料与方法
1.1 材 料
红凉伞购于山东省潍坊市高新区广发花卉城,经四川农业大学马明东教授鉴定为红凉伞,种植于潍坊学院园林植物温室盆栽试验区,常规养护管理。
1.2 方 法
1.2.1种子无菌苗培养
于12月、翌年3月、6月、9月采集红凉伞成熟果实进行试验。选择健康饱满的种子,洗衣粉溶液浸泡30 min→流水冲洗2 h→无菌水冲洗3次→75%乙醇消毒1 min→0.1% HgCl2消毒10 min,无菌水冲洗5遍,用无菌滤纸吸去种子表面水分,接种到MS+BA 0.2 mg/L+NAA 0.1 mg/L培养基上,培养获得无菌苗。每处理接种15个外植体,3次重复。统计污染率、萌发率、观察启动时间和无菌苗生长情况。
污染率/%=(污染数/接种数)×100%;
萌发率/%=(萌发数/未污染数)×100%。
1.2.2愈伤组织诱导
将无菌苗叶片、茎段和根切成1 cm长,接种到MS+2,4-D 0.1 mg/L+NAA 0.2 mg/L+6-BA 0.05 mg/L培养基上,筛选诱导愈伤组织的最佳外植体类型,20 d后统计愈伤组织的诱导率和褐化率。将茎段接种到添加不同浓度6-BA、2,4-D、NAA的MS培养基,筛选愈伤组织诱导的最佳激素组合,培养每处理接种15个外植体,3次重复,35 d后记录愈伤组织诱导和生长情况。
诱导率/%=(诱导出愈伤的外植体数/外植体总数)×100%;
褐化率/%=(褐化的外植体数/外植体总数)×100%。
1.2.3丛生芽诱导与增殖培养
以培养45 d的红凉伞无菌苗带芽茎段为材料,切成2.0 cm长,进行丛生芽诱导培养。设计不同培养基、不同浓度6-BA、NAA的3因素3水平正交试验,每处理接种15个外植体,3次重复,统计不定芽诱导率、繁殖系数以及丛生芽生长状况。
诱导率/%=(诱导出丛芽的茎段个数/接种茎段总数)×100%;
增殖系数=60 d后丛生芽总数/接种茎段总数。
1.2.4生根培养及炼苗移栽
将生长健壮的单株芽苗接种到附加不同质量浓度 IBA的1/2 MS培养基中,记录根系生长情况,40 d后统计生根率。打开培养瓶封口膜,对高4~6 cm、长势良好的生根苗进行炼苗。10 d后取出小苗,洗去根部培养基,移植到V营养土∶V珍珠岩∶V蛭石=2∶1∶2的基质中,35 d后统计成活率。
生根率/%=(生根苗数/接种苗数)×100%;
成活率/%=(成活苗数/移栽苗数)×100%。
1.2.5培养条件
试验所用培养基均附加琼脂5.8 g/L、蔗糖30 g/L、pH=5.8~6.0,培养温度(25±1)℃,光照12~14 h/d,光照强度1 500~2 000 lx。
1.2.6数据处理与分析
采用Excel 2013软件进行数据整理,SPSS 20.0软件进行方差分析和多重比较(Duncan)。
2 结果与分析
2.1 种子无菌苗萌发
不同时间取材的红凉伞种子(图1)污染率、萌发率和启动时间差异显著,表现出一定的时间效应(表1)。3月份的种子污染率最低,12月、9月污染率次之,6月污染率最高,达28.89%。12月种子萌发率最低,仅为44.32%,启动时间28 d;其他月份萌发率差异不显著。以翌年3月取材的种子污染率低、诱导萌发效果最佳,启动时间7 d,萌发率为93.68%。接种后红凉伞种子的胚根点颜色逐渐变绿,7 d左右胚根尖开始膨大,胚根伸长变粗,21 d胚根长至2~2.5 cm,幼芽萌出,新叶纤细,叶表绿色、背面紫红色,60 d左右无菌苗高3 cm以上。
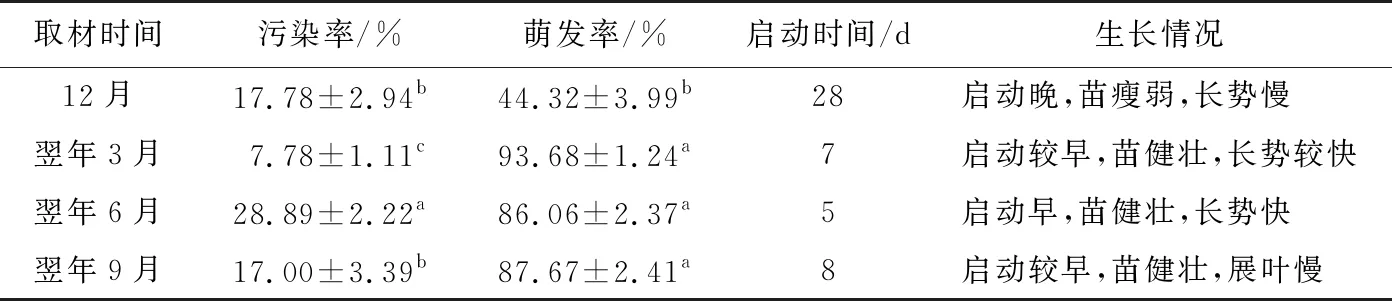
表1 不同取材时间种子无菌苗的萌发情况

注:A为红色果实;B为胚根点突出;C为胚根伸长;D为萌发的幼苗;E为诱导不定芽;F为不定芽增殖;G为不定芽成苗;H为长大的芽苗;I为组培苗生根。
2.2 红凉伞愈伤组织的诱导
2.2.1外植体类型对愈伤组织诱导的影响
接种7 d时,叶、茎段、根外植体切口处开始膨大,颜色变浅,14 d左右产生愈伤组织(图2)。不同外植体类型愈伤组织诱导情况见表2。茎段愈伤组织诱导率最高,为91.11%,茎段两端切口处形成黄白色愈伤组织,慢慢增殖成球状,愈伤组织颜色鲜亮、生长迅速。根和叶愈伤组织的诱导率比较低,愈伤组织呈水渍状,生长缓慢。

表2 不同外植体诱导的愈伤组织及生长情况
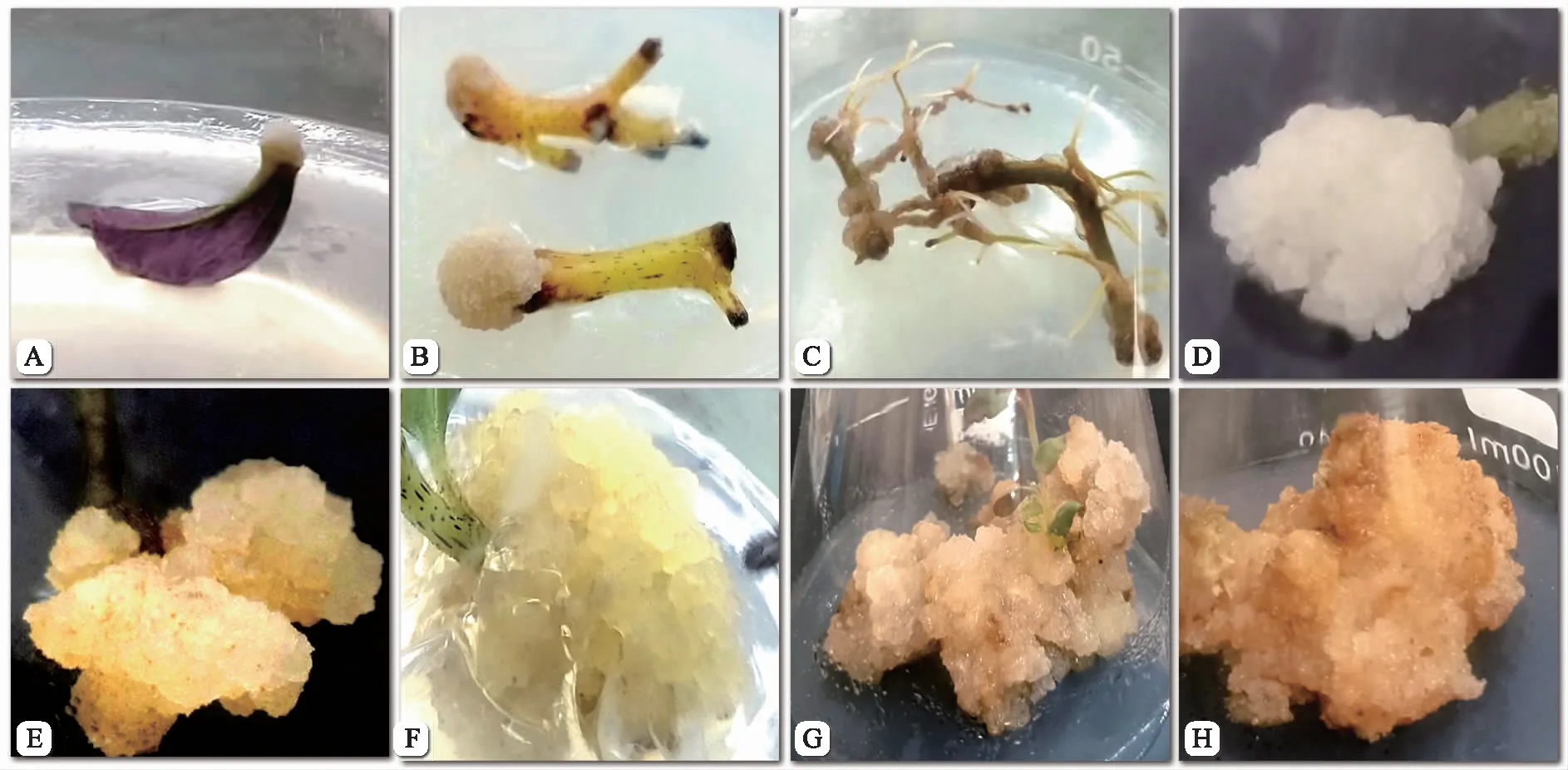
注:A为叶诱导愈伤组织;B为茎段诱导愈伤组织;C为根诱导愈伤组织;D为淡黄白色愈伤组织;E为愈伤组织增殖;F为颗粒状愈伤组织;G为水渍状愈伤组织;H为致密状愈伤组织。
2.2.2激素对愈伤组织诱导的影响
不同激素组合对红凉伞愈伤组织的诱导和生长影响结果见表3。愈伤组织诱导的最佳培养基是MS+2,4-D 0.2 mg/L+NAA 0.5 mg/L+6-BA 0.2 mg/L,诱导率为93.33%。愈伤组织呈3种状态,颗粒状愈伤组织黄白色,表面有球形突起,生活力强;冰沙状愈伤组织结构疏松,增殖速度快,易褐变为茶色水渍状;致密状愈伤组织,质地坚硬,增殖较慢。红凉伞愈伤组织增殖过程中易褐化,最终失去分化能力死亡,进一步分化成苗难度较大。

表3 不同激素对愈伤组织诱导的影响
方差分析结果(表4)表明,3种激素对红凉伞愈伤组织诱导率的影响程度依次为2,4-D>NAA>6-BA。2,4-D、NAA的影响呈极显著(p<0.01),6-BA的影响不显著(p>0.05)。对2,4-D、NAA 两种激素不同浓度水平进行多重比较(表5),2,4-D 三个浓度水平对红凉伞愈伤组织诱导率的影响呈极显著差异,影响最大的是水平2(0.2 mg/L);NAA对红凉伞愈伤组织诱导率影响在水平2(0.5 mg/L)与水平3(1.0 mg/L)差异不显著,与水平1(0.2 mg/L)差异极显著。
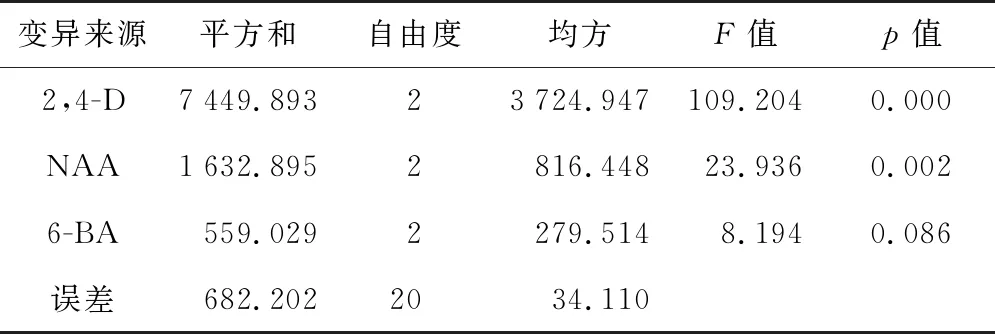
表4 激素影响愈伤组织平均诱导率的方差分析

表5 不同激素水平对愈伤组织诱导效果的多重比较
2.3 茎段诱导丛生芽
将红凉伞无菌苗的带节茎段接种于正交实验设计的培养基中进行丛芽诱导(图1),统计结果(表6)表明,带节茎段诱导不定芽的最佳培养基组合是MS+6-BA 2.0 mg/L+NAA 0.05 mg/L,诱导率达91.11%,增殖系数3.47,丛生芽分化数量多,芽苗健壮、叶片舒展,生长良好。极差分析表明,3种因素及因素水平对红凉伞不定芽诱导率的影响不同,极差依次是培养基>6-BA>NAA。方差分析结果(表7)表明,培养基类型对红凉伞茎段诱导不定芽的影响最大,培养基类型和6-BA达极显著水平(p<0.01),NAA影响差异不显著(p>0.05)。

表6 不同因素对茎段诱导不定芽的影响和极差分析
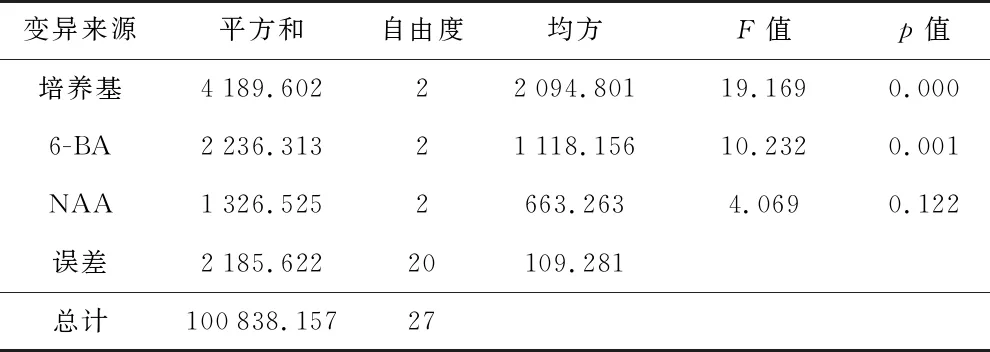
表7 丛芽诱导率的方差分析
2.4 生根及移栽
将高4~5 cm的健壮芽苗接种到生根培养基,10 d 左右,部分小苗基部开始出现白色根点,20 d时白色不定根长1~1.5 cm,培养40 d左右,根长达3~5 cm,根系粗壮。小苗叶片伸展,生长良好,结果如表8所示。随着IBA浓度的升高,红凉伞小苗生根率先升高后下降。IBA浓度为0.5 mg/L时,生根率达90.74%,平均生根数4.6条,根长而粗壮,是最佳的生根培养基。移栽前开盖炼苗10 d左右,用流水洗净小苗根上的培养基,移栽到V营养土∶V珍珠岩∶V蛭石=2∶1∶2的混合基质中,温度为25~30 ℃,湿度为90%~100%,遮荫度为85%,小苗成活率达75.40%。
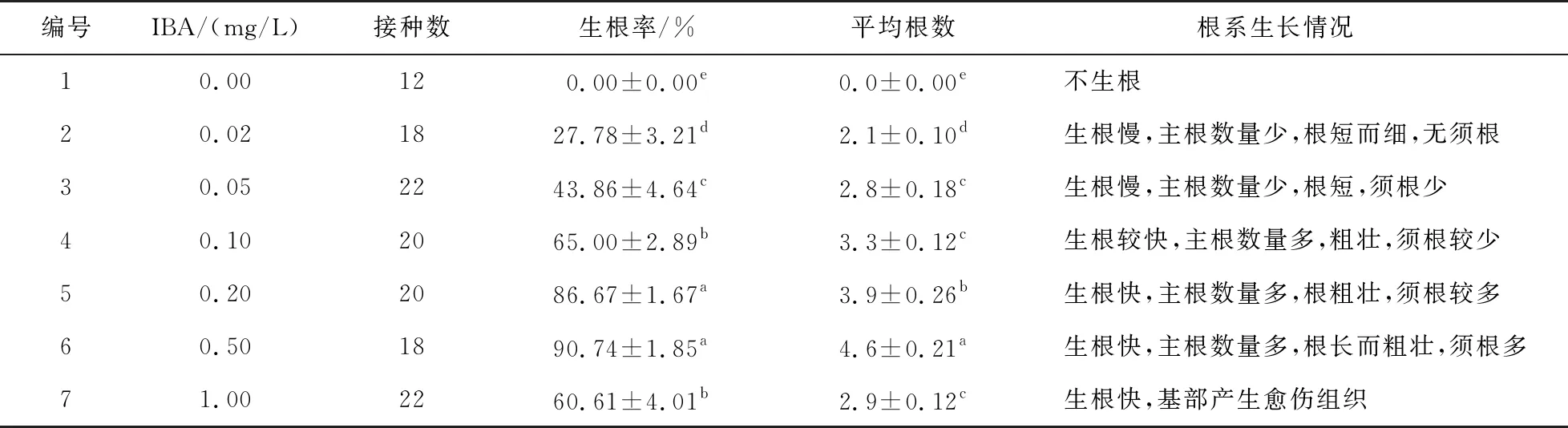
表8 不同浓度IBA对红凉伞无菌苗生根的影响
3 讨 论
植物种子取材方便、消毒彻底,更易于通过无菌苗培养方式建立快繁体系[12-13]。红凉伞种子数量多,挂果期长,取材时间不受季节限制,是理想的材料。12月种子萌发率最低,启动时间最长,可能与红凉伞种子的后熟特性有关。果实成熟时种胚仍然处于发育前期,需要经过胚的后熟作用发育成熟[14]。翌年3月、6月种胚后熟发育完成,种子启动时间较早,萌发率差异不显著。6月污染率最高,与此时细菌、真菌微生物生命活动旺盛有关,适当延长消毒时间1~2 min能降低污染率。翌年9月种子发生胎萌现象,胚根从果实内伸出,消毒处理严重伤害胚根的活力,影响种子萌发。
影响愈伤组织诱导的主要因子包括外植体类型、培养基、植物激素等。袁云香[15]以蝴蝶荚蒾幼叶为外植体,诱导出淡黄色、小颗粒状的愈伤组织;贾明良等[16]以三叶木通幼嫩枝条及叶片作为外植体诱导愈伤组织,诱导率分别为92.00%和97.53%。本研究中,红凉伞茎段诱导愈伤组织的效果最好,诱导率达91.11%。植物激素对于愈伤组织的诱导也具有重要作用,不同植物或同种植物不同器官所需的植物激素的种类和浓度有较大差异。曾超珍等[17]研究发现,2,4-D对虎杖愈伤组织增殖培养有显著影响;张旭红等[18]在研究欧洲百合愈伤组织诱导时发现,NAA的添加最有利于愈伤组织的诱导。本研究中,红凉伞愈伤组织的诱导主要受到2,4-D和NAA质量浓度的影响,随着2,4-D浓度的升高以及NAA的协同作用,愈伤组织诱导率逐渐增加,但浓度过高时,愈伤组织的诱导受到抑制。6-BA的配合使用显著提高了愈伤组织的诱导率,愈伤的结构由疏松变得致密。红凉伞愈伤组织有颗粒状、冰沙状、致密状3种形态,黄白色颗粒状愈伤组织生活力强、增殖速度快,可能为胚性细胞。冰沙状、致密状愈伤组织生活力弱,增殖缓慢,生长后期易褐化死亡,可能是因为2,4-D浓度过高,抑制了愈伤组织再分化成苗的能力,后面将做进一步研究。
腋芽萌发是植物离体再生的重要途径[19-21],培养基、激素的种类与浓度是丛芽再生的重要影响因素。植物基因型不同,丛生芽诱导增殖的培养基也不同。青钱柳适宜的芽诱导增殖培养基为1/2 MS培养基[22];毛棉杜鹃在Read培养基上诱导的丛生芽最多[23];悬铃木最佳丛生芽诱导培养基是WPM[24]。本研究中,红凉伞丛生芽诱导的最适培养基是MS,丛生芽分化数量多,芽苗健壮。植物生长调节剂通过改变内源激素水平调控形态建成,在不定芽直接分化途径中起着关键性作用[25]。一定范围内,高质量浓度细胞分裂素与低质量浓度生长素配合使用,有利于不定芽的诱导发生,但二者的质量浓度大小和比值因植物的基因型不同而有所不同。太行花在0.6 mg/L 6-BA与0.15 mg/L IBA组合下,丛生芽增殖系数最高且无玻璃化现象[26],醉鱼草不定芽诱导研究中,9 mg/L 6-BA与1 mg/L IBA配合使用显著增加了芽的诱导数量,诱导率达100%[27]。本研究中,6-BA、NAA的配合使用对红凉伞不定芽诱导有显著影响。随着6-BA浓度的增加,红凉伞不定芽诱导率增加,分化数量多,芽苗健壮。NAA浓度增加导致不定芽基部长出大量愈伤组织,增殖系数降低,苗细弱不伸展。6-BA在红凉伞芽诱导增殖过程中起主导作用,与齐贤等[28]在“黄水蜜”桃实生苗茎段诱导不定芽再生体系研究的结果相似。
植物组织培养的生根培养基一般以1/2 MS为主,添加生长素IBA或者NAA,不同植物适用的生长素种类和浓度不同。“金皇后”变叶木最适生根培养基为1/2 MS+IBA 1.5 mg/L,生根率达100%[29];胡杨花药再生体系在1/2 MS+1.2 mg/L IBA培养基中芽苗的生根率最高,达96.7%[30]。红凉伞组培苗生根培养的最适培养基为1/2 MS+IBA 0.5 mg/L,生根率达90.74%,主根长而粗壮。组培苗叶片极易失水萎蔫,移栽成活的关键因子是湿度,湿度90%、遮荫度85%的条件下移栽成活率较高。本试验以红凉伞种子培养的无菌苗为材料,探讨了培养基、外植体类型、植物生长调节剂等因素对愈伤组织诱导、丛生芽诱导增殖及生根移栽的最适培养条件,建立了红凉伞植株快繁技术体系,为红凉伞野生种质资源保存、优质种苗繁育和次生代谢产物开发利用提供了研究基础。
