肉苁蓉和管花肉苁蓉种子萌发及质量研究
2023-06-19朱文娟郭晔红
朱文娟, 郭晔红, 姜 侃, 杜 弢, 陈 垣
(1.甘肃农业大学农学院/省部共建干旱生境作物学国家重点实验室, 兰州 730070;2.甘肃中医药大学, 兰州 730000)
肉苁蓉始载于《神农本草经》,列为上品,是名贵的滋补中药材,具有补肾阳、益精血、润肠通便的功效[1-2]。近年来,自然灾害和生态环境恶化,导致肉苁蓉的野生资源急剧下降,已被列入《中国植物红皮书》,也是国际贸易的管制物种。《中国药典》(2020年版)规定,肉苁蓉为列当科植物肉苁蓉(CistanchedeserticolaY.C.Ma)或管花肉苁蓉[Cistanchetubulosa(Schenk) Wight]干燥带鳞叶的肉质茎。肉苁蓉又名大芸,寄生于藜科植物梭梭[Haloxylonammodendron(C. A. Mey.) Bunge]和白梭梭(HaloxylonPersicumBunge ex Boiss. Et Buhse)的根部。管花肉苁蓉又名红柳大芸,寄生于柽柳属(Tamarix)植物的根部[3]。为满足市场需求,人工种植逐渐发展起来,种植肉苁蓉和管花肉苁蓉成为肉苁蓉药材的主要来源。
肉苁蓉和管花肉苁蓉都是专性寄生植物,人工种植需要先栽培其寄主植物,然后用肉苁蓉或管花肉苁蓉的种子接种[4],种子质量直接影响药材的产量和品质。目前,肉苁蓉种子的生产规模小,种质混杂且存在萌发率低甚至不萌发等问题,种子质量成为制约肉苁蓉高产及规范化种植的重要因素。建立全面系统的种子质量检验方法,对种子进行质量检验和筛选,接种高质量种子,可以在源头上提升肉苁蓉药材的种植效率。周峰等[5]研究发现,根寄生植物的种子萌发具有特异性,刚成熟的种子需要在低温下完成胚的后熟,再经过一段时间的预培养,在合适浓度的寄主根系分泌物诱导下才能萌发。大多数植物的种子萌发受赤霉素和脱落酸平衡的调节,赤霉素可以促进种子萌发,脱落酸则维持种子休眠,抑制种子萌发,氟啶酮和氟草敏可以抑制类胡萝卜素的生物合成从而抑制脱落酸的生物合成[6-7]。因此,本研究以赤霉素、氟啶酮、氟草敏处理种子,探索肉苁蓉和管花肉苁蓉的快速萌发条件。
目前,鲜有文献研究肉苁蓉和管花肉苁蓉的种子质量检验规程。本试验以肉苁蓉种子和管花肉苁蓉种子为材料,优化出肉苁蓉种子和管花肉苁蓉种子的快速萌发条件,解决专性寄生和生理休眠所致的种子发芽周期长、发芽率低的问题;参照《农作物种子检验规程》,建立了包括真实性、大小、净度、千粒重、含水量、发芽率等指标的种子质量检验方法,初步制订肉苁蓉和管花肉苁蓉的种子质量检验规程;收集市售及种植基地的种子共45份,包括37份肉苁蓉种子和8份管花肉苁蓉种子,调查种子的质量现状,以期为其种子质量检验提供科学依据,促进肉苁蓉药材的高效率种植。
1 材料与方法
1.1 种子样本
肉苁蓉种子采集于甘肃省白银市靖远县,管花肉苁蓉种子产自新疆维吾尔自治区于田县奥依托格拉克乡喀拉库木什村。种子质量调查的样本详见表1,将种子装在牛皮纸信封袋中,存放于4 ℃冰箱备用。
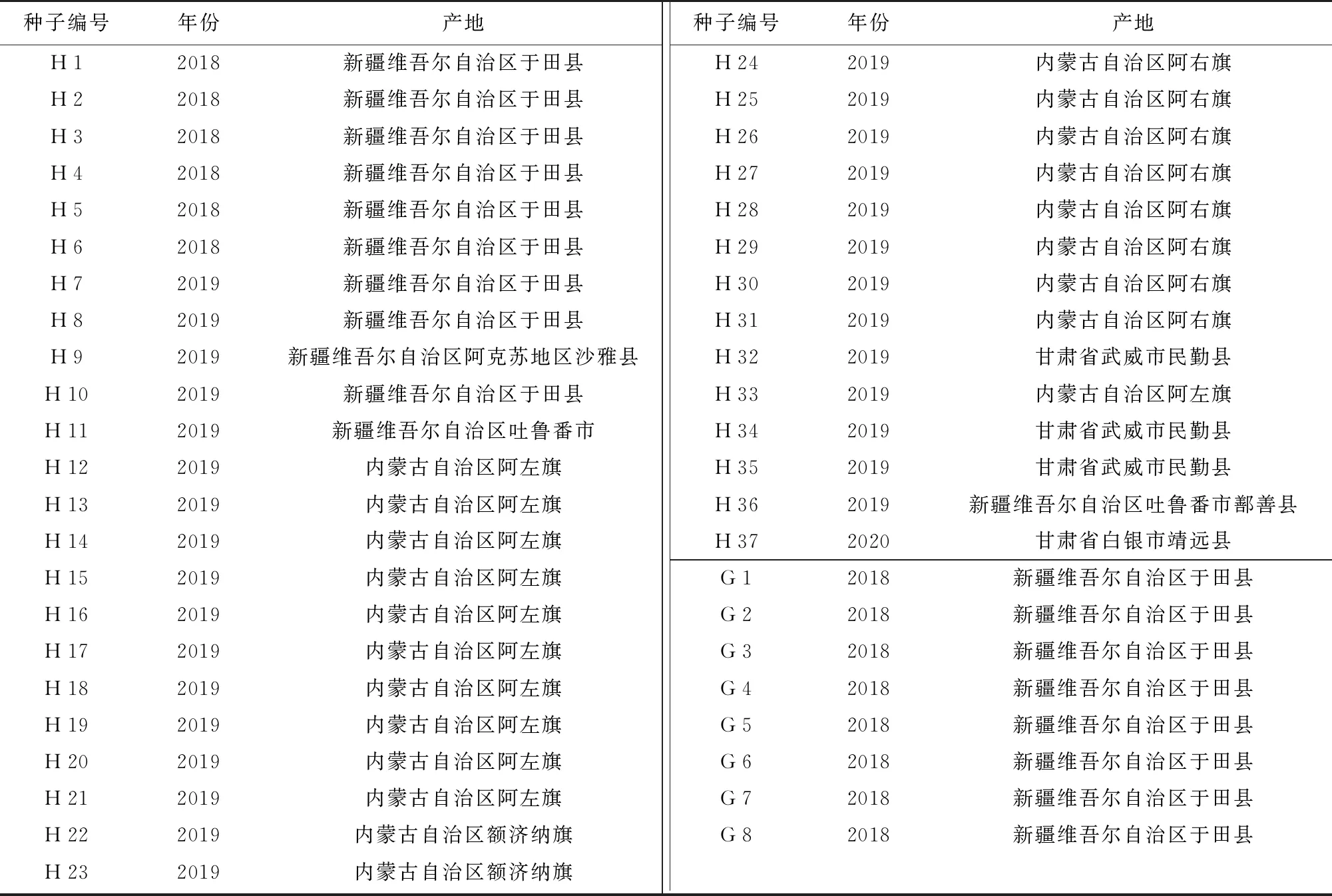
表1 肉苁蓉和管花肉苁蓉的种子质量调查样本
1.2 仪器与试剂
场发射扫描电镜(美国-FEI-Quanta 250 FEG),环境扫描电镜(美国-FEI-Quanta FEG 250),光学显微镜(OLYMPUSCKX 53),真空干燥箱(上海新苗医疗器械制造有限公司,DZF-6050型),恒温光照培养箱(BoxunBSP-150)。
次氯酸钠溶液(Innochem),赤霉素(Aladdin,95%),氟啶酮(Aladdin,分析标准品),氟草敏(Aladdin,分析标准品)。
1.3 方 法
1.3.1种子的形态鉴定
利用扫描电镜和环境扫描电镜观察肉苁蓉种子和管花肉苁蓉种子在干燥状态和吸水状态下的形态特征。随机取10粒干燥成熟的净种子,均匀粘贴在导电胶上,喷金60 s,在扫描电镜下观察并拍照,利用Nano Measurer 1.2软件计算种子的长度和宽度;随机取吸水状态和发芽状态的种子,将其粘贴在导电胶上,迅速在环境扫描电镜下观察并拍照。
种子在蒸馏水中充分吸胀后,用镊子及解剖针去掉种皮,将种仁粘贴在导电胶上,滴水保持样品的水分,在环境扫描电镜下观察种仁的结构特征。使用解剖刀将种子横切,按照切面向上和切面向下,将样品粘贴在导电胶上,喷金60 s,在扫描电镜下观察并拍照[8]。
1.3.2发芽率测定
种子萌发采用培养皿滤纸法,包括浸种、赤霉素溶液预处理、种子消毒、萌发培养等4个阶段。分别取适量肉苁蓉和管花肉苁蓉的净种子,用蒸馏水将种子冲洗3次,置于15 mL无菌离心管中,加入10 mL蒸馏水,在25 ℃黑暗条件下浸泡24 h[9],使种子充分吸胀。此时种皮的蜂窝状小孔中所带杂质更容易冲掉,再用蒸馏水冲洗2次,防止种子在萌发培养过程中发霉。离心管中换入10 mL赤霉素溶液,25 ℃黑暗条件下浸种72 h。换入12 mL 2%次氯酸钠溶液,摇匀,使种子充分消毒10 min以杀灭种皮携带的真菌和细菌等,用无菌水冲洗3次,备用。
用镊子取2层已灭菌的90 mm滤纸,置于90 mm无菌培养皿中,加入4 mL培养液,每个培养皿中按照5行、每行10粒的方式放置50粒种子,以封口膜封住培养皿,在25 ℃黑暗条件下培养21 d。每7 d统计一次发芽种子数,去除已经发芽的种子,补加1 mL蒸馏水,计算发芽势和发芽率[10]。


首先,比较氟啶酮和氟草敏对种子萌发的影响,筛选出适宜肉苁蓉种子和管花肉苁蓉种子萌发的培养物质。取种子0.5 g,以10 mg/L赤霉素溶液预处理72 h。使用不同浓度的氟啶酮或氟草敏溶液作为培养液,设0,0.1,1.0,10,100,200 mg/L等6个处理,每个处理重复3次,计算发芽势和发芽率。
其次,考察不同浓度赤霉素预处理对肉苁蓉种子和管花肉苁蓉种子萌发的影响。以10 mg/L适宜培养物质作为培养液,赤霉素浓度设0,0.1,1.0,10,100,1 000 mg/L等6个处理,每个处理取0.5 g种子,重复3次,计算发芽势和发芽率。
最后,比较培养液浓度对肉苁蓉种子和管花肉苁蓉种子萌发的影响。取种子0.5 g,以最佳浓度赤霉素预处理种子,培养液浓度设0,0.01,0.1,1.0,10,100,200 mg/L等7个处理,每个处理重复3次,计算发芽率。
1.3.3千粒重测定
将样品充分混匀,采用四分法分取初次样品和试验样品,以百粒法、二百粒法、五百粒法、千粒法分别测定肉苁蓉种子和管花肉苁蓉种子的千粒重,即随机数取100,200,500,1 000粒种子,在万分之一分析天平上称重并记录,计算1 000粒种子的重量。利用SPSS 19.0软件统计重复间的变异系数以及不同测定方法的差异显著性。
1.3.4净度测定
种子净度的高低受采收、清选等外部因素影响,并非种子的生物学特性[11],通过检测样品中不同成分的百分率和混合物特性可以推测种子批的组成。按照《农作物种子检验规程》的规定,试验样品应至少含有2 500个种子单位的重量,样品在分析前后增失比例不得超过5%。通过千粒质量的测定,估计合适的试验样品重量,将试验样品分为净种子、其他植物种子和杂质,分别称重记录,计算各成分的重量百分率,重复4次。肉苁蓉和管花肉苁蓉的种子样本中均未见其他植物种子,因此净度不计算这一项。


1.3.5水分测定
水分测定必须使种子中自由水和束缚水全部除去,并最大可能减少氧化、分解或其他挥发性物质的损失。本试验采用高恒温烘干法(133±1)℃测定种子的含水量[12],将烘箱预热至指定温度,称量瓶及其盖子分别编号。取肉苁蓉的净种子(0.5±0.02)g,管花肉苁蓉的净种子(0.3±0.02)g,重复3次,开始烘烤并计时。每隔1 h盖上称量瓶盖子,取出放入干燥器内冷却至室温,称重记录。

1.3.6肉苁蓉种子和管花肉苁蓉种子的质量现状调查
采用建立的种子质量检验方法,对收集到的37份肉苁蓉种子(H 1~H 37)和8份管花肉苁蓉种子(G 1~G 8)进行质量检验(表1)。测定种子的长度、宽度、净度、千粒重、含水率和发芽率,每个样本重复3次,使用SPSS 19.0软件进行数据分析,比较不同来源种子的质量,分析种子质量现状。
2 结果与分析
2.1 种子的形态特征
肉苁蓉和管花肉苁蓉的种子都呈黑色或黑褐色,种仁呈白色或褐色。如图1和图2所示,两种肉苁蓉种子的种皮上均布满蜂窝状的不规则多边形小孔,且有一层薄膜覆盖在孔上,大部分薄膜已脱落,孔壁上具有条状纹饰。种脐为近圆形,种皮和种仁之间存在间隙,易于分离,种仁表面具有网格状纹饰。

注:A 1为种子(30×);A 2为种子(500×);A 3为种子(300×);A 4为种子的横切面(110×);A 5为吸水状态的种子(1 500×);A 6为种仁(1 000×)。

注:B 1为种子(30×);B 2为种子(500×);B 3为种脐(600×);B 4为种子的横切面(120×);B 5为吸水状态的种子(2 500×);B 6为种仁(1 000×)。
肉苁蓉种子形状不规则,多数为一端钝圆一端尖,少数种子为长圆形,种脐位于尖端。种子吸水后细胞膨胀,外种皮孔壁上可见不连续的条状纹饰和内凹小孔。管花肉苁蓉种子呈近球形,种子吸水后,外种皮孔壁上的条状纹饰均匀增厚,纹路连续,这可作为与肉苁蓉种子的鉴别点。
2.2 种子的萌发条件
2.2.1萌发培养物质的筛选
空白试验表明,不添加任何外源物质,在蒸馏水条件下,肉苁蓉种子和管花肉苁蓉种子30 d内均不发芽。由图3和图4可知,肉苁蓉种子以10 mg/L赤霉素溶液预处理72 h后,10 mg/L氟啶酮培养,可使发芽率增加至66.67%;100 mg/L氟草敏培养,可使发芽率增加至58.67%。因此,拟定氟啶酮溶液作为肉苁蓉种子的萌发培养液。

注:不同小写字母表示p<0.05差异显著。下同。
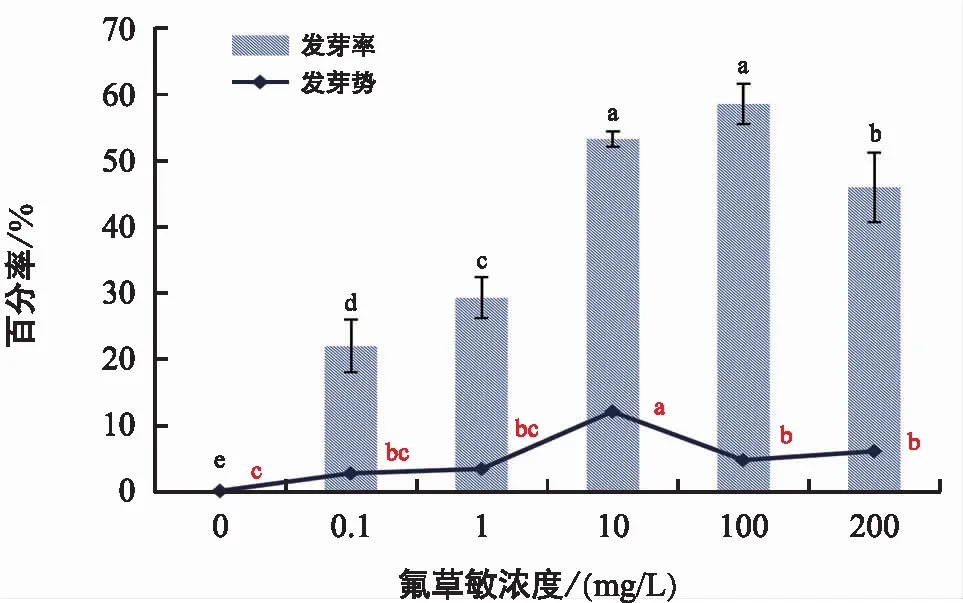
图4 氟草敏对肉苁蓉种子萌发的影响
肉苁蓉种子在培养7 d内开始萌发,其发芽势以培养7 d时的发芽数计算。仅在低浓度(0~10 mg/L)的培养液条件下,种子发芽势与发芽率的升降趋势一致;当培养液浓度为10~200 mg/L时,种子发芽势与氟啶酮浓度呈正相关,高浓度的氟草敏则导致种子发芽势下降。
由图5和图6可知,10 mg/L赤霉素溶液预处理管花肉苁蓉种子72 h后,在蒸馏水培养条件下,其发芽率为24%;1 mg/L氟啶酮培养,可使发芽率增加至64%;0.1 mg/L氟草敏培养,可使发芽率增加至64.67%。氟啶酮或氟草敏培养,种子的最高发芽率仅相差0.67%,二者都可以作为管花肉苁蓉种子的萌发培养物质。为和肉苁蓉种子统一,本文以氟啶酮作为管花肉苁蓉种子的萌发培养物质。
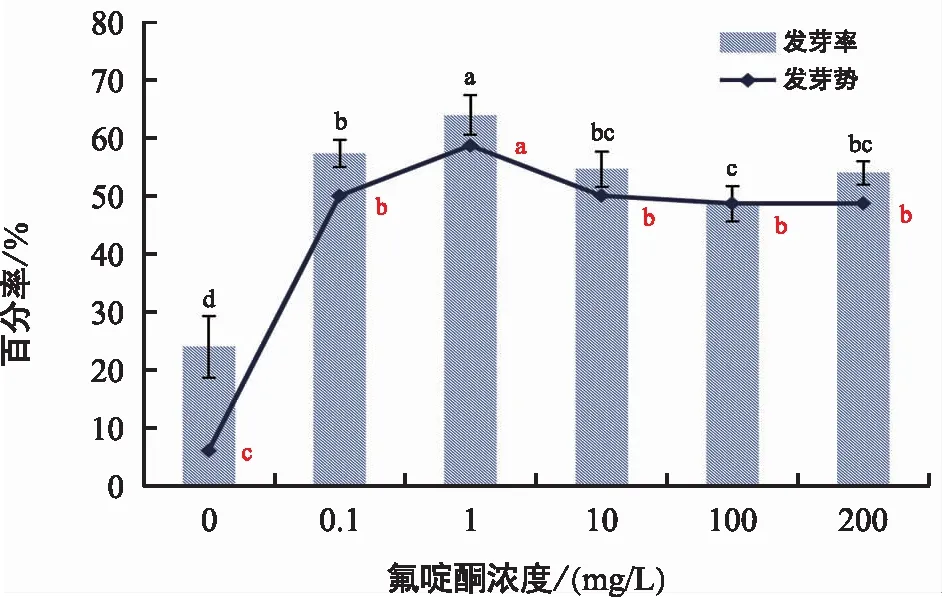
图5 氟啶酮对管花肉苁蓉种子萌发的影响
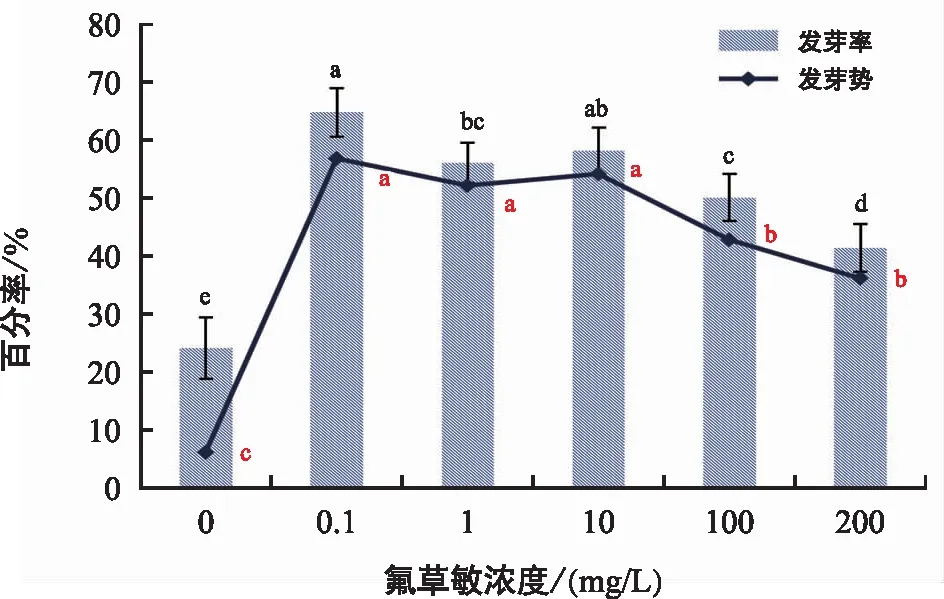
图6 氟草敏对管花肉苁蓉种子萌发的影响
在所有的处理水平下,管花肉苁蓉种子培养7 d内均未见萌发,其发芽势以14 d内的发芽总数计算。在0~200 mg/L培养液浓度范围内,发芽势和发芽率升降趋势一致。
2.2.2赤霉素浓度的筛选
基于上述结果,以10 mg/L氟啶酮作为肉苁蓉种子和管花肉苁蓉种子的萌发培养液,考察赤霉素预处理浓度对种子萌发的影响。由图7可知,肉苁蓉种子不进行预处理,以10 mg/L氟啶酮溶液培养,也可以促进其萌发,发芽率为39.33%。赤霉素预处理对种子萌发具有显著的促进作用(p<0.05),不同浓度赤霉素预处理下,种子发芽势和发芽率的升降趋势一致。当赤霉素预处理溶液的浓度为1 000 mg/L时,促进种子发芽的效果最为显著,发芽率可提高至87.33%,发芽势达到最大。
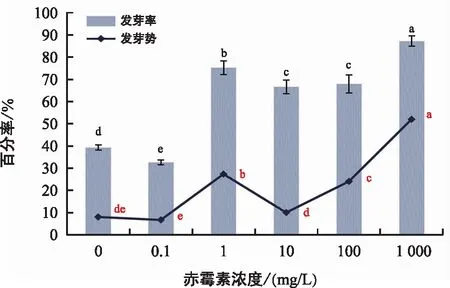
图7 赤霉素对肉苁蓉种子萌发的影响
由图8可知,一定浓度的赤霉素预处理可以显著促进管花肉苁蓉种子的萌发,在0~1000 mg/L赤霉素浓度范围内,种子的发芽率和发芽势变化趋势一致。对种子不进行预处理,在10 mg/L氟啶酮培养条件下其发芽率为66%。1 mg/L赤霉素对管花肉苁蓉种子的萌发促进效果最好,可使发芽率提高至72.67%,发芽势达到最大。
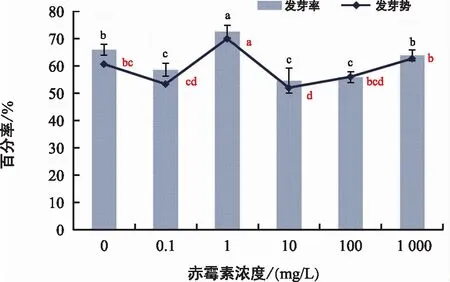
图8 赤霉素对管花肉苁蓉种子萌发的影响
2.2.3不同培养方式对种子萌发的影响
为研究单一赤霉素、氟啶酮或二者组合对肉苁蓉种子和管花肉苁蓉种子萌发的影响,以2.2.1项下的最佳浓度氟啶酮作为培养液,以2.2.2项下的最佳浓度赤霉素预处理种子,种子的发芽率如表2所示。不添加外源物质的条件下,肉苁蓉种子不萌发;1 000 mg/L赤霉素预处理,蒸馏水培养条件下,发芽率为18%;对种子不进行预处理,仅以100 mg/L氟啶酮溶液培养,发芽率可达65%;1 000 mg/L赤霉素预处理,100 mg/L氟啶酮溶液培养,种子的发芽率可达87%。赤霉素、氟啶酮、赤霉素+氟啶酮等3种培养方式下,种子的发芽率差异显著,赤霉素预处理和氟啶酮培养能够协同促进肉苁蓉种子的萌发。
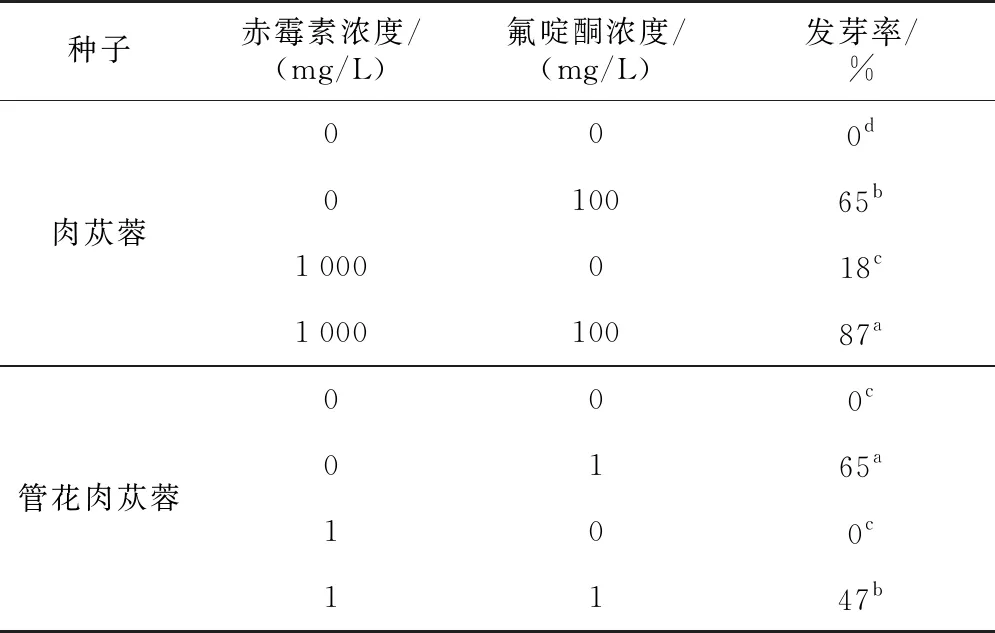
表2 赤霉素和氟啶酮对肉苁蓉种子和管花肉苁蓉种子萌发的影响
不添加外源物质的条件下,管花肉苁蓉种子不萌发;1 mg/L赤霉素预处理,蒸馏水培养条件下,发芽率为0;对种子不进行预处理,以1 mg/L氟啶酮溶液培养,发芽率可达65%;1 mg/L赤霉素预处理,1 mg/L氟啶酮溶液培养,种子的发芽率为47%。相比于单一氟啶酮培养,最佳浓度赤霉素预处理和最佳浓度氟啶酮培养条件下,种子发芽率由65%下降至47%。由此可见,赤霉素和氟啶酮在调控管花肉苁蓉种子的萌发时是相互影响的,这种影响并不是简单的协同促进作用。
2.2.4氟啶酮培养液浓度的筛选
如图9所示,1 000 mg/L赤霉素预处理肉苁蓉种子后,蒸馏水培养条件下发芽率为18%,0.01 mg/L氟啶酮培养可使发芽率显著增加至88.67%,达到最大。之后随着氟啶酮浓度的增大,发芽率变化趋势平缓,在1~200 mg/L氟啶酮浓度范围内,种子发芽率都在80%以上。因此,肉苁蓉种子的最佳萌发条件为25 ℃黑暗下、蒸馏水中吸胀24 h、1 000 mg/L赤霉素预处理72 h、0.01 mg/L氟啶酮培养21 d。管花肉苁蓉种子在1 mg/L赤霉素溶液预处理下,其发芽率随着氟啶酮浓度的增加先升后降,在氟啶酮浓度为100 mg/L时发芽率最高,为77%。因此,管花肉苁蓉种子的最佳萌发条件为25 ℃黑暗下,蒸馏水中吸胀24 h,1 mg/L赤霉素预处理72 h,100 mg/L氟啶酮培养21 d。
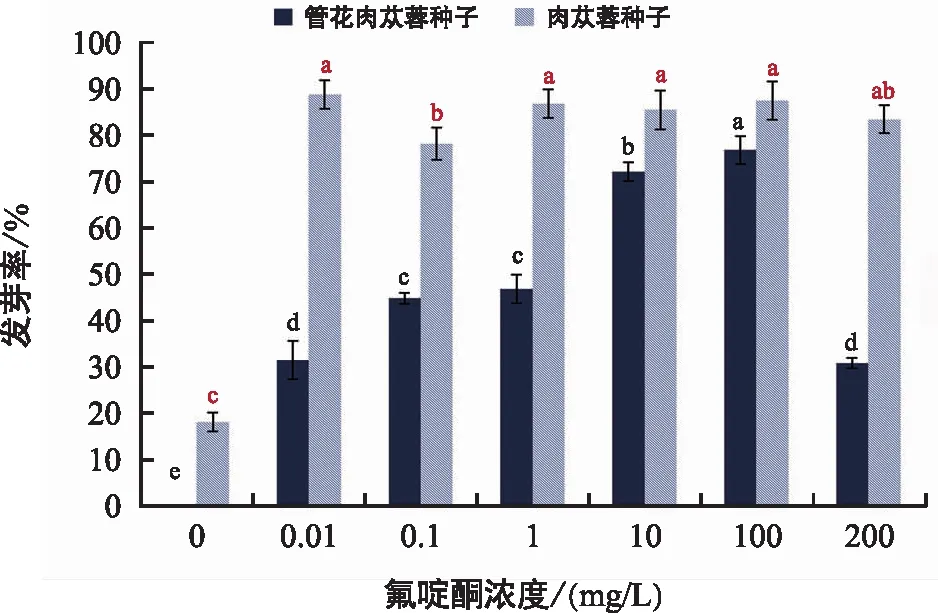
图9 氟啶酮培养液浓度对肉苁蓉种子和管花肉苁蓉种子萌发的影响
2.3 千粒重测定方法
不同测定方法测得的肉苁蓉种子和管花肉苁蓉种子的千粒重如表3所示。4种测定方法测得的肉苁蓉种子千粒重,变异系数均小于4%,百粒法和二百粒法与其他两种方法的测定结果差异显著(p<0.05),误差较大,这可能是肉苁蓉种子形状不规则所致。因此,肉苁蓉种子的千粒重测定宜采用五百粒法。4种方法测得的管花肉苁蓉种子千粒重没有显著差异,百粒法的变异系数为5.87%,不符合规定,二百粒法可作为管花肉苁蓉种子的千粒重测定方法。
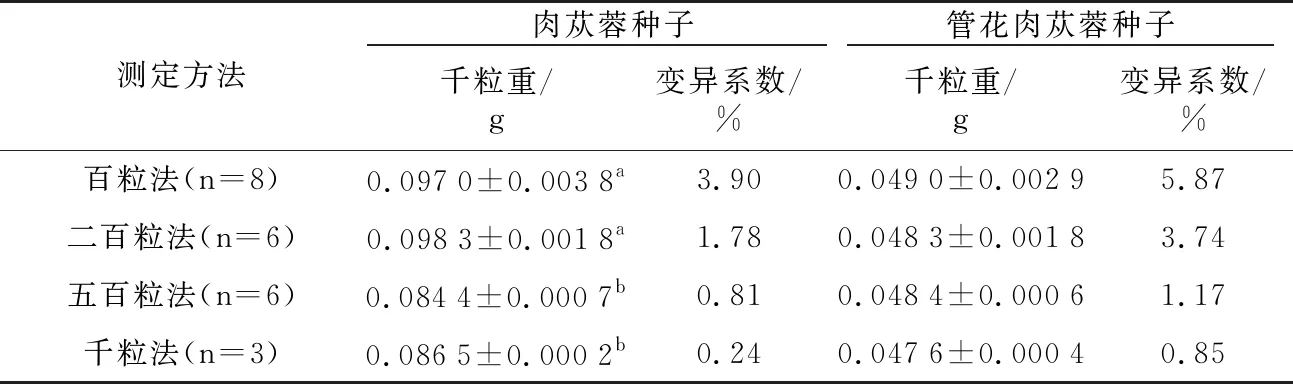
表3 肉苁蓉种子和管花肉苁蓉种子的千粒重测定
2.4 净度分析方法
由千粒重测定结果可知,肉苁蓉种子的千粒重为0.084 4 g左右,2 500粒种子的质量约为0.21 g。管花肉苁蓉种子的千粒重为0.048 3 g左右,2 500粒种子的质量约为0.12 g。按照净度分析的试验样品应至少含有2 500个种子单位,送验样品的质量为试验样品的10倍。考虑到样品通常含有杂质,确定肉苁蓉种子的净度分析送验样品为2.5 g,试验样品为0.25 g;管花肉苁蓉种子的净度分析送验样品为1.5 g,试验样品为0.15 g,净度分析结果如表4所示,各处理在分析前后样品的增失比例均小于5%,方法和程序切实可行。

表4 肉苁蓉种子和管花肉苁蓉种子的净度分析
2.5 水分测定方法
种子以(133±1)℃烘6 h,不同时间测得的含水率如图10所示,在最初的2 h内,种子快速失水,随后失水缓慢,3 h及以后测得的种子含水率趋于稳定,(133±1)℃烘干3 h可作为肉苁蓉种子和管花肉苁蓉种子的水分测定方法。
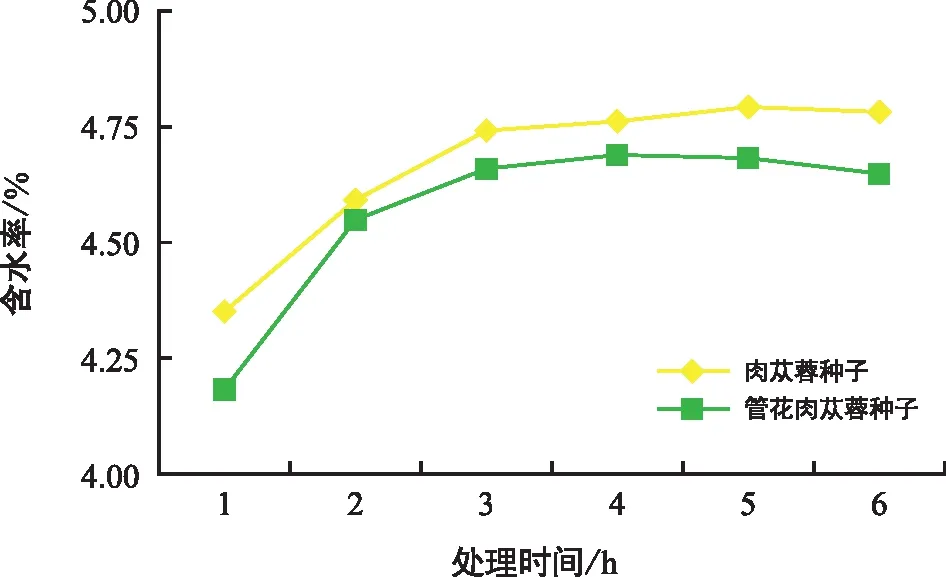
图10 高恒温烘干法测定肉苁蓉种子和管花肉苁蓉种子的水分
2.6 肉苁蓉和管花肉苁蓉的种子质量检验规程
通过研究种子形态特征、净度、千粒重、含水率、发芽率的测定方法,制订了肉苁蓉种子质量检验规程(表5)和管花肉苁蓉种子质量检验规程(表6)。

表5 肉苁蓉种子质量检验规程

表6 管花肉苁蓉种子质量检验规程
2.7 种子的质量现状调查
肉苁蓉种子的质量检验结果详见表7,本次收集的种子净度范围在67.78%~99.64%之间。其中,净度>90%的种子占84%,少数种子中掺入了和种子大小、形状较为相似的沙粒。肉苁蓉种子的长度为0.71~1.18 mm,宽度0.52~0.83 mm,千粒重在0.069 7~0.136 5 g之间,含水率3.39%~5.87%。种子的发芽率相差较大,最低为20.67%,最高为92.67%。其中,32%的种子发芽率在20%~50%之间,51%的种子发芽率在50%~80%之间,发芽率80%以上的种子占16%。

表7 肉苁蓉种子的质量检验结果
管花肉苁蓉种子的质量检验结果详见表8,净度在76.5%~95.92%之间,长度为0.72~0.87 mm,宽度为0.56~0.73 mm,千粒重在0.021 8~0.047 3 g之间,含水率4.37%~5.08%,发芽率最低为0,最高为76.67%。
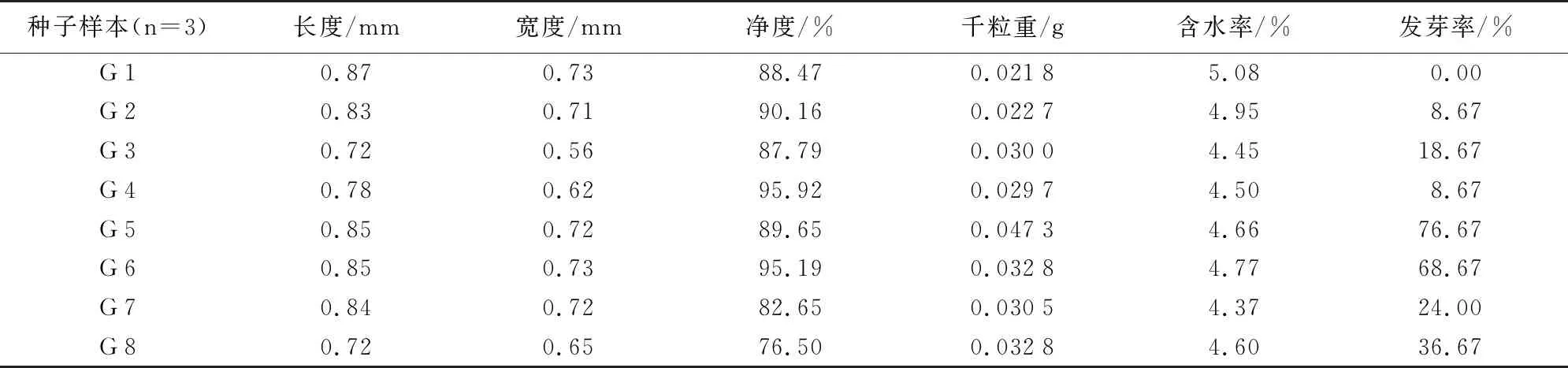
表8 管花肉苁蓉种子的质量检验结果
3 讨论与小结
肉苁蓉种子和管花肉苁蓉种子极小,肉眼难以准确鉴定,人工测量大小时误差大。扫描电镜具有制样简单、快速准确的优点,NanoMeasurer 1.2软件能够准确测量种子的长度和宽度。本研究利用扫描电镜和环境扫描电镜观察了肉苁蓉种子和管花肉苁蓉种子的形状、种皮结构、横切面、种脐以及种仁的特征,这对种子形态鉴定是重要的补充。种子吸水后细胞膨胀,肉苁蓉种子的外种皮孔壁上可见不连续的条状纹饰和内凹小孔,管花肉苁蓉种子的外种皮孔壁上,条状纹饰均匀增厚,纹路连续,且孔壁不存在内凹小孔。从种子的扫描电镜图像可见,种皮的蜂窝状小孔中存在大量杂质,这也是发芽率测定过程中种子容易发霉的原因,在测定前需对种子进行充分清洗和消毒。肉苁蓉种子的形状不规则,单粒种子之间质量差异较大,这可能是百粒法和二百粒法测得的千粒重误差较大的原因,五百粒法测量千粒重较为合适。
以赤霉素预处理,氟啶酮或氟草敏培养,可以显著促进肉苁蓉种子和管花肉苁蓉种子的萌发。与氟草敏相比,氟啶酮对肉苁蓉种子的促进萌发效果更好。管花肉苁蓉种子以氟啶酮或氟草敏培养,最高的发芽率仅相差0.67%,二者都可以作为其萌发培养物质。肉苁蓉种子在培养7 d以内开始萌发,管花肉苁蓉种子在培养7~14 d迅速萌发,两种肉苁蓉种子的萌发速度不一样。发芽率直接影响田间接种率和种植效率,本次收集的种子质量参差不齐,发芽率差异较大,种子存在萌发率低甚至不萌发的现象。这可能是种子在采收时成熟度不够,或者发霉导致种子内含物被微生物消耗所致。
本试验通过对种子真实性、大小、净度、千粒重、含水量和发芽率的测定方法进行研究,建立了肉苁蓉和管花肉苁蓉的种子质量检验规程,方法具有良好的可行性和重复性。采用扫描电镜和环境扫描电镜可以快速鉴定肉苁蓉种子和管花肉苁蓉种子。肉苁蓉种子和管花肉苁蓉种子以赤霉素预处理,经氟啶酮或氟草敏培养,可以显著促进萌发,解决了发芽率测定过程中萌发率低、萌发周期长的问题。不同来源的种子质量差异较大,存在萌发率低或者不萌发的情况,在接种前应对种子进行质量检验和筛选,保障萌发率和接种率,促进肉苁蓉和管花肉苁蓉的高效率种植。
