健康成人下丘脑不同核团参与瞬时血糖调控通路的静息态fMRI
2023-06-19刘葳蕤张东升刘莎莎雷雨萌邵志荣张小玲
刘葳蕤,张东升,黄 杨,刘莎莎,雷雨萌,邵志荣,张小玲
(西安医学院附属陕西省人民医院MRI室,西安 710068;*通讯作者,E-mail:zxl.822@163.com)
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以持续高血糖和胰岛素抵抗为特征的代谢紊乱性疾病[1]。以往主流观点认为胰岛是调节血糖浓度的重要器官,其分泌的胰岛素和胰高血糖素是参与调控血糖平衡的主要激素[2]。目前,越来越多的研究发现下丘脑在血糖调控方面具有重要作用[3]。动物实验进一步发现下丘脑不同核团的神经活动变化在调控血糖方面具有不同的作用[4-6],然而目前对于下丘脑与人类血糖调控关系的研究大多集中在下丘脑的整体水平,人类下丘脑不同核团在血糖调控之中发挥怎样的作用仍不清楚。功能磁共振成像(functional magnetic resonance imaging,fMRI)技术的进步为解决这一问题提供了技术支持,高分辨率fMRI技术已经能够实现亚毫米级的fMRI,可进一步提高对区域间和个体间解剖差异的敏感性[7]。已有研究利用高分辨率fMRI将下丘脑分为左右各10个不同的核团,并且证实其与先前组织学研究中确定的下丘脑核团位置基本匹配[8]。因此,本研究拟采用高分辨率静息态fMRI功能连接(functional connectivity,FC)的方法,通过观察口服高糖溶液前后下丘脑不同核团及环路的神经变化与被试血糖及胰岛素水平变化相关性,推测人体下丘脑不同核团及环路在血糖调控中的作用,初步揭示中枢血糖调控的神经机制。
1 材料与方法
1.1 研究对象
公开招募14名健康被试,其中男性7例,女性7例,其受教育年限平均为(18.57±1.16)年,身体质量指数(body mass index,BMI)为(23.4±4.23)kg/m2,平均年龄(26.5±1.22)岁。健康被试纳入标准包括:无进食障碍、果糖不耐受、糖尿病或其他影响食物代谢的内科疾病史(肝脏疾病、胃肠道疾病等)。排除标准:①存在幽闭恐惧症、金属植入物或任何其他MRI禁忌证;②近期有服用可能干扰血糖水平的药物、草本提取物等;③有重大的身体疾病,神经或精神疾病、头部创伤的病史或者常规MRI扫描显示有脑部器质性病变者。本研究通过了陕西省人民医院伦理委员会批准(批准文号:2021-58),所有参与者在参加本研究前都已经详细了解了本研究的试验流程并签署知情同意。
1.2 试验设计
14名健康被试均需进行口服温水及口服高糖溶液的实验。所有被试到达陕西省人民医院MRI操作间前,禁食3 h,采集肘前静脉血10 ml,分装2个试管并即刻送至本院检验科及放免中心测定其血糖及胰岛素水平。静脉血样标本采集完成后立即进行第一次高分辨率静息态fMRI扫描,约20 min,扫描结束后,被试在休息室一次性口服高糖溶液(含25%葡萄糖溶液温水300 ml)或温水,休息10 min后进行第二次高分辨率静息态fMRI扫描,扫描结束后再次采集静脉血样,血样采集及处理方式同第一次。
1.3 fMRI数据采集及分析
受试者采用3.0T Philips Ingenia CX 32通道相控阵头颅线圈采集MRI数据。对受试者进行高分辨率静息态fMRI扫描时,要求受试者仰卧,闭目,保持清醒,用海绵垫固定头部,佩戴耳塞帮助减少噪音。静息态fMRI数据采用梯度回波平面成像序列,扫描参数:TR 5 000 ms,TE 41 ms,FOV 200 mm×200 mm;矩阵160×160,翻转角90°,层厚1.25 mm,共120层。高分辨率静息态fMRI数据采用基于Matlab的SPM12和DPABI工具包进行预处理。具体数据处理流程包括:DICOM数据格式转化;去除前10个时间点;时间校正及头动校正;空间标准化;采用半高全宽为4 mm的高斯平滑核进行平滑处理;滤波。以双侧下丘脑不同核团作为种子点区域,分别计算双侧下丘脑不同核团与全脑各体素之间FC值。采用Fisher转换把计算得到的FC值转换为Z值。
1.4 统计学分析
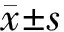
2 结果
2.1 人口学资料及静脉血样差值分析结果
相对于口服温水前,口服温水后,被试血糖差值水平为(-0.00±0.34)mmol/L,胰岛素差值水平为(-3.52±4.64)μIU/ml。相对于口服高糖溶液前,口服高糖溶液后被试血糖差值水平为(3.19±1.92)mmol/L,胰岛素差值水平为(54.86±38.93)μIU/ml。相对于口服温水后,口服高糖溶液后血糖差值及胰岛素差值均明显升高(均P<0.001)。
2.2 静息态FC结果
相对于口服温水前,口服温水后左侧弓状核与左侧颞上回FC减低,左侧外侧下丘脑与右侧距状皮层FC增高,右侧外侧下丘脑与左侧距状皮层FC增高(见图1)。结果均采用采用GRF校正(单个体素P<0.005,校正后P<0.05)。具体脑区坐标、BA分区、体素大小、t值见表1。
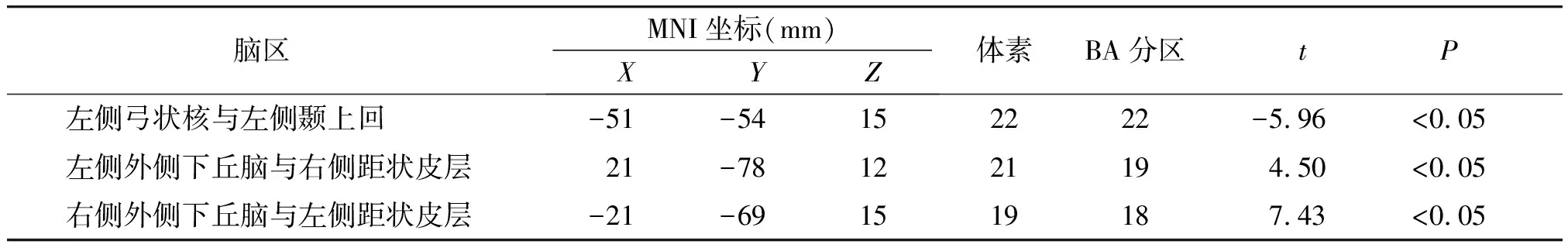
表1 相对于口服温水前口服温水后FC异常改变的脑区
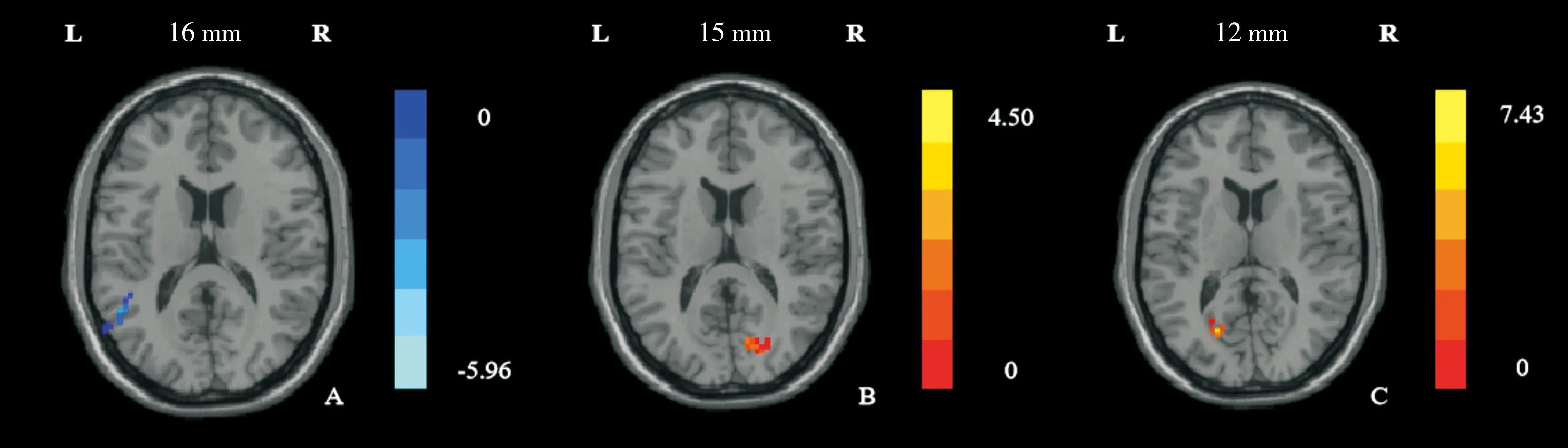
A.口服温水后左侧弓状核与全脑FC减低的脑区(条图上浅蓝色至深蓝色对应t值从小到大) B.口服温水后左侧外侧下丘脑与全脑FC增加的脑区(条图上红色至黄色对应t值从小到大) C.口服温水后右侧外侧下丘脑与全脑FC增加的脑区(条图上红色至黄色对应t值从小到大)
相对于口服高糖溶液前,口服高糖溶液后右侧弓状核与右侧小脑后叶、左侧楔前叶FC增高,与右侧枕下回FC减低(见图2);左侧室旁核与左侧角回、右侧颞中回FC增高(见图3);左侧腹内侧核与右侧楔前叶FC增高(见图3);右侧腹内侧核与左侧楔前叶FC增高(见图4);右侧背内侧核与右侧脑岛FC增高(见图4)。结果均采用GRF校正(单个体素P<0.005,校正后P<0.05)。具体脑区坐标、BA分区、体素大小、t值见表2。
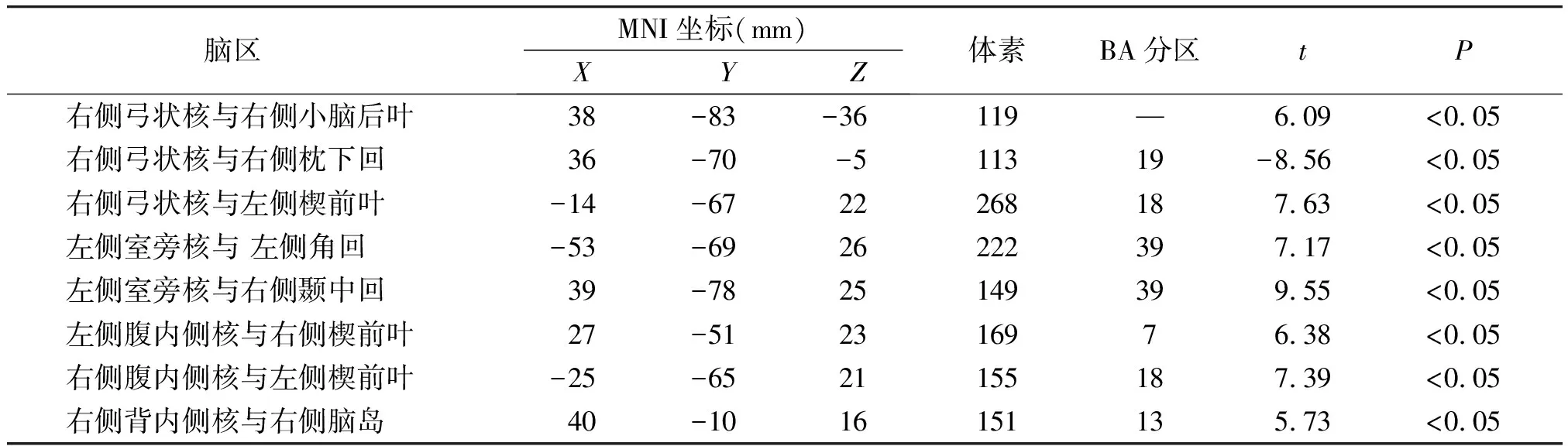
表2 口服高糖溶液后相对于口服高糖溶液前FC异常改变的脑区
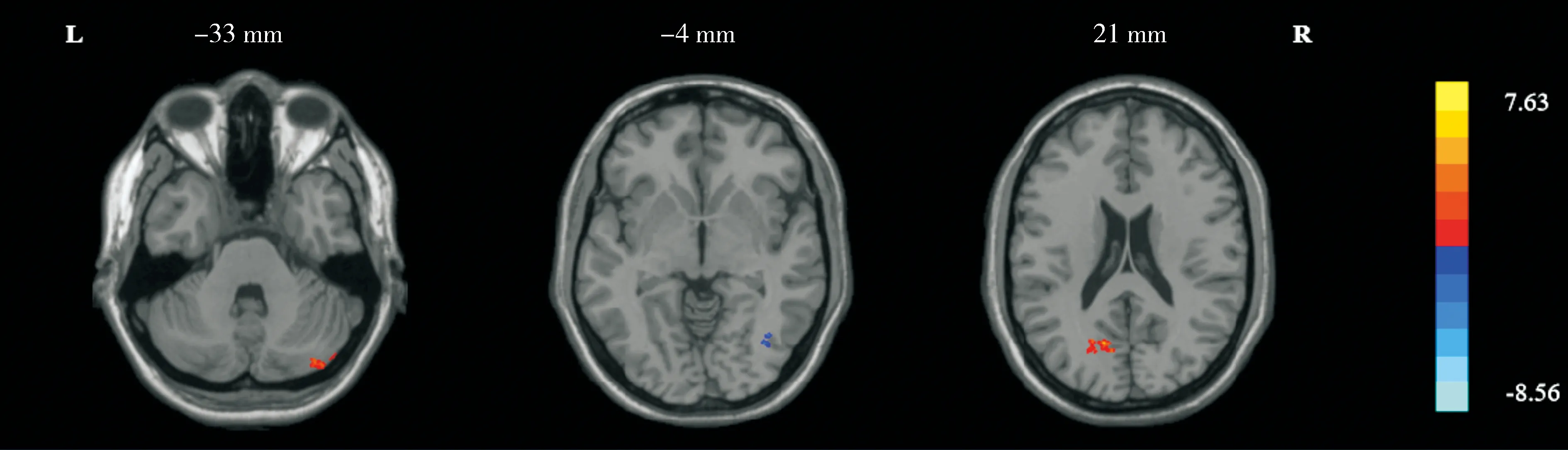
条图上浅蓝色至黄色对应t值从小到大(对应-8.56至7.63)

A.口服高糖溶液后左侧室旁核与全脑FC增加的脑区(条图上红色至黄色对应t值从小到大) B.口服高糖溶液后左侧腹内侧核与全脑FC增加的脑区(条图上红色至黄色对应t值从小到大)

A.口服高糖溶液后右侧腹内侧核与全脑FC增加的脑区(条图上红色至黄色对应t值从小到大) B.口服高糖溶液后右侧背内侧核与全脑FC增加的脑区(条图上红色至黄色对应t值从小到大)
2.3 相关性分析结果
以被试BMI作为协变量,对存在显著差异的脑区的FC平均值与口服高糖溶液前后的血糖差值、胰岛素差值行相关性分析,结果显示:口服高糖溶液后,上述存在显著差异脑区的FC平均值与胰岛素差值未发现明显相关性,而口服高糖溶液后被试者左侧腹内侧核与右侧楔前叶FC强度与血糖差值呈正相关(r=0.589,P=0.034,见图5)。
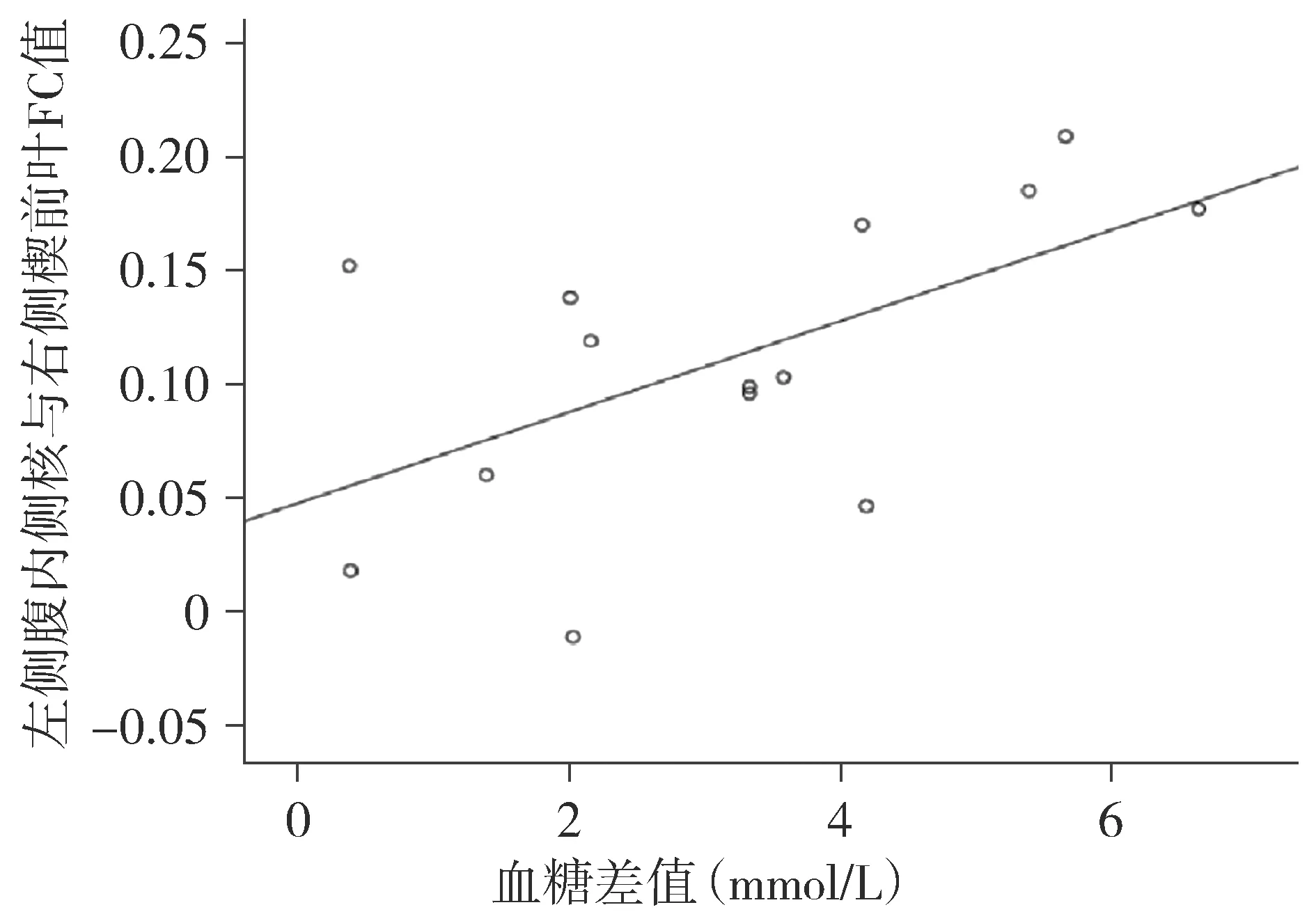
图5 口服高糖溶液后受试者左侧腹内侧核与右侧楔前叶FC值与血糖差值相关关系图
3 讨论
本研究利用高分辨率静息态fMRI技术,采用FC的方法探讨口服高糖溶液前后青年健康被试下丘脑不同核团与全脑FC的改变模式。结果显示口服高糖溶液后,下丘脑多个核团与多个脑区FC发生了改变,并且左侧腹内侧核与右侧楔前叶增加的FC与血糖差值呈正相关。
下丘脑外侧区在调节钠和尿的排泄、水的摄入以及控制动脉血压方面起着重要作用[9],弓状核在饥饿状态下会分泌大量神经肽Y并会促进摄食[10]。先前的研究发现摄入清水后,颞上回血氧水平依赖(blood oxygen level dependent,BOLD)信号减少而距状皮层BOLD信号增加[11,12]。本研究表明口服温水后,左侧弓状核与左侧颞上回FC减低,外侧下丘脑与距状皮层FC增加。这可能提示摄入温水会刺激弓状核、外侧下丘脑及相应脑区对此做出实时反应。
楔前叶、颞中回及角回均属于默认模式网络(default mode network,DMN)的一部分[13]。DMN与内省及外部环境监测密切相关[14],在维持正常认知过程中具有重要作用[15]。当个体不关注外部环境而将注意力转向内部时,DMN脑区活动增加[16]。下丘脑被认为是人脑中调控代谢的中心,先前的研究表明鼻内喷洒胰岛素后下丘脑与DMN之间的FC增强[17],提示内源性胰岛素会增强代谢中心与认知中心的联系。本研究结果与之类似,在口服葡萄糖后,下丘脑多个核团与楔前叶、颞中回及角回FC增强。这可能提示在口服葡萄糖后,胰岛素水平增高,DMN脑区参与了对血糖变化的监测过程。楔前叶是DMN的核心脑区,与注意力及摄食行为密切相关[18,19]。神经解剖学已经证实下丘脑与楔前叶在结构及功能方面均存在关联[20]。下丘脑结节区的腹内侧核含有表达瘦素受体的神经元[21]。研究发现楔前叶的活性同样受瘦素水平影响,当血糖水平升高时,瘦素水平增加并会抑制摄食[22]。此外,下丘脑腹内侧核的解偶连蛋白2,可通过调节线粒体动力学和葡萄糖敏感神经元的兴奋性,对升高的血糖水平作出调节,引起外周器官胰岛素敏感性增加,在短期内有效减低血糖[5]。可见,在血糖升高后,无论是腹内侧核还是楔前叶,都参与了降低血糖这一过程。本研究发现左侧腹内侧核与右侧楔前叶之间的FC增加并与血糖差值呈正相关,这可能提示腹内侧核与楔前叶的功能通路参与了中枢血糖调控过程。
下丘脑、小脑等部位可广泛表达胰岛素受体,而脑中的胰岛素受体信号对于血糖调节、摄食行为等过程至关重要[23]。胰岛素受体可与磷脂酰肌醇-3激酶的激活偶联,增加前阿黑皮素原(proopiome-lanocortin,POMC)神经元的兴奋性[24]。弓状核内含有大量POMC神经元,POMC神经元通过接收胰岛素信号,可减少能量摄入、增加能量消耗,调节机体基础代谢[21,25]。研究发现POMC神经元中线粒体融合蛋白2的表达缺失会导致机体过量摄食、减少耗能同时引发肥胖[21]。因此,我们推测,口服葡萄糖后弓状核与小脑FC增强可能是由于激活了胰岛素相关化学通路,提示机体血糖水平明显升高,进而抑制摄食。
以往研究发现,岛叶参与饥饿及饱腹感的调控[26],饥饿状态时,岛叶区域血流量增加,饱食状态时,岛叶区域血流量减少[27]。血糖抑制理论认为下丘脑可感知葡萄糖水平的剧烈变化,并及时将这一信息发送到岛叶等其他参与调节饥饿和饱腹感的大脑区域[28]。有学者推测,脑岛和下丘脑似乎形成了一个与认知控制进食有关的动态平衡网络[29]。本研究结果表明在高糖冲击后右侧背内侧核与右侧脑岛FC增高,这可能提示背内侧核与岛叶形成的通路与血糖调控有关。
众所周知,枕叶主要参与视觉处理,与觅食行为密切相关[30,31]。研究发现,在食物线索诱导下,枕叶的激活程度显著增加[32]。相对于摄入水,摄入葡萄糖溶液后枕叶血氧水平依赖信号强度降低[12]。而相对于饥饿状态,饱食状态下枕叶局部脑血流量降低[27]。此外,血糖水平升高时下丘脑活动的减少会导致饱腹感增加,对食物的反应减弱[33]。本研究发现口服葡萄糖后,右侧弓状核与右侧枕下回FC减低,这可能提示血糖升高后对食物的线索诱导反应减低。
本研究存在一定的局限性。首先,本研究所选取的样本量较小而且都是青年人,这可能会影响研究结果的普适性,未来的研究中需要扩大样本量并探讨不同年龄段健康被试的中枢血糖调控通路。其次,本研究被试的血糖基线状态为禁食3 h后的状态,并非完全空腹状态,被试的基线水平血糖差异较大。但是有研究证实在餐后3 h血糖水平基本恢复至空腹浓度[34];此外,本研究采用喝糖水及温水前后胰岛素及血糖差值与FC差值行相关性分析,有效地避免了基线水平不一致可能造成的偏倚。第三,本研究仅采集了被试的血糖及胰岛素水平,没有采集如瘦素、胆囊收缩素等其他影响血糖调控的激素,今后的研究我们会更加全面地考虑这些激素对血糖调控的影响。
综上所述,本研究结果显示,下丘脑虽然是能量调控中枢,但是调控水及葡萄糖的核团及神经通路可能并不一致,左侧腹内侧核与右侧楔前叶组成的通路可能参与了健康成人中枢血糖稳态调控的过程。这将为未来绘制健康成人血糖调控的神经网络环路提供基础,并为从中枢神经机制方面着手寻找T2DM的治疗方案提供新的思路。
