党参经PI3K/Akt干预溃疡性结肠炎黏膜细胞铁死亡-线粒体动力学失衡的机制研究
2023-06-19陈正君葛俊李王春霞梁建庆冯翠娟杨扶德
李 芳,陈正君,葛俊李,王春霞,梁建庆,冯翠娟,杨扶德*
党参经PI3K/Akt干预溃疡性结肠炎黏膜细胞铁死亡-线粒体动力学失衡的机制研究
李 芳1,陈正君1,葛俊李1,王春霞1,梁建庆2,冯翠娟3,杨扶德1*
1. 甘肃中医药大学药学院,甘肃 兰州 730000 2. 甘肃中医药大学基础医学院,甘肃 兰州 730000 3. 甘肃卫生职业学院中医药学院,甘肃 兰州 730300
探究党参经磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)调控Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)/核因子E相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)/谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)、线粒体动力相关蛋白1(dynamin-related protein1,DRP1)信号通路抑制氧化应激干预溃疡性结肠炎(ulcerative colitis,UC)肠黏膜细胞铁死亡-线粒体动力学失衡的分子机制。采用网络药理学京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析预测党参干预UC的关键信号通路。SD大鼠采用2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulphonic acid,TNBS)-乙醇复合方法制备UC模型,随机分为对照组、模型组、柳氮磺胺吡啶(0.3 g/kg)组、铁抑制剂Ferrostatin-1(0.8 mg/kg)组和党参高、中、低剂量(18、9、4.5 g/kg)组,每组12只;给予药物连续干预7 d,收集各组大鼠血清、结肠组织。采用苏木素-伊红(HE)染色进行组织病理观察及结肠黏膜组织学损伤评分(tissue damage index,TDI);ELISA法检测血清中Fe2+、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-8、GPX4、C-反应蛋白(C-reactive protein,CRP)、-乳酸含量;生化法检测血清中超氧化物歧化酶(superoxide dismutase,SOD)活力及丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)含量,检测结肠组织三磷酸腺苷(adenosine triphosphate,ATP)含量及髓过氧化物酶(myeloperoxidase,MPO)、Ca2+, Mg2+-ATP酶、Na+, K+-ATP酶、ATP酶活力。转录测序分析对照组、模型组、党参高剂量组结肠组织差异表达基因,并进行KEGG通路富集分析获得党参干预UC差异表达信号通路。Western blotting检测结肠组织p-PI3K、PI3K、p-Akt、Akt、Keap1、Nrf2、GPX4、重组人铁蛋白重链(recombinant Human Ferritin heavy chain,FTH1)、DRP1和线粒体转运蛋白(mitochondrial Rho-GTP,MIRO)蛋白表达;qRT-PCR检测结肠组织、、、、、mRNA表达。病理观察及评分结果显示党参有效改善了结肠组织的炎症水肿状态;网络药理学预测结果表明党参干预UC关键靶点显著富集于PI3K/Akt信号通路。ELISA实验结果表明党参可有效降低UC模型大鼠血清中IL-1β、IL-6、IL-8、TNF-α、-乳酸、CRP水平(<0.05、0.01、0.001),抑制炎症;降低血清Fe2+、MDA含量及MPO活力(<0.001),升高血清GPX4、GSH水平及SOD活力(<0.001),抑制氧化应激;升高结肠组织ATP含量及ATP酶、Ca2+, Mg2+-ATP酶、Na+, K+-ATP酶活力(<0.05、0.01、0.001),提升能量代谢。转录组学KEGG通路分析提示对照组模型组差异基因及党参高剂量组模型组差异基因均显著富集于PI3K/Akt等信号通路。Western blotting实验结果确证党参可有效下调结肠组织p-PI3K/PI3K、p-Akt/Akt、Keap1、MIRO和DRP1蛋白表达(<0.05、0.01、0.001),上调Nrf2、FTH1和GPX4蛋白表达(<0.05、0.01、0.001),发挥抗氧化应激、抑制铁死亡、调节线粒体动力学作用。qRT-PCR实验结果亦表明党参可有效下调结肠组织、、基因表达(<0.05、0.001),上调、、基因表达(<0.05、0.01、0.001)。党参是干预UC的有效药物,其机制可能与经PI3K/Akt干预Keap1/Nrf2/GPX4、DRP1信号通路抑制肠黏膜细胞线粒体动力学失衡-铁死亡氧化应激损伤有关。
党参;溃疡性结肠炎;PI3K/Akt;氧化应激;线粒体动力学失衡;铁死亡;党参炔苷;苍术内酯III
随着国民生活水平日益提高及饮食结构的改变,溃疡性结肠炎(ulcerative colitis,UC)发病人群数量逐年增高,患者以腹痛、腹泻、黏液脓血便、体质量减轻等为主要症状,部分患者伴发肠病性关节炎、肝胆管等肠外病[1],病情迁延且复发率高,是诱发结肠癌的主要危险因素之一[2],己成为我国消化系统常见性难治疾病。UC的治疗目前主要依赖药物控制症状,氨基水杨酸类药物、皮质类固醇类激素、免疫抑制剂及抗肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)制剂等是目前治疗UC的主要药物,但腹痛、发烧、腹泻、抽筋、皮疹和肾衰竭以及不耐受性的诸多不良反应严重限制了临床使用。
近年来,大量研究显示应用中药对炎症性肠病具有良好的治疗效果。中药党参以桔梗科植物党参(Franch.) Nannf.、素花党参Nannf. var.(Nannf.) L. T. Shen或川党参Oliv.的干燥根入药,具有健脾益肺、养血生津之功的补益类中药,《本草正义》中指出其效用“与人参不甚相远”[3],且具有毒性小、补益作用缓和的特点[4]。数据挖掘结果显示党参及其配伍为治疗UC的高频次药物[5-7]。现代药理学研究表明,党参含有多糖类、黄酮类、萜类、炔类、苯丙素类、生物碱类等多种化学成分,课题组前期实验证明了党参水煎液对UC模型大鼠具有良好的干预效应,其作用机制可能与抑制炎症及氧化应激有关[8-9],但其机制阐述尚不完全明确,制约了党参的临床应用。
中药网络药理学是可以对中药的分子复杂性与复杂疾病间的分子关联进行系统探索的有效方法,转录组学所强调的完整性和系统性与中医药整体辨证观吻合[10-14],二者的联合使用为多成分、多目标的治疗作用机制研究提供了新的突破视角。本研究运用转录组学技术联合网络药理学京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集确证了磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路在党参干预UC中的核心作用,并基于PI3K/Akt信号通路进一步探究党参通过调控Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)/核因子E相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)/ 谷胱甘肽过氧化物酶4(glutathione peroxidase4,GPX4)信号通路及线粒体动力相关蛋白1(dynamin-related protein1,DRP1),从而抑制黏膜细胞铁死亡,维护线粒体动力学功能以维持黏膜屏障功能的作用机制,为党参临床治疗UC提供理论依据。
1 材料
1.1 动物
SPF级SD雄性大鼠(体质量180~220 g)由斯贝福(北京)生物技术有限公司提供,实验动物许可证号[SCXK(京)2019-0010],分笼饲养于甘肃中医药大学实验动物中心,室温(22±2)℃,相对湿度50%~70%,昼夜自然明暗交替光照,颗粒饲料喂养,自由饮水。动物实验获得甘肃中医药大学伦理委员会批准(批准号2022-022)。
1.2 药材
党参(甘20160027)购自甘肃康乐药业有限责任公司,经甘肃中医药大学杨扶德教授鉴定为桔梗科植物党参(Franch.) Nannf.的干燥根。
1.3 药品与试剂
柳氮磺胺吡啶(sulfasalazine tablets,SASP)肠溶片(0.25 mg/片,批号NO.9210105)购自上海信谊天平药业有限公司;2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulphonic acid,TNBS,批号MB5547-1)购自大连美仑生物技术有限公司;铁抑制剂Ferrostatin-1(Fer-1,批号HY-100579)购自美国Med Chem Express公司;水合氯醛(批号20211201)购自天津市大茂化学试剂厂;大鼠C-反应蛋白(C-reactive protein,CRP)ELISA试剂盒(批号MM-0081R2)、白细胞介素-8(interleukin-8,IL-8)ELISA试剂盒(批号MM-0175R2)、IL-6 ELISA试剂盒(批号MM-0190R1)、IL-1β ELISA试剂盒(批号MM-0047R2)、TNF-α ELISA试剂盒(批号MM-0180R2)、-乳酸ELISA试剂盒(批号MM-21239R2)均购自江苏菲亚生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号A001-1-1)、丙二醛(malondialdehyde,MDA)试剂盒(批号A003-1-1)、髓过氧化物酶(myeloperoxidase,MPO)试剂盒(批号A044-1-1)、谷胱甘肽(glutathione,GSH)试剂盒(批号A006-2-1)均购自南京建成生物研究所;p-Akt抗体(批号130387)购自美国CST公司;β-actin抗体(批号GTX109639)、Akt抗体(批号GTX121937)、p-PI3K抗体(批号GTX132597)、Keap1抗体(批号GTX54329)、Nrf2抗体(批号GTX103322)、DRP1抗体(批号GTX135364)均购自美国GeneTex公司;PI3K抗体(批号YT6156)购自美国Immunoway公司;重组人铁蛋白重链(recombinant human ferritin heavy chain,FTH1)抗体(批号Ab183781)、GPX4抗体(批号Ab125066)、线粒体转运蛋白(mitochondrial Rho-GTP,MIRO)抗体(批号Ab88029)均购自英国Abcam公司;Hieff®Qpcr SYBR Green Master Mix(批号11202ES08)购自翌圣生物科技(上海)股份有限公司。
1.4 仪器
Vanquish 超高液相色谱仪(美国Thermo Fisher Scientific公司)、NC2000型Nanodrop超微量分光光度计、ST16R型高速冷冻离心机(美国Thermo Fisher Scientific公司);DYY-6C型电泳仪(北京六一仪器厂);GelDoc 2000型凝胶成像系统(美国Bio-Rad公司);Tissuelyser-48型研磨仪(上海净信实业发展有限公司);PS-60AL型超声仪(深圳市雷德邦电子有限公司);SpectraMax i3x酶标仪[美谷分子仪器(上海)有限公司]。
2 方法
2.1 党参水煎液的制备
取党参1 kg,加入8倍量的水浸泡1 h后,加热煮沸,沸腾后文火煎熬1 h,收集药液。重复2次,合并药液,滤过后趁热抽滤,浓缩药液至以生药量计为1.0 g/mL。采用HPLC法测定党参炔苷、苍术内酯III质量分数分别为0.261 2、0.019 2 mg/g。除菌,装瓶,置于4 ℃冰箱保存备用。
2.2 造模、分组与给药
84只大鼠适应性饲养1周后,随机取12只作为对照组,其余72只作为造模组,禁食禁水24 h后采用TNBS-乙醇复合法制作UC模型。大鼠出现食欲减退、懒动、消瘦、拱背、毛色暗淡毛糙状态,稀便、黏液便、血便,隐血试验阳性为造模成功。造模成功大鼠随机分为模型组、SASP(0.3 g/kg)组、Fer-1(0.8 mg/kg)组和党参高、中、低剂量(18、9、4.5 g/kg)组,每组12只,分笼饲养。各给药组ig相应药物(10 mL/kg),对照组和模型组ig等体积生理盐水,1次/d,连续7 d。
2.3 样本采集及处理
末次给药后,各组大鼠禁食不禁水24 h,ip 10%水合氯醛(3 mL/kg)麻醉,腹主动脉取血后室温静置30 min,4 ℃、3500 r/min离心10 min,分离血清,−80 ℃冷冻保存。颈椎脱臼处死大鼠,分离大鼠病结肠病变严重部位组织,置于预冷的生理盐水中,漂洗后置于加入RNAiso Plus试剂的无酶冻存管中,经液氮速冻后,置于−80 ℃冰箱中保存待检。
2.4 结肠组织病理学观察及组织损伤评分
将结肠组织于4%多聚甲醛中固定,按照浸蜡、包埋、切片、脱蜡、染色、脱水、透明、封片流程制作苏木素-伊红(HE)病理切片,在激光共聚焦显微镜下观察组织病理状态并拍照。根据炎症程度及溃疡深度和范围进行大鼠结肠黏膜组织学损伤评分(tissue damage index,TDI)[15]。
2.5 网络药理学KEGG富集分析预测党参干预UC核心信号通路
利用TCMSP数据库、Perl语言、Uniprot数据库、GeneCard数据库、DisGeNET数据库及STRING数据库,挖掘药物活性成分、疾病靶点,构建“党参活性成分-UC疾病靶点”可视化调控网络及蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,进行KEGG通路富集及分析。
2.6 转录组学KEGG富集分析确证党参干预UC核心信号通路
按照试剂盒说明书提取各组大鼠结肠组织总RNA,通过Oligo(dT)磁珠富集总RNA中带有polyA结构的mRNA,逆转录合成cDNA。样品进行RNA抽提、纯化、建库,测序生成FASTQ原始数据(raw data)。原始数据经滤过、质量评估后比对到参考基因序列,对各样本在不同表达量区间内的基因的数目进行统计及差异基因PPI分析,并进行差异基因KEGG信号通路富集分析。
2.7 ELISA检测血清IL-1β、IL-6、IL-8、TNF-α、Fe2+、CRP、GPX4和D-乳酸含量
按照ELISA试剂盒说明书测定各组大鼠血清中IL-1β、IL-6、IL-8、TNF-α、Fe2+、CRP、GPX4和-乳酸含量。
2.8 生化法检测血清中GSH、MDA含量及SOD活力和结肠组织中三磷酸腺苷(adenosine triphosphate,ATP)含量及MPO、Ca2+, Mg2+-ATP酶、Na+, K+-ATP酶、ATP酶活力
微板法测定血清GSH含量,设置空白孔、标准孔、样品测定孔,各孔加样,405 nm处测定各孔吸光度()值,计算GSH含量。TBA荧光法测定血清MDA含量,设置空白管、标准管、样品测定管、对照管,各管加样,于532 nm波长处,1 cm光径,蒸馏水调零,测定各管值,计算MDA含量。羟胺法测定血清SOD活力,设置对照管、样品测定管,各管加样,于550 nm波长处,1 cm光径比色杯,蒸馏水调零,比色,计算SOD活力。比色法测定结肠组织MPO活力,结肠组织匀浆,设定对照孔、样品测定孔,空白孔,各孔加样,于460 nm处,1 cm光径,双蒸水调零,测定各孔值,计算MPO活力。考马斯亮蓝法测定各组结肠组织蛋白浓度。磷钼酸比色法检测大鼠结肠组织ATP含量,设定空白管、对照管、标准管和样品测定管,加入工作液,636 nm,光径0.5 cm,双蒸水调零,测定各管值,计算ATP含量。酶促反应、定磷反应测定结肠组织Ca2+, Mg2+-ATP酶、Na+, K+-ATP酶、ATP酶活力。
2.9 Western blotting检测结肠组织p-PI3K、PI3K、p-Akt、Akt、Keap1、Nrf2、GPX4、FTH1、DRP1和MIRO蛋白表达
取结肠组织50 mg,解冻、研磨,加入RIPA蛋白裂解液及苯甲基磺酰氟裂解,BCA法测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭,洗膜,加入一抗,4 ℃孵育过夜;洗涤,加入二抗,室温孵育,洗涤,加入显色剂避光显影,采用凝胶图像处理系统分析条带灰度值。
2.10 qRT-PCR检测PI3K、Akt、Keap1、Nrf2、GPX4和FTH1基因表达
按照试剂盒说明书提取各组大鼠结肠组织中总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。

表1 引物序列
2.11 统计学分析
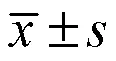
3 结果
3.1 党参对UC大鼠结肠组织病理变化的影响
如图1所示,对照组大鼠黏膜层肠上皮结构完整,形态结构正常;模型组结肠组织显示黏膜下层重度炎症,伴有淋巴细胞浸润严重水肿,固有层肠腺数量减少,隐窝和表面上皮细胞缺失。各给药组不同程度减少了炎性细胞的浸润,修复腺体结构,改善了结肠黏膜的充血水肿。与对照组比较,模型组TDI评分明显升高(<0.01);与模型组比较,各给药组TDI评分均显著降低(<0.05、0.01)。
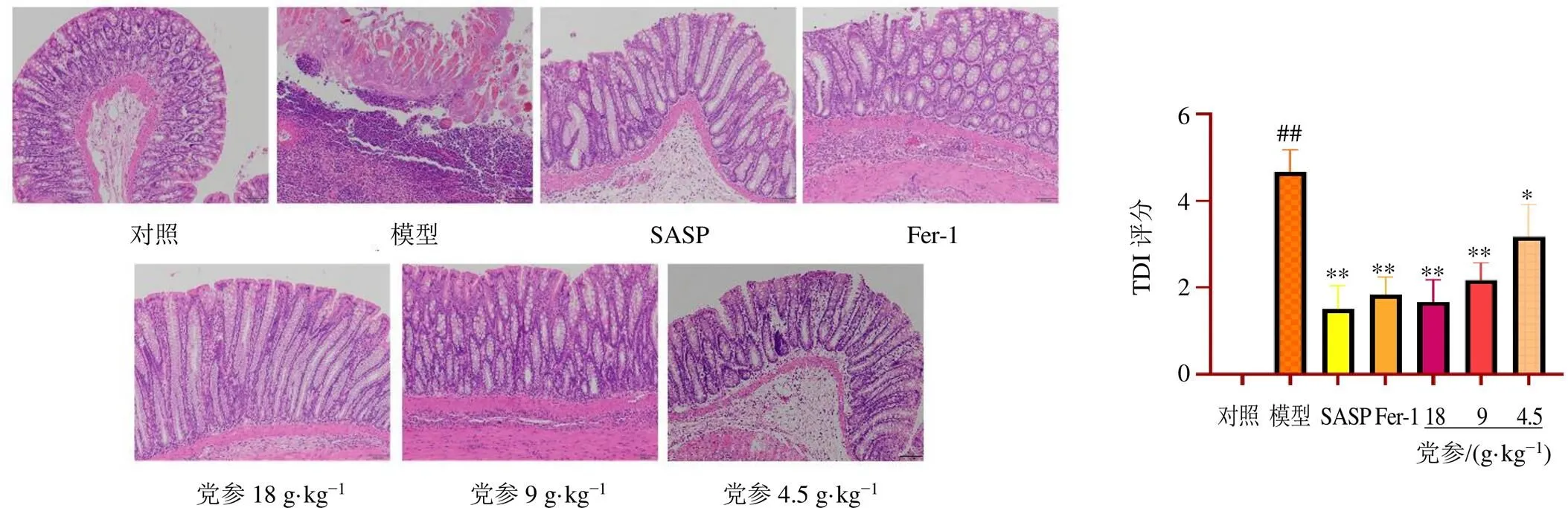
3.2 党参干预UC的网络药理学交集靶点基因Venn图与转录组学差异表达基因
网络药理学获得党参活性成分对应的靶点基因109个,有关UC的靶点基因4852个,得到72个交集靶点基因,见图2-A。如图2-B所示,与对照组比较,模型组结肠组织差异表达的基因4727个(上调2157个、下调2570个);与模型组比较,党参高剂量组差异表达的基因1058个(上调669个、下调389个)。采用R语言ggplots2软件包绘制差异表达基因火山图,展示对照组模型组(图2-C)及模型组党参高剂量组(图2-D)的基因分布情况,上调和下调的差异基因分布大致对称。
与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下图同
A-网络药理学党参-UC交集靶点基因Venn图 B-转录组学差异基因统计图 C-转录组学对照组vs模型组基因表达火山图 D-模型组vs党参高剂量组基因表达火山图
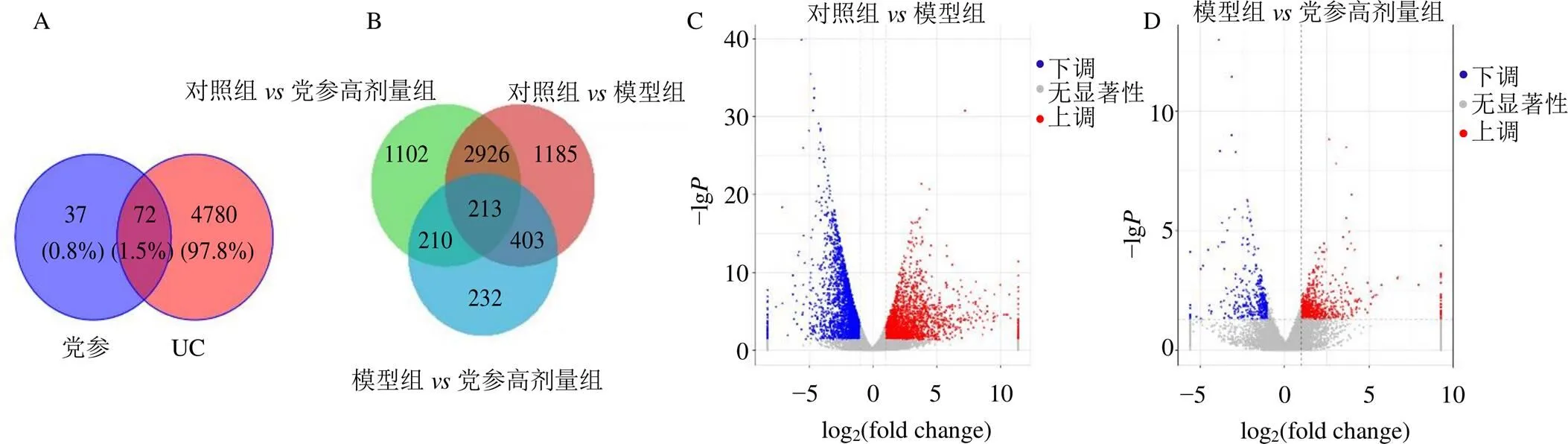
3.3 网络药理学与转录组学差异表达基因的PPI分析
网络药理学将党参与UC交集基因通过STRING数据库分析交集靶点,并进行PPI分析,获得AKT1、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、IL-6、溶质载体家族6A4(solute carrier family 6A4,SLC6A4)、雌激素受体1(estrogen receptor 1,ESR1)、TNF、TP53、谷胱甘肽S-转移酶P1(glutathione S-transferase P1,GSTP1)、糖皮质激素受体3C1(nuclear receptor subfamily 3 group C,NR3C1)、血管内皮生长因子α(vascular endothelial growth factor α,VEGFA)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、乙酰胆碱受体亚基α7(nicotine acetylcholine receptors α7,CHRNA7)、前列腺素内过氧化物合酶2(prostaglandin G/H synthase 2,PTGS2)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARG)、IL-2、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,CASP3)等靶点蛋白,以及木犀草素等党参主要活性成分(图3-A、B)。转录组学将差异基因蛋白与蛋白表达量结合构建PPI网络(图3-C、D),图中的点为基因对应的蛋白质,其中红色表达上调差异基因,绿色表达下调差异基因,黄色表达非显著差异基因,经分析获得了在模型组上调,经党参干预后下调基因140个,包括CRP、突触活性蛋白1(complexin1,Cplx1)、硫氧还蛋白域蛋白15(recombinant human thioredoxin domain containing protein 15,Txndc15)、anoctamin家族1(anoctamin 1,Ano1)、溶质载体转运蛋白家族35成员(solute carrier family 35 member F1,SLC35F1)等;在模型组下调,经党参干预后上调基因440个,包括低密度脂蛋白受体衔接蛋白1(low-density lipoprotein receptor adapter protein 1,Ldlrap1)、RTKN蛋白2(rhotekin 2,Rtkn2)、阿拉伯半乳糖蛋白(Arabinogalactan proteins,Agps)、p21蛋白激活激酶2(p21-activated protein kinase 2,Pak2)、T-Box1基因(T-box 1,Tbx1)等。
A-网络药理学蛋白互作关系靶点图 B-网络药理学党参-UC靶点PPI网络 C-转录组学模型组vs党参高剂量组PPI网络 D-转录组学对照组vs模型组PPI网络
3.4 网络药理学与转录组学差异表达基因KEGG通路分析
网络药理学KEGG分析结果显示党参干预UC排名靠前的信号通路包括PI3K/Akt信号通路、HIF-1信号通路等。其中PI3K/Akt信号通路为影响度最高的信号通路,见图4-A。转录组学KEGG分析显示,党参高剂量组与模型组的1058个差异表达基因富集于59个KEGG通路,见图4-B,其中PI3K/Akt信号通路为显著表达通路;模型组与对照组的4727个差异表达基因富集于145个KEGG通路,见图4-C,其中PI3K/Akt信号通路亦为显著表达通路。进一步分析富集在PI3K/Akt信号通路上的差异基因,与对照组比较,在模型组下调、党参处理后上调的显著差异基因有IV型胶原蛋白(collagen IV a6,Col4a6)、层黏连蛋白α2(Laminin alpha,Lama2)、神经生长因子受体(nerve growth factor receptor,Ngfr)、Lamc3、LAMB2、整合素α7(integrinα7,Itga7)、溶血磷脂酸受体3(recombinant lysophosphatidic acid receptor 3,Lpar3)等;与对照组比较,在模型组上调、党参处理后明显下调逆转明显的差异基因有3′-磷酸肌醇依赖性蛋白激酶1(recombinant phosphoinositide dependent protein kinase 1,Pdpk1)、细胞周期蛋白D1(cyclin D1,CCND1)等。上述结果表明网络药理学预测核心通路与转录组学富集确证信号通路PI3K/Akt信号通路是党参干预UC的关键信号通路。
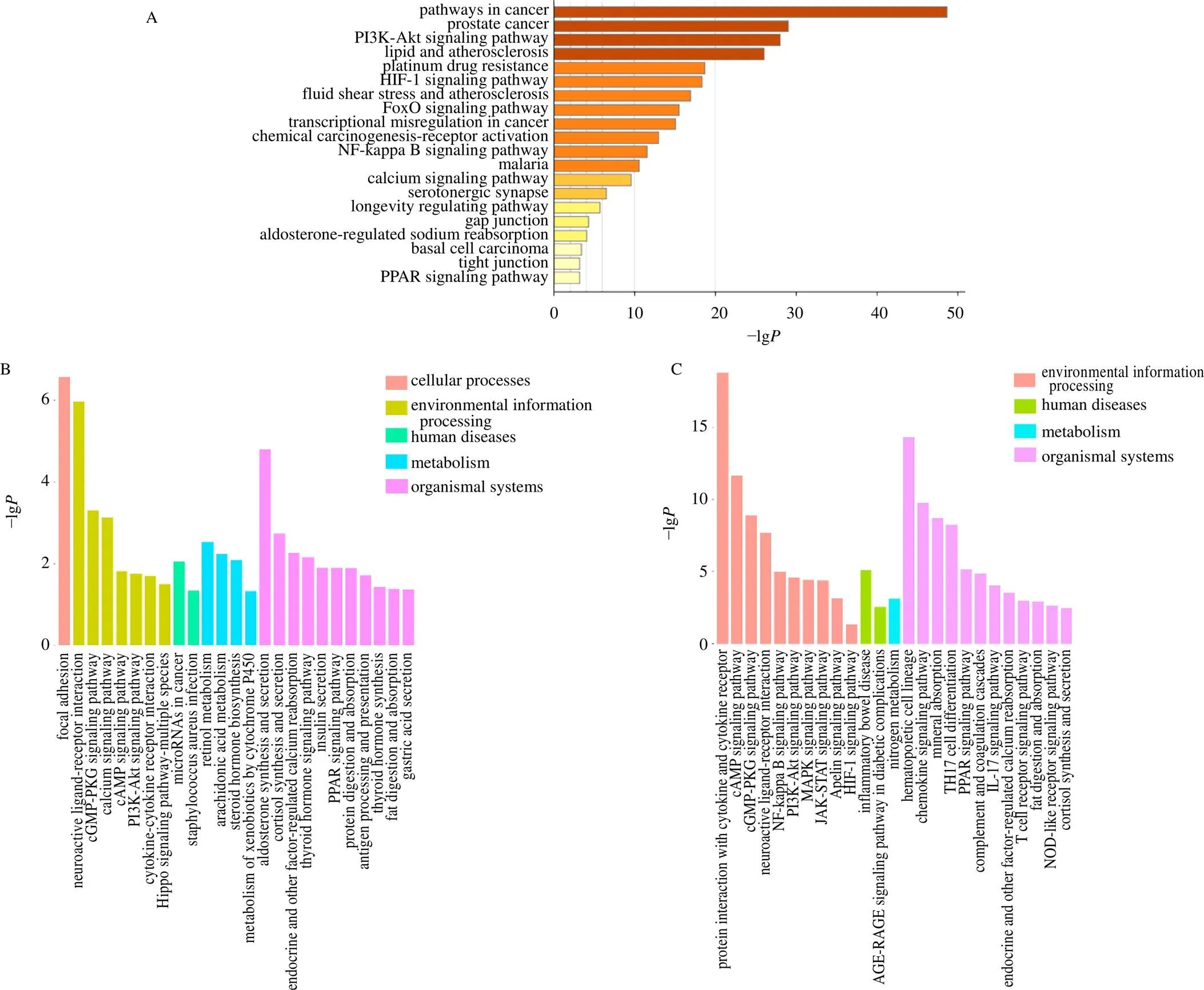
A-网络药理学党参干预UC KEGG通路富集分析 B-模型组vs党参高剂量组KEGG分析 C-对照组vs模型组KEGG分析
3.5 党参对UC大鼠血清中炎症因子水平的影响
如图5所示,与对照组比较,模型组血清中IL-1β、IL-6、IL-8、TNF-α、-乳酸、CRP水平均显著升高(<0.001);与模型组比较,各给药组血清中IL-1β、TNF-α和CRP水平均显著降低(<0.05、0.01、0.001),SASP组、Fer-1组和党参高剂量组血清中IL-6、IL-8和-乳酸水平均显著降低(<0.001)。表明党参可有效降低UC模型大鼠炎症因子及炎症损伤介质水平。
3.6 党参对UC大鼠氧化应激水平的影响
如图6所示,与对照组比较,模型组血清Fe2+、MDA含量明显升高(<0.001),血清GPX4、GSH水平及SOD活力均显著降低(<0.001),结肠组织MPO活力显著升高(<0.001);与模型组比较,各给药组血清Fe2+、MDA含量明显降低(<0.001),血清GPX4水平显著升高(<0.001);SASP组、Fer-1组和党参低、高剂量组血清GSH水平显著升高(<0.001);SASP组、Fer-1组和党参中、高剂量组结肠组织MPO活力显著降低(<0.001);SASP组、Fer-1组和党参高剂量组血清SOD活力明显降低(<0.001)。表明党参可有效干预UC血清Fe2+堆积状态,调控氧化应激脂质过氧化物含量与过氧化酶活力。
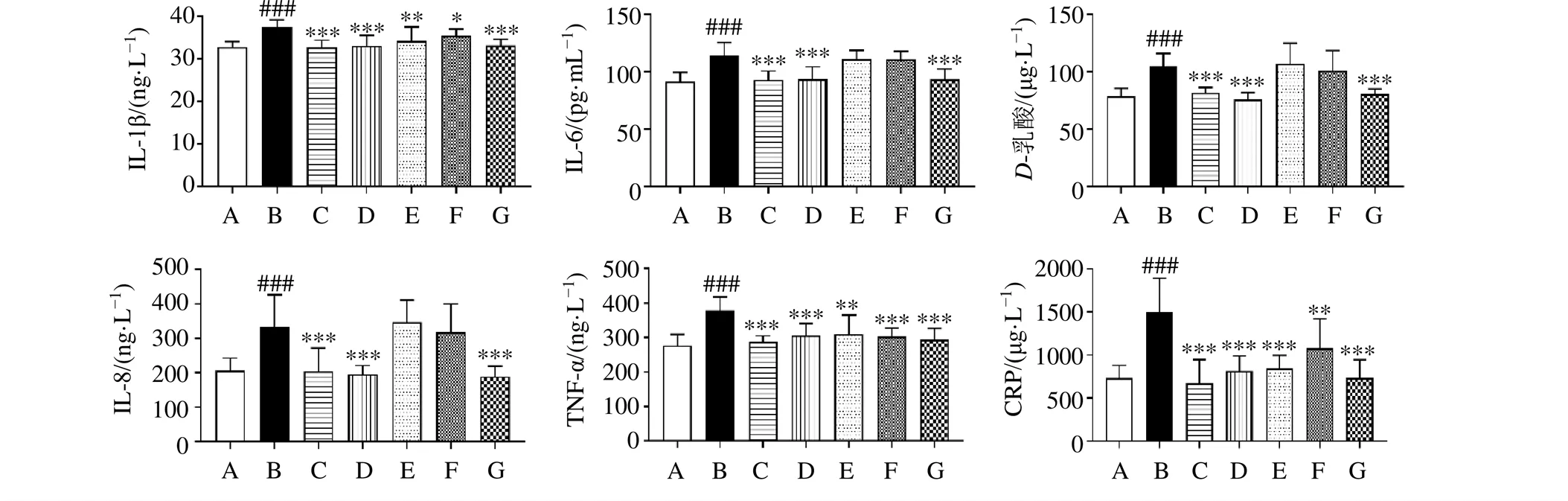
A-对照组 B-模型组 C-SASP组 D-Fer-1组 E-党参低剂量组 F-党参中剂量组 G-党参高剂量组,下图同
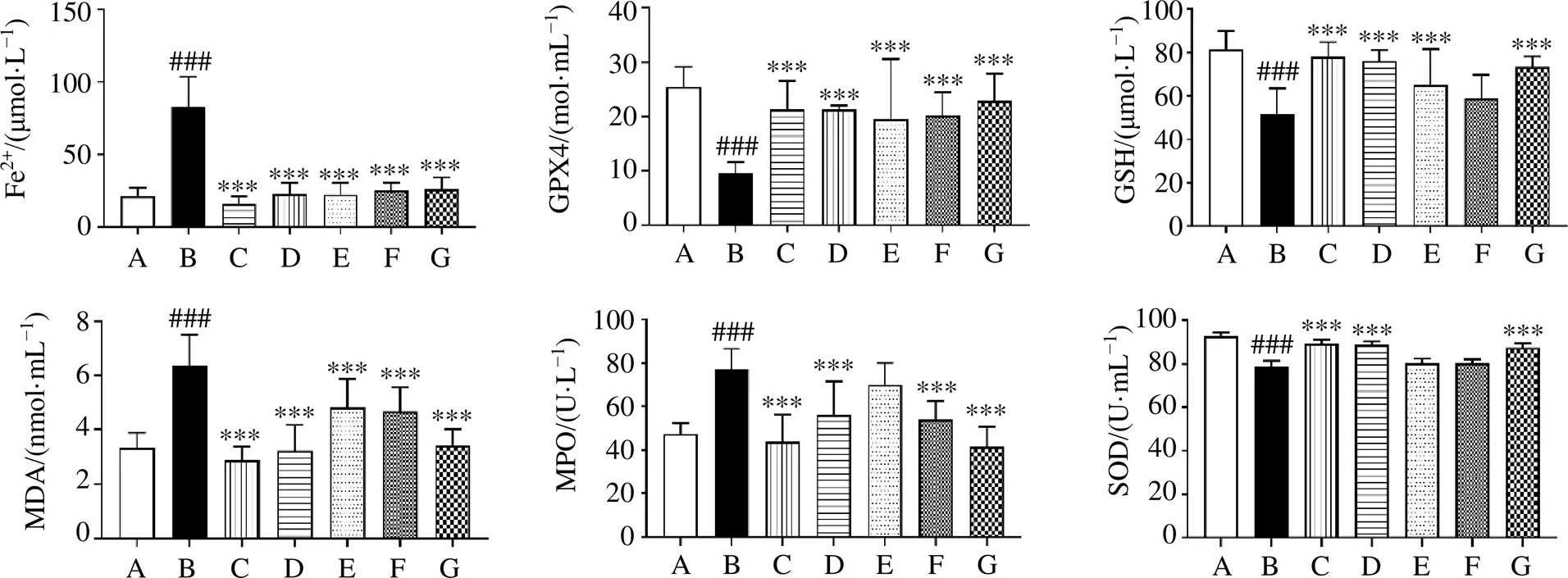
图6 党参对UC大鼠氧化应激水平的影响(, n = 12)
3.7 党参对UC大鼠能量代谢ATP含量及ATP酶、Ca2+, Mg2+-ATP酶、Na+, K+-ATP酶活力的影响
如图7所示,与对照组比较,模型组结肠组织ATP含量及ATP酶、Ca2+, Mg2+-ATP酶、Na+, K+-ATP酶活力均明显降低(<0.05、0.001);与模型组比较,各给药组结肠组织Na+, K+-ATP酶活力明显升高(<0.001),SASP组、Fer-1组和党参中、高剂量组结肠组织ATP含量及ATP酶、Ca2+, Mg2+-ATP酶活力均显著升高(<0.05、0.01、0.001)。表明党参对UC模型大鼠结肠能量代谢具有较好提升效果,尤其对Na+, K+-ATPase活力提升优于阳性对照药物。
3.8 党参对UC大鼠结肠组织p-PI3K、PI3K、p-Akt、Akt、Keap1、Nrf2、GPX4、FTH1、DRP1和MIRO蛋白表达的影响
如图8所示,与对照组比较,模型组大鼠结肠组织p-PI3K/PI3K、p-Akt/Akt、Keap1、MIRO和DRP1蛋白表达水平均显著升高(<0.001),Nrf2、FTH1和GPX4蛋白表达水平均显著降低(<0.001);与模型组比较,SASP组、Fer-1组和党参中、高剂量组结肠组织p-PI3K/PI3K和DRP1蛋白表达水平均显著降低(<0.05、0.001),Nrf2和FTH1蛋白表达水平均显著升高(<0.05、0.01、0.001);SASP组、Fer-1组和党参高剂量组结肠组织p-Akt/Akt、Keap1和MIRO蛋白表达水平均显著降低(<0.01、0.001),GPX4蛋白表达水平均显著升高(<0.01、0.001)。
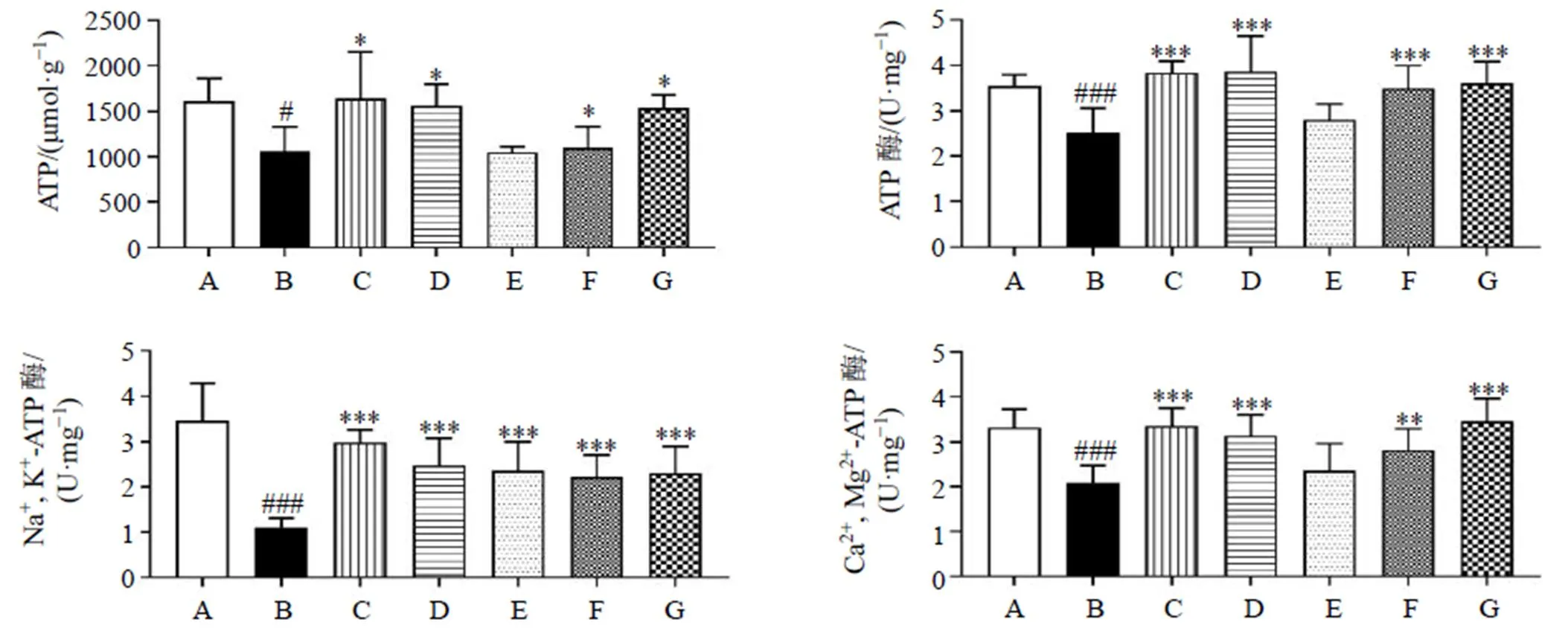
图7 党参对UC大鼠结肠组织ATP含量及ATP酶、Ca2+, Mg2+-ATP酶、Na+, K+-ATP酶活力的影响(, n = 12)
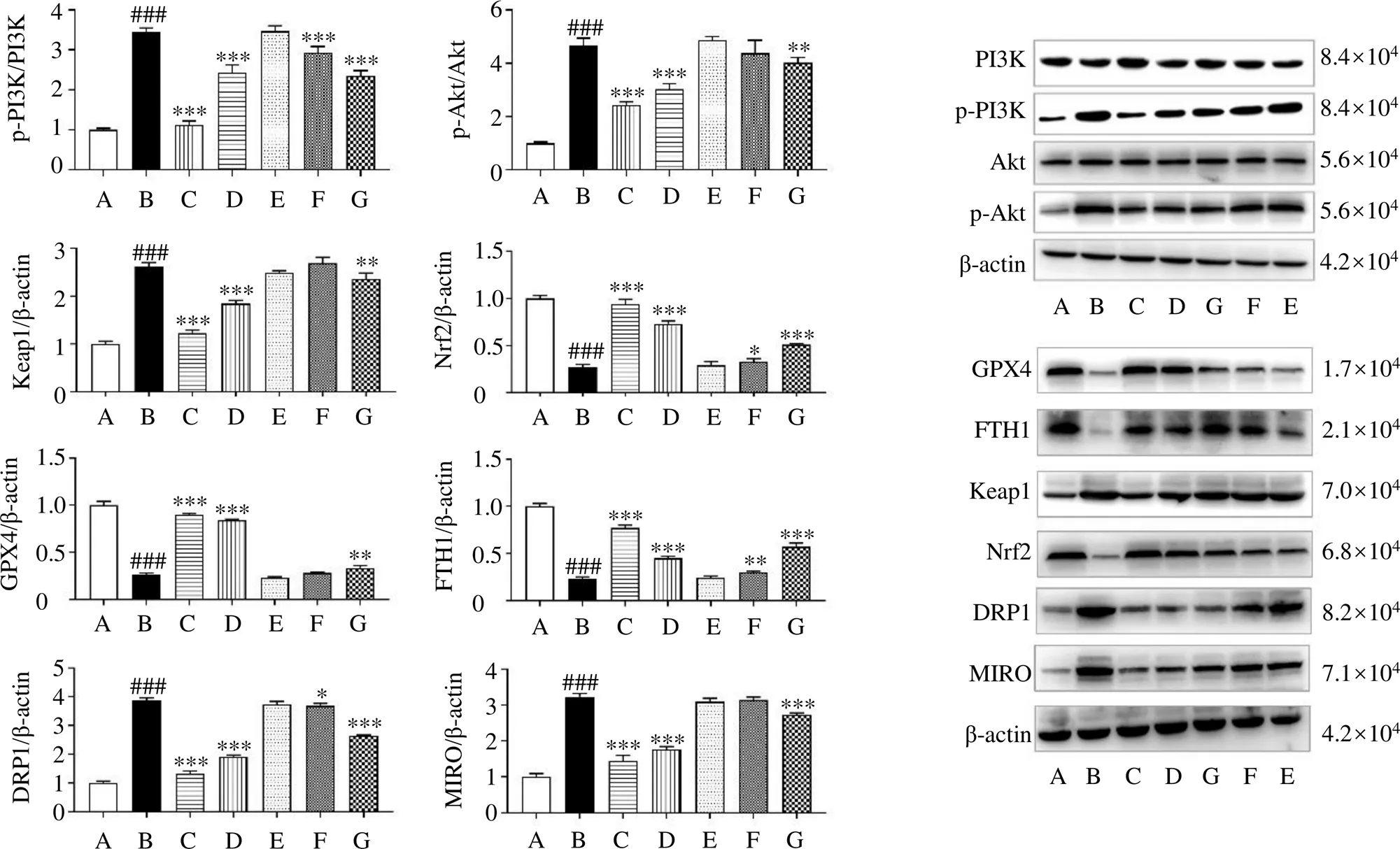
图8 党参对UC大鼠结肠组织p-PI3K、PI3K、p-Akt、Akt、Keap1、Nrf2、GPX4、FTH1、DRP1和MIRO蛋白表达的影响(, n =3)
3.9 党参对UC大鼠结肠组织PI3K、Akt、Keap1、Nrf2、FTH1和GPX4基因表达的影响
如图9所示,与对照组比较,模型组结肠组织、、基因表达水平均显著升高(<0.001),、、基因表达水平均显著下降(<0.001);与模型组比较,各给药组结肠组织、基因表达水平显著降低(<0.001),SASP组、Fer-1组和党参中、高剂量组、、基因表达水平显著升高(<0.05、0.01、0.001);SASP组和党参高剂量组基因表达水平均显著降低(<0.05、0.01)。
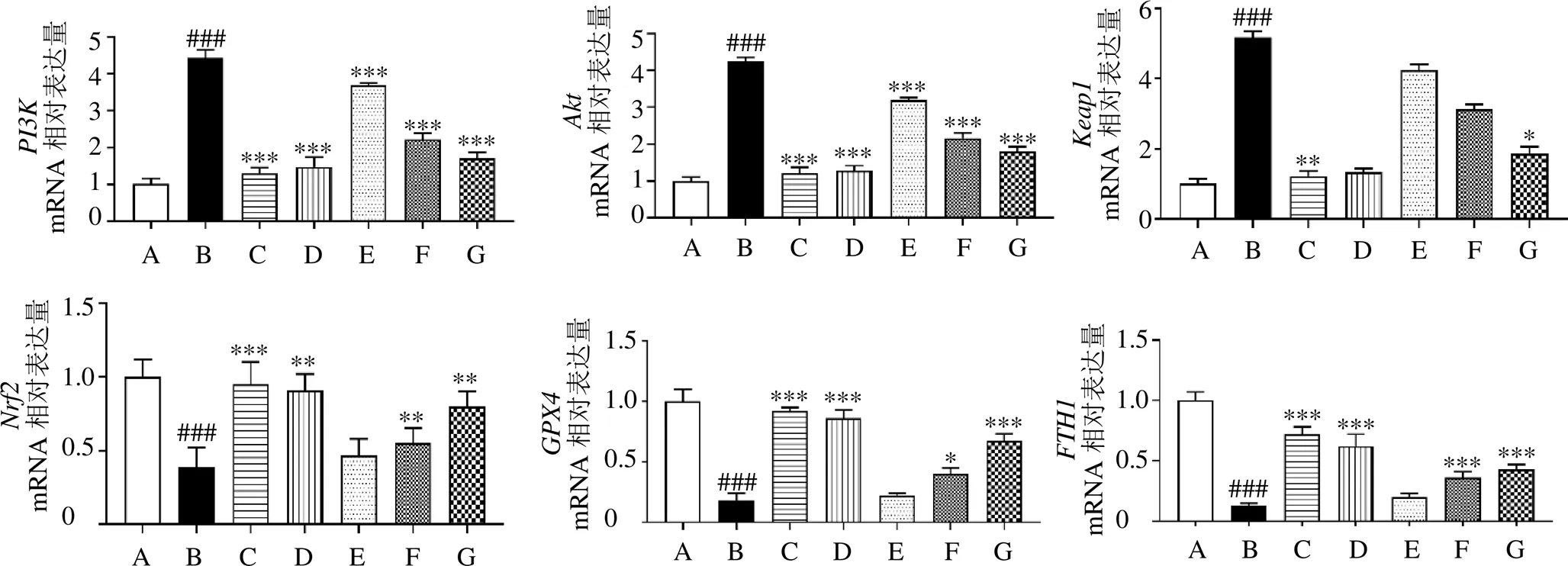
图9 党参对UC大鼠结肠组织PI3K、Akt、Keap1、Nrf2、FTH1和GPX4基因表达的影响(, n = 3)
4 讨论
肠黏膜是维持上皮细胞功能完整性的结构基础,具有阻止肠腔内细菌、抗原等物质进入肠黏膜固有层激活免疫细胞[16-18]的生物屏障作用,黏膜受损有助于有害物质入侵黏膜层激活免疫应答诱发炎症反应促进病情的进一步发展[19]。UC发生时,肠腔内抗原物质向肠黏膜固有层移位并激活免疫细胞导致大量炎症细胞因子(IL-6、IL-1β、TNF-α、IL-8)及炎症损伤介质如CRP、-乳酸产生并进一步作为信号分子激活炎症途径[20-21],促使活性氧(reactive oxygen species,ROS)爆发性增加。ROS的聚集消耗过多的SOD、GSH、GPX4等抗氧化酶打破机体氧化平衡系统引起氧化应激[22],使细胞内GPX4催化的GSH还原反应受到抑制,继而氧化性极强的Fe2+与H2O2以类似Fenton反应的方式氧化脂质,细胞膜和细胞器膜磷脂双分子层被氧化降解,从而破坏膜结构的流动性和稳定性并且使膜通透性增加,细胞伴随着大量的铁离子的累积破裂死亡[23]。线粒体是提供能量并调节细胞代谢的重要细胞器,处于“分裂-融合”的动态平衡之中,氧化应激至过氧化脂如MDA等大量堆积,与线粒体DNA形成加合物造成蛋白质肽链断裂、交联、碳基生成和构象变化,损伤线粒体呼吸链复合物及其关键酶活性,影响线粒体能量代谢功能至ATP产出不足[24],引起细胞连接分布和功能的改变,细胞间隙增宽[25]损伤呼吸传递链功能,抑制能量代谢。因此氧化应急反映激发细胞膜的多链不饱和脂肪酸发生脂质过氧化链式反应,黏膜细胞发生铁依赖性崩解死亡的同时降低细胞线粒体酶活性及能量代谢功能[24],从而诱发肠黏膜损伤。
Nrf2是CNC-bZIP家族中活力最强的转录激活因子,在细胞抗氧化和亲电应激反应及铁代谢中发挥关键作用[25]。生理状态下Nrf2接受Keap1作为负调控因子将Nrf2靶定在胞质内形成Keap1-Nrf2复合体,并通过介导Nrf2泛素化降解以维持胞内较低水平的Nrf2[27-28]。而当细胞处于UC氧化应激状态时Keap1-Nrf2复合体解偶联,活化的Nrf2进入细胞核内形成异二聚体,通过形成半胱氨酸/谷氨酸转运体系统(System Xc-)参与关键抗氧化剂GSH的合成[29],调节下游SOD、FTH1等抗氧化和保护性基因的表达[30-32]。GPX4依赖辅因子GSH将有毒的脂质过氧化物还原为无毒的脂质醇,同时自身转变为氧化型谷胱甘肽,可通过减少脂质过氧化作用以抑制细胞发生铁死亡。当氧化应激状态下GSH被耗尽时会导致GPX4失活[33],GPX4的下调被认为是铁死亡的关键特征[34]。FTH1具有铁氧化酶活性,可以催化Fe2+转化为Fe3+形式,从而降低游离铁的含量,维持细胞内铁稳态[35]。
细胞铁死亡是导致肠上皮细胞死亡造成肠黏膜屏障受损的关键病理环节[36]。铁死亡细胞在电镜下可观察到细胞膜和细胞核形态完整、无破裂,但细胞内线粒体形态小于正常细胞,线粒体膜皱缩致密度增高,嵴减少甚至消失,外膜破碎[37-38]。DRP1是介导线粒体动力学中线粒体融合与分裂的关键蛋白,参与调控线粒体内膜及外膜的融合与分裂过程[39]。UC状态下肠黏膜细胞铁死亡致线粒体受损,诱导DRP1过表达会使线粒体的“分裂-融合”的动态平衡破坏,分裂加速,促进线粒体呼吸传递链功能受损,进一步导致ROS产生增加促进氧化应激脂质过氧化反应[22],造成循环损伤。DRP1的抑制和激活受到MIRO对线粒体形态的影响[40],UC发生时线粒体需要足量MIRO蛋白发挥运输功能满足炎症状态的能量需求,MIRO表达量急剧增加,加快运输线粒体到高能量需求的部位以满足能量的供应,过量的ROS导致线粒体损伤启动清除MIRO的机制,MIRO蛋白从受损线粒体上脱离后会被迅速泛素化,缺乏MIRO的受损线粒体将无法继续沿着细胞内的微管继续移动转运[41]。本研究发现在肠黏膜组织损伤大鼠模型中,结肠组织线粒体分裂蛋白DRP1表达量上升,表明此时结肠黏膜细胞线粒体呈过度分裂,融合受抑制,结肠组织细胞处于线粒体动力学失衡状态。ATP酶活力的大小是细胞能量代谢及功能有无损伤的重要指标[42],本实验结果显示,UC大鼠结肠组织ATP酶活性下降,表明结肠细胞内外渗透压失衡,结肠局部炎症水肿[43],进一步引起结肠动力功能障碍,甚至造成结肠肌肉痉挛[44]。实验结果还显示UC大鼠结肠组织Ca2+, Mg2+-ATP酶、Na+, K+-ATP酶活力降低,酶活力的降低将影响线粒体对胞质Ca2+摄取,减缓呼吸链速率,减少ATP的合成[45-46]。
研究表明PI3K/Akt信号通路可以磷酸化多种转录因子,在肠黏膜细胞的氧化应激反应等过程中发挥重要的调控作用[47]。本研究中网络药理学预测及转录分析均证实了PI3K/Akt是党参干预UC发生发展的核心差异表达基因及重要信号通路。磷酸化的Akt可促进Keap1/Nrf2核转移与抗氧化反应元件结合,促进下游抗氧化系统的表达调控GPX4,从而清除氧自由基[48],抑制肠黏膜细胞铁死亡;同时氧自由基的清除有助于恢复线粒体正常能量代谢功能,促进ATP产出及ATP酶活力的增加。
综上,肠黏膜损伤是UC的核心病理因素[49],氧化应激诱导的铁死亡是导致细胞死亡造成肠黏膜屏障受损的关键病理环节[36,50],线粒体动力学失衡诱发的能量代谢障碍是UC的核心病理过程[51]。Akt磷酸化与PI3K联动反应调控Keap1/Nrf2,促进GPX4合成调节抗氧化系统抑制肠黏膜细胞铁死亡,调控DRP1减少线粒体氧化应激损伤维护线粒体动力学平衡状态,促进细胞能量代谢恢复是修复肠黏膜屏障损伤的有效途径。
利益冲突 所有作者均声明不存在利益冲突
[1] Segal J P, LeBlanc J F, Hart A L. Ulcerative colitis: An update [J]., 2021, 21(2): 135-139.
[2] Tanaka T, Kobunai T, Yamamoto Y,. Increased copy number variation of mtDNA in an array-based digital PCR assay predicts ulcerative colitis-associated colorectal cancer [J]., 2017, 31(4): 713-718.
[3] 谢琦, 程雪梅, 胡芳弟, 等. 党参化学成分、药理作用及质量控制研究进展 [J]. 上海中医药杂志, 2020, 54(8): 94-104.
[4] 靳贵林, 侯嘉, 崔治家, 等. 党参的本草考证及药理作用和质量控制的研究进展 [J]. 世界中医药, 2016, 11(8): 1635-1639.
[5] 芦易, 刘起立, 张道平, 等. 基于数据挖掘及网络药理学探究中药复方治疗溃疡性结肠炎的用药规律及机制 [J]. 实用中医内科杂志, 2023, 37(2): 25-29.
[6] 裴银奇, 赵党生. 基于中医传承辅助系统的溃疡性结肠炎方剂用药规律分析 [J]. 亚太传统医药, 2016, 12(24): 92-94.
[7] 彭卓嵛, 陶丽芬, 蓝斯莹, 等. 基于数据挖掘对溃疡性结肠炎中医用药规律的分析 [J]. 世界科学技术—中医药现代化, 2020, 22(7): 2269-2275.
[8] 刘雪枫, 乔婧, 高建德, 等. 党参多糖对溃疡性结肠炎大鼠结肠上皮NF-κB信号通路的影响 [J]. 中成药, 2021, 43(6): 1445-1450.
[9] 刘雪枫, 乔婧, 高建德, 等. 党参水煎液对大鼠溃疡性结肠炎的抗炎作用及机制 [J]. 中兽医医药杂志, 2020, 39(5): 21-25.
[10] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[11] He R P, Jin Z, Ma R Y,. Network pharmacology unveils spleen-fortifying effect ofon different gastric diseases based on theory of “same treatment for different diseases” in traditional Chinese medicine [J]., 2021, 13(2): 189-201.
[12] Nüesch E, Häuser W, Bernardy K,. Comparative efficacy of pharmacological and non-pharmacological interventions in fibromyalgia syndrome: Network meta-analysis [J]., 2013, 72(6): 955-962.
[13] Ru J L, Li P, Wang J N,. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines [J]., 2014, 6: 13.
[14] Pang X C, Kang D, Fang J S,. Network pharmacology-based analysis of Chinese herbal Naodesheng formula for application to Alzheimer’s disease [J]., 2018, 16(1): 53-62.
[15] 王亚东, 徐志庆, 夏丹, 等. 基于NLRP3炎症小体研究白头翁汤正丁醇提取物对白念珠菌定植下小鼠溃疡性结肠炎的作用机制[J]. 中草药, 2022, 53(13): 3997-4006.
[16] Turner J R. Intestinal mucosal barrier function in health and disease [J]., 2009, 9(11): 799-809.
[17] 毛靖伟, 王英德. 肠黏膜屏障在炎症性肠病中作用机制的研究进展 [J]. 世界华人消化杂志, 2010, 18(7): 695-698.
[18] 赵美华, 龚陈, 楼江明, 等. 黏蛋白与炎症性肠病关系的研究进展 [J]. 世界华人消化杂志, 2014, 22(27): 4100-4106.
[19] 李卓原, 刘剑, 刘聪聪, 等. 中西医治疗溃疡性结肠炎的研究进展 [J]. 中国肛肠病杂志, 2020, 40(12): 72-74.
[20] Ng S C, Shi H Y, Hamidi N,. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: A systematic review of population-based studies [J]., 2017, 390(10114): 2769-2778.
[21] Cui G L, Yuan A P. A systematic review of epidemiology and risk factors associated with Chinese inflammatory bowel disease [J]., 2018, 5: 183.
[22] Li W J, Yang S H. Targeting oxidative stress for the treatment of ischemic stroke: Upstream and downstream therapeutic strategies [J]., 2016, 2(4): 153-163.
[23] Angeli J P F, Schneider M, Proneth B,. Inactivation of the ferroptosis regulator Gpx4 triggers acute renal failure in mice [J]., 2014, 16(12): 1180-1191.
[24] Raza H, John A, Brown E M,. Alterations in mitochondrial respiratory functions, redox metabolism and apoptosis by oxidant 4-hydroxynonenal and antioxidants curcumin and melatonin in PC12 cells [J]., 2008, 226(2): 161-168.
[25] Söderholm J D, Olaison G, Peterson K H,. Augmented increase in tight junction permeability by luminal stimuli in the non-inflamed ileum of Crohn’s disease [J]., 2002, 50(3): 307-313.
[26] Dodson M, Castro-Portuguez R, Zhang D D. NRF2plays a critical role in mitigating lipid peroxidation and ferroptosis [J]., 2019, 23: 101107.
[27] Zhang D D, Lo S C, Cross J V,. Keap1 is a redox-regulated substrate adaptor protein for a Cul3-dependent ubiquitin ligase complex [J]., 2004, 24(24): 10941-10953.
[28] Cullinan S B, Gordan J D, Jin J P,. The Keap1-BTB protein is an adaptor that bridges Nrf2 to a Cul3-based E3 ligase: Oxidative stress sensing by a Cul3-Keap1 ligase [J]., 2004, 24(19): 8477-8486.
[29] Chen L Y, Li X X, Liu L B,. Erastin sensitizes glioblastoma cells to temozolomide by restraining xCT and cystathionine-γ-lyase function [J]., 2015, 33(3): 1465-1474.
[30] Kwak M K, Wakabayashi N, Itoh K,. Modulation of gene expression by cancer chemopreventive dithiolethiones through the Keap1-Nrf2 pathway. Identification of novel gene clusters for cell survival [J]., 2003, 278(10): 8135-8145.
[31] Pajares M, Jiménez-Moreno N, García-Yagüe Á J,. Transcription factor NFE2L2/NRF2is a regulator of macroautophagy genes [J]., 2016, 12(10): 1902-1916.
[32] Knatko E V, Ibbotson S H, Zhang Y,. Nrf2 activation protects against solar-simulated ultraviolet radiation in mice and humans [J]., 2015, 8(6): 475-486.
[33] Ursini F, Maiorino M. Lipid peroxidation and ferroptosis: The role of GSH and GPx4 [J]., 2020, 152: 175-185.
[34] Alim I, Caulfield J T, Chen Y X,. Selenium drives a transcriptional adaptive program to block ferroptosis and treat stroke [J]., 2019, 177(5): 1262-1279.
[35] Xie Y, Hou W, Song X,. Ferroptosis: Process and function [J]., 2016, 23(3): 369-379.
[36] 龚卓之, 曹增, 姚梦茜, 等. 从铁死亡探讨溃疡性结肠炎不同时期的发病机制及相关天然药物筛选[J]. 中草药, 2023, 54(7): 2187-2196.
[37] Yang W S, Stockwell B R. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells [J]., 2008, 15(3): 234-245.
[38] Yagoda N, von Rechenberg M, Zaganjor E,. RAS-RAF-MEK-dependent oxidative cell death involving voltage-dependent anion channels [J]., 2007, 447(7146): 864-868.
[39] Chan D C. Mitochondrial dynamics and its involvement in disease [J]., 2020, 15: 235-259.
[40] Sesaki H, Adachi Y, Kageyama Y,.functions of Drp1: Lessons learned from yeast genetics and mouse knockouts [J]., 2014, 1842(8): 1179-1185.
[41] Birsa N, Norkett R, Wauer T,. Lysine 27 ubiquitination of the mitochondrial transport protein Miro is dependent on serine 65 of the Parkin ubiquitin ligase [J]., 2014, 289(21): 14569-14582.
[42] 邱林, 李美红, 夏洽思, 等. 中医药对线粒体保护机制的研究进展 [J]. 湖南中医杂志, 2017, 33(6): 214-215.
[43] 温超玮, 仇如意, 胡念琪, 等. 线粒体DNA单体型M8a对转线粒体细胞线粒体能量代谢的影响 [J]. 中国细胞生物学学报, 2017, 39(5): 607-614.
[44] Jin X, Chen D, Zheng R H,. miRNA-133a-UCP2pathway regulates inflammatory bowel disease progress by influencing inflammation, oxidative stress and energy metabolism [J]., 2017, 23(1): 76-86.
[45] Park S G, Kim S H, Kim K Y,. Toyocamycin induces apoptosis via the crosstalk between reactive oxygen species and p38/ERK MAPKs signaling pathway in human prostate cancer PC-3 cells [J]., 2017, 69(1): 90-96.
[46] Liu C X, Ye Y J, Zhou Q,. Crosstalk between Ca2+signaling and mitochondrial H2O2is required for rotenone inhibition of mTOR signaling pathway leading to neuronal apoptosis [J]., 2016, 7(7): 7534-7549.
[47] Brazil D P, Yang Z Z, Hemmings B A. Advances in protein kinase B signalling: AKTion on multiple fronts [J]., 2004, 29(5): 233-242.
[48] Wu J X, Li Q, Wang X Y,. Neuroprotection by curcumin in ischemic brain injury involves the Akt/Nrf2 pathway [J]., 2013, 8(3): e59843.
[49] 陈璐璐, 刘小伟. 饮食、肠道菌群与炎症性肠病 [J]. 生物医学转化, 2021, 2(3): 42-48.
[50] Jiang X J, Stockwell B R, Conrad M. Ferroptosis: Mechanisms, biology and role in disease [J]., 2021, 22(4): 266-282.
[51] 张昊悦, 赵蓓, 王业皇, 等. 大黄素通过调节Nrf2/HO-和MAPKs抑制炎症和氧化应激机制研究 [J]. 中国免疫学杂志, 2021, 37(9): 1063-1068.
Intervention of Codonopsis Radix on ferroptosis and mitochondrial dynamics imbalance in mucosal cells of ulcerative colitis via PI3K/Akt
LI Fang1, CHEN Zheng-jun1, GE Jun-li1, WANG Chun-xia1, LIANG Jian-qing2, FENG Cui-juan3, YANG Fu-de1
1. School of Pharmacy, Gansu University of Chinese Medicine, Lanzhou 730000, China 2. School of Basic Medicine, Gansu University of Chinese Medicine, Lanzhou 730000, China 3. School of Chinese Medicine, Gansu Health Vocational College, Lanzhou 730300, China
To explore the mechanism of Dangshen () on intervening intestinal mucosal cells ferroptosis-mitochondrial dynamics imbalance in ulcerative colitis (UC) via Kelch like ECH-associated protein 1 (Keap1)/nuclear factor E-related factor 2 (Nrf2)/glutathione peroxidase 4 (GPX4) and mitochondrial related protein 1 (DRP1) signaling pathway regulated by phosphatidylinositol 3-kinase (PI3K)/protein kinase B (Akt).Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis in network pharmacology was used to predict the key signaling pathways ofintervention in UC. SD rats were used to prepare UC models by 2,4,6-trinitrobenzene sulfonic acid (TNBS)-ethanol composite method, rats were randomly divided into control group, model group, sulfasalazine tables (0.3 g/kg) group, iron inhibitor Ferrostatin-1 (0.8 mg/kg) group, andhigh-, medium-, and low-dose (18, 9, 4.5 g/kg) groups, with 12 rats in each group; Drugs were given for 7 d, serum and colon tissue from each group of rats were collected. Histopathological observation and histological damage index (TDI) of colon mucosa were performed by HE staining; ELISA was used to detect Fe2+, interleukin-1β (IL-1β), IL-6, tumor necrosis factor-α (TNF-α), IL-8, GPX4, C-reactive protein (CRP),-lactate contents in serum; Superoxide dismutase (SOD) activity and contents of malondialdehyde (MDA), glutathione (GSH) in serum were detected, adenosine triphosphate (ATP) content and activities of myeloperoxidase (MPO), Ca2+, Mg2+-ATPase, Na+, K+-ATPase and ATPase in colon tissue were detected by biochemical method. Differentially expressed genes in colon tissues of control group, model group, andhigh-dose group were analyzed by transcription sequencing, and KEGG pathway enrichment analysis were performed to obtain the differentially expressed signal pathway ofintervention in UC. Western blotting was used to detect the expressions of p-PI3K, PI3K, p-Akt, Akt, Keap1, Nrf2, GPX4, recombinant human ferritin heavy chain (FTH1), DRP1 and mitochondrial Rho GTP (MIRO) proteins in colon tissue; qRT-PCR was used to detect the mRNA expressions of,,,,andin colon tissue.The pathological observation and scoring results showed thateffectively improved the inflammatory and edema state of colon tissue; The network pharmacology prediction results indicated that the key targets ofintervention in UC were significantly enriched in PI3K/Akt signaling pathway. The results of ELISA experiments indicated thateffectively reduced IL-1β, IL-6, IL-8,TNF- α,-lactate and CRP levels in serum of UC model rats to inhibit inflammation (< 0.05, 0.01, 0.001), reduced Fe2+, MDA contents and MPO activity in serum (< 0.001), increased GPX4, GSH levels and SOD activity in serum (< 0.001), and inhibited oxidative stress;elevated the ATP content and activities of ATPase, Ca2+, Mg2+-ATPase, Na+, K+-ATPase in colon tissue (< 0.05, 0.01, 0.001), and enhanced energy metabolism. The analysis of KEGG pathway in transcriptome suggested that the differential genes in control groupmodel group andhigh-dose groupmodel group were significantly enriched in PI3K/Akt and other signal pathways. The results of Western blotting experiments confirmed thateffectively downregulated the expressions of p-PI3K/PI3K, p-Akt/Akt, Keap1, MIRO and DRP1 proteins in colon tissue (< 0.05, 0.01, 0.001), and upregulated the expressions of Nrf2, FTH1 and GPX4 proteins (< 0.05, 0.01, 0.001), exerting antioxidant stress, inhibiting iron death, and regulating mitochondrial dynamics. qRT-PCR experiment results also showed thateffectively downregulated the expressions of,andgenes in colon tissue (< 0.05, 0.001), and upregulated the expressions of,andgenes (< 0.05, 0.01, 0.001).is an effective drug for intervention in UC, and its mechanism may be related to PI3K/Akt intervention in Keap1/Nrf2/GPX4, DRP1 signaling pathways to inhibit mitochondrial dynamic imbalance-ferroptosis oxidative stress injury in intestinal mucosal cells.
; ulcerative colitis; PI3K/Akt; oxidative stress; mitochondrial dynamics imbalance; ferroptosis;lobetyolin; atractylenolide III
R285.5
A
0253 - 2670(2023)12 - 3865 - 13
10.7501/j.issn.0253-2670.2023.12.013
2023-01-12
国家重点研发计划(2018YFC1706305);甘肃省自然科学基金项目(22JR5RA590);甘肃省教育科技创新项目(2022A-064,2023A-297)
李 芳(1982—),女,博士研究生,研究方向为中药药理与毒理。Tel: (093)15162472 E-mail: 119232388@qq.com
通信作者:杨扶德(1972—),男,教授,博士生导师,主要从事中药品质及中药材规范化栽培研究。Tel: (0931)5162435 E-mail: gszyyfd@163.com
[责任编辑 李亚楠]
