不同饮食结构的脑瘫伴癫痫患儿的肠道微生物群差异及其影响
2023-06-17温壮飞李发龙蔡青桐邰先韬
温壮飞,李发龙,蔡青桐,林 野,朱 彬,邰先韬
(1.海南省海口市妇幼保健院 儿童康复科,海南 海口,570000;2.昆明中医学院 康复教研室,云南 昆明,650000)
脑性瘫痪(CP)是一组持续存在的中枢性运动障碍和姿势性发育障碍、活动受限的症候群,是发育中的胎儿或婴幼儿的脑部非进行性损伤所致[1-3]。运动功能障碍是CP的核心症状,此外还常伴有其他功能障碍,例如感觉、知觉、认知、沟通和行为障碍,继发性肌肉骨骼疾病和癫痫[4-6]。癫痫定义为在新生儿期之后出现2次或多次非热性惊厥,不同类型脑瘫患儿的癫痫发病率存在差异。癫痫在四肢瘫痪CP患者中尤为常见,而在运动障碍或共济失调型CP患儿中相对罕见[7]。大多数CP患儿存在喂养困难和胃肠道功能障碍,而胃肠道功能障碍和喂养困难在CP患儿营养不良的发展中起着重要作用,并增加了生长障碍的发生风险[8]。除导致生长障碍外,营养不良还会引发脑功能下降和发育潜力降低、免疫功能受损、循环受损、伤口愈合不良等问题[9]。
胃肠道功能障碍可以通过饮食对肠道微生物群的影响来进行调节[10]。近年来,人类肠道微生物群受到越来越多的关注,研究[11]发现,微生物组-肠道-脑轴是肠道微生物组与中枢神经系统的双向通讯系统,涉及神经、内分泌和免疫通路。研究表明,微生物群改变作为环境因素通过微生物组-肠道-脑轴发挥作用,并提出生酮饮食在调节肠道微生物群和癫痫发作中的有益作用[12-13]。胃肠道功能受肠道微生物群的饮食结构的影响,目前国内在肠道菌群对脑瘫伴癫痫患儿胃肠功能障碍影响的研究较为有限。本研究分析不同饮食结构的脑瘫伴癫痫患儿在肠道微生物群方面的差异及其影响,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2021年5月—2022年5月在海口市妇幼保健院儿童康复科就诊的脑瘫伴癫痫患儿为研究对象,经纳入标准和排除标准筛选后共有41例脑瘫伴癫痫患儿入选。本研究获得海口市妇幼保健院医院伦理委员会的审核批准。依据患儿的基本饮食情况,将其分为观察组23例和对照组18例。观察组患儿基本饮食情况为流质饮食,日常食物主要包括呈液体状的米糊和奶,易消化吞咽。对照组患儿基本饮食情况为普通饮食,日常食物主要包括谷物、淀粉以及水果、蔬菜,少量动物蛋白和脂肪,少油腻、粗纤维、无刺激性。
纳入标准:① 已确诊符合《脑性瘫痪共患癫痫诊断与治疗专家共识》[14]中相关诊断标准的患儿;② 年龄≤10周岁者;③ 患儿家属知晓本研究目的及过程并签署病情知情同意书。排除标准:① 患有胃肠道疾病(消化道溃疡、出血,细菌性痢疾,胃食管反流等)或胃肠功能异常的患儿;② 入组前14 d内使用过益生菌或抗生素治疗的患儿;③ 有代谢疾病的患儿;④ 大便轮状病毒检测阳性的患儿。
1.2 研究方法
收集患儿的粪便样本并进行DNA提取测序[15]:使用无菌干燥棉拭子和采便盒收集患儿入组当天的新鲜粪便3~5 g,随后转移至-80 ℃冷冻管液氮冷冻,使用天根粪便基因组DNA提取试剂盒DP328提取粪便微生物全DNA,DNA样本随后进行16S rRNA基因扩增和高通量测序。部分患儿因便秘未在入组当天采集到粪便,则收集在住院治疗期间的粪便样品进行研究。
测序数据分析[16]:2组患儿的测序数据通过生物信息学工具进行序列拼接、过滤、去嵌合体。优化后的序列在USEARCH中聚合成可操作的分类单元,参考Greengene v201305细菌库对这些单元进行比较和注释,得到每个样本的微生物组成信息。基于此对2组所有样本进行细菌丰度分析。最后在基于属的组成和相对丰度上进行主成分分析(PCA),并绘制了按组划分的样本的整体微生物群分布。
1.3 统计学分析
使用北京大数惠康医疗科技有限公司的临床科研智能决策系统分析所有数据,描述性数据以平均值±标准差表示,独立样本t检验用于识别描述性数据的显著差异;频率数据以[n(%)]表示,使用卡方检验和Fisher精确概率法比较频率数据。基于属的组成和相对丰度进行PCA,并绘制了按组划分的样本的整体微生物群分布。P<0.05为差异有统计学意义。
2 结 果
2.1 2组患儿一般资料比较
2组患儿在性别、年龄、脑性瘫痪类型、病程、癫痫持续时间、发作频率方面比较,差异无统计学意义(P>0.05),但2组在身高、体质量以及粗大运动功能分级系统(GMFCS)分级方面比较,差异有统计学意义(P<0.05)。见表1。
表1 2组患儿一般资料比较
2.2 2组患儿胃肠道功能障碍发生情况比较
2组患儿均发生胃肠道功能障碍,其中最多的是便秘,其次是腹胀、腹泻。观察组患儿呕吐、腹胀、腹泻、胃肠道出血以及便秘发生率高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 2组患儿胃肠道功能障碍发生情况比较[n(%)]
2.3 2组患儿胃肠道优势微生物组成分析
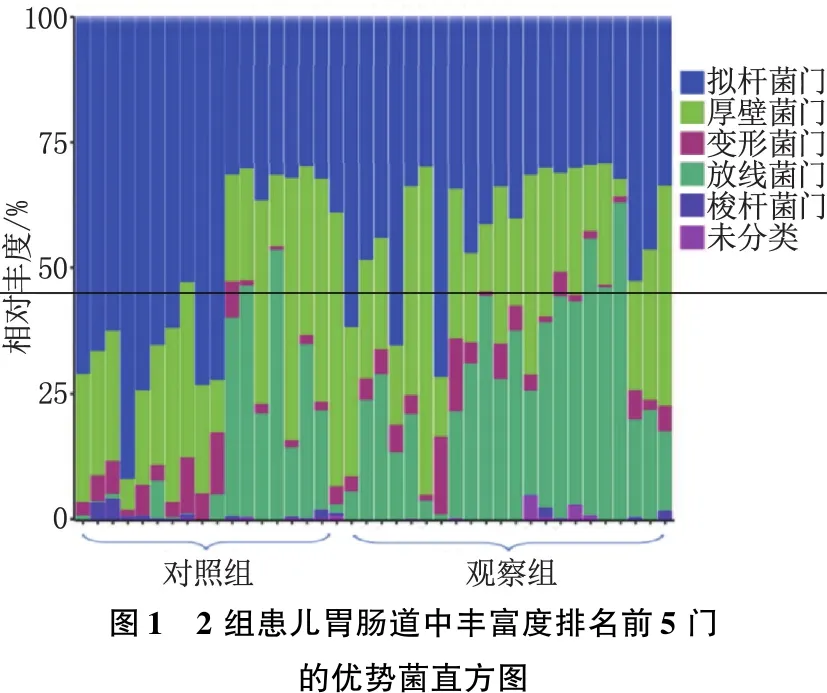
对照组丰富度排名前5门的优势菌分别是厚壁菌门、拟杆菌门、放线菌门、变形菌门和梭杆菌门。观察组丰富度排名前5门的优势菌分别是厚壁菌门、放线菌门、拟杆菌门、变形菌门和疣微菌门。2组拟杆菌门、放线菌门及梭杆菌门、疣微菌门相对丰度比较,差异有统计学意义(P<0.01)。见表3、图1。

表3 2组患儿胃肠道中丰富度排名前5门的优势菌的相对丰度
2.4 2组患儿胃肠道优势菌属组成分析
2组患儿胃肠道排名前10属的优势菌分布情况见表4。对照组前5个属中有4个属与观察组有重叠,分别为普雷沃氏菌属、拟杆菌属、双歧杆菌属、副杆菌属。观察组的拟杆菌属、双歧杆菌属和副杆菌属相对丰度均高于对照组,普雷沃氏菌属的相对丰度低于对照组,差异有统计学意义(P<0.05),见表5。

表4 2组排名前10菌属的相对丰度

表5 2组重叠菌属相对丰度的差异比较 %
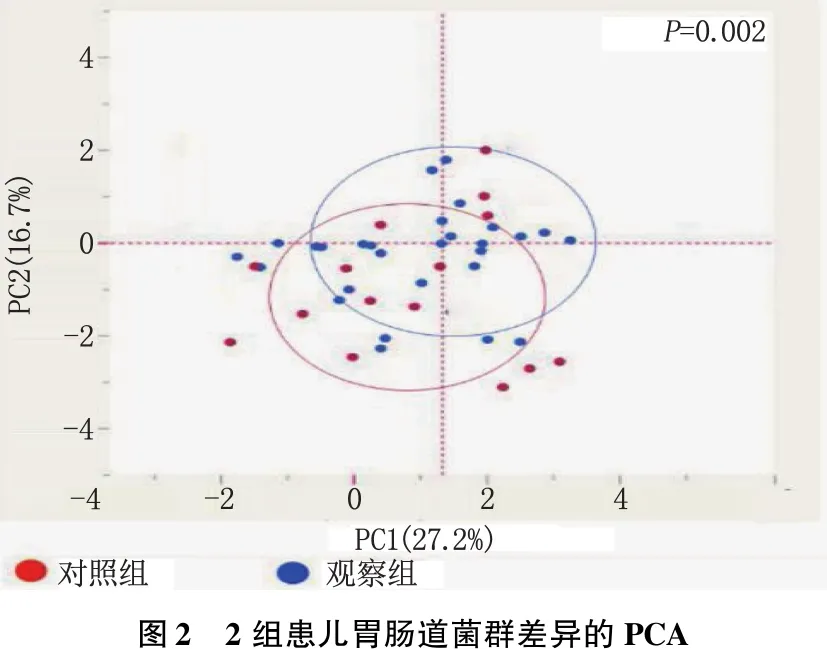
2.5 2组组间细菌差异的PCA
PCA显示观察组的肠道菌群结构与对照组相比,差异有统计学意义(P=0.002)。见图2。
3 讨 论
虽然CP和癫痫虽然是2种不同的神经系统疾病,但两者之间存在联系密切。超过25%的CP患者被诊断为癫痫[17],而癫痫也加重了CP患者的运动和精神障碍[18]。关于微生物-肠-脑轴的研究[19]表明肠道菌群对各种神经系统疾病有潜在影响。本研究发现,2组患儿在身高、体质量以及GMFCS分级存在显著差异。GMFCS分级是以患儿的自发运动为依据来描述患儿现阶段的活动能力以及运动功能受限制的程度,等级越高表明患儿活动越困难[20]。本研究中,对照组有较多的Ⅰ级、Ⅱ级患儿,而观察组有较多的Ⅲ级患儿,表明观察组中多为运动受限的患儿,这些患儿需要通过流质饮食来提供日常所需营养。受液体质地的影响,流质饮食的营养不完整[21],患儿更容易出现营养不良的情况,因此观察组患儿的身高、体质量均显著低于对照组。此外,2组患儿均发生胃肠道功能障碍,其中最多的是便秘,其次是腹胀、腹泻;观察组患儿呕吐、腹胀、腹泻、胃肠道出血以及便秘发生率显著高于对照组。便秘是CP患儿最常见的合并症之一,发生率为26%~74%。CP患儿的水和膳食纤维摄入量通常低于正常同龄儿童推荐的摄入量[22],这主要是因为CP严重的患儿在客观上难以口服富含纤维的全植物性食物,而膳食纤维能够通过刺激肠道运动、吸收水分和润滑肠道来改善便秘情况[23]。因此,虽然观察组摄入的水分较多,但流质饮食中的膳食纤维不足,进而导致便秘易发。
研究[24]发现,肠道功能障碍、肠道微环境失调与炎症、神经调节物(如内啡肽、干扰素、白细胞介素等)的变化与生物信号传导受损有关。食物成分(维生素、碳水化合物、脂肪、矿物质等)的信息通过肠道菌群以“微生物群-肠-脑轴”的方式处理并传递到中枢神经系统,引发反映营养和能量状态的系统反应。当微生物种群失衡时,异常信号将被传递至大脑,从而导致不良情况发生,例如细胞退化、能量稳态破坏和氧化应激增加[25]。本研究中,2组患儿胃肠道排名前10属的优势菌中,对照组前5个属中的普雷沃氏菌属、拟杆菌属、双歧杆菌属、副杆菌属与观察组有重叠,且观察组的拟杆菌属、双歧杆菌属和副杆菌属相对丰度均显著高于对照组,而普雷沃氏菌属的相对丰度显著低于对照组。普雷沃氏菌擅长从阿拉伯木聚糖和低聚果糖中提取短链脂肪酸丙酸。普氏菌的组成和代谢活动在很大程度上受饮食调节,也可以影响食物的代谢,有研究[26]表明低脂高纤维饮食的儿童肠道普氏菌丰富。本研究也证实有普通饮食的对照组患儿有较多纤维摄入,普雷沃氏菌属的相对丰度明显较高。双歧杆菌是乳酸的主要生产者,可抑制大肠杆菌等病原体在上皮细胞中的生长,减少肠道炎症,并与免疫系统配合。粪便中普雷沃氏菌属与游离氨基酸和短链脂肪酸(SCFA)的改善肠道运动功能密切相关[27]。低水平的SCFA可能与益生菌的使用、有益细菌的糖酵解发酵降低或肠道通透性增加有关。本研究观察组柯林斯菌属、另枝菌属、伊格尔兹氏菌属可诱发肠道炎症和肠渗漏,这可能与流质饮食患儿胃肠道出血、腹胀有关。
综上所述,与普通饮食相比,食用流质饮食的脑瘫伴癫痫患儿的肠道微生物群中共生病原体水平升高,肠道屏障保护细菌减少,增加了脑瘫伴癫痫患儿发生胃肠道功能障碍的风险。长期采取流质饮食的患儿可以服用含有纤维或含有葡萄糖聚合物和长链甘油三酯的膳食补充剂,或者在饮食过程中补充益生菌。在无法通过口服满足营养需求的情况下,应考虑使用肠内营养。若儿童处于营养不良的高危状态,可进行肠内管饲,其配方(脂肪、热量、纤维素、微量元素等)应基于儿童的年龄、能量需求和肠内途径进行选择。
