基于血液学指标的胃癌前病变诊断模型的构建及价值
2023-06-17许叶旻李贵庆李瑶瑶丁岩冰
徐 夕,许叶旻,李贵庆,李瑶瑶,佘 强,丁岩冰,邓 彬
(1.扬州大学 医学院,江苏 扬州,225001;2.扬州大学附属医院 消化内科,江苏 扬州,225001)
胃癌(GC)的发生及发展是一个多因素参与的复杂病理过程,目前研究已明确的主要危险因素包括幽门螺杆菌(H.pylori)感染、不良饮食习惯、吸烟、饮酒、一级亲属GC家族史[1]。胃黏膜在不良因素侵袭下产生长期慢性活动性炎症,最终使部分人群进入Correa提出的肠型胃癌模式,并经历慢性浅表性胃炎、慢性萎缩性胃炎、肠上皮化生、上皮内瘤变等阶段,最终导致癌变[2]。慢性萎缩性胃炎、肠上皮化生、上皮内瘤变等胃黏膜病变与GC的发生关系密切,又被称为胃癌前病变(GPL)[3]。张华颖等[4]研究显示,在长达(7.57±1.74)年的随访中,有4.41%的GPL患者最终罹患GC,且随着胃黏膜病变严重程度的增加,GC发生的风险也不断增高。近年来,多项研究[5-8]证实了胃黏膜血清学、血常规等血液学指标在GC的早期诊断和预后方面的价值。本研究分析GPL患者的部分临床特征与血液学指标的特异性,并建立基于血液学指标的GPL诊断模型,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2019年3月9日—2021年6月14日参加扬州地区常驻居民上消化道肿瘤筛查项目的受试者进行回顾性研究。纳入标准:① 年龄40~79岁者;② 完成生活状况和健康问卷调查者,具有血清胃蛋白酶原(PG)、血清胃泌素-17(G-17)、血常规、H.pylori检测、胃镜及相关病理检查结果;③ 经胃镜证实无食管、十二指肠溃疡及其他病变者。排除标准:① 既往有明确的上消化道肿瘤或上消化道手术史者;② 存在长期服用抗凝药物、重要脏器功能不全或精神障碍等胃镜检查禁忌证者;③ 合并严重感染者;④ 合并其他系统肿瘤或血液系统疾病者。根据纳入与排除标准,选择胃镜病理结果为萎缩性胃炎、肠上皮化生及上皮内瘤变的受试者1 142例,正常或浅表性胃炎的受试者1 222例。采用Rand随机函数抽取70%的受试者[9]组成训练组(1 655例,其中GPL组779例,对照组876例),剩余30%的受试者组成验证组(709例,其中GPL组363例,对照组346例)。训练组与验证组的基线资料比较,差异无统计学意义(P>0.05),见表1。
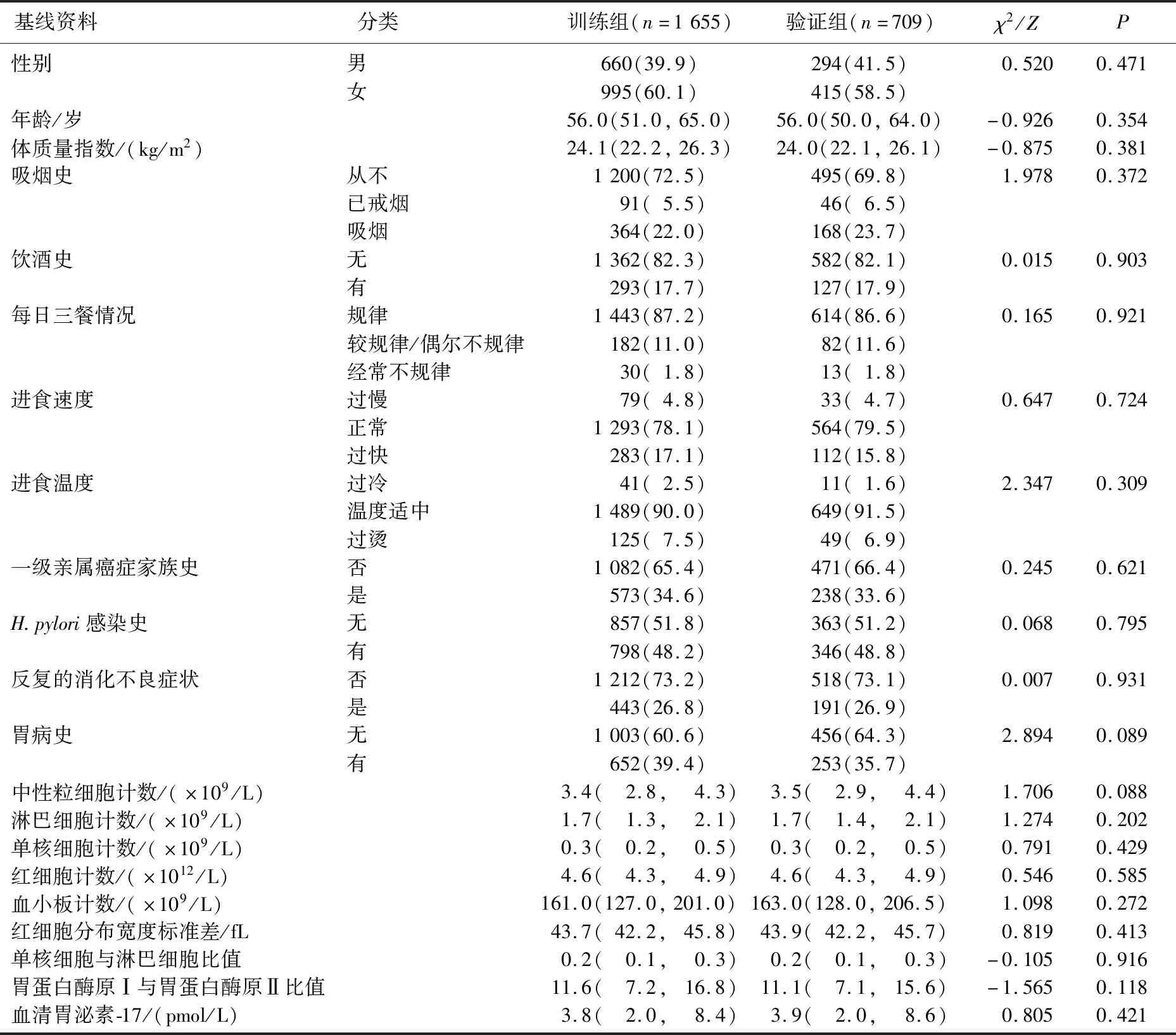
表1 训练组与验证组的基线资料比较[M(P25,P75)][n(%)]
1.2 临床资料收集
1.2.1 临床基础信息:采用生活状况和健康问卷调查表收集患者的一般信息,包括性别、年龄、体质量指数(BMI)、吸烟史、饮酒史、每日三餐情况、进食速度、进食温度、一级亲属癌症家族史、H.pylori感染史、反复出现消化不良症状情况及胃病史;吸烟史包括已戒烟及仍在吸烟且每天≥1支,持续6个月以上;饮酒史指仍规律饮酒≥1次/周,持续6个月以上;进食规律指采用三餐制,每日定时、定量进食,三餐间隔时间4~6 h为宜;进食速度过慢指进食速度超过30 min,进食速度过快指进食速度不足10 min;进食温度主要取决于受试者的自我感觉,进食温度适中的餐食温度定义为10~60 ℃,进食温度过烫者餐食温度>60 ℃,进食温度过冷者的餐食温度<10 ℃;H.pylori感染史包括既往H.pylori阳性和现症H.pylori阳性(尿素呼气试验结果阳性);消化不良症状包括腹痛、纳差、饱胀、胃灼烧或吞咽不畅等常见非典型症状;胃病史指既往有胃溃疡、胃息肉、胃食管反流症、慢性浅表性胃炎、慢性萎缩性胃炎、胃黏膜肠上皮化生、胃黏膜上皮内瘤变等胃良性病变。
1.2.2 实验室检查:对受试者进行采血和内镜检查,获得血常规、胃黏膜血清学及活检病理结果。血常规主要包括中性粒细胞计数、淋巴细胞计数、单核细胞计数、红细胞计数、血小板计数和红细胞分布宽度标准差(RDW-SD),并计算单核细胞与淋巴细胞比值(MLR)。红细胞分布宽度(RDW)的输出包括2个项目,分别为红细胞分布宽度变异系数(RDW-CV)和RDW-SD。RDW-SD是以飞升(fL)为单位,在红细胞分布曲线高于基线20%的点处进行测量得到的实际宽度能更真实地反映红细胞大小的变化,因此将RDW-SD作为RDW的预测值进行分析。胃黏膜血清学包括胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)、G-17,并计算PGⅠ与PGⅡ比值(PGR)。内镜检查由技术熟练且具有高级职称的消化内科医师进行操作,分别在胃窦、胃体各取2块组织和胃角1块组织送病理检查,按照中国慢性胃炎病理诊断标准和新悉尼系统直观模拟评分法[10]进行诊断和病理分级。
1.3 统计学方法
采用SPSS 25.0软件进行统计学分析。计量资料采用Kolmogorov-Smirnov检验其正态性,呈偏态分布的计量资料以中位数(第25百分位数,第75百分位数)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。计数资料以例数和百分比表示,组间比较采用卡方检验。采用受试者工作特征(ROC)曲线分析敏感指标诊断GPL的效能及最佳临界值。采用多因素Logistic回归模型分析GPL的独立危险因素,建立GPL的诊断模型,采用Hosmer-Lemeshow检验评估模型的拟合度,根据模型应用于训练组和验证组的曲线下面积(AUC)评估模型的区分度。P<0.05为差异有统计学意义。
2 结 果
2.1 训练组中GPL患者与对照组的临床特征及实验室指标比较
训练组中,男性、有吸烟史、饮酒史和H.pylori感染史的受试者更易出现GPL,差异有统计学意义(χ2=5.049、11.007、6.716、208.144,P=0.025、0.004、0.010、<0.001)。与GPL组相比,对照组的受试者进食速度更快、更易出现消化不良症状和胃病史,差异有统计学意义(χ2=7.121、4.243、16.986,P=0.028、0.039以及P<0.001)。在实验室指标方面,GPL组的单核细胞计数、RDW-SD、MLR、G-17均高于对照组,PGR低于对照组,差异有统计学意义(Z=3.058、2.884、2.321、7.007、-12.408,P=0.002、0.004、0.020以及P<0.001、<0.001)。见表2。
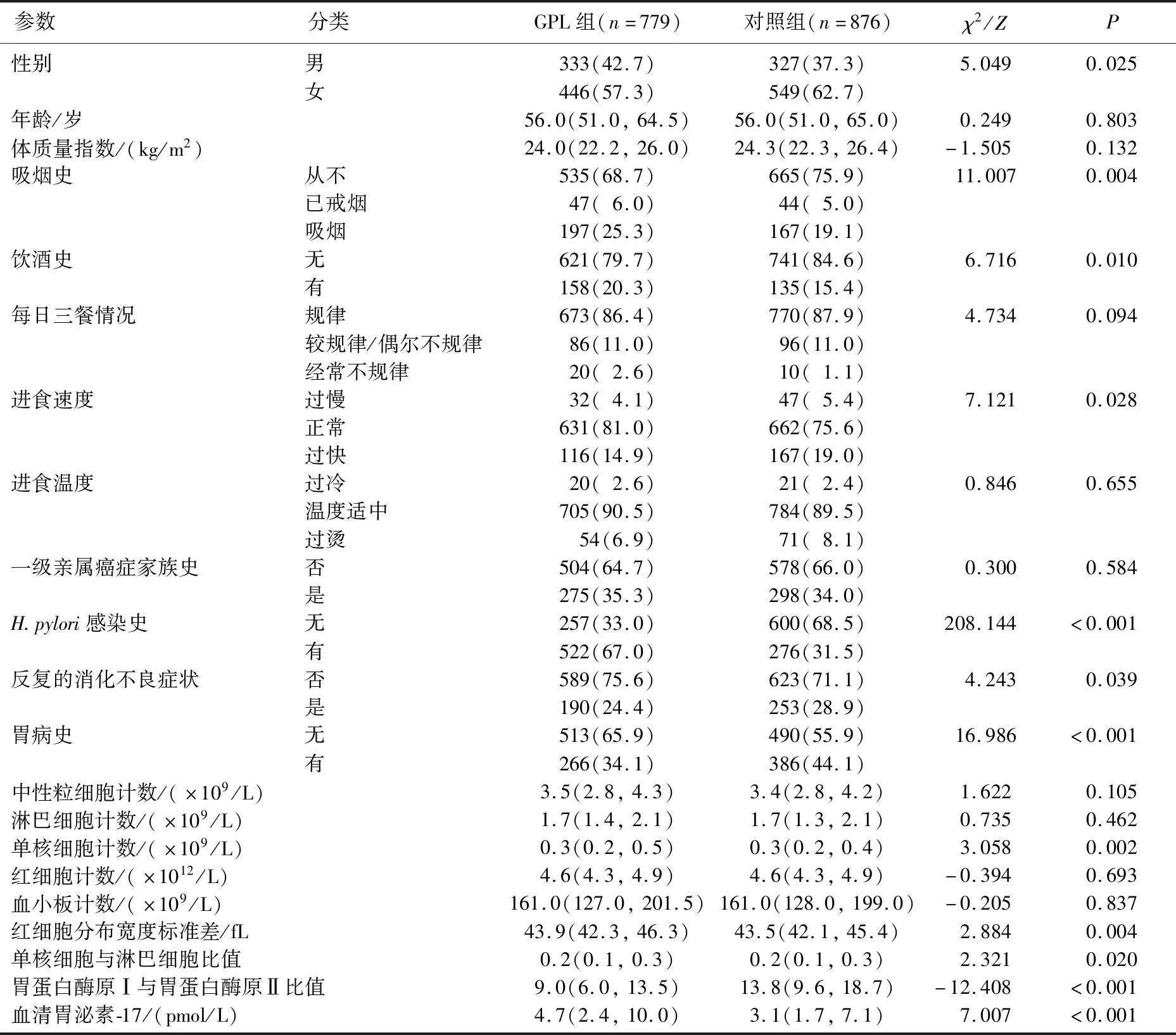
表2 训练组中GPL相关参数的单因素分析[M(P25,P75)][n(%)]
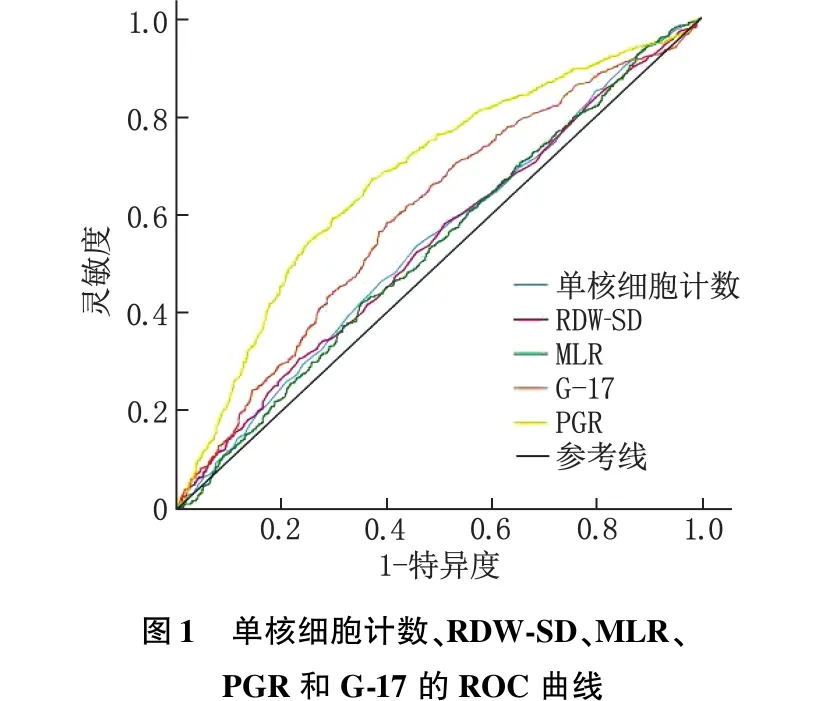
2.2 单核细胞计数、RDW-SD、MLR、PGR和G-17的最佳临界值分析
ROC曲线显示,单核细胞计数、RDW-SD、MLR、PGR和G-17的最佳临界值分别为0.34×109/L(AUC=0.543,灵敏度=53.4%,特异度=54.5%)、46.55 fL(AUC=0.541,灵敏度=30.6%,特异度=76.7%)、0.23(AUC=0.533,灵敏度=42.1%,特异度=64.8%)、11.80(AUC=0.676,灵敏度=67.1%,特异度=62.9%)和3.98 pmol/L(AUC=0.600,灵敏度=58.3%,特异度=60.0%)。见图1。
2.3 多因素Logistic回归模型分析GPL的独立危险因素
将单核细胞计数、RDW-SD、MLR、PGR和G-17分别根据最佳临界值分为2个水平,最佳临界值及以下为低水平,最佳临界值以上为高水平。将5个不同水平参数与性别、吸烟史、饮酒史、H.pylori感染史、进食速度、具有消化不良症状和胃病史均纳入多因素Logistic回归分析,结果显示,有H.pylori感染史(OR=0.266,95%CI:0.213~0.332,P<0.001)、RDW-SD>46.55 fL(OR=0.524,95%CI:0.400~0.687,P<0.001)、PGR<11.80(OR=0.420,95%CI:0.335~0.527,P<0.001)和G-17>3.98 pmol/L(OR=0.632,95%CI:0.507~0.788,P<0.001)是GPL的独立危险因素。见表3。
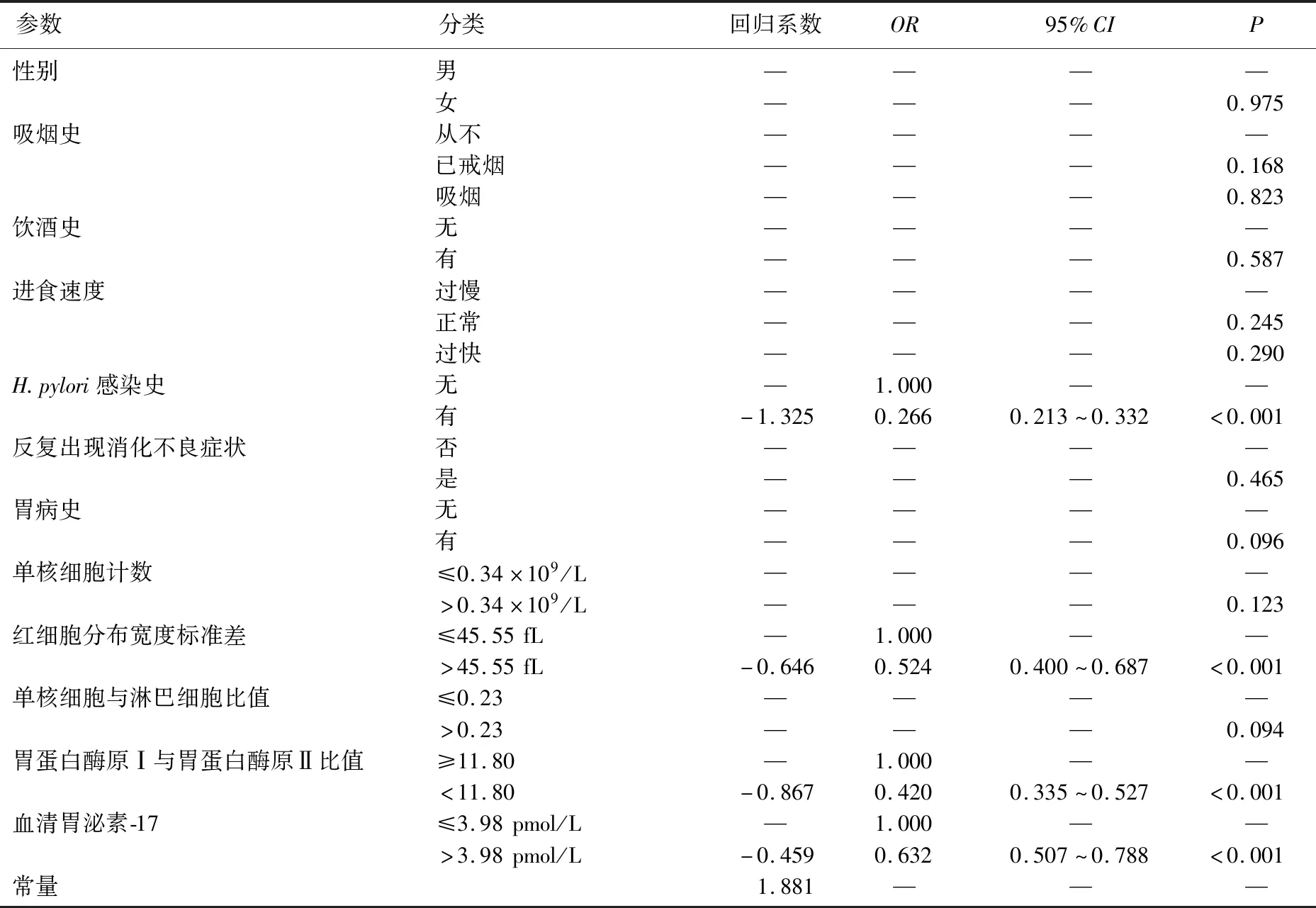
表3 多因素Logistic回归模型分析GPL的独立危险因素
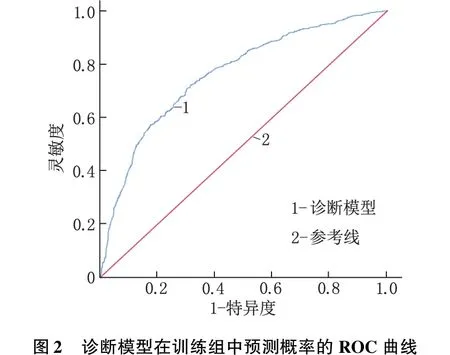
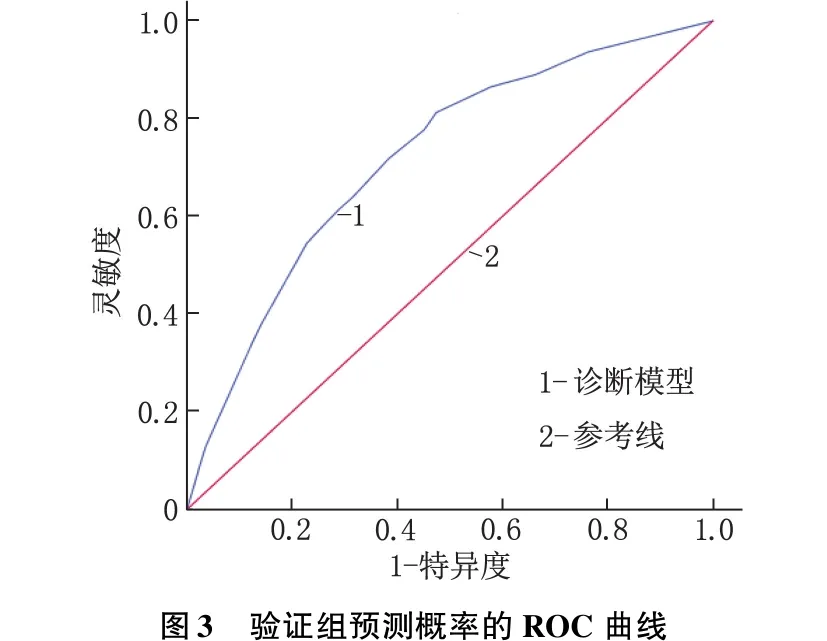
2.4 GPL诊断模型的建立与验证
采用Logistic回归分析构建GPL的诊断模型,预测概率P=1/[1+exp(Z)],Z=b0+b1×X1+b2×X2+b3×X3+b4×X4。其中,b为表3中的各项回归系数,b0为常量,b0=1.881,b1=-1.325,b2=-0.646,b3=-0.867,b4=-0.459。从未感染过H.pylori时X1=0,具有H.pylori感染史时X1=1;RDW-SD≤46.55 fL时X2=0,RDW-SD>46.55 fL时X2=1;PGR≥11.80时X3=0,PGR<11.80时X3=1;G-17≤3.98 pmol/L时X4=0,G-17>3.98 pmol/L时X4=1。该诊断模型在训练组中的AUC=0.762(95%CI:0.739~0.785,P<0.001),灵敏度为72.2%,特异度为68.5%,准确率为69.9%,阳性预测值为66.8%,阴性预测值为72.7%。诊断模型的Hosmer-Lemeshow拟合优度检验显示,模型预测值与实际观测值的差异无统计学意义(χ2=12.927,P>0.05),提示模型校准度高。将该诊断模型应用于验证组,计算出预测概率并绘制ROC曲线,结果显示该模型的AUC=0.719(95%CI:0.681~0.756,P<0.001),灵敏度为81.3%,特异度为52.6%,提示该模型的区分度较好。见图2、图3。
3 讨 论
GC是消化道最常见的恶性肿瘤之一,根据2020年世界卫生组织(WHO)数据显示,2020年中国GC新发病例47.9万例,死亡病例37.4万例,分别位列恶性肿瘤发病率的第4位和致死率的第3位[11]。由于GC早期缺乏特异性症状和体征,诊断较为困难,大部分患者确诊时多处于肿瘤中晚期[12],错失了最佳治疗时机。因此,尽早对GPL及早期胃癌(EGC)进行诊断和干预对改善患者预后具有重要的意义。
目前,中国已在部分地区小范围内开展了上消化道癌症筛查项目[13-14],内镜检查及病理活检依然是EGC和GPL诊断的金标准。然而,由于内镜检查的费用较高、受试者痛苦明显,且对设备和内镜医师具有较强的依赖性,使得大范围人群筛查的开展依旧困难重重。本研究针对GPL创新性地提出了RDW这一指标。RDW是临床实验室中常规分析的参数,作为全血细胞计数的组成部分,其反映了红细胞的体积异质性,既往主要用于判断患者的营养状况,包括铁、叶酸或维生素B12缺乏性贫血等,属于低侵入性检查。将H.pylori和胃黏膜血清学检测与RDW相结合,能够更为经济地、全面地评估受试者的胃黏膜状态和全身状态,筛选GPL高风险个体,为下一步内镜检查提供参考,对早癌筛查的程序改善具有指导意义。
目前RDW与GC相关的确切机制尚未阐明,推测有以下可能:① 肿瘤相关性炎症。炎症介质和炎症因子构成肿瘤微环境的重要组成部分[15],目前已有多项研究[16-17]表明炎症的血液学指标是癌症的潜在预测因子。RDW升高与炎症因子相关,包括白细胞介素-6、肿瘤坏死因子-α、铁调素和其他循环细胞因子[18-19]。炎症因子能够抑制促红细胞生成素对骨髓造血干细胞的刺激作用、抗凋亡作用及其在促红细胞成熟中的作用,使更多未成熟的红细胞被释放到外周血液循环中,从而使外周RDW升高[20]。② 营养不良。GPL患者常常会出现腹痛、纳差、饱胀、胃灼烧或吞咽不畅等消化不良症状,致使患者主动摄入量减少;同时,胃黏膜病变也会造成胃酸分泌减少、蛋白质及微量元素吸收障碍、急性及慢性出血等,造成患者营养不良,尤其是维生素B12、叶酸、铁元素等造血原料不足会影响红细胞生成,造成小细胞低色素性贫血和巨幼细胞性贫血双相性贫血,红细胞大小不一,从而使外周RDW水平升高。因此,肿瘤患者的RDW可能高于健康人群。PIETRZYK L等[21]对61例GC患者和61例健康对照者的血液学参数进行了回顾性分析,与对照者相比,GC患者的RDW显著高于对照组,且诊断灵敏度为76.9%,特异性为92.3%。本研究GPL组的RDW-SD高于对照组,且RDW-SD>46.55 fL是GPL的独立危险因素。RDW也被证实与结直肠癌[22]、胰腺癌[23]等多种癌症预后相关。
本研究还证实了H.pylori感染、PGR和G-17是GPL的独立危险因素。H.pylori感染诱导胃黏膜慢性炎症,刺激机体免疫系统释放活性氮造成DNA损伤,扰乱细胞正常的增殖-凋亡平衡,从而形成癌前病变的潜在恶性特征[24]。PG是由胃黏膜细胞分泌的特异性功能酶,随胃黏膜的形态和分泌功能变化而变化,当胃黏膜出现萎缩时,PGⅠ较PGⅡ水平下降更快,因而PGR随之降低。G-17是由胃窦G细胞分泌的胃肠激素,同样能够反映胃黏膜的功能状态,既往研究[25-26]证实了PGR、G-17在GPL诊断方面的价值。
本研究中,根据GPL独立危险因素构成的诊断模型在训练组中的AUC为0.762,在验证组中的AUC为0.719,说明模型具有良好的区分度;Hosmer-Lemeshow检验显示模型具有较好的校准度。本研究的局限性:① 本研究为回顾性单中心研究,可能会造成选择和回忆偏倚;② 仅采取了内部随机验证作为模型的验证方法,未来尚需更大样本的多中心研究来进一步进行外部验证。本研究仅将部分胃黏膜病变归纳为GPL组与对照组进行分析,后续研究将进一步分析不同病理类型胃黏膜病变的危险因素,以提高诊断价值。
综上所述,RDW、PGR、G-17和H.pylori感染史是GPL的独立危险因素,基于这4个变量建立的GPL诊断模型具有较好的区分度和校准度,可以帮助早期识别GPL患者。
