米格列奈-精氨酸复合物的制备与评价
2023-06-17王苗苗李航航贾丽丽吴丽欣杨文智
王苗苗,李航航,贾丽丽,吴丽欣,杨文智
(1.保定市第一中心医院 药剂科,河北 保定 071000;2.河北大学 药学院,河北 保定 071002)
米格列奈钙(MTG,图1a)是治疗Ⅱ型糖尿病药物,其通过抑制胰腺β细胞的KATP通道来刺激胰岛素分泌,可有效降低糖尿病病人的血糖水平,其促胰岛素作用比那格列奈强[1].但MTG是疏水性药物,市售MTG多为片剂,其溶液剂开发因其水中溶解度低而受限.助溶技术是一种简单、易行的改善难溶药物溶解度的方法,良好的助溶剂可与难溶药物生成可溶性络合物、复盐和缔合物,从而改善药物的溶解度和生物利用度.课题组曾将瑞格列奈-精氨酸复合物分散于聚乙二醇基质,采用助溶和固体分散技术,制备瑞格列奈滴丸,实现难溶瑞格列奈药物溶解度提高和药物体内生物利用度的改善[2].精氨酸(Arg,图1b)是一种人体非必需氨基酸,可与难溶药物相互作用,起到增加药物溶解度的功能[3-4].Rami等[5]制备无定形布洛芬-精氨酸和吲哚美辛-精氨酸复合物,与纯药物相比,溶解度得到改善.疏水性药物辛伐他汀和咖啡酸用精氨酸作为助溶剂,溶解度和生物利用度均得到提高且增强了药物的稳定性[6-7].精氨酸助溶难溶药物,制备方法简单易行,可实现大规模工业化生产.因此,难溶药物分子含有羰基或羧基且pKa偏酸或中性,采用精氨酸助溶易成功.此外,助溶或固体分散技术,均可实现难溶药物高度分散在载体分子中,获得改善药物溶解度和生物利用度的结果.但二者根本区别在于,助溶强调助溶剂与药物分子间形成复盐、分子缔合物或络合物;而固体分散强调在熔融骤冷下,制备所得分散体中药物分子均匀分散在易溶的载体中且分子由稳定晶态变为无定型态.本研究采用碱性的精氨酸小分子与酸性米格列奈药物形成复盐或络合物,采用助溶技术来探索制备酸性的米格列奈-精氨酸(MTG-Arg)复合物最佳条件,获得MTG-Arg复合物并制备其溶液剂,对MTG-Arg复合物的稳定性、药物体外溶出、大鼠体内药代动力学和糖尿病小鼠降糖作用进行考察,探讨采用精氨酸助溶剂制备MTG-Arg复合物溶液剂的可行性.

图1 米格列奈钙(a)和精氨酸(b)分子结构式Fig.1 Molecule structure of MTG (a) and Arg (b)
1 实验部分
1.1 仪器与试剂
LGJ-18冷冻干燥机(北京松源华兴发展有限公司);T6型紫外可见分光光度计(北京普析通用仪器有限公司);D8 ADVACE型X线粉末衍射仪(Bruker,德国);差式扫描量热仪(DSC-60Plus, Shimadzu, 日本);LC3000型高效液相色谱仪(北京创新通恒科技有限公司);三诺安淮血糖测试仪.
米格列奈钙(武汉远程科技发展有限公司);精氨酸(国药集团化学试剂有限公司);其余试剂均为分析纯.
Wistar大鼠(150~200 g)和BALB/c小鼠(18~20 g)由河北省实验动物中心提供(合格证号:1807012).
1.2 实验方法
1.2.1 米格列奈钙-精氨酸复合物的制备
采用紫外-可见分光光度法测定药物含量,在190 ~ 400 nm波长处扫描,确定米格列奈钙的最大检测波长.精密称取米格列奈钙原料药10 mg,配制成0.5 mg/mL贮备液,并将其稀释至0.1、0.5、1、2、5、10、15和20 μg/mL溶液,在最大检测波长处测定各质量浓度的吸光度,以质量浓度(μg/mL)-吸光度建立标准曲线.
采用单因素实验优化MTG-Arg制备工艺,分别考察质量比m(MTG)∶m(Arg) = 4∶1、3∶1、2∶1、1∶1、2∶3、1∶2、1∶3、1∶4、1∶5和1∶6、温度(30、40、50、60、70和80 ℃)和pH(5、6、7、8、9和10)对药物含量的影响.精密称取米格列奈钙5 mg,加蒸馏水5 mL,随后加入不同质量的精氨酸,调节不同的pH值,在一定温度下水浴1 h.离心吸取上清液,采用紫外分光光度法测定药物含量.
采用Job’s plot实验进一步确定米格列奈钙与精氨酸的结合比.固定MTG与Arg的浓度之和为10-5mol/L,配制两者物质的量比为0.1至0.9依次增大的溶液,混合后置于37 ℃避光的气浴恒温振荡器1 h.3 500 r/min离心10 min,取上清液,在210 nm处测定样品吸光度A,以ΔA和药物含量对比系数r作图,其中ΔA为加入精氨酸与不加精氨酸时吸收度之差,r=c(MTG)/[c(MTG)+c(Arg)][8].
在获得最佳制备条件下,将MTG-Arg澄清溶液冻干后得到MTG-Arg复合物粉末.
1.2.2 MTG-Arg复合物的表征
测定MTG、Arg、MTG-Arg复合物和m(MTG)∶m(Arg)=2∶3的物理混合物样品X线衍射,Cu-Ka靶,扫描2θ为5~80°,λ=1.54 nm;称取各样品3~5 mg置于坩埚中进行DSC分析,在20 mL/min的氮气流下,以10 ℃/min的升温速率,在50 ~ 300 ℃,测得DSC图谱.
1.2.3 MTG-Arg复合物的稳定性考察
按照中国药典方法,对MTG-Arg复合物进行稳定性考察.称取MTG-Arg复合物粉末适量,置于称量瓶中,将样品平铺,厚度≤5 mm,分别置于湿度75%,温度60 ℃或光照强度(4 500 ± 500) lx条件下的药品稳定性仪中,于0、5和10 d,采用高效液相色谱法(HPLC),Hypersil BDS C18色谱柱(4.6 mm×250 mm,5 μm),室温210 nm,波长20 μL进样,乙腈-水(V(乙腈)∶V(水)=55∶45,pH 2.4)为流动相,1 mL/min流速,测定样品药物含量.
1.2.4 MTG-Arg复合物的体外释放
称取MTG原药和MTG-Arg复合物,分别置于3 000 u透析袋中,采用透析法测定体外累积释放.将透析袋置于20 mL磷酸盐缓冲溶液(PBS)中,调节pH值为1.2或7.4,在37 ℃、100 r/min的气浴恒温振荡器中震荡.在0.083、0.25、0.5、1、1.5、2、3、4、6、8、12、24、36和48 h取出全部释放液,加入同体积相同的PBS溶液,紫外-可见分光光度法测定各时间点药物含量,依公式(1)计算药物累积释放率(Q).
(1)
其中,ρn:在Tn时间点时样品的质量浓度,μg/mL;V:释放介质总体积,mL;Vi:在Ti时间点时释放介质的体积,mL;ρi:在Ti时间点时样品的质量浓度,μg/mL;W0:复合物中药物的质量.
1.2.5 大鼠药代动力学考察
取9只健康雌性Wistar大鼠,实验前12 h禁食不禁水,随机分为3组,分别灌胃给予MTG混悬液、灌胃MTG-Arg复合物溶液和尾静脉注射MTG-Arg复合物溶液,剂量均为20 mg/kg的米格列奈钙.在0.083、0.25、0.5、1、2、3、4、6、8、12、24、36、48 h眼眶取血0.5 mL,置于装有肝素的EP管中,12 000 r/min离心10 min,取上清液200 μL置于EP管中,加入0.6 mL萃取剂V(甲醇)∶V(三氯甲烷)=1∶4,涡旋震荡5 min,12 000 r/min离心10 min,0.22 μm微孔滤膜过滤,滤液氮气吹干,流动相复溶,离心后取20 μL进样,HPLC法测定米格列奈钙的血药浓度.
建立血样中米格列奈钙标准曲线.精密称取米格列奈钙10 mg,配制成1 mg/mL的贮备液,并将其稀释成质量浓度为500、250、100、50、10、1、0.1 μg/mL的标准溶液.精密量取标准溶液20 μL,加入大鼠血浆样品180 μL,按照上述方法处理样品,HPLC法测定药物质量浓度.以质量浓度-峰面积做图,得标准曲线,并考察方法的加样回收率、日间及日内精密度.
1.2.6 糖尿病小鼠模型的建立及MTG-Arg复合物降糖作用考察
雌雄各半的BALB/c小鼠正常饲养1周,建模前禁食12 h,腹腔注射180 mg/kg的四氧嘧啶生理盐水溶液[9],于第3天和7天测定禁食12 h的小鼠血糖,血糖值大于14.5 mmol/L,出现典型的多食和体重减轻症状,视为糖尿病小鼠建模成功[10].造模成功的糖尿病小鼠随机分成3组,每组4只,采用灌胃给药方式考察MTG-Arg溶液剂的降糖作用,设定1、2和4 mg/kg MTG-Arg复合物溶液的低、中和高剂量组.灌胃给药后,在0.5、1、1.5、2、3、4、6、8、10、12和24 h小鼠尾端取血,血糖仪测量小鼠血糖值.
2 结果与讨论
2.1 MTG-Arg复合物的制备
在190 ~ 400 nm对米格列奈钙与精氨酸溶液进行波长扫描,确定米格列奈钙最大检测波长为210 nm,且精氨酸在此无干扰.米格列奈钙溶液的标准曲线方程为y=0.041 16x+0.006 69,在0.1~20 μg/mL线性关系良好(R2= 0.999 5).
精氨酸用量对米格列奈钙溶解度的影响,见图2a,随助溶剂精氨酸增多,米格列奈钙的溶解度先增后降,当米格列奈钙与精氨酸的质量比为2∶3时,米格列奈钙的溶解度达到最大值.米格列奈钙是弱酸性药物,分子结构中的酮羰基可作氢键受体,精氨酸属于碱性氨基酸,它具有多电子中心,随精氨酸增加,米格列奈钙溶解度增大,推测米格列奈钙与精氨酸间可形成分子间氢键,但米格列奈钙与精氨酸的质量比超过2∶3,精氨酸助溶米格列奈钙达饱和,再增加精氨酸,过量精氨酸发生自聚集,反而阻碍米格列奈钙的溶解[11-13].采用Job’s plot实验进一步确定米格列奈钙与精氨酸结合比,如图2b所示,当γ= 0.12,即米格列奈钙与精氨酸的物质的量比为1∶6时,米格列奈钙的溶解度达到最大,此结果与米格列奈钙和精氨酸2∶3质量比一致.图2c为温度对米格列奈钙溶解度影响,温度升高,利于精氨酸助溶米格列奈钙,在70 ℃达到最佳效果.图2d为pH对米格列奈钙溶解度影响,偏碱性pH利于提升米格列奈钙溶解度,考虑到人体适宜pH,选择pH 7为其制备条件.因此,经单因素实验获得制备MTG-Arg复合物最佳条件:MTG与Arg的质量比为2∶3,溶液pH值为7,反应温度为70 ℃.制备澄清溶液后冻干,获得MTG-Arg复合物粉末.

a.质量比;b.Job’s plot物质的量比;c.温度;d.pH图2 制备MTG-Arg复合物的单因素考察Fig.2 Preparation of MTG-Arg complex using single factor experiment
2.2 MTG-Arg复合物的XRD和DSC表征
图3A是XRD检测图谱,米格列奈钙(图3Aa)的特征晶体衍射峰出现在5.1、5.9、14.7、17.4、21.1°,精氨酸(图3Ab)的特征晶体衍射峰出现在10.9、16.9、18.4、19.3、23.1、27.4°[14].其物理混合图谱(图3Ac),两者各自的特征衍射峰存在,而MTG-Arg复合物(图3Ad)中两者的晶体峰消失,说明生成的MTG-Arg复合物使MTG和Arg均由结晶态转变为无定形态.图3B是DSC检测图谱,米格列奈钙(图3Ba)结构中含有2个结晶水,102 ℃出现水分蒸发吸热峰,224 ℃是MTG的吸热熔融峰,表明药物呈结晶态[15].精氨酸(图3Bb)分别在218.8 ℃和242.6 ℃出现2个吸热峰,219 ℃处为熔融峰,243 ℃为精氨酸完全分解[14].在两者的物理混合物(图3Bc)中,吸热熔融峰偏移至217 ℃和239 ℃,混合物以晶态存在.而MTG-Arg复合物(图3Bd)未见明显吸热峰,证明复合物以无定态存在.
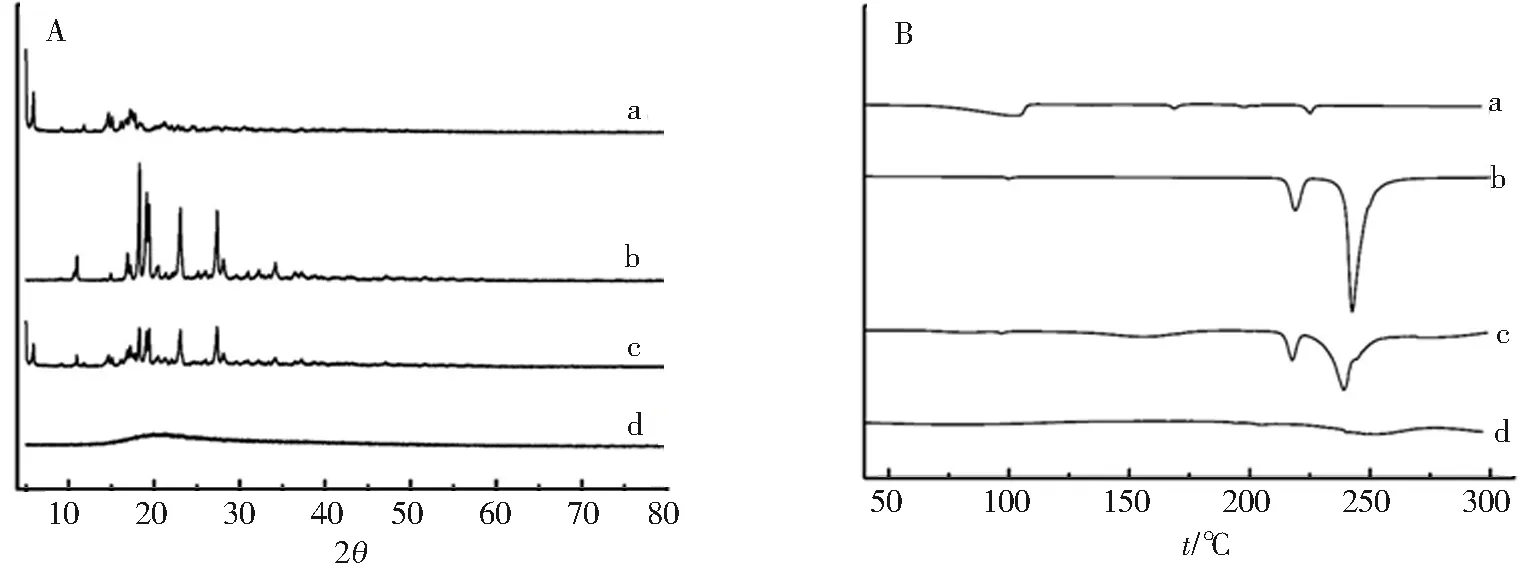
a.米格列奈钙;b.精氨酸;c.a和b的物理混合物(2∶3);d.MTG-Arg复合物图3 X线粉末衍射(A)与差示扫描量热图谱(B)Fig.3 X-ray powder diffractions (A) and DSC therograms (B)
2.3 MTG-Arg复合物的稳定性
药物稳定性是评价药物质量的一项重要标准.分别测定MTG-Arg复合物在RH 75%高湿、60 ℃高温和(4 500±500)lx强光照射下,米格列奈钙含量变化,结果如表1所示.5 d内药物质量分数均高于98%,10 d的药物质量分数均高于95%,表明MTG-Arg复合物具备良好稳定性.此外,采用HPLC测定MTG-Arg复合物杂质,图谱中除米格列奈钙峰外,未见其他杂质峰.

表1 MTG-Arg复合物稳定性评价
2.4 MTG-Arg复合物的体外释放
图4为MTG-Arg复合物和MTG原料药在模拟胃液和正常体液pH中的药物累积释放曲线.米格列奈钙原药在pH为1.2和7.4下的药物累积释放量均小于MTG-Arg复合物,证明MTG与Arg形成药物的无定态,可加速药物溶出.如图4所示,在pH 7.4释放液中,MTG-Arg复合物12 h的药物累积释放率接近100%,而MTG在48 h累积释放率32%;在pH为1.2释放介质中,MTG-Arg复合物的药物累积释放同样优于MTG.释放介质的pH增高,利于MTG-Arg复合物中药物溶出,这与单因素实验考察pH对MTG-Arg复合物的溶解度影响结果相符.

a.pH 1.2;b.pH 7.4图4 MTG-Arg复合物和MTG在37 ℃下的累积释放曲线Fig.4 Cumulative drug release curve of MTG-Arg complex and MTG at 37 ℃
2.5 大鼠体内药代动力学与糖尿病小鼠治疗评价
采用HPLC法测定血样,血样中米格列奈钙不受空白血浆的干扰,方法专属性良好,日内和日间精密度RSD值分别为2.57%和6.74%,加样回收率为96.4%~104.8%.米格列奈钙出峰时间在7.9 min,标准曲线方程为y=254 543x+3.33×106,药物质量浓度在0.01~50 μg/mL线性关系良好(R2=0.997).如图5a和表2所示,与MTG混悬剂相比(8.23 ± 0.95) mg/L,灌胃MTG-Arg溶液剂(14.76 ± 1.10) mg/L的最大血药质量浓度提高约1.8倍,尾静脉注射MTG-Arg溶液剂(18.72 ± 1.39) mg/L提高2.3倍.灌胃MTG-Arg复合物溶液的药时曲线下面积(AUC)相比MTG混悬剂增大3.2倍,表明MTG-Arg复合物制备可促进药物体内吸收.灌胃MTG-Arg复合物溶液的AUCi.g.值为(91.11 ± 9.23) (mg·h)/L,但尾静脉注射MTG-Arg溶液的大鼠AUCi.v.值为(116.80±9.11) (mg·h)/L,根据公式2可得,MTG混悬剂和MTG-Arg复合物溶液剂相比大鼠尾静脉注射MTG-Arg溶液剂的绝对生物利用度(F)分别为25%和78%.式(2)中,Dosei.v.表示尾静脉给药剂量;Dosei.g.表示灌喂给药剂量.

表2 米格列奈钙混悬液和MTG-Arg复合物溶液的大鼠体内药代动力学参数(n=3)

图5 大鼠药代动力学曲线(a)及糖尿病小鼠灌胃MTG-Arg溶液剂的降糖效果(b)Fig.5 Pharmacokinetic curve of Wistar rats (a) and treatment of diabetic mice by MTG-Arg complex solution (b)
(2)
为了评价MTG-Arg复合物溶液剂的降血糖效果,选取糖尿病造模组小鼠,灌胃给予4、2、1 mg/kg高、中、低不同剂量,降糖结果如图5b所示.灌胃MTG-Arg复合物溶液3种不同剂量,均有降血糖作用.中、低剂量组小鼠在1~1.5 h血糖略有上升,随后下降;而高剂量组给药小鼠,血糖呈下降趋势,6 h后血糖低于14.5 mmol/L且维持至24 h.
3 结论
选择精氨酸作为难溶米格列奈钙药物助溶剂,成功自制MTG-Arg复合物.XRD和DSC结果显示,MTG-Arg复合物中药物以无定形态分散.MTG-Arg复合物稳定性良好,体外释放显示复合物更利于药物溶出.大鼠灌胃MTG-Arg复合物溶液的药代动力学参数显示,体内吸收优于原药.而糖尿病小鼠灌胃MTG-Arg复合物溶液,可有效降血糖.因此,采用助溶技术制备MTG-Arg复合物,可充分保证MTG无定形态存在,能促进药物溶出,改善难溶药物体内生物利用度.此实验结果可为米格列奈溶液剂的开发提供必要实验数据支持.
