慢性肾脏病患者心血管钙化评估方法的研究进展
2023-06-16李贤慧姚翠微
李贤慧,姚翠微
(广东医科大学附属医院肾脏疾病研究所,广东 湛江 524001)
慢性肾脏病(CKD)是一种持续超过3 个月的进行性不可逆的肾功能丧失,可根据残余肾功能的程度和估计的肾小球滤过率(eGFR) 分为五个阶段(CKD1-CKD5)。血管钙化(VC)是一个复杂的、多因素的生物过程,众多分子通过各种信号通路和靶点参与介导。血管钙化评分对CKD 患者的死亡率具有预测作用。临床上可以使用各种成像方式检测血管钙化,例如X片、CT 及超声检查等方式。本文对慢性肾脏病患者的心血管钙化评估方法进行综述,旨在为今后慢性肾脏病患者的心血管疾病管理提供重要信息。
1 计算机断层扫描(CT)
1.1 冠状动脉钙化评分(CACS)
电子束CT 和多层螺旋CT 是经过充分验证的无创成像方式,一直以来都被认为是检测冠状动脉钙化的金标准。Agatston 积分、容积积分和质量积分均为临床上通过CT 测量来量化冠状动脉钙化时常用的积分工具。Agatston 积分是目前最常用的钙化积分,它是针对每个斑块计算得出的。容积积分和质量积分虽然更具可重复性,但对斑块的钙含量不太敏感[1]。Agatston 积分将钙化病变的阈值设置为面积≥1 mm2、CT 值>130 HU 的斑块定义为钙化斑块。将钙化斑块的CT 值分为四个等级,130 ~199 HU为1 分,200 ~299 HU 为2 分,300 ~399 HU 为3分,≥400 HU 为4 分。根据钙化区域的面积与钙化斑块CT 值的乘积可以计算出钙化区域的积分。通过将所有区域的钙化积分相加,可确定总冠状动脉钙化积分(即CACS)[2]。根据CACS 可将稳定缺血性心脏病患者冠状动脉血运重建的风险分为以下等级:CACS >400 分 为 高 风 险;CACS 为100 ~400 分 为中等风险;CACS <100 分为低风险。Xiang 等[3]的研究显示,CAC 评分>400 分的CKD 患者其全因死亡和心血管住院风险高于CAC 评分较低的患者。使用心脏计算机断层扫描确定的CACS 有助于心血管风险评估,从而有助于临床决策。但是,CT 检测价格昂贵、射线剂量大等因素限制了其广泛使用。
1.2 腹主动脉钙化指数(ACI)
腹主动脉钙化指数(ACI)是使用CT 对腹主动脉钙化进行量化的评估方法,即计算腹主动脉钙化横切面的周长比例。具体评估方法为患者处于仰卧位,使用CT 对患者进行从头到脚方向的扫描,获得5 mm层厚的图像,若面积≥1 mm2且CT 值≥130 HU,定义为存在腹主动脉钙化,计算从肾动脉延伸到腹主动脉分叉处以及进入髂总动脉主动脉段的钙化评分。每个切片上的腹主动脉横截面被径向分为12 段,ACI =(所有切片钙化总分)/12×1/(切片数)×100(%)[4]。相关研究提示ACI 与血液透析患者发生的心脑血管疾病密切相关[5]。
1.3 3D-CT 成像
有研究提示,即使两名患者的钙化评分相当,其心血管疾病和死亡的发生风险也可能因血管钙化的形态而存在差异[6]。CACS 和ACI 无法准确评估血管钙化的形态。研究发现可以通过3D-CT 成像的方法对血管钙化的体积和位置进行评估。Fujii 等[7]使用3D可视化和量化方法的研究表明,与没有糖尿病的患者相比,患有糖尿病的终末期肾病患者腹主动脉中的主动脉钙化更严重且发生频率更高。
2 正电子发射断层扫描(PET)在血管钙化中的应用
在大多数非侵入性成像中无法检测到直径小于50 μm 的微钙化的情况下,PET 作为一种新技术应运而生,PET 可用于识别血管钙化,尤其是微钙化,具有广阔的临床市场。它主要有两种识别方式,一是直接检测钙化,另一种是通过反映与血管斑块相关的其他因素,如炎症,间接识别钙化[8]。PET 的出现,特别是与CT 相结合,在血管钙化的临床鉴别方面取得了重大进展。更重要的是,许多新技术的引入有利于血管钙化的识别,如Micro-PET/CT、PET/MRI 和AI的使用[8]。通过使用这种无创成像技术,可以评估药物在抑制斑块内炎症和钙化过程中的疗效,并预测斑块的发展趋势,以及未来的心血管疾病风险。
3 X 线
X 线应用广泛、无创、费用相对低廉,可用于快速评估主动脉弓、腹主动脉、髂动脉、股动脉等血管的钙化程度。与CT 相比,X 线具有费用低廉和辐射暴露较少的优势,但缺乏CT 的定量准确性。
3.1 主动脉弓钙化评分(AoAC)
胸部X 线是CKD 患者一种常用的非侵入性且费用相对较低的检查,通过胸部X 线评估的AoAC 是一种半定量的钙化评估方法。Ogawa 等[9]开发的AoAC钙化评估方法主要是通过特定标尺在胸部正位片上进行评估,该标尺将主动脉弓分为16 个圆周,将标尺附着在胸部X 线图像的主动脉弓上,记录存在钙化的象限数目,以此计算AoAC 分数。AoAC 分数= 钙化象限数/16×100%,以百分数表示结果。Iijima 等[10]将主动脉弓的钙化程度分级如下:0 级,无可见钙化;1 级,小斑点或单个薄区域钙化;2 级,一处或多处厚钙化;3 级,环向钙化。主动脉弓评分与腹透患者的全因死亡和心血管死亡独立相关[11]。
3.2 腹主动脉钙化评分(AACS)
腹主动脉钙化评分(AACS)是Kauppila 等[12]通过腹部侧位片对腹主动脉钙化进行的半定量评估方法,其主要是评估腰椎侧位片各腰椎节段(L1- L4) 对应动脉的钙化程度,各节段对应前壁和后壁的钙化范围<1/3 计1 分,为1/3 ~2/3 计2 分,>2/3 计3分,主动脉前壁和后壁各节段评分之和为24 分。根据CORD 的研究方法,通过钙化评分评估钙化严重程度的标准是:AAC 评分≤4 分为无钙化或轻微钙化;5 ~15 分为中度钙化;≥16 分为重度钙化。2017 年改善全球结局(KDIGO)指南建议使用腹部侧位片来检测CKD 3 ~5 期患者是否存在血管钙化。AACS 已被证明是CKD 患者心血管事件的独立预测因子[13]。
3.3 骨盆和手X 线检查中的血管钙化评分
在骨盆和双手X 线检查中进行血管钙化评分,主要是将骨盆平片通过两条假想线(分别为两个股骨头上限上方的水平线和脊柱上方的中位垂直线)进行区域划分,而双手平片则通过掌骨上限的水平线进行区域划分。每个部分中存在的线性钙化被计为1 分,其不存在为0 分。最终得分是所有部分钙化评分的总和,范围为0 ~8 分。通过骨盆平片评估髂动脉和股动脉钙化,双手正位片评估桡动脉及指间动脉钙化,最终钙化分数仅考虑线性钙化(有或没有斑块状钙化),在该评分中未考虑可能与内膜钙化相关的斑片状分离钙化,因为它们可能与其他类型的血管外钙化(例如静脉石)混淆[14]。基于骨盆平片和手正位片的血管钙化评分是评估血透患者心血管风险的简单工具。
4 超声检查
4.1 心脏瓣膜钙化——超声心动图得出的钙化评分(eCS)
超声心动图技术可以有效地检测心脏瓣膜钙化,它的优势显而易见:操作简便、重复性高、非侵入性,而且费用低廉,与CT 相比,超声心动图是一种更容易获得结果且无放射性的检查方式,可以系统地评估心脏钙化和心血管风险。2017 年KDIGO 指南建议将瓣膜钙化评估作为透析患者心血管风险分层的一种手段,并建议将超声心动图作为检测钙化的工具。Nucifora 等[15]开发了通过超声心动图评估的半定量心脏总钙评分,该评分利用经胸超声心动图评估4 个心脏部位的钙化严重程度,即乳头肌、二尖瓣环、主动脉瓣和升主动脉(见表1)。二尖瓣环钙化是位于房室沟与二尖瓣后叶交界处清晰回声区域的钙化,可通过在胸骨旁长轴视图中测量其前后直径来评估其大小,升主动脉钙化是胸骨旁长轴切面中主动脉根部回声增强或增厚的局灶性或弥漫性区域的钙化,主动脉瓣硬化或钙化是指在胸骨旁长轴切面测量的受累最严重的主动脉瓣叶回声增强或增厚,乳头肌钙化是指在任何视图中涉及一个或两个乳头肌的明确回声点。eCS 在预测需要无创评估的多中心患者群体的预后中可显示出显著的价值。
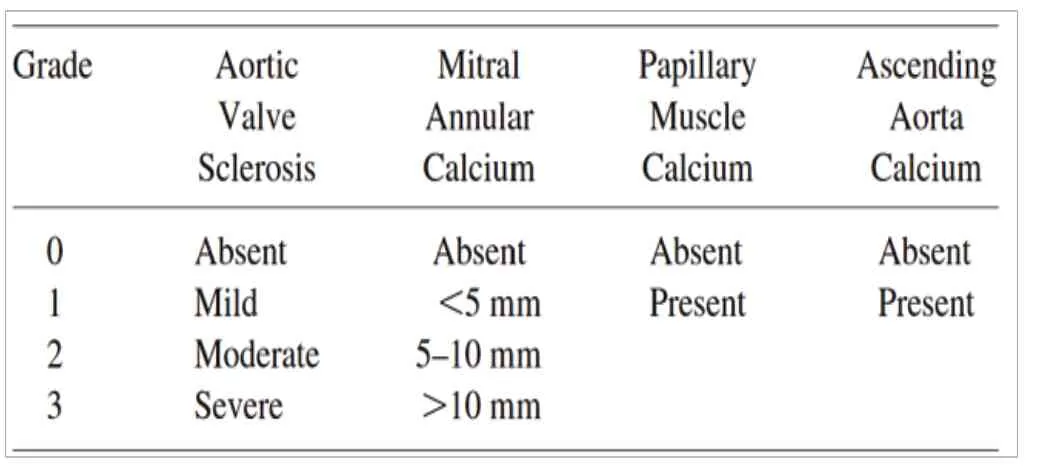
表1 超声心动图钙化评分表[15]
4.2 颈动脉超声检查——颈动脉内膜中层厚度(IMT)
颈动脉内膜中层厚度是广泛性动脉粥样硬化的评价指标[16]。IMT 测量方法:在颈动脉分叉处近心端 1.0 ~1.5 cm 处,避开颈动脉斑块,测量内膜前缘到外膜前缘的垂直距离。颈动脉IMT ≥1.0 mm 或分叉处IMT ≥1.2 mm 为内- 中膜增厚;当IMT 局限性≥1.5 mm,可定义为动脉粥样硬化斑块形成[17]。颈动脉内膜中层厚度是心血管疾病发病率和致死率的强大且独立的预测因子,应被视为慢性肾病患者心血管风险分层有价值的工具[18]。
4.3 新型基于彩色多普勒超声(DUS)的血管钙化评分(CALCS)
通过DUS 可在11 个血管节段(颈总动脉、股动脉、腘动脉、胫后动脉、胫前动脉和腹主动脉等)中测量血管钙化的存在和等级。定义为纵向扫描中厚度<0.5 mm 的单个内膜或内侧钙化(微钙化)计1 分,同一血管节段超过1 个微钙化计2 分,任何钙化厚度≥0.5 mm 的计3 分(大钙化)。每个血管段的最终分数总和为CALCS,范围从0 到33 分[19]。CALCS 的评分简单、易于执行,并且是非侵入性的、可重复的。在评估外周血管钙负荷时,CALCS 可能是传统冠状动脉钙化评分的可靠替代方案。
5 脉搏波速度
脉搏波速度(PWV)是目前检测动脉僵硬度最经典的指标[20]。PWV 是通过两个间隔动脉之间距离和经过时间计算出的速度,表示为动脉长度(米)除以通过时间(秒)。PWV 包括反映大弹性动脉僵硬度的颈- 股PWV 及反映中等肌性动脉僵硬度的颈- 桡PWV,最常用的是颈动脉和股动脉之间的PWV。相关研究提示颈- 股动脉脉搏波速度升高是 CKD 3 ~5期非糖尿病非透析患者发生心脑血管死亡及全因死亡的独立危险因素[21]。CKD 患者的预后与PWV 的关系在未来仍需要进一步研究。
6 冠状动脉磁共振血管造影(CMRA)
冠脉CTA 是临床上评估冠状动脉疾病的常用方法,但其具有使用碘造影剂的缺点,在慢性肾脏病患者群体中应用受限。CMRA 是一种新型的心血管系统磁共振影像学技术,其具有无创、安全、图像分辨率高、不使用碘造影剂、不使用电离辐射等优点,可用于检测冠状动脉狭窄和高风险冠状动脉斑块[22]。但它费用昂贵,在冠状动脉疾病检查中的具体效用目前尚未明确,需要进行更多的研究,以评估这种新兴且有前途的成像技术。
总之,心血管钙化可以通过多种技术进行检测。CT 扫描是金标准,可以对钙化的严重程度进行准确和客观的分析。X 线检查操作简单且结果容易获得,费用相对低廉。超声检查具有安全无放射性、非侵入性等优点。另外,还有一些其他评估钙化的新方式,如磁共振成像等。综上所述,这些技术应用于慢性肾脏病患者的心血管钙化评估中均有其优点及缺点。心血管钙化是慢性肾脏病患者的常见并发症,也是心血管疾病发展公认的危险因素,是决定慢性肾脏病患者预后的重要因素。心血管钙化的早期诊断和干预治疗有助于预防慢性肾脏病患者心血管疾病的进展。
