可溶性T细胞免疫球蛋白黏蛋白3、淋巴细胞激活基因3表达水平与子宫内膜癌疾病转归的相关性*
2023-06-14张瑞红张海涛
张瑞红 张海涛
山东省成武县人民医院 1 妇产科 2 病理科 274200
我国子宫内膜癌发病率约为14%,5年生存率约为20%,且呈年轻化趋势,由于早期临床症状不明显导致大部分患者确诊时已发展至晚期[1-2]。目前以手术治疗为主,由于局部复发、转移导致疾病转归不一,因而寻找预测子宫内膜癌疾病转归的潜在标志物有助于改善患者预后。可溶性T细胞免疫球蛋白黏蛋白3(sTim-3)属于免疫抑制分子,可负向调节Th1细胞增殖,抑制肿瘤相关免疫反应,其高表达与多种恶性肿瘤不良预后有关[3]。淋巴细胞激活基因3(LAG-3)属于免疫球蛋白超家族成员,可抑制T细胞增殖、活化,并可能参与宫颈鳞癌等多种肿瘤发生发展过程[4]。目前sTim-3、LAG-3与子宫内膜癌相关研究报道较少。本研究主要观察子宫内膜癌患者血清sTim-3、LAG-3水平变化,分析其与临床病理特征及疾病转归的相关性,旨在为子宫内膜癌免疫治疗提供新思路。
1 资料与方法
1.1 一般资料 选取2019年2月—2021年3月于本院接受手术治疗的52例子宫内膜癌患者为对象,依据术后1年疾病转归情况分为良好组34例、不良组18例。良好组:年龄44~65(54.31±3.26)岁,体质量指数18~26(22.35±1.16)kg/m2,是否绝经:是18例、否16例。不良组:年龄43~63(53.27±3.18)岁,体质量指数18~28(23.01±1.38)kg/m2,是否绝经:是10例、否8例。两组一般资料比较无明显差异(P>0.05),具有可比性。本研究经本院伦理委员会批准。
1.2 纳入与排除标准 纳入标准:符合子宫内膜癌诊断标准[5],且经组织病理学检查确诊;原发性子宫内膜癌;术前经宫颈细胞学检查显示阳性;经阴道镜检查显示无宫颈恶性病变者;接受腹腔镜手术治疗者;术前未接受放化疗或激素治疗者。排除标准:合并严重内外科合并症者;合并其他部位恶性肿瘤者;精神障碍者;合并免疫缺陷疾病者。
1.3 方法
1.3.1 治疗方法。腹腔镜手术治疗:阴道内留置举宫器建立人工气腹,于患者侧下腹置入第2、3套管针,同时探查腹腔,留取腹腔冲洗液(100ml)进行细胞学检查,腹腔镜下切除子宫双附件、盆腔淋巴结,放置引流管,使用生理盐水冲洗盆腹腔,腹腔镜退出,术后予以抗生素治疗。术后1年观察疾病转归情况,其中患者无复发为预后良好;出现复发或死亡为预后不良。
1.3.2 采集血液样本。分别于术前、术后1d、术后1个月采集两组空腹静脉血5ml,4℃条件下经3 000r/min离心(10min)留取血清,储存于-80℃冰箱。
1.3.3 检测血清sTim-3、LAG-3水平。采用ELISA法检测血清sTim-3水平,上海臻科生物科技有限公司提供检测试剂盒。采用双抗体夹心酶联免疫吸附试验检测血清LAG-3水平,杭州齐誉生物科技有限公司提供检测试剂盒。
1.4 观察指标 (1)分析两组术前、术后1 d、术后1个月血清sTim-3、LAG-3水平。(2)分析术前不同临床病理特征患者血清sTim-3、LAG-3水平,其中临床病理特征包括肿瘤大小、临床FIGO分期、组织学分级、分化程度、肌层浸润深度。(3)分析血清各指标(术前)与临床病理特征相关性及其(术后1个月)对疾病转归的预测价值。(4)分析各指标对疾病转归不良发生危险度的影响。

2 结果
2.1 两组血清sTim-3、LAG-3水平比较 与术前比较,术后1d、术后1个月两组血清sTim-3、LAG-3水平降低(P<0.05);与良好组比较,术后1d、术后1个月不良组血清sTim-3、LAG-3水平升高(P<0.05),见表1。

表1 两组血清sTim-3、LAG-3水平比较
2.2 不同临床病理特征患者血清sTim-3、LAG-3水平比较 随着临床FIGO分期升高、组织学分级升高、分化程度降低及发生淋巴结转移,血清sTim-3、LAG-3水平升高(P<0.05),见表2。

表2 不同临床病理特征患者血清sTim-3、LAG-3水平比较
2.3 血清各指标水平与临床病理特征相关性 血清sTim-3、LAG-3水平与临床FIGO分期、组织学分级、淋巴结转移呈正相关(P<0.05),而与分化程度呈负相关(P<0.05),见表3。
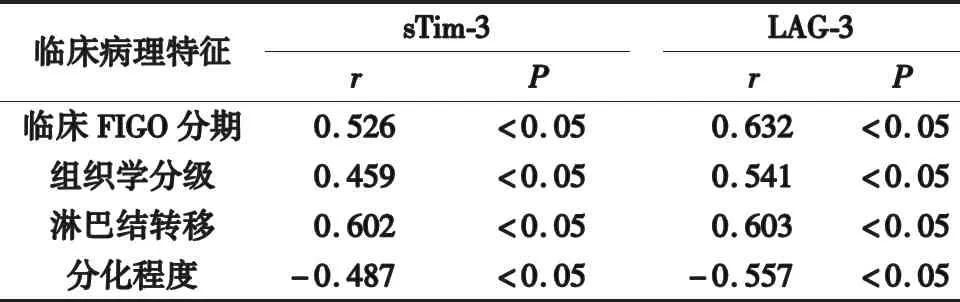
表3 血清各指标水平与临床病理特征相关性
2.4 血清各指标对疾病转归的预测价值 以不良组18例为阳性样本,以良好组34例为阴性样本,绘制ROC曲线,结果显示,术后1个月血清sTim-3、LAG-3水平联合预测疾病转归不良的AUC大于单项预测(P<0.05),见表4。
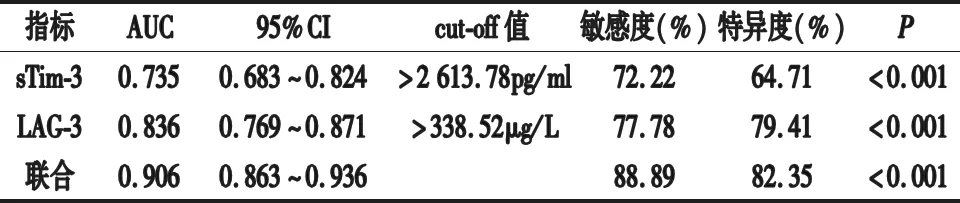
表4 血清各指标对疾病转归的预测价值
2.5 血清各指标不同表达者疾病转归不良的危险度分析 以2.4结果中各指标截断值为分界,患者分为高表达者、低表达者。sTim-3、LAG-3高表达者疾病转归不良的危险度分别是低表达者的1.789倍、1.737倍,见表5。
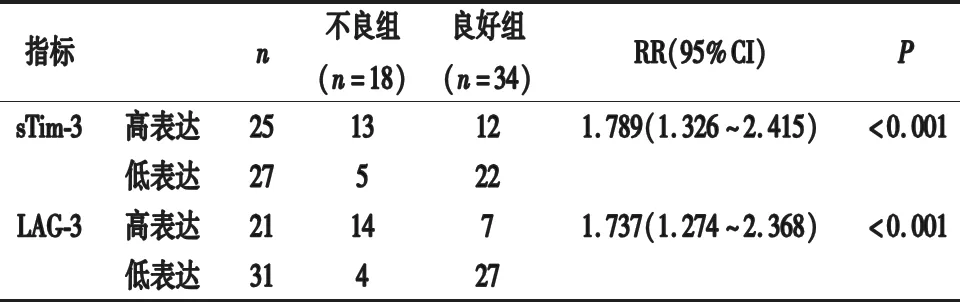
表5 血清各指标不同表达者疾病转归不良的危险度分析
3 讨论
子宫内膜癌发病机制与抑癌基因失活、致癌基因活化、先天性/适应性免疫细胞改变有关,免疫相关因子可参与T细胞、自然杀伤细胞活化及肿瘤免疫耐受过程,同时机体内持续炎性状态可增强肿瘤免疫原性,促使子宫内膜细胞损伤,进一步促进子宫内膜癌发生发展[6]。
Tim-3可调节免疫反应,诱导免疫耐受,介导效应T细胞凋亡,并可促进肿瘤相关巨噬细胞M2极化,阻断自然杀伤细胞功能,还可通过白细胞介素-6(IL-6)自分泌方式,促进肿瘤细胞增殖、迁移及侵袭[7]。Tim-3配体包括半乳凝素-9(Gal-9)、癌胚抗原细胞黏附分子1(CEACAM1)等,Tim-3与配体结合可激活钙—钙蛋白酶—含半胱氨酸的天冬氨酸蛋白水解酶-1(caspase-1)通路,介导效应T细胞凋亡,促进肿瘤细胞免疫逃逸[8]。本研究结果显示,术后不良组血清sTim-3水平高于良好组,表明sTim-3水平变化可反映疾病转归情况。本研究进一步分析发现,随着临床FIGO分期升高、组织学分级升高、分化程度降低及淋巴结转移的发生,血清sTim-3水平明显升高,表明sTim-3可能参与子宫内膜癌发展进程,并可能在一定程度上反映子宫内膜癌细胞增殖、转移情况。其原因可能为:sTim-3可参与子宫内膜癌免疫应答过程,可能通过内源性或外源性途径,介导肿瘤相关炎性因子生成,改变肿瘤炎性微环境,增强肿瘤细胞侵袭性,导致其逃避免疫监视。早期临床试验证实采用免疫抑制因子抑制剂可抑制肿瘤转移,治疗后监测免疫抑制因子水平对评价机体免疫功能及治疗效果具有重要意义[9]。Chen等[10]的研究报道显示,血清sTim-3水平升高可能作为预测术后复发的潜在指标。本研究结果显示,血清sTim-3水平预测子宫内膜癌疾病转归不良的AUC为0.735,提示sTim-3对子宫内膜癌疾病转归不良具有一定预测价值,但仍需结合其他指标共同预测,以此提高预测效能。
LAG-3可抑制T细胞增殖及其相关细胞因子表达,负向调节T细胞功能,参与肿瘤免疫逃逸过程,并可激活一系列信号通路,抑制免疫细胞活化及分泌抗体[11]。LAG-3与肿瘤临床病理特征相关,可在一定程度上影响肿瘤发生发展[12]。本研究结果显示,术后不良组血清LAG-3水平高于良好组,有淋巴结转移、较低分化程度者LAG-3水平分别高于无淋巴结转移、较高分化程度者,且临床FIGO分期、组织学分级越高,LAG-3水平越高,这与王聪等[13]研究结果相似。提示LAG-3高表达与子宫内膜癌发生、浸润等一系列过程密切相关。但吴玲等[14]发现,LAG-3水平与淋巴结转移、TNM分期呈负相关。本研究结果显示血清LAG-3水平与临床FIGO分期、组织学分级、淋巴结转移呈正相关,而与分化程度呈负相关,与上述研究结果不一致[14]。原因可能为:不同类型肿瘤患者体内免疫微环境不同,选取检测诊断方法不同,此外,LAG-3对肿瘤的作用机制可能存在双向作用。同时本研究发现血清sTim-3、LAG-3联合预测疾病转归不良的AUC大于单项预测,提示联合检测血清sTim-3、LAG-3水平可提高子宫内膜癌疾病转归的预测效能。
综上所述,子宫内膜癌患者血清sTim-3、LAG-3水平升高,且与临床病理特征密切相关,其联合预测对子宫内膜癌疾病转归不良具有一定预测价值,可为临床对子宫内膜癌患者转归结局预测提供可靠依据。
