纤溶酶原激活物抑制物-1在哮喘小鼠气道炎症反应中的作用*
2023-06-14杜春玲
周 霞 杜春玲
复旦大学附属中山医院青浦分院呼吸与危重症医学科,上海市 201700
支气管哮喘(以下简称哮喘)是由嗜酸性粒细胞、肥大细胞和T细胞等多种炎性细胞参与的气道慢性炎症性疾病。纤溶酶原激活物抑制物-1(Plasminogen activator inhibitor 1,PAI-1)是纤维蛋白溶解系统的主要抑制剂,通过抑制纤溶酶原激活物对纤溶酶原的激活,抑制细胞外基质成分降解,促进细胞外基质成分过多沉积,从而在组织重塑中发挥重要作用;PAI-1还可调节细胞黏附、运动和细胞因子水平,在机体免疫、炎症控制及细胞内信号转导等方面具有重要作用[1-2]。目前有关PAI-1在哮喘炎症反应中的作用研究甚少,本实验通过PAI-1基因敲除(PAI-1-/-)小鼠制备哮喘模型,旨在探讨PAI-1在哮喘炎症反应中的作用。
1 材料与方法
1.1 实验动物及分组 野生型BALB/C小鼠,购于上海斯莱克实验动物有限责任公司。来源于BALB/C背景的PAI-1基因敲除小鼠为复旦大学呼吸病研究所繁育的稳定种群。鼠龄6~8周, 饲养于复旦大学医学院SPF级动物室。将野生型和基因敲除小鼠随机分为野生型对照组(NS/WT 组)、基因敲除对照组(NS/PAI-1-/-组)、野生型哮喘组 (OVA/WT组)和基因敲除哮喘组(OVA/PAI-1-/-组),每组8只。动物饲养及实验方案均严格按照复旦大学动物伦理委员会动物实验规范执行。
1.2 主要药物和试剂 卵白蛋白、氢氧化铝购于美国Sigma公司;生理盐水购于上海百特医疗用品有限公司;磷酸盐缓冲溶液(PBS)购于吉诺生物医药有限公司;CD68单克隆抗体和免疫组化试剂盒购于北京中杉金桥生物技术有限公司。小鼠Magnetic LuminexAssays (IL-4、IL-13、IL-10、IL-2、INF-γ),购于美国Life Technologies;戊巴比妥钠购于德国默克公司。
1.3 主要仪器 压缩式雾化器,型号:AG CLASSIC,购于飞利浦公司;全自动动物血细胞分析仪,型号:ProCyte Dx,购于美国IDEX公司;高通量多元生物医学应用软件MILLIPLEX Analyst,购于美国密理博公司;小动物肺功能检测分析仪,型号:FinePointeTM NAM,购于美国Buxco公司。
1.4 动物模型复制[3]哮喘组均于第0天和第7天小鼠腹腔内注射致敏液(0.1mg OVA+2mg氢氧化铝溶于0.1ml生理盐水),第14天将小鼠置于自制透明密闭容器中40cm×30cm×20cm,用1% OVA溶液进行雾化吸入,1次/d,30min/次,连续7d。对照组则均使用生理盐水腹腔注射,生理盐水雾化吸入。最后1次激发后24h,用小动物肺功能仪检测气道反应性,以PBS、不同浓度的乙酰甲胆碱溶液(3.125、6.25、12.5、25、50mg/ml)进行支气管激发,观察不同浓度乙酰甲胆碱激发下特殊气道阻力(specific airway resistance,sRaw)值的变化。
1.5 取材 腹腔注射1.5%戊巴比妥钠60mg/kg麻醉,眼球取血后开胸,气管插管并固定,使用1 ml注射器以无菌PBS行双肺肺泡灌洗,回收率>80%,肺泡灌洗液(BALF)进行细胞分类计数。全血于3 000r/min,4℃,离心10min,取上清于-80℃冻存。
1.6 肺组织HE染色和CD68免疫组化染色 未灌洗过的肺组织放入缓冲中性福尔马林液,固定48h后常规石蜡包埋切片、HE染色;免疫组化检测肺组织巨噬细胞数量,阳性反应为细胞质呈棕褐色。

2 结果
2.1 肺功能检测 OVA/WT组小鼠sRaw值在乙酰甲胆碱浓度为6.25、12.5和25mg/ml时显著高于NS/WT组,表明哮喘模型构建成功。见表1。
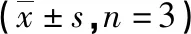
表1 不同浓度乙酰甲胆碱激发下sRaw值变化
2.2 BALF炎症细胞计数 OVA/PAI-1-/-组和OVA/WT组BALF的炎症细胞总数及各分类计数均显著高于对照组(P<0.01)。其中,OVA/PAI-1-/-组的中性粒细胞数量较OVA/WT组显著上升(P<0.01)。见表2。
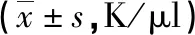
表2 BALF中炎性细胞水平
2.3 肺组织HE染色 NS/WT组和NS/PAI-1-/-组小鼠肺泡结构完整,未见明显肺损伤;OVA/PAI-1-/-组气道炎症细胞浸润及平滑肌增厚程度较OVA/WT组更为显著。见图1。
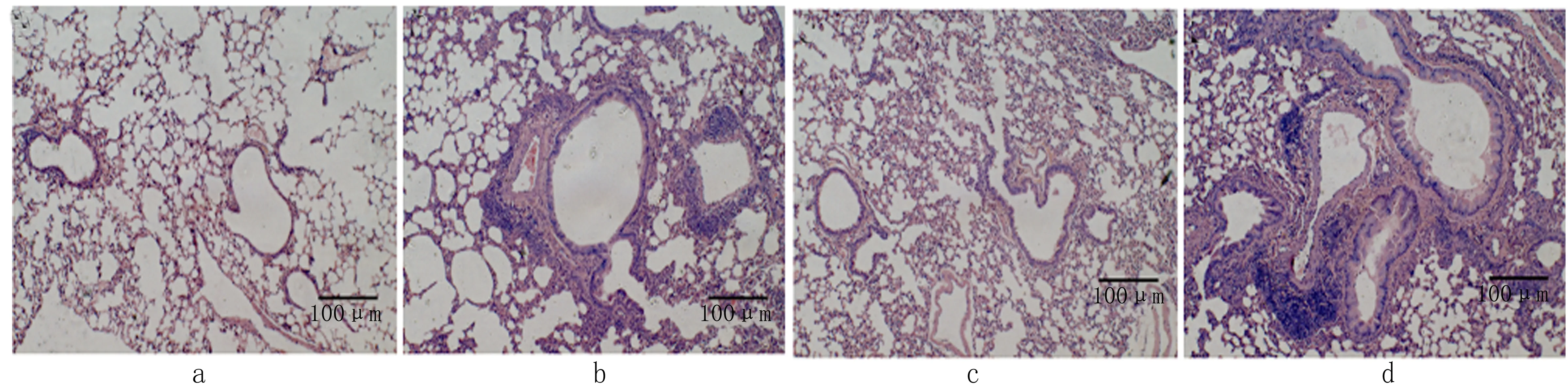
图1 肺组织HE染色(×100)a.NS/WT 组 b.OVA/WT组 c.NS/PAI-1-/-组 d.OVA/PAI-1-/-组
2.4 肺组织CD68免疫组化染色 巨噬细胞是组织炎症的主要来源。正常肺组织CD68表达较低,呈弱阳性,主要分布在肺泡腔内侧。OVA激发后,OVA/WT组肺组织有大量的CD68+强阳性染色,提示巨噬细胞激活明显。OVA/PAI-1-/-组小鼠肺组织CD68+阳性细胞数较OVA/WT增多。见图2。
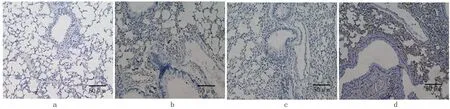
图2 肺组织CD68的免疫组化染色(×200)a.NS/WT 组 b.OVA/WT组 c.NS/PAI-1-/-组 d.OVA/PAI-1-/-组
2.5 血浆细胞因子水平 与NS/WT组比较,NS/PAI-1-/-组血浆IL-13水平明显升高,而INF-γ水平明显降低(P<0.01或P<0.05)。OVA/PAI-1-/-组小鼠血浆中细胞因子IL-10、INF-γ含量较OVA/WT组显著减少(P<0.01或P<0.05)。IL-4和IL-2水平在各组间无统计学差异。见表3。
3 讨论
支气管哮喘是由嗜酸性粒细胞、中性粒细胞、肥大细胞等多种炎症细胞和细胞组分参与,与Th1/Th2型细胞因子产生失衡有关,以气道高反应性、黏液过分泌和嗜酸性粒细胞浸润为特征的气道慢性炎症性疾病。PAI-1可在中性粒细胞、单核细胞、肥大细胞、T淋巴细胞等细胞上表达,并与这些炎症细胞的迁移活化密切相关,在机体免疫和炎症控制方面发挥重要作用[4]。本研究发现,OVA/PAI-1-/-组小鼠BALF中的中性粒细胞数量较OVA/WT明显增加;肺组织HE染色结果也显示OVA/PAI-1-/-组小鼠肺组织炎性细胞浸润较OVA/WT组更严重,CD68阳性细胞数较OVA/WT组增加,表明PAI-1在哮喘中对炎症细胞的募集与趋化具有负调节作用,PAI-1基因缺失导致肺部炎症细胞聚集。相反的,Ara Jo等人发现PAI-1-/-哮喘小鼠BALF中总炎症细胞和嗜酸性粒细胞数量较野生型哮喘小鼠明显减少,且肥大细胞来源的PAI-1在促进肺部炎症反应和气道重构中起主要作用[5]。慢性哮喘小鼠给予PAI-1抑制剂治疗后,小鼠气道炎症反应和胶原沉积明显减轻[6]。Tutluoglu B等人发现哮喘急性发作期患者血浆 PAI-1水平较健康者虽增加,但经激素治疗后反而进一步升高[7]。因此,受研究对象、疾病严重程度等影响,PAI-1在哮喘病程中到底是起促炎还是抗炎作用及其具体调节机制需进一步研究。
PAI-1还可影响多种炎症因子水平,Renchens等人发现PAI-1在健康肺组织过表达可导致肺内TNF-α、IL-6、IFN-γ和角质细胞源性趋化因子等细胞因子表达水平增加[8]。本研究显示,PAI-1基因敲除使哮喘小鼠血浆中IL-10和INF-γ水平显著降低。IL-10是具有抗炎和免疫调节的细胞因子,可抑制Th2细胞因子和抗原特异性IgE分泌,抑制肥大细胞脱颗粒释放炎症介质,阻止嗜酸粒细胞聚集及气道高反应性,从而抑制过敏性炎症反应[9-11]。INF-γ有利于Th1细胞的分化,抑制Th2细胞的分化,使Th1/Th2亚群达到平衡[12-13]。因此,PAI-1表达降低导致哮喘小鼠血浆中L-10和INF-γ水平降低不利于哮喘气道炎症的控制。除此之外,PAI-1在哮喘气道重构中也占有重要地位,有研究表明,PAI-1通过抑制基质金属蛋白酶和纤维蛋白溶解酶的活性促进气道的胶原沉积,促进气道高反应性、过敏性炎症、气道重塑的发生,加重哮喘[14]。哮喘患者的支气管平滑肌细胞、炎症细胞可在体外产生大量PAI-1,抑制纤溶酶的分裂作用,导致TGF-β1释放减少,诱导平滑肌细胞合成胶原[15]。研究还发现缓解组哮喘患者血浆PAI-1水平还与FEV1% pred呈负相关,进一步提示PAI-1可能与气道重构有关[16]。本实验只局限在PAI-1对哮喘气道炎症水平的研究,对气道重构的研究有待进一步探索和论证。
综上所述,PAI-1表达降低促进哮喘小鼠肺部炎症细胞募集,降低血浆IL-10和INF-γ水平,可加重哮喘气道炎症,提示血浆PAI-1水平或许可以成为评估哮喘患者气道炎症程度的标志物之一,为病情评估和指导用药提供依据。
