全瘤及瘤周感兴趣体积双区域T1 mapping定量参数结合钆塞酸二钠增强MRI对肝细胞癌微血管侵犯的评估价值
2023-06-14蔡志平刘子蔚陈伊凡关星群陈新杰李晓虹胡秋根
蔡志平,刘子蔚,陈伊凡,刘 伟,关星群,陈新杰,李晓虹,胡秋根
南方医科大学顺德医院(佛山市顺德区第一人民医院)放射科,广东 佛山528308
肝细胞癌(HCC)在诊断和治疗方面取得了长足的进步,但其仍是癌症中导致死亡的第大原因,约50%的新发HCC患者来自中国,是中国第二常见的恶性肿瘤[1-3]。手术切除是HCC患者的首选治疗方法[4],肿瘤的大小、数目和细胞核的级别、肝脏疾病的严重程度以及是否有血管侵犯都被认为是HCC术后复发和生存的重要预测指标[5-6],其中血管侵犯,无论大血管或者微血管侵犯(MVI)均是HCC患者术后的主要预后影响因素[7],可使肿瘤复发的风险大大增加[8]。因此,在确定手术切除或肝移植的患者和预测术后的预后结果时,术前识别血管侵犯是很重要的[9]。虽然门静脉或肝静脉主要分支的侵犯可以在术前影像上准确识别,但是HCC所引起的MVI很难在术前影像上被发现[10-11],多依赖术后的手术标本进行病理检查从而确诊。肝脏特异性对比剂钆塞酸二钠(Gd-EOB-DTPA)能被正常肝细胞摄取,并且被应用于HCC的诊断[12]。T1 mapping是一种能测量出病灶的T1弛豫时间的绝对值的定量技术,能与钆塞酸二钠增强MRI结合形成一种客观的提供定量参数的功能成像[13]。既往在肝炎纤维化分期[14-15]、鉴别不同分化程度HCC[16]、HCC与Ki-67表达的相关性[17]等研究充分体现了T1 mapping技术的应用价值,然而能否定量的评估HCC的MVI仍未被系统描述。T1弛豫时间可以由肿瘤感兴趣区域(ROI)的测量方式在T1 mapping图上得出[18],然而HCC具有异质性[19],HCC的异质性往往与MVI的发生密切相关[20]。与既往研究不同,本研究创新性地采用感兴趣体积(VOI)的测量方式,并采用全瘤及瘤周双区域的方法客观的评估HCC的MVI。目前国内尚未见通过测量全瘤以及瘤周双区域VOI的T1弛豫时间来评估HCC的MVI表达情况的报道。本研究拟将全瘤及瘤周VOI 双区域T1 mapping 定量参数与Gd-EOB-DTPA增强MRI结合对HCC的MVI进行评估。
1 资料与方法
1.1 一般资料
本研究属于回顾性研究,经南方医科大学顺德医院(佛山市顺德区第一人民医院)伦理委员会批准,免除受试者知情同意。收集并分析2019年1月~2022年9月于南方医科大学顺德医院(佛山市顺德区第一人民医院)因HCC行根治性手术的患者资料。纳入标准:术后病理确诊为单发的HCC并行根治性手术;术前1月内行Gd-EOB-DTPA增强MRI T1 mapping检查;术后病理有观察MVI的表达状态。排除标准:术后病理诊断为其他肝脏肿瘤;MRI图像存在严重伪影;术后病理诊断为多发性(>2个)HCC;术前接受过射频消融、放射治疗或者介入治疗。本研究最终纳入72例患者病例,男67例,女5例,年龄27~77(57.78±11.64)岁。根据MVI表达状态将患者分为MVI阳性组(n=23)和MVI阴性组(n=49),其中MVI 阴性组中男46 例,女3 例,年龄58.33±11.39岁,肝功能Child-Pugh评分A级20例,B级29例;MVI阳性组中男21例,女2例,年龄56.61±12.31岁,肝功能Child-Pugh评分A级9例,B级14例。两组性别、年龄、肝功能Child-Pugh评分的差异无统计学意义(P=0.652、0.591、0.892)。
1.2 MRI检查方法
所有患者均采用Siemens Magnetom Skyra及Lumina 3.0T磁共振扫描仪及配套的腹部专用线圈(体部相控阵线圈,18通道/16通道)进行扫描,采集肝脏MRI图像。先行平扫轴位T1 mapping 图像,之后用Gd-EOB-DTPA(Primo-vist;Bayer Schering Pharma AG,Berlin,Germany)经肘静脉进行轴位增强扫描,剂量0.1 mL/kg,流速1.0 mL/s,然后以相同速率注射30 mL生理盐水冲管。20 min后行轴位肝胆期轴位T1 mapping扫描。T1 mapping采用T1Map-双翻转角VIBE序列,并进行B1 mapping匀场校正,扫描完后自动生成mapping图像,Skyra及Lumina主要参数:TR 5.01 ms,TE 2.3 ms,层厚3 mm,双翻转角3°、15°,视野380 mm×285 mm,矩阵224×168。
1.3 图像分析与数据测量
将患者的影像数据从PACS中以DICOM格式导出,采用3D Slicer v4.11.20210226 软件进行VOI 勾画。由2位分别有12年和10年腹部专业诊断经验的放射科副主任医师在不知晓患者临床资料的前提下勾画VOI,勾画及测量前先进行培训以及标准的制定。2位医师在平扫(Pre)、肝胆期(HBP)两期的T1 mapping图像上逐层勾画出全瘤(tumor)、瘤周(peritumor)、全瘤+瘤周的VOI,其中瘤周扩张的区域采用1 cm[21-24]及2 cm[25],分别得到平扫、肝胆期的VOItumor、VOIperitumor1cm、VOIperitumor2cm、VOItumor+1cm、VOItumor+2cm(图1),勾画完毕后使用3D Slicer中Quantification模块里的Segment Statistic功能得出各VOI的平均T1弛豫时间(T1rt),以2名医师测量结果的平均值作为最终测量值,计算出两期之间各VOI的T1松弛时间下降率(rrT1rt),公式为:rrT1rt=100%×[(T1rt-Pre)-(T1rt-HBP)]/T1rt-Pre[26-27]。
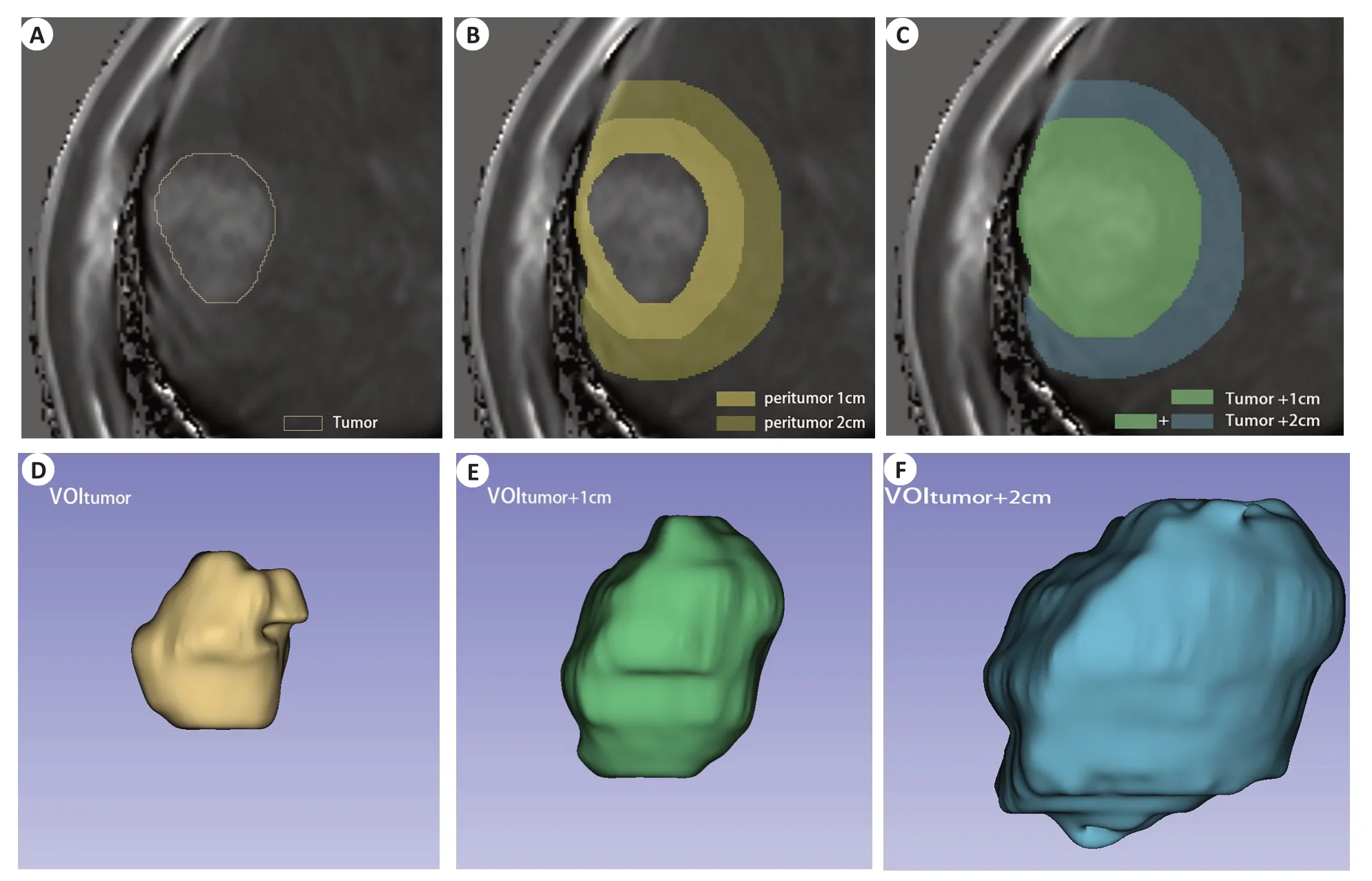
图1 VOI的绘制以及T1弛豫时间的测量Fig.1 The drawing of VOI and the measurement of T1 relaxation time.A: VOI of HBP tumor,T1rt-HBP-VOItumor=685.20 ms;B:VOI of HBP peritumor,T1rt-HBP-VOIperitumor1cm=507.44 ms,T1rt-HBP-VOIperitumor2cm=483.70 ms;C:VOI of HBP tumor and peritumor,T1rt-HBP-VOItumor+1cm=570.61 ms,T1rt-HBP-VOItumor+2cm=521.41 ms;D-F:Display 3D views of VOItumor,VOItumor+1cm,and VOItumor+2cm,respectively.
1.4 病理分析
所有术后组织标本均在我院病理科进行切片并观察。在不知道影像学征象的情况下,由2位高年资病理科医师独立观察,病理结果有异议时协商达成一致意见。MVI阳性被定义为在显微镜下观察到肿瘤周围微血管内的肿瘤栓子[28]。
1.5 统计学分析
使用IBM SPSS25.0及R-project4.1.3软件进行统计学分析,采用Kolmogorov-Smirnov方法检测样本是否符合正态分布。符合正态分布的计量资料以均数±标准差表示,不符合正态分布的计量资料以中位数(四分位间距)表示。采用组内相关系数评价2位医师测量结果的一致性(组内相关系数>0.75认为具有良好的一致性,0.65~0.75 认为一致性一般,<0.65 则认为一致性差)。MVI表达组间的MRI定量参数的比较采用独立样本t检验或Mann-WhitneyU检验。通过ROC曲线下面积(AUC)以及净重分类指数(NRI)来评估各定量参数以及联合定量参数在MVI表达组间的诊断效能。以P<0.05为差异有统计学意义。NRI使用R-project中的PredictABEL包得出,NRI>0意味着正向改善,表明新因素的评估能力优于旧因素。
2 结果
2.1 医师之间测量结果的一致性
2位医师测量T1rt-Pre-VOLtumor、T1rt-Pre-VOIperitu-mor1cm、T1rt-Pre-VOIperitumor2cm、T1rt-Pre-VOItumor+1cm、T1rt-Pre-VOItumor+2cm、T1rt-HBP-VOLtumor、T1rt-HBP-VOIperitu-mor1cm、T1rt-HBP-VOIperitumor2cm、T1rt-HBP-VOItumor+1cm、T1rt-HBP-VOItumor+2cm的组内相关系数分别为0.902(95%CI:0.621~0.979)、0.951(95%CI:0.792~0.990)、0.982(95%CI:0.914~0.996)、0.971(95%CI:0.863~0.994)、0.989(95%CI:0.945~0.998)、0.915(95%CI:0.320~0.985)、0.986(95%CI:0.938~0.997)、0.983(95%CI:0.919~0.997)、0.881(95%CI:0.552~0.974)、0.994(95%CI:0.972~0.999)。2名医师测量间的一致性较好。
2.2 MVI阴性组与MVI阳性组间定量参数的比较
在平扫及肝胆期T1mapping序列中,MVI阳性组均具有较大的T1弛豫时间VOI值,MVI阴性组则具有较小的T1弛豫时间VOI值,而MVI阳性组具有较小的T1弛豫时间减低率,MVI阴性组则具有较大的T1弛豫时间减低率。其中T1rt-Pre-VOItumor、T1rt-Pre-VOIperitu-mor1cm、T1rt-Pre-VOItumor+1cm、T1rt-Pre-VOItumor+2cm、T1rt-HBP-VOItumor、T1rt-HBP-VOItumor+1cm、T1rt-HBP-VOItumor+2cm、rrT1rt-VOItumor+2cm差异均有统计学意义(P<0.05),其他参数的差异无统计学意义(P>0.05,表1、图2~3)。MVI阴性组及阳性组代表性T1 mapping图像(图4)。
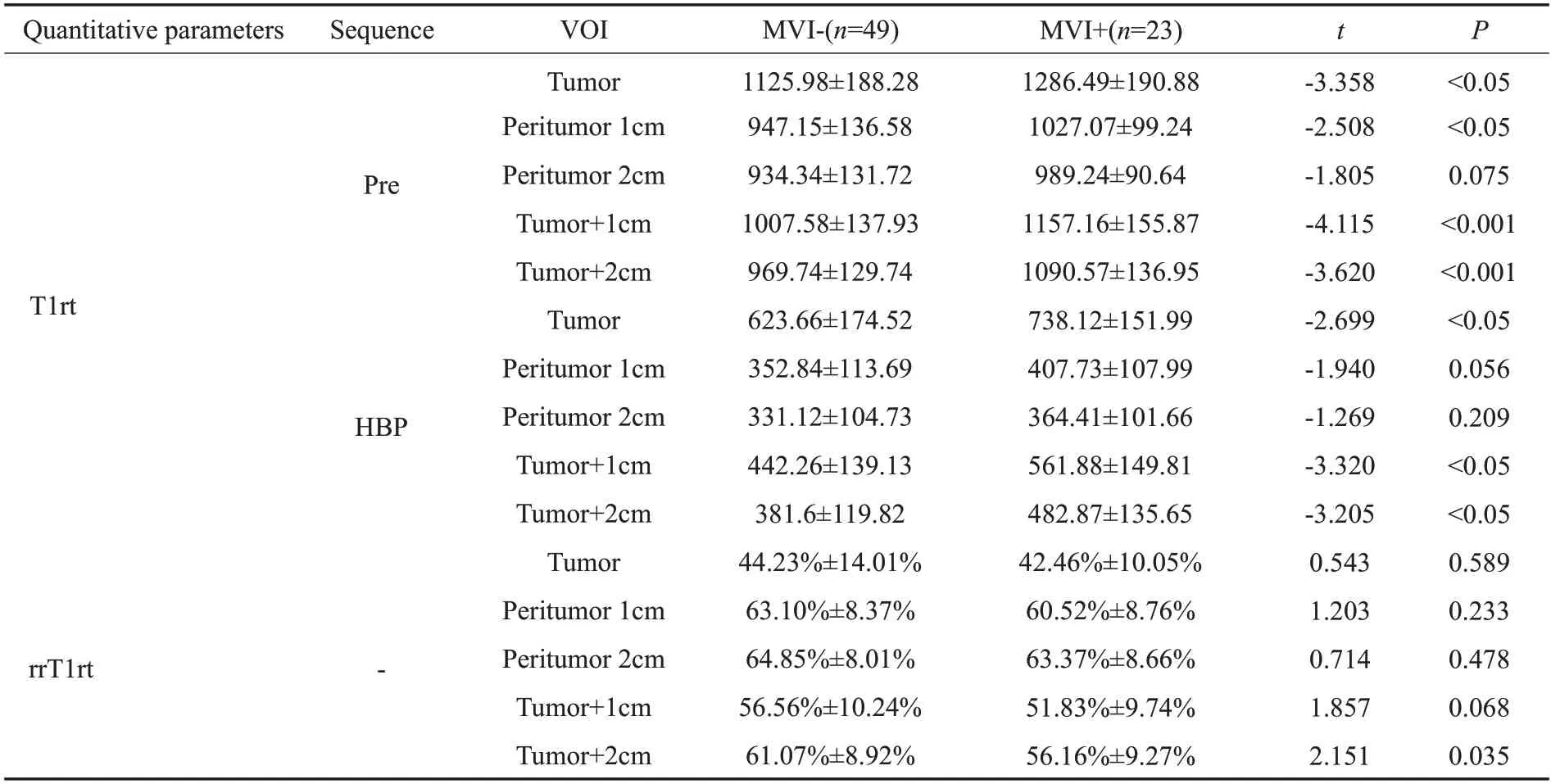
表1 两组间定量参数比较Tab.1 Comparative analysis of quantitative parameters between two groups
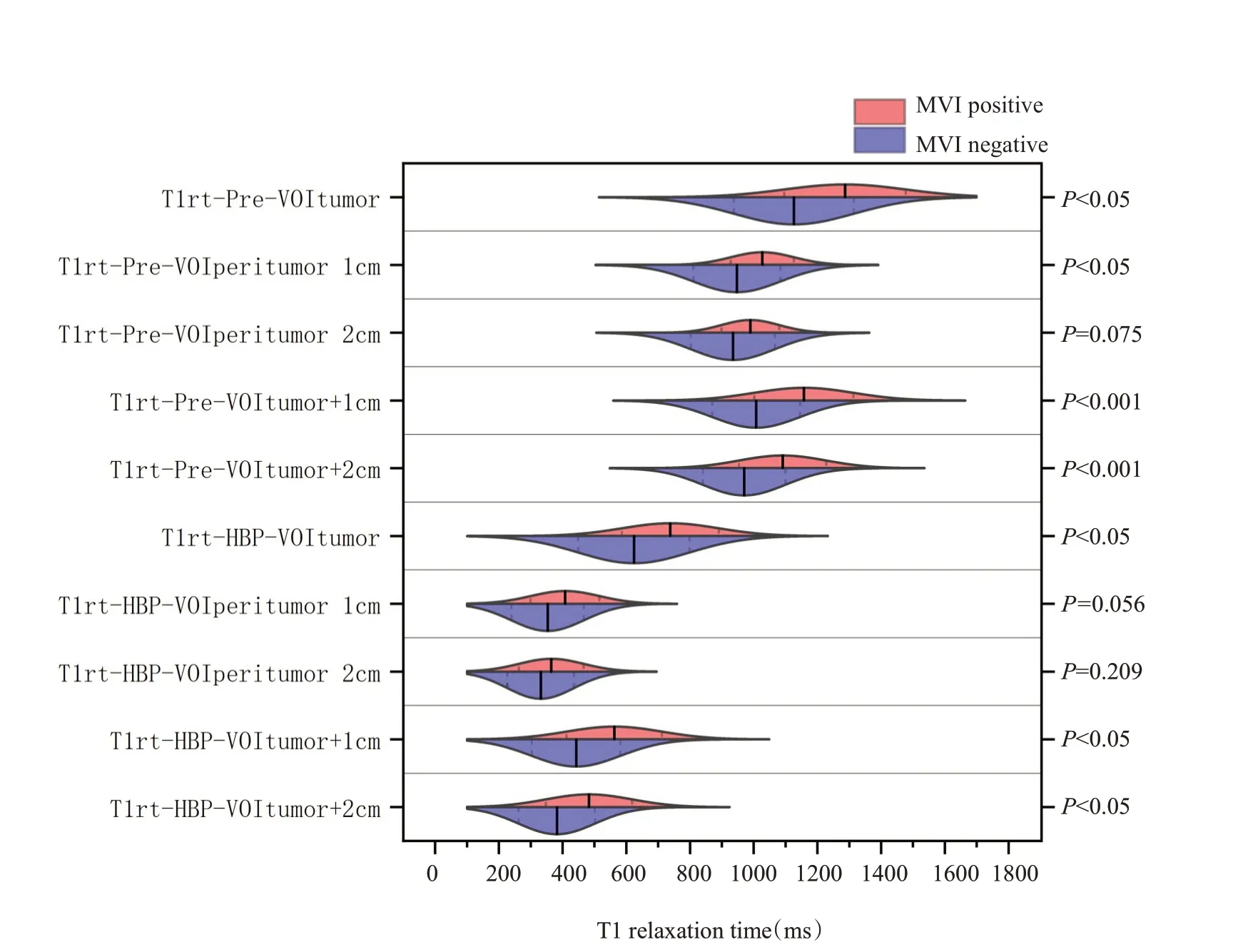
图2 MVI 阳性组与MVI 阴性组HCC 之间T1 弛豫时间的比较Fig.2 Comparisons of T1 relaxation time between MVIpositive and MVI-negative HCCs.
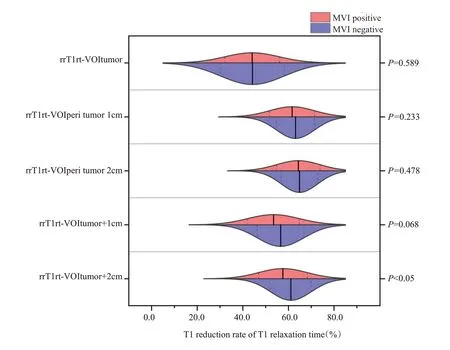
图3 MVI 阳性组与MVI 阴性组HCC 之间T1 弛豫时间减低率的比较Fig.3 Comparisons of reduction rate of T1 relaxation time between MVI-positive and MVI-negative HCCs.
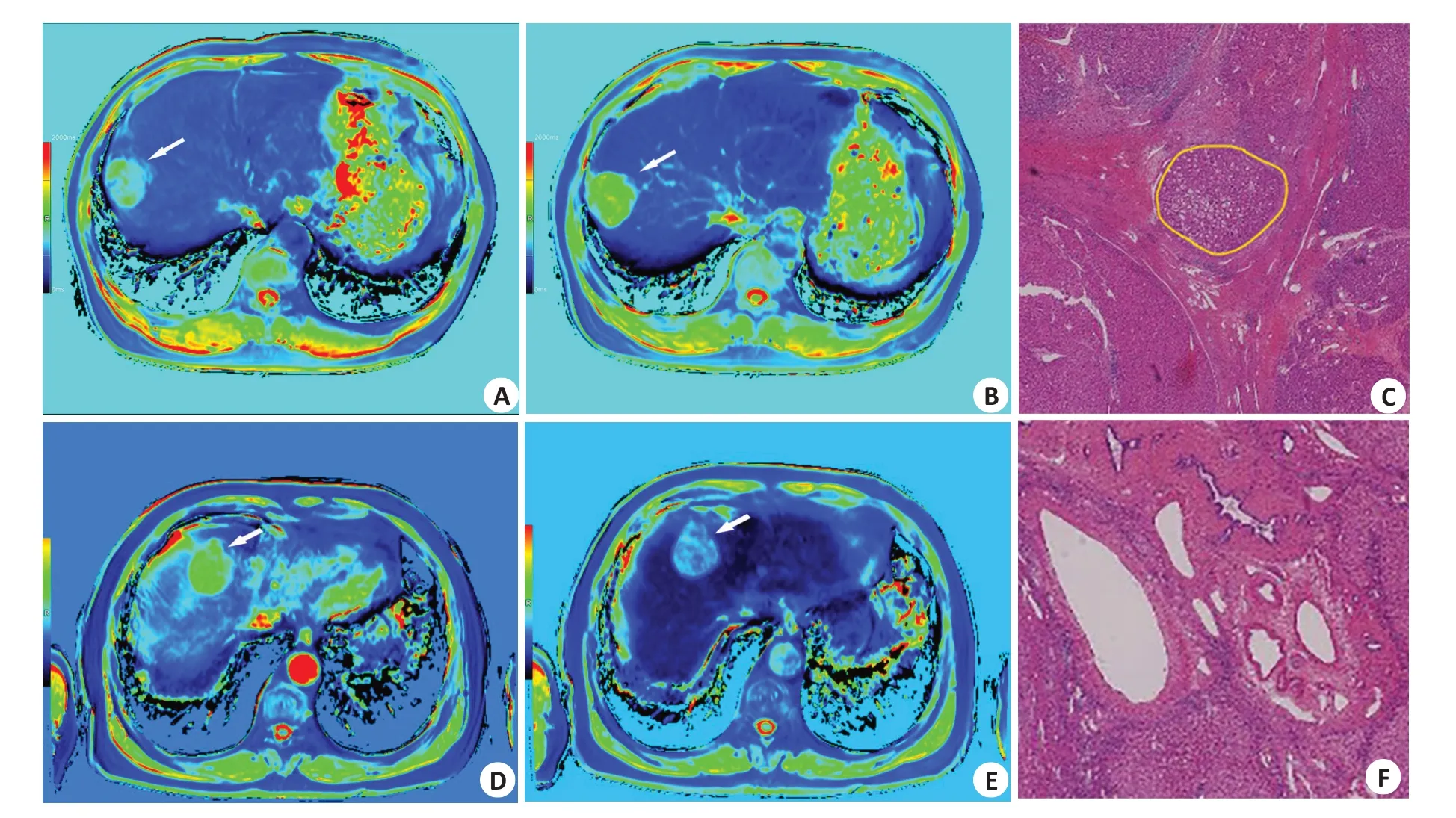
图4 MVI阴性组及阳性组具有代表性的T1 mapping图像Fig.4 Representative T1 mapping images of MVI negative group and positive group.A-C:Male,50-year-old,hepatocellular carcinoma grade 3,MVI positive.A: The tumor can be seen in T1 mapping pseudo-color image during Pre(white arrow),T1rt-Pre-VOItumor=1211.39 ms;B:The tumor can be seen in T1 mapping pseudo-color image during HBP(white arrow),T1rt-HBP-VOItumor=685.20 ms;C:Pathology showed tumor emboli in the microvessels around the tumor(in the yellow circle,HE,×20);D-F: Male,36-year-old,hepatocellular carcinoma grade 3,MVI negative.D: The tumor can be seen in T1 mapping pseudo-color image during Pre (white arrow),T1rt-Pre-VOItumor=1473.92 ms;E: The tumor can be seen in T1 mapping pseudo-color image during HBP(white arrow),T1rt-HBP-VOItumor=740.32 ms;F:Pathology showed that there were no tumor emboli in the microvessels around the tumor(HE staining,×20).
2.3 MVI 阴性组与MVI 阳性组间定量参数诊断效能分析
T1rt-Pre-VOItumor、T1rt-Pre-VOIperitumor1cm、T1rt-Pre-VOItumor+1cm、T1rt-Pre-VOItumor+2cm、T1rt-HBP-VOItumor、T1rt-HBP-VOItumor+1cm、T1rt-HBP-VOItumor+2cm的AUC 值分别为0.720(95%CI:0.594~0.847)、0.689(95%CI:0.567~0.810)、0.748(95%CI:0.625~0.871)、0.730(95%CI:0.607~0.854)、0.727(95%CI:0.595~0.859)、0.726(95%CI:0.601~0.851)、0.717(95%CI:0.591~0.843)(P<0.05),而rrT1rt-VOItumor+2cmAUC 值为0.639(0.517~0.749)(P=0.059)。其中T1rt-Pre-VOItumor、T1rt-HBP-VOItumor诊断效能较高,其临界值为1251.54 ms、740.33 ms,结合瘤周1 cm 诊断效能高于瘤周2 cm(0.748vs0.730、0.726vs0.717)。通过联合平扫及肝胆期的T1 mapping得出T1rt-Pre-HBP-VOItumor、T1rt-Pre-HBP-VOItumor+1cm、T1rt-Pre-HBP-VOItumor+2cm的AUC值分别为0.740(CI:0.623~0.836)、0.756(CI:0.640~0.850)、0.743(CI:0.626~0.839)(P<0.001),其中T1rt-Pre-HBPVOItumor+1cm的诊断效能最高(表2)。进一步NRI分析得出T1rt-Pre-VOItumor+1cm、T1rt-HBP-VOItumor+1cm与T1rt-Pre-VOItumor+2cm、T1rt-HBP-VOItumor+2cm比较均具有正向改善,NRI 值分别为0.6158、0.401。联合参数T1rt-Pre-HBP-VOItumor+1cm与T1rt-Pre-VOItumor+1cm、T1rt-HBP-VOItu-mor+1cm比较具有正向改善,NRI值分别为0.0692、0.5643(表3)。而平扫单纯瘤周的T1弛豫时间以及T1弛豫时间减低率的诊断效能较低。
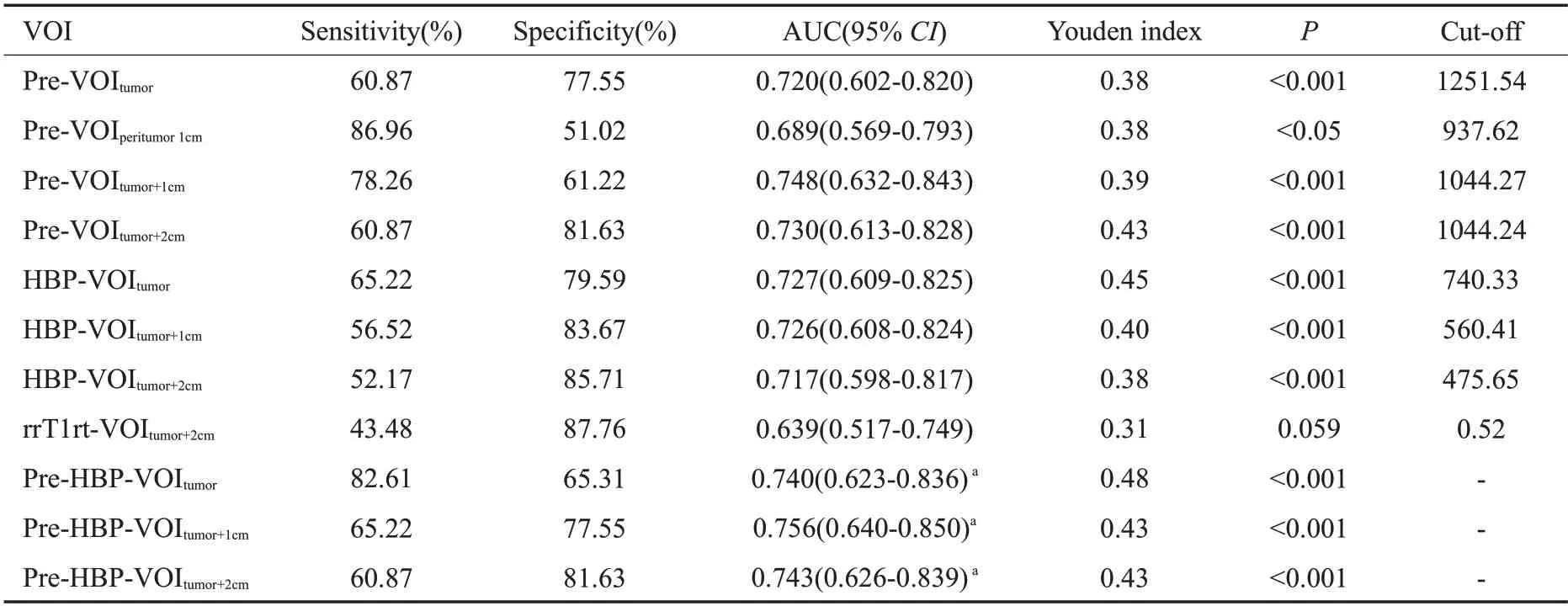
表2 两组间定量参数诊断效能分析Tab.2 Analysis of diagnostic efficacy of quantitative parameters between two groups
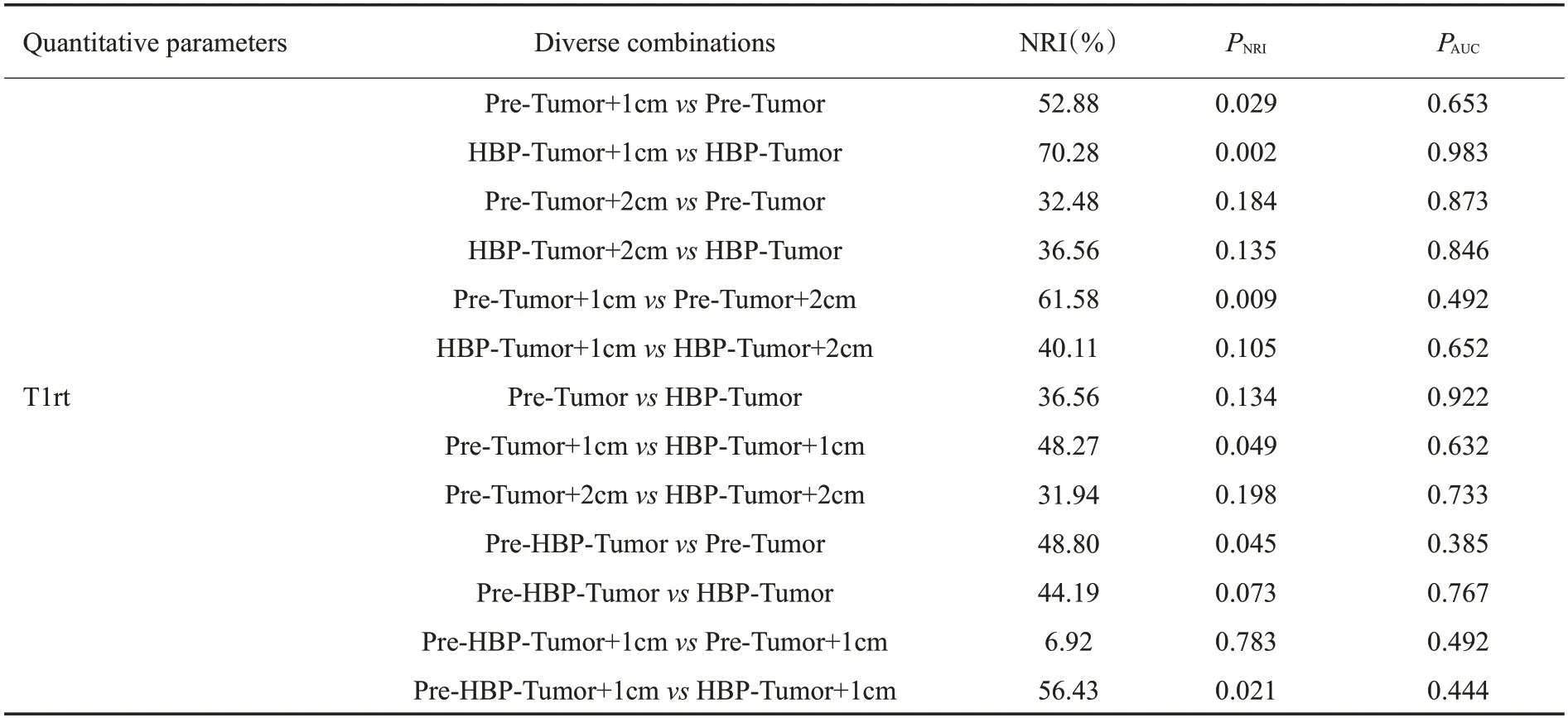
表3 VOI间定量参数诊断效能比较分析Tab.3 Comparative analysis of diagnostic efficiency of quantitative parameters between VOI
3 讨论
本研究首次尝试全瘤及瘤周VOI双区域定量参数对HCC的MVI进行评估。采用VOI的勾画方法能让本研究得到良好的可重复性以及一致性,从而使本研究的结果更加客观,而二维ROI受观察者之间的变异性影响要大得多[29],可重复性较差。VOI作为一种三维的勾画方法,在外扩时能外扩到二维ROI所无法外扩到的位置。既往研究表明,使用VOI得出整个肿瘤的ADC值较仅从肿瘤的存活区域选择的二维ROI的ADC值相比,是更好的疗效预测指标[30]。然而,有学者采用二维ROI的研究得出的AUC高于本研究[31],笔者推测可能是二维ROI仅包括了最有活力的肿瘤实体部分,忽略了瘤体内惰性的实体部分、瘤内坏死、出血以及纤维化等[29],这些成分恰恰反映了肿瘤的异质性[20]。而包含这些成分必然会影响到整个瘤体的T1驰豫时间,产生较大的方差和标准差,尤其是在较大的瘤体内。虽然本研究中VOI的AUC值可能会低于既往研究使用的ROI,但这恰恰反映了肿瘤的异质性,符合客观的肿瘤特征。
本研究发现MVI阳性组无论瘤体或瘤周的T1弛豫时间均高于MVI阴性组,其中平扫及肝胆期T1 mapping序列中的全瘤T1弛豫时间、全瘤+瘤周1 cm及2 cm的T1弛豫时间以及全瘤+瘤周2 cm的T1弛豫时间减低率组间差异均具有统计学意义(P<0.05),而瘤周1 cm的T1弛豫时间仅在平扫中组间差异有统计学意义(P<0.05),上述结果与既往研究结果较为一致[21,32]。虽然是基于影像组学的研究,有学者也得出了平扫及肝胆期的全瘤+瘤周2 cm组间差异具有统计学意义的结论[25]。其病理基础可能是MVI容易导致瘤周肝细胞周围的血流灌注异常,进而HCC有机阴离子转运多肽转运体功能受损,从而使肝胆期瘤体摄取EOB的能力降低,T1弛豫时间延长并且在图像上呈现低信号[33],因此MVI阳性的肝细胞癌更可能表现出较高的T1弛豫时间和较低的T1弛豫时间缩减率。但两组间单纯瘤周T1弛豫时间不叫人满意,其中肝胆期瘤周T1弛豫时间组间差异无统计学意义。这可能是由于对MVI的研究不能脱离瘤体本身,许多已报道的能用来预测MVI的放射学特征中,与肿瘤本身的大小以及异质性有关的占了多数[20],这也从侧面说明MVI与肿瘤本身的异质性以及大小有一定程度上的关系,故不能脱离肿瘤本身来评估肿瘤的MVI。
本研究结果表明平扫、肝胆期的全瘤T1弛豫时间诊断效能较高(0.720、0.727),临界值分别为1251.54 ms、740.33 ms,这与既往研究[21,34]得出的结果较为相同,也在许多研究所得出的范围之内[35-36]。通过结合瘤周1 cm 诊断效能高于瘤周2 cm(0.748vs0.730、0.726vs0.717),虽然AUC值并无差异(P>0.05),但通过NRI进一步比较发现,NRI值均大于0,意味着诊断效能有一定程度上的正向提高,这与之前使用影像组学的研究所得出的结果相一致[21-25],分析原因可能是由于全瘤+瘤周1 cm相较于全瘤+瘤周2 cm减少了正常肝组织的干扰,既往文献也报道肝功能的差异会影响正常的肝组织摄取Gd-EOB-DTPA的能力[37],虽然本研究中肝功能Child-Pugh评分差异并无统计学意义,但MVI阳性组中Child-Pugh B级评分的相对会多。相对单一参数,两组间平扫、肝胆期的联合参数(全瘤、全瘤+瘤周1 cm、全瘤+瘤周2 cm)的T1弛豫时间均表现出较好的诊断效能,其中全瘤+瘤周1 cm的AUC最高(0.756),与单一参数相比,NRI值大于0,意味着诊断效能有一定程度上的正向提高,这说明了联合诊断的能力要高于单一诊断。有研究采用了多序列联合的方式所得出的AUC值均大于单一序列[21-22,25],与本研究相仿。
本研究具有一些局限性:本研究为回顾性研究并且样本量较少,存在选择性偏倚的可能;本研究仅研究了Gd-EOB-DTPA增强图像上的定量参数,而没有考虑其他临床因素以及影像特征;本研究使用了2台机器,虽然扫描序列的参数均一致,但是所测量出来的T1弛豫时间也可能会稍微有所不同;未考虑肝内多发病灶的影像图像与病理图像一一对应,而多发性肝癌临床并不少见。因此,在后续前瞻性研究中,我们将联合肝胆外科、病理科进一步精准匹配病理影像结果。
综上所述,平扫、肝胆期的全瘤T1弛豫时间具有较好的诊断效能,且结合瘤周1 cm的T1弛豫时间诊断效能高于瘤周2 cm。多期T1弛豫时间的诊断效能高于单期,其中平扫+肝胆期的全瘤+瘤周1 cm的T1弛豫时间诊断效能最高。总之,全瘤及瘤周VOI 双区域的T1 mapping定量成像技术对于评估MVI具有潜在价值,能为HCC患者术前手术方案的制订以及预后的判断起到积极的辅助作用。