全脑加或不加同期推量放疗对大于3个脑转移瘤的疗效
2023-06-14李子煌杨红丽李先明
周 略,李子煌,樊 娟,龚 龙,盛 阳,杨红丽,李先明,唐 娜
南方科技大学第一附属医院,暨南大学第二临床医学院,深圳市人民医院1肿瘤放疗科,2病理科,广东深圳518020
约30%的肿瘤患者会出现脑转移[1]。脑转移是肿瘤患者预后差的一个主要因素[2-3],全脑放疗(WBRT)可使生存期延长至6月[4-5]。对小于3个病灶的脑转移患者,手术和立体定向外科放疗(SRS)是标准的治疗的方式,其较WBRT疗效更优[6-8];而对于大于3个脑转移病灶的患者,考虑颅内其它部位转移风险高,往往选择WBRT[9]。而WBRT的疗效仍不理想[10-11]。对小于3个脑转移的患者行全脑加SRS可增加疗效,但会带来脑坏死等副作用。研究显示,该类患者予以WBRT加局部病灶同步推量放疗(SIB)在提高疗效的同时,并未增加脑坏死等副作用[12-15];而对于大于3个转移病灶的患者,尚无关于采用WBRT 加局部病灶SIB 的大型随机研究。本研究回顾性分析了深圳市人民医院肿瘤放疗科对大于3个脑转移瘤患者进行WBRT及WBRT加局部病灶SIB的疗效。相较于传统的WBRT,本研究尝试对大于3个转移病灶的脑转移患者在WBRT的基础上对转移病灶进行同期推量,提高肿瘤局部的剂量,以期提高脑转移患者的治疗效果。通过观察WBRT加同步推量与WBRT对大于3个脑转移灶患者的治疗,了解其是否有生存优势及对生活质量的影响,同时观察其对肿瘤标志物的影响,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2011年7月~2020年7月就诊于深圳市人民医院肿瘤放疗科的118例脑转移瘤患者(表1)。按照治疗方法的不同,将患者分为WBRT 组(n=62)和WBRT+SIB组(n=56)。纳入标准:年龄18~80岁;所有患者经行颅脑增强MRI扫描;转移病灶4~10个;明确的肿瘤病理诊断。排除标准:Karnofsky评分<70分;诊断脑转移时预计生存时间<3月;既往有脑放疗病史;脑干转移;脑膜转移;颅外病灶未控。
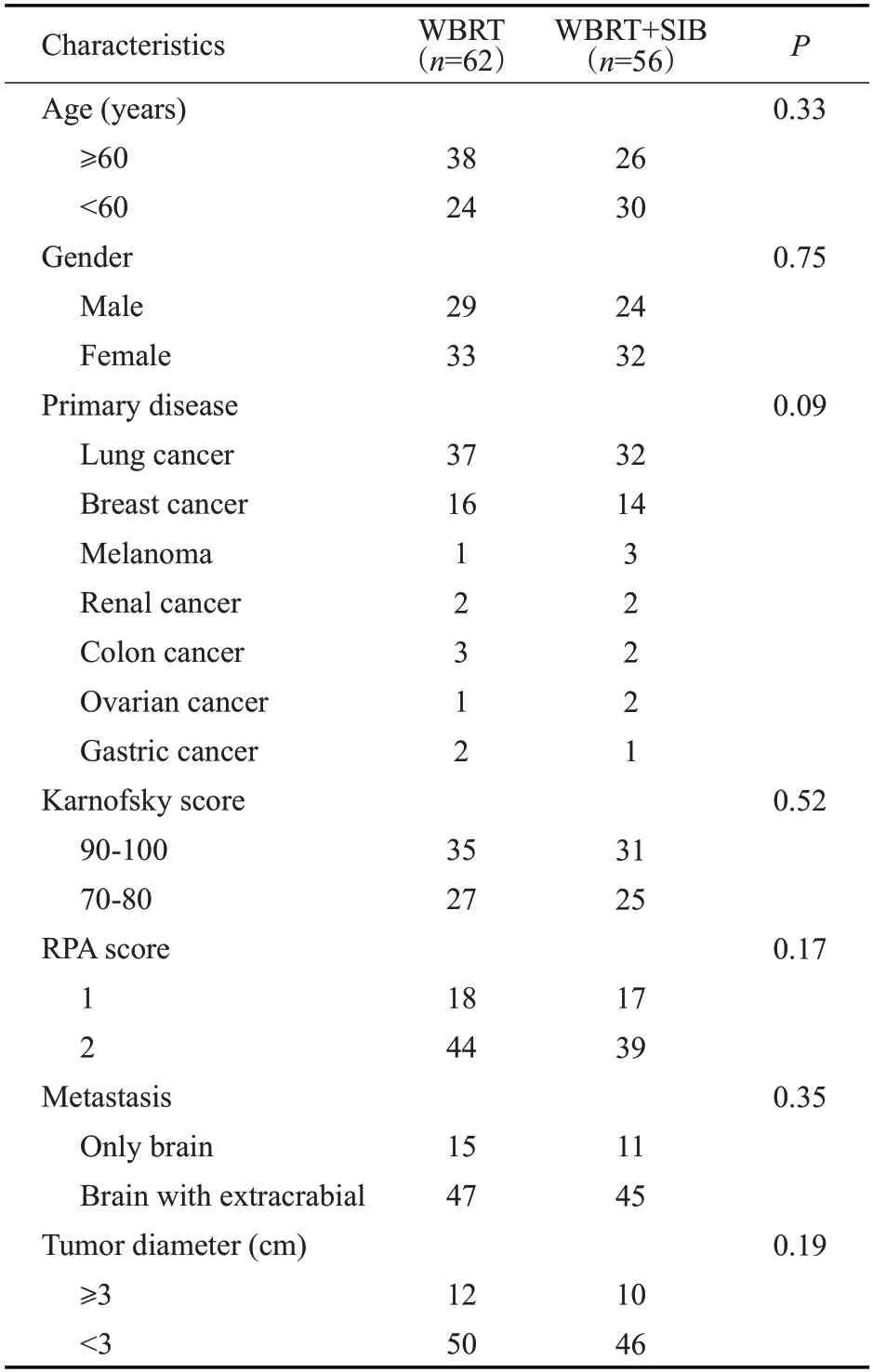
表1 患者临床特征Tab.1 Clinical characteristics of patients(n)
1.2 治疗方法
1.2.1 WBRT 采用西门子大孔径CT定位,3 mm层厚扫描,无需增强。靶区设计:临床靶区为颅内脑组织,计划靶区为临床靶区外扩3 mm。放疗剂量为30 Gy/10 F,1次/d,5次/周。采用三维或调强放射治疗。
1.2.2 WBRT+SIB 采用西门子大孔径CT定位,3 mm层厚增强扫描,如转移瘤小于5 mm,则扫描层厚选取1~1.5 mm。融合同体位增强MRI图像。靶区设计:肿瘤区MRI T1增强相所见转移病灶,瘤周水肿不需包括在靶区内。临床靶区等同肿瘤区,计划靶区为临床靶区外扩3 mm。放疗剂量为,全脑30 Gy/10 F,对于转移病灶直径大于3 cm者同期推量10 Gy/10 F,总量至40 Gy/10 F;直径小于3 cm者同期推量15 Gy/10 F,总量至45 Gy/10 F,100%的处方剂量包括95%的计划靶区体积,计划靶区Dmax<110%处方剂量。均为1次/d,5次/周。均采用保护海马技术。采用调强放射治疗或容积调强放射治疗技术,放疗均采用CBCT图像引导。
1.3 统计学分析
所有患者均采用颅脑增强MRI随诊复查。复查及随访时间:放疗结束后6~8周,此后每3~4月随访1次及复查1次MRI。随访的内容包括毒副反应、局部控制率及总生存率。毒副反应采用CTCAE V4.0版标准。放疗后3月内的副反应定义为急性毒副反应,3月后的副反应定义为晚期毒副反应。
采用SPSS23软件进行统计学分析。采用COX回归模型进行多因素分析,排除混杂因素干扰。对生存率采用Kaplan-Meier分析。非正态分布的无序定性资料以n(%)表示,组间对比采用卡方检验,单向有序定性资料采用秩和检验。以P<0.05为差异有统计学意义。采用Medcalc软件计算样本量,取α=0.05,β=0.2。
2 结果
2.1 WBRT+SIB与WBRT副反应的比较
WBRT组只有1例III级嗜睡的急性毒副反应,该患者放疗前就存在II级的嗜睡,放疗后加重,其余急性毒副反应均集中在I~II级。WBRT+SIB组1例患者出现III度的急性恶心、呕吐反应,2例出现III度急性头痛、头晕反应,其中1例患者同时出现上述两种反应,经过脱水降颅压对症处理后均缓解;1例患者放疗期间出现肌力III度下降,两组所有急性毒副反应的差异均无统计学意义(P>0.05)。WBRT组未出现III度以上晚期毒副反应;WBRT+SIB组只有1例III级头痛、头晕的晚期毒副反应,其余均为I、II级晚期毒副反应(表2~3)。
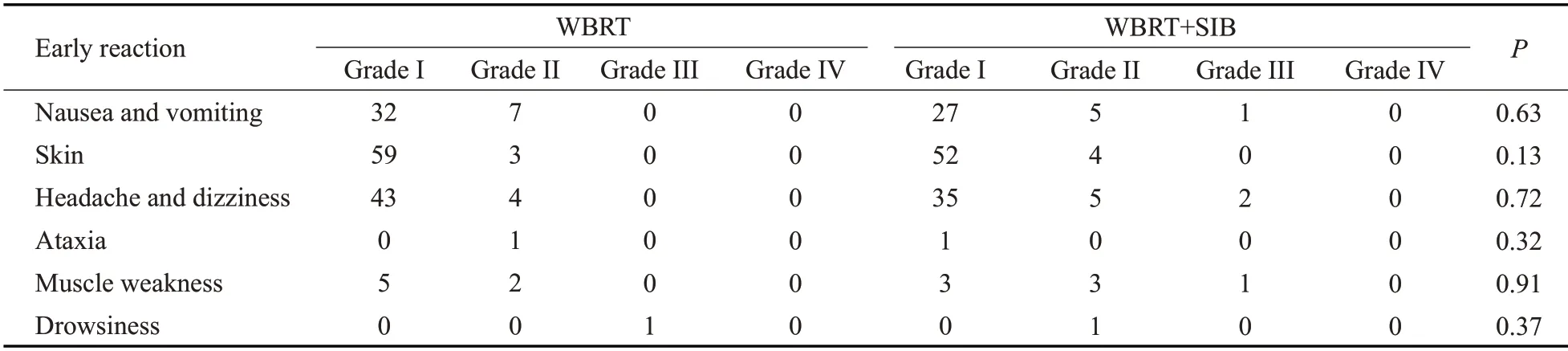
表2 急性毒副反应Tab.2 early reaction(n)

表3 晚期毒副反应Tab.3 Late reaction(n)
2.2 WBRT+SIB与WBRT生存预后的对比
COX 回归分析显示,放疗方式(WBRT+SIB、WBRT)(HR=0.68,95%CI: 0.42~0.82)及RPA 评 分(HR=0.49,95%CI: 0.32~0.74)是影响预后的独立因素。在生存率上,WBRT+SIB组优于WBRT组,两者中位生存时间分别为10.7月和7.8月,1年生存率分别为32%和13%(P=0.02,图1)。RPA 1分和RPA 2分两者的中位生存时间分别为12.5月和8.0月,1年生存率分别为43%和16%(P=0.01,图2)。RPA 1分者WBRT+SIB和WBRT中位生存时间分别为13.6月和10.5月,1年生存率分别为51%和28%(P=0.01,图3);RPA 2 分者WBRT+SIB和WBRT中位生存时间分别为9.3月和6.8月,1年生存率分别为18%和11%(P=0.39,图4)。

图1 WBRT+SIB与WBRT生存曲线图Fig.1 Survival curve of WBRT+SIB and WBRT.
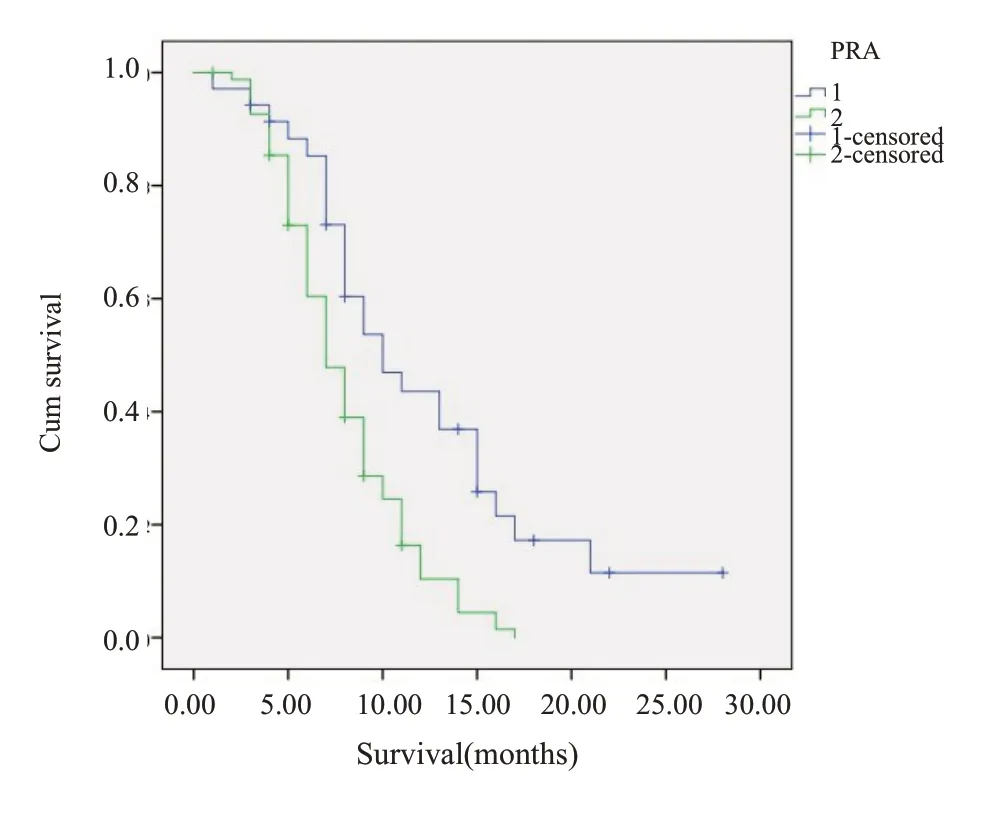
图2 PRA 1分与2分患者生存曲线图Fig.2 Survival curve of PRA 1 point and PRA 2 points.

图3 PRA 1分患者WBRT+SIB与WBRT生存曲线图Fig.3 Survival curve of WBRT+SIB and WBRT in patients with PRA 1 point.
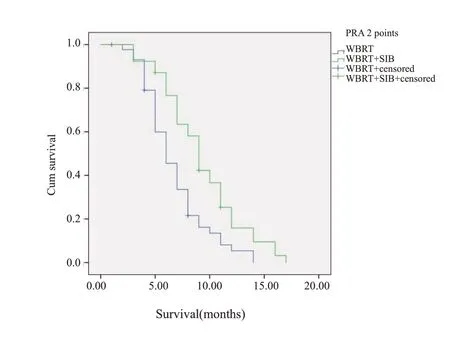
图4 PRA 2分患者WBRT+SIB与WBRT生存曲线图Fig.4 Survival curve of WBRT+SIB and WBRT in patient with PRA 2 points.
2.3 WBRT+SIB与WBRT 对肿瘤标志物的影响
对比两种放疗方式于放疗前后患者肿瘤标志物的变化,结果显示两种放疗方式所观察指标如癌胚抗原(CEA)、CA125、CA199下降的差异无统计学意义(P>0.05,表4)。

表4 两种放疗前后肿瘤标志物下降幅度Tab.4 Decrease of tumor markers before and after two kinds of radiotherapy(%,Mean±SD)
3 讨论
肿瘤脑转移是患者致死的主要病因之一,由于血脑屏障的缘故,药物控制脑转移瘤的作用有限,放疗是脑转移瘤的重要治疗手段。有学者研究了1~3个脑转移患者采用WBRT和WBRT+SRS治疗的疗效,结果显示WBRT+SRS对单个脑转移有着延长生存时间的优势,表明加强肿瘤局部的剂量可以延长这类患者的生存时间,提高生存率[16]。对于大于3个脑转移病灶者,既往常规使用WBRT,但WBRT剂量偏低肿瘤局部控制率低,疗效欠佳。本研究试图在WBRT的基础上对转移病灶予以同期局部推量,以提高肿瘤局部剂量,达到提高肿瘤控制率及提高生存率,我们对比分析了大于3个脑转移患者采用传统WBRT和WBRT+SIB治疗的效果,结果显示WBRT+SIB的平均生存优于单纯WBRT,两者中位生存时间分别为10.7月和7.8月,1年生存率分别为32%和13%(P=0.02)。随着肿瘤治疗的进步,脑转移患者的生存时间不断延长,对于颅脑放疗的副反应越来越受到关注,本研究中WBRT+SIB 和WBRT两者无论是急性毒副反应还是晚期毒副反应,差异均无统计学意义。对于WBRT加转移病灶同步推量的患者能否降低WBRT的剂量以减轻副反应,尤其是晚期毒副反应仍需进一步探索。有研究采取降低WBRT的剂量加转移病灶同步推量的方式对脑转移瘤进行治疗,结果显示该方式在延长患者的生存时间上并无差异,但减轻了脑认知功能障碍[17]。WBRT+SIB如何寻求最佳的全脑和补量剂量组合将是今后的研究方向。
随着肿瘤个体化治疗的到来,筛选合适的患者予以最佳的治疗是探索重点。有研究对脑转移患者按预后制作了RPA评分系统,并根据评分等级制定相对应的治疗推荐[18]。随着对肿瘤特征及分子生物学研究的进一步发展,衍生出了不同瘤种的评分系统[10,19-20]。其中加入分子指标的肺癌评分系统Lung-molGPA,其3.5~4分者中位生存时间达到了46.8 月[21]。本研究也显示RPA 1分者WBRT+SIB和WBRT中位生存时间分别为13.6 月和10.5 月,1 年生存率分别为51%和28%(P=0.01),RPA 2分者WBRT+SIB和WBRT中位生存时间分别为9.3 月和6.8 月,1 年生存率分别为18%和11%(P=0.39),可见WBRT+SIB在预后好的RPA 1分组中优势更明显,但在RPA 2分组并未体现出生存获益。
对于大于3个脑转移患者的放射治疗,WBRT是当前标准治疗方式。随着放疗技术的发展,SRS已在脑转移中广泛应用,其在1~3个脑转移灶的治疗效果已获得证明[22],对大于3个脑转移SRS的研究也在进行中[23]。但SRS在多发脑转移中的副反应不容忽视,有研究显示其放射性脑坏死的发生率在5.6%~13%[24-25],放射性脑坏死严重影响患者的生活治疗,如何提高脑转移患者的治疗效果同时减轻治疗相关副作用逐步受到重视。近年来,大分割放疗开始应用于脑转移瘤,且显示了其良好的效果及相对低的毒副作用[26]。本研究显示,WBRT+SIB相较于单纯WBRT并未明显增加治疗相关的毒副反应,且在整个观察过程中也未出现放射性脑坏死。因此,对于大于3个脑转移灶的患者WBRT+SIB是一种值得探索的治疗选择。
血液学肿瘤标志物,包括CEA、CA125、CA199、神经元特异性烯醇化酶等广泛应用于预测肺癌、乳腺癌、消化道肿瘤的治疗效果和预后[27-30]。而对于脑转移患者,如是脑膜转移,常伴随血液肿瘤增高。而对于脑实质转移,确诊时血液学肿瘤标志物常无明显增高的变化过程[31-35]。这可能与血脑屏障相关,脑膜转移可能导致血脑屏障的屏障作用减弱,使得肿瘤标记物更易进入脑脊液并随之进入血液[36-37]。研究显示,放疗可破坏血脑屏障,增加血脑屏障的通透性,但何种放疗方式及放疗剂量的作用最明显尚无定论[38-40]。本研究显示,无论是WBRT还是WBRT+SIB对降低血液肿瘤标志物的幅度均有限,差异无统计学意义,也同样表明脑转移瘤可能由于血脑屏障的作用,其肿瘤标志物的变化与肿瘤负荷及治疗疗效并不能相应的反应于血液循环里。
综上,本研究初步探讨了WBRT+SIB在治疗大于3个脑转移瘤的应用,相较于传统的全脑放疗,其存在生存获益,尤其是对于RPA 1分的患者,其生存获益更明显,同时并未明显增加早晚期毒副作用,但仍需进一步的前瞻性、随机对照研究进行验证。