高镍正极材料的稳定改性方法研究综述
2023-06-14李金涛邱景义
李金涛,牟 粤,王 静,邱景义,明 海
(1燕山大学环境与化学工程学院,河北 秦皇岛 066004;2北京航空航天大学,北京 100191;3军事科学院防化研究院,北京 100191)
锂离子电池因其高比能量、长循环寿命和使用过程清洁等优点受到广泛研究[1-2],其中正极材料是决定电池的各项性能的关键因素之一。最早的商用锂离子电池正极材料为LiCoO2[3],但其在充放电时尤其在高压下易产生不可逆相变造成容量的快速衰减[4]。随后的研究中人们相继设计出多种LiTMO2(TM=Ni、Co、Mn、Ti 等)型正极材料[5],其中高镍材料因其良好的性能与成本优势得到广泛应用[6]。但是,性能提升的同时也带来了电化学稳定性问题[7],一般来说,引起高镍正极材料不稳定性的原因有多种,一是高镍正极内部因Li+(0.76 Å,1Å=0.1 nm)与Ni2+(0.69 Å)离子半径相似引起的阳离子混排,产生晶相转变,造成层状结构破坏[8]。二是在制备过程中残留的锂化物还会与电解液发生副反应,释放热量并加速正极材料与电解液之间的副反应[9]。这些因素造成了高镍正极材料本身结构、界面和热稳定性的下降。
针对上述问题,研究人员提出了对高镍正极材料实施组分调控、结构优化、浓度梯度控制、元素掺杂、包覆或多种手段耦合联用等改性手段,从材料本征和微观结构等角度对材料进行了改性。其中组分调控与结构优化的手段,主要是通过不同元素比例和晶相结构的控制来提升正极的比容量和稳定性;材料的浓度梯度设计和元素掺杂可以根据电极所预期的比容量、使用环境和匹配电解液组分进行响应,不同离子在内部的分布情况控制可以直接决定材料的容量、循环稳定性及对电极液的表-界面反应过程;包覆手段则可以选用快离子导体、磷酸盐等无机物或者导电的、耐高压稳定且不溶于电解液的高分子聚合物,在确保高电子迁移率和快离子迁移率的同时,优化材料与电解液的表-界面反应,抑制副反应、调控电池循环前后的正极电解质界面(cathode electrolyte interphase,CEI)。多种手段联用是综合利用不同方法的优势以实现电极材料最佳改性的策略,实现正极材料多方面的性能提升或对改性效果的增强。这些改性手段效果不尽相同,研究的进展也不尽相同,因此,对于高镍正极材料的稳定改性方法的回顾是必要的。
基于上述考虑,本文梳理了高镍正极材料存在的阳离子混排、残留锂化物、界面稳定性、结构稳定性以及热稳定性和安全性问题,阐述了上述问题产生的机制、机理,并对其中涉及的不同元素比例、充/放电压等影响因素进行了分析,系统地比较了近年来应用于高镍正极材料改性的方法和策略,包括本征组分调控与结构优化、浓度梯度控制、元素掺杂优化、包覆结构设计,以及多方法耦合联用等,重点讨论了上述改性策略的作用机理以及研究进展,并对高镍正极材料稳定化改性方法的发展与应用前景进行了论述,有助于人们全面了解相关技术改性的发展水平和创新性突破。
1 高镍正极材料主要问题分析
1.1 阳离子混排
高镍层状正极材料拥有R3ˉm的空间点群,而理想的R-3m点群的八面体的3a位点(过渡金属位点)和3b位点(锂位点)是明显分离开的,应当拥有重复O3 结构,即O-Li-O-TM-O 的排布。但事实上,高镍层状正极材料常常伴随着Li 和Ni 之间的阳离子混排,即3a位点的过渡金属离子和3b位点的锂离子互相占据对方在点阵中的位置。根据晶体场理论,Ni 离子在面心立方(face center cubic,FCC)八面体位置上倾向于以Ni2+的形式存在而不是Ni3+,但是Ni2+会因为e轨道未成对的电子自旋而不稳定[10-11]。同时Ni2+(0.69 Å)的半径和Li+(0.76 Å)非常接近,这就使得Ni2+非常容易占据Li+的3b位点,尤其是当电池循环过程中时,锂离子脱嵌形成大量Li 空位时,这一过程一般不会改变R-3m的空间点群结构。但当阳离子无序积累到一定程度后,会发生层状结构向电化学惰性的岩盐相的转变。
对LiTMO2(TM=Ni、Co、Mn)而言,阳离子混排会严重影响正极材料在循环过程中的性能。Ni2+占据Li+的晶格位点后,正极的Li 嵌入/脱出过程会变得更加困难[12]。与最初的层状结构相比,混排后Li层的层间距变小,锂离子的扩散势垒提升,输运更加困难;同时由于锂层中过渡金属离子的占位,不会在充放电过程中脱嵌,将会对正极材料本体中的锂离子通道造成堵塞,降低锂离子的输运效率。因此,高镍正极材料的各项电化学性能,包括倍率性能、可逆比容量、循环稳定性以及热稳定性,在阳离子混排后会有明显的降低[13-14]。LiTMO2型材料的阳离子混排示意图如图1所示,(003)面主要为过渡金属离子,而(104)面体现了O-Li-O-TM-O 的排布。X 射线衍射(X-ray diffraction,XRD)图像中的(003)面和(104)面的衍射峰强度比体现了LiTMO2材料的阳离子混排程度[15]。一般而言,高镍正极材料常引入Mn 作为支撑离子,稳定其层状结构,但是因为Mn 本身几乎没有容量贡献,因此高镍正极的Mn 含量往往会控制在一个较低的水平,这也使得阳离子混排更容易发生。Kondrakov等[16]通过XRD和中子衍射,计算分析了LiNi0.8Co0.1Mn0.1O2正极及其在循环后的Li/Ni 混排程度,研究发现后者的混排程度更高,这和LiNi0.8Co0.1Mn0.1O2正极本身的高Ni含量有着明显的关系。
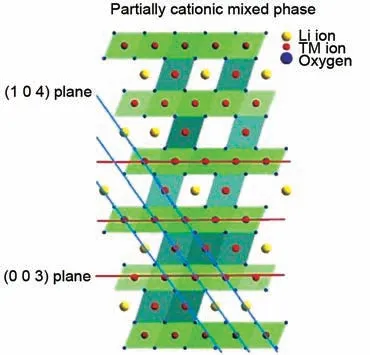
图1 高镍层状正极材料中阳离子混排的示意图[24]Fig.1 Schematic diagram of cation mixing in layered ternary material[24]
为了获得更高性能的高镍正极,一般都会相应地降低Li/Ni混排的程度,甚至降低Ni2+在体相中的含量。已有研究工作表明,Ni2+的含量和Li/Ni混排的程度都受到煅烧制备过程中O 的变化影响。Koyama 等[17]通过第一性原理计算证明煅烧过程中O 的变化会影响Ni 的存在价态,导致Ni3+还原为Ni2+,并在之后引发阳离子混排。为进一步研究煅烧过程中O的变化对阳离子混排的影响,Bi等[18]通过控制煅烧过程中的O 分压,发现Li/Ni 混排程度和非化学计量比的O高度相关。随着O分压逐渐升高,Li/Ni 混排比例也随之降低,Ni2+含量也大幅降低。除此之外,合理的金属离子掺杂及表面涂层也可以降低Li/Ni 混排、提高循环稳定性[19],Wang等[20]还采用Ce0.8Dy0.2O1.9表面涂层和Ce4+掺杂的策略,材料较大的I(003)/I(104)比值(1.5398>1.2)也显示出了显著提高的阳离子有序程度,对阳离子混排起到了明显的抑制作用。
另一方面,之所以会出现阳离子混排,一定程度上是因为高镍材料本身的不稳定性,因此适当的阳离子混排可以提供一定的稳定性佐助。如果高镍材料本征混排程度太低,在电池充放电过程中,随着锂离子不断地进行脱嵌,其在高能态驱使下会更快地发生混排。Tang 等[21]发现LiNi0.8Co0.2O2的Li/Ni在混排约为2.3%时表现出最佳的倍率性能,因为一定的Li 占据Ni 位点后能降低Li 通过四面体位置扩散时的阻力,而Ni 占据Li 位点则可以为Li 在Li层中的扩散提供一个源自静电斥力的动力,并且受到了相应的理论计算结果支持。
目前有很多工作致力于减轻高镍正极材料的Li/Ni混排程度,因为除了材料制备过程中本身带来的Li/Ni混排,正极材料的混排也会在循环过程中伴随锂离子脱嵌加剧,最终导致材料失效。人们预期希望通过掺杂不同离子半径的过渡金属原子以支撑离子间作用力,调节Li 和Ni 的迁移过程,改善煅烧过程的热力学等,阻止或抑制高镍正极材料的Li/Ni混排[22-23]。
1.2 残余锂化合物
残余锂化合物在高镍正极材料表面的出现是无可避免的,其主要的存在形式为LiOH和Li2CO3等。残余锂出现首先是因为高镍正极材料在前驱体和锂盐混合煅烧的过程中,为了弥补高温下Li挥发的损失,需要加入过量的锂盐(通常过量3%~5%,摩尔分数),虽然过量的锂盐能促进形成更为有序的层状结构,但表面剩余的锂盐往往会在材料表面形成残余锂。此外,烧结完成后的高镍正极材料在空气中也极易因为Ni3+的高反应活性而在材料表面出现残余锂[25]。通常,材料表面的Ni3+会自发还原为Ni2+,随之在衍变过程中使晶格氧脱离,并最终演化成为残余锂化合物,其反应过程可由如下所示[26]:
由于表面残余锂化合物的强碱性,因此高镍正极材料会使得聚偏氟乙烯(Polyvinylidene Fluoride,PVDF)黏合剂脱氟,从而导致浆料凝胶化并使后续的涂布工序无法进行[27]。此外,残余锂化合物的出现也意味着活性锂的消耗和比容量的降低,相应杂质覆盖正极材料表面也会增大电池的内阻,导致电池极化增加,倍率性能无法得到有效发挥。根据上述式(1)~式(5),残余锂的增加也意味着Ni2+在材料表面的含量升高,这也将导致表面性能的劣化。尤其值得注意的是,正极释放的CO2也归因于表面Li2CO3在高压下的分解(见图2),气体的释放诱发电池膨胀使得其安全性急剧下降[28-29]。因此,高镍正极材料在生产、储存和使用过程中均需要严格控制环境湿度,以保证其不会和空气中的CO2、H2O等发生反应,这意味着在正极材料制备成电极以及后续的电芯叠片/卷绕制作工程中需要投入较多的生产车间环境控制成本。由此可见,高镍正极材料表面的残余锂化合物是其商业化推广使用的一个较大阻碍。
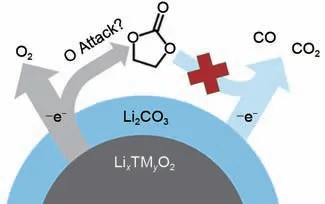
图2 高镍正极材料表面残留锂化物释放气体示意图[29]Fig.2 High nickel cathode material Schematic diagram of gas release from surface residual lithium[29]
目前研究主要是专注于在清理正极表面残余锂的同时恢复其原本性能[30],也有一部分研究专注于维持高镍正极材料的表面清洁,避免其和CO2、H2O等发生反应。为去除残余锂,实际生产中广泛采用水洗或酸洗工艺,并在之后煅烧以恢复其性能[31-34]。然而,额外的表面清洁工艺步骤,不仅延长了生产时间,且水洗、煅烧后高镍正极材料也很难恢复到初始性能,经过水洗或酸洗后虽然不会改变材料本征的晶体结构,但是其会破坏材料表面的稳定结构,加速其与电解液(电解质)的表-界面副反应,促进表面类NiO岩盐相的生成,而这种绝缘的NiO 岩盐层的形成将会显著增加表-界面电阻,降低电极的性能与循环稳定性[35]。疏水材料包覆则能提升高镍材料表面的稳定性,避免和CO2、H2O的直接接触,从而抑制电极表面副反应[36]。Doo 等[37]用聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)包覆膜显著提高了LiNi0.8Co0.1Mn0.1O2的疏水性,在贮存性能方面取得了很大进展。但聚二甲基硅氧烷包覆层太厚,无法保持LiNi0.8Co0.1Mn0.1O2正极的电化学性能,这是由聚二甲基硅氧烷本身的电化学惰性引起的。Mu 等[38]报道了采用分子层级聚二甲基硅氧烷包覆法对高镍正极材料进行表面钝化处理,克服了因涂层材料惰性引起的正极电化学活性衰减,这种分子层级的聚二甲基硅氧烷钝化层不仅赋予电极材料优异的疏水性,使得电极材料在潮湿环境中保持了原有相对光滑的表面结构(如图3),而且还尽可能地保持了原始LiNi0.8Co0.1Mn0.1O2材料的电化学活性,使其仍具有优异的电化学性能。

图3 裸LiNi0.8Co0.1Mn0.1O2和2% PDMS溶液处理的LiNi0.8Co0.1Mn0.1O2在潮湿环境不同暴露时间的扫描电子显微(Scanning electron microscopy,SEM)图像 (a)~(d) 裸LiNi0.8Co0.1Mn0.1O2:初始,暴露24 h、72 h、120 h(e)~(h) 2%PDMS溶液处理后:初始,暴露24 h、72 h、120 h[38]Fig.3 SEMimages of bareLiNi0.8Co0.1Mn0.1O2 and2%PDMS solution-processedLiNi0.8Co0.1Mn0.1O2for different exposuretimes:(a)fresh,(b)24 hexposed, (c)72hexposed, and (d)120 hexposed bareLiNi0.8Co0.1Mn0.1O2;(e) fresh, (f) 24 h exposed, (g) 72 h exposed, and (h) 120 h exposed SiMH-LiNi0.8Co0.1Mn0.1O2[38]
1.3 界面稳定性
高镍正极材料在电池循环过程中往往会表现出过度脱锂的现象,这是由于电极材料在充电过程中会发生层状结构向尖晶石结构乃至惰性岩盐结构的转变,并因此造成活性锂损失,发生容量损耗[39]。形成的岩盐相成分主要是NiO,具有Fm-3m空间群,其形成过程和阳离子混排以及晶格氧损失有关,过程反应式如下所示[40]:
形成的岩盐相的离子输运能力较差,阻碍离子传导并降低离子电导率。Xu 等[41]对LiNi0.8Co0.1Mn0.1O2进行了失效性实验,使用原位XRD观察发现正极材料本体并未出现明显的相变,Li/Ni混排程度也没有明显上升,只有局部结构和锂离子迁移速率的微小变化。晶间裂纹和动力学限制不是其结构疲劳的主要原因,相反,表面重构相变诱导的岩盐相等使得层状结构和岩盐相之间的晶格失配急剧增加才是原因。此外,晶体内的缺陷也对表面相变有一定的作用。Li等[42]依靠原位透射电子显微镜(Transmission electron microscope,TEM)在原子尺度观察了高镍正极材料在表面区域的结构演变,确认晶体缺陷可以引发形成杂质相,并且各相之间拥有明显的边界,过多的边界会迟滞离子的扩散。此外,当Li耗尽时,反向晶界沿层状结构扩展,而Li/TM离子在层状相中混排,沿相邻的孪晶边界诱导成形盐岩相。
除此之外,高镍正极材料表面在高温煅烧过程中还会在其表面会生成一定的强氧化性Ni4+,在电池循环过程中,过于活泼的组分会和电解液发生副反应,导致性能快速劣化,内部极化也会急剧增大[25]。目前对该问题的解决策略主要还是构筑稳定的表层,例如包覆、表面定点掺杂以及进行浓度梯度控制等。包覆和掺杂是较为传统的改性方式,浓度梯度控制则是在高镍正极材料的核心为高镍成分,而外层为富锰成分时,根据合成方式不同分为核壳型[43]和全浓度梯度型[44]。这种方式得到的高镍正极材料没有掺杂异原子,但表面的稳定性却因为表面高浓度的Mn得到极大提升。
1.4 结构稳定性
高镍正极材料会在充放电过程中发生机械疲劳,其最终表现形式为正极材料颗粒的晶内或晶间产生裂纹。通常,研究者认为晶内裂纹主要源自Li/Ni 混排、O 的释放以及晶粒内部本身存在的缺陷,而晶间裂纹则来自于Li嵌脱晶格时取向不一的一次晶粒的晶格应变。Mu 等[45]通过X 射线吸收光谱以及电子能量损失谱验证了裂纹的引发因素主要是层状结构中晶格O的释放和循环时层状结构向类岩盐结构相变引起的体积应变,并通过有限元模拟计算进一步说明了相应结果的合理性。Yan 等[46]也通过对高电压下循环的正极做出裂纹机制分析,扫描透射电子显微(Scanning transmission electron microscopy,STEM)图像显示晶内裂纹起源于晶粒内部,其出现、生长和晶粒内部与边界的位错存在着密切的关联。Kondrakov 等[16]观察了LiNi1/3Co1/3Mn1/3O2和LiNi0.8Co0.1Mn0.1O2在充放电过程中的晶格参数变化以及裂纹扩展情况。原位XRD结果显示,LiNi0.8Co0.1Mn0.1O2的晶胞体积变化明显大于LiNi1/3Co1/3Mn1/3O2,而原位光学显微镜观察到两者不同的体积变化,前者为(3.3±2.4)%,而后者为(7.8±1.5)%,如人们所预期。LiNi0.8Co0.1Mn0.1O2会呈现出更多的晶内裂纹,其形成过程如图4所示。
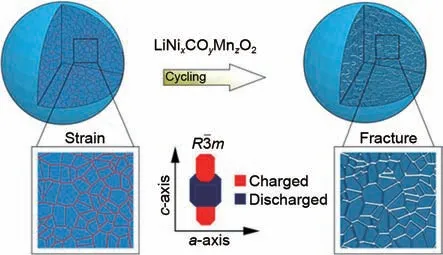
图4 高镍正极材料因各向异性的晶格应变产生晶间裂纹的示意图[16]Fig.4 Schematic diagram of high nickel ternary positive electrode producing intergranular crack due to anisotropic lattice strain[16]
但在电池的充放电过程中,因Li+的嵌脱会导致材料内部产生各向异性应力,相应的膨胀或收缩促使材料的本体内产生微裂纹[47]。这些裂纹使得正极的比表面积增大,经历多次反复的锂离子脱嵌之后,电极颗粒发生粉碎裂化。此外,电极材料的新增表面暴露在电解液中,新的界面形成会加剧或诱发新的副反应,加速正极电化学性能的衰减[48]。
1.5 热稳定性和安全性
在实际的工业化生产中,锂离子电池正极材料的热稳定性对电池安全性能的影响至关重要,因为导致电池热失控的主要原因在于电极材料与电解液。研究表明,在电池的充/放电过程中,随着电压的变化,高镍层状正极将会发生晶相的转变[49],其中的H3 相由于具有低热力学稳定性,尤其是在高温下易发生自身析氧反应,这种晶格氧的释放被认为是引起正极材料与电解液成分间副反应的根本原因之一[50],发生副反应过程中产生热量或释放可燃气造成电池的热失控,引起安全事故[40]。其中,又因LiNiO2的高镍含量,故其热稳定性相对来说低于一般正极材料[51],和LiNiO2相近的高镍正极材料也会有类似的问题。如图5所示的差示扫描量热分析(Differential scanning calorimetry,DSC) 结果[52],Ni 含量为1/3 时,其放热峰出现在306 ℃;Ni 含量为0.85 时,放热峰出现在225 ℃,热稳定性下降明显。随着Ni含量和Li脱嵌数量的增加,O和过渡金属离子的结合能逐渐降低,而Ni3+本身具有还原倾向,还原时往往将晶格O释放出来。而高温合并脱锂的状态下,TM-O 的结合能降低,O 的释放以及Ni 的还原都将加剧[39]。Lee 等[53]也提出热膨胀和氧空位均会影响高镍正极材料的热稳定性。X 射线近边吸收谱(X-ray absorption near edge structure,XANES)表明高温下Ni4+发生了剧烈的还原并形成了O空位。而热膨胀带来的晶格变化为阳离子迁移提供了有利途径,加剧了热分解,也是高镍正极材料高温下不稳定的因素之一。Bak 等[54]还提出O2和CO2出现与热分解过程中发生的相变密切相关,尤其是从层状结构向尖晶石相,再向岩盐相的转变。根据同步辐射X 射线衍射和质谱分析,高镍正极的荷电程度越高,发生相变的温度就越低,而O的释放就越迅速。
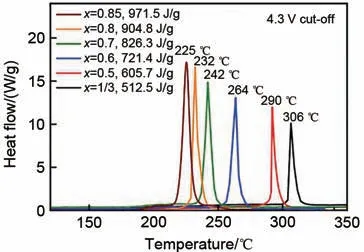
图5 不同含量高镍正极材料的DSC分析[52]Fig.5 DSC results of the Li1-δ[NixCoyMnz]O2 materials(x=1/3, 0.5, 0.6, 0.7, 0.8 and 0.85)[52]
2 高镍正极材料的稳定化改性方法
为应对上述各种高镍正极材料存在的问题,目前主要的稳定化改性方法和策略为本征组分调控与结构优化、浓度梯度控制、元素掺杂优化、包覆结构设计,以及多方法耦合联用等。
2.1 本征组分调控与结构优化
对高镍正极材料而言,不同的Ni、Co、Mn的原子比意味着材料具有不同的性质,因此寻找最合适的原子比以及调节元素分布就是材料设计的重中之重[55]。一般认为高镍正极的Ni提供主要的可逆容量,Co提高材料的电导率和倍率性能,而Mn则作为支撑离子保持层状结构的稳定。众所周知,Ni含量过高时会增加正极的不稳定性,引起层状结构坍塌,并发生容量衰退,但随着对高镍正极材料的研究深入,一些颠覆常规认知的观点也陆续被报道。例如,Lee等[56]对比了一系列的Ni含量不同的正极材料,发现随着Ni含量升高占据Li位点的Ni2+反而减少了,并且Li 层的宽度随Ni 的浓度上升而有所增加。尽管c轴在Li高度脱嵌状态下略有坍塌,但锂离子的输运路径却被保存下来,而且Ni含量更高的样品的电化学稳定性还要高过低Ni含量样品。无独有偶,Wu等[57]也报道了随着Ni2+含量上升,Li/Ni混排程度反而下降的现象,I(003)/I(104)的比值切实证明了这一点。基于以上的发现,Ni 含量超过90%(摩尔分数)的高镍正极越来越受到人们的关注,并且表现出了极为优秀的性能[58-59]。除了运用传统实验方法进行组分设计之外,高通量和人工智能技术在新材料研发过程中的应用也受到了研究者的广泛关注[60],运用计算机技术大大降低了新材料研发所需的物质成本与时间成本[61]。自从Ceder团队通过调整含有特定聚阴离子化合物中的元素,并计算其电化学参数进而选择优势材料以来[62],高通量理论计算在新材料探索上的应用得到不断发展。Min等[63]还通过机器学习技术对LiNixCo1-x-yMn1-x-y-zO2(x>0.8)合成过程中的元素比例等不同条件进行了模拟,通过逆设计得出了材料具有最佳性能的最优化合成参数,在后续实验中也验证了预测的正确性。
除了调控高镍正极中各元素组分外,材料晶体中某一特殊晶面的取向控制、暴露比例控制或晶界面结构优化,也可以帮助优化高镍正极材料的性能。Hua 等[64]采用高剪切混合器,以共沉淀法制备花朵状的前驱体。煅烧完成后,生成的层状氧化物材料具有明显的电化学活性平面[19]。通过SEM、TEM、和高分辨透射电子显微镜(High-resolution transmission electron microscopy,HR-TEM)观察了合成纳米片样品的正面和侧面,发现了明显的各向异性。并证实了纳米片的侧平面属于(010)晶面,这对提升电极的电化学性能很有帮助。还有研究人员结合纳米结构,对高镍正极材料晶界结构进行了优化。Park等[65]合成了具有棒状一次颗粒外壳的高镍正极材料,一次颗粒径向取向的一致性也促进了Li+在循环过程中的均匀分布以缓解充放电过程中引起的体积变化引起的应力,提供了更长的循环寿命和更高的容量保持率(2000次,78.5%)。为了稳定材料本体晶体结构,Xu等[67]还通过调控局部电子状态将C2/m型单斜相引入初级晶粒表面,形成了基于单斜晶系的网格状晶界结构,这种特殊晶界形态稳定了内部结构,在一定程度上抑制了充放电过程中的H2→H3不利相变,增强了正极材料的循环稳定性,在循环300次后正极材料没有明显降解现象发生。此外,三维网状分布的单斜晶界结构也为电子和离子提供了有利的扩散通道,正极材料在5 C倍率下仍具有152.7 mAh/g放电比容量,提升了材料的倍率性能。研究还发现单晶NCM 正极材料具有更高的结构完整性,为得到单晶正极材料,通常通过精确控制共沉淀前驱体的煅烧温度来实现晶粒尺寸的有效细化,离子扩散通道的缩短有助于正极材料的容量发挥,较少的晶间界面则更有利于材料结构稳定性,有效减少或抑制正极材料与电解液/质之间的副反应[66]。通过控温共沉淀法,Saleem等[68]合成了由微米级初级颗粒构成的单晶高镍正极材料,次级离子的分层微球结构有效减少了电极材料与电解液之间的副反应,在循环200 次后仍有85%以上的容量保持率,并且保持了材料的结构完整性,未观察到明显的晶格位移与微裂纹,这也确保了材料较高的循环稳定性,在500次循环后容量仍能达到121.3 mAh/g。虽然单晶高镍正极材料相比典型多晶高镍正极材料在性能上的提升显著,但目前主流的用于合成单晶高镍正极材料的熔盐法和高温法还存在很多缺点和难题,一是熔盐法中用到的熔盐会随着熔融过程进入单晶,造成正极性能的损失,因此熔盐的选择也成为了熔盐法合成所面临的主要问题之一;二是在高温法合成过程中由于较高的温度易造成Li 和O 的释放,形成结构缺陷,在一定程度限制了单晶正极材料的性能[69]。Cao等[70]通过在块状前驱体中添加聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)和Na2SiO4,而后再通过高温锂化合成了具有大量暴露(010)晶面的微块状单晶LiNi0.8Co0.1Mn0.1O2正极材料,大量与c轴平行的(010)晶面使得Li+能够快速在微粒内扩散,在20 C、4.4 V 的高倍率放电条件下仍表现出152.2 mAh/g的高放电比容量,原位XRD测试结果表明其在循环中的结构稳定性显著增强。除此之外研究人员还利用单晶一次颗粒对正极材料本体结构进行了优化[71],合成了由径向单晶一次颗粒组成的具有大量活性(010)晶面的微米级高镍正极材料,形成的中心到表面的三维离子扩散通道增强了Li+的扩散,材料内部的应力能够在这种径向具有一致取向的结构中得到缓解。为缓解高镍正极材料循环过程中的应力引起的异常形变,Wang 等[72]还通过相干相的引入来稳定晶格(结构示意图见图6),由于相干钙钛矿相的“钉扎效应”,循环过程中的晶格结构变化得到了明显的抑制,在1 C下循环200次后具有94.7%的优异容量保持率,循环性能明显得到增强。稳定的晶体结构能够增强正极材料的循环稳定性,提高正极材料的耐用性,对于高镍正极材料的稳定化改性具有重要意义。
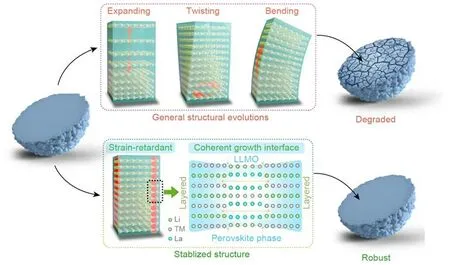
图6 材料结构示意图[72]Fig.6 Schematic diagram of material structural design[72]
2.2 浓度梯度控制
高镍正极材料的很多问题来自于表面,包括Li/Ni混排、表面副反应、残余锂化合物、结构稳定性低等都和颗粒表面有相当的关系,或者一些负面作用都需要通过表面的缺陷衍化才能进一步影响到正极材料的性能。为了改善高镍正极材料的稳定性,同时不引入其他的异元素的影响,汉阳大学的Sun Yang-Kook 团队[73-75]用共沉淀法合成了核壳型的浓度梯度高镍正极前驱体,其在体相内部是高镍低锰的核心,而外部在共沉淀时通过溶液调配得到低镍高锰的外壳,最大限度地保证了正极材料的总Ni含量的同时,减少了Ni2+的比例。正极材料中Ni、Co、Mn 三种元素呈梯度分布,而其表面具有高Mn4+含量,为了平衡电性,Ni2+含量随之减少,Ni3+的含量相对提高[76],一定程度上增加了电池的循环稳定性,达到了提升电池电化学稳定性的目的,图7为浓度梯度分布高镍正极材料的示意图。在浓度相同时,相比于一般均一浓度的高镍正极材料而言,浓度梯度正极的初始容量更高,而循环稳定性和热稳定性也更好。
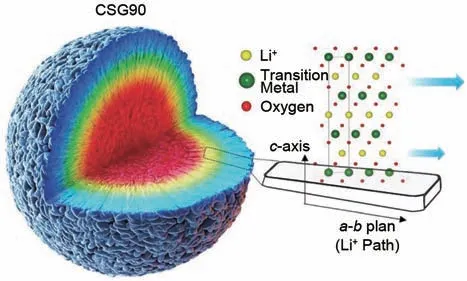
图7 浓度梯度分布高镍正极材料的示意图[77]Fig.7 Schematic diagram of CSG particle with Ni-rich core surrounded by compositional partitioning outer layer[77]
全浓度梯度型高镍正极材料的合成同样基于共沉淀法,在进料的时候将低Ni 的溶液缓慢泵入高Ni 的溶液,泵入的同时在Ni 溶液的容器中不断搅拌至溶液均匀,同时将混合均匀的溶液泵入反应釜中进行反应,这样就可以得到完全浓度梯度(Full concentration gradient,FCG)的材料[78]。相比于均一核壳型结构,这样获得的材料具有连续的浓度梯度,材料的结合更加紧密,充放电过程中的晶格配位更加合理,而核壳结构的结合层则存在较多的缺陷,会更容易引发机械性失效,造成裂纹[79]。Sun Yang-Kook团队[80]在共沉淀过程中,将较低镍含量溶液(Ni∶Co∶Mn 摩尔比为0.25∶0.23∶0.52)溶液与高镍含量溶液缓慢混合(Ni∶Co∶Mn 摩尔比为0.9∶0.05∶0.05),在连续搅拌反应釜中反应后,最终得到原子配比为LiNi0.83Co0.07Mn0.10O2的正极材料。与单纯的高镍核心材料相比,浓度梯度材料具有更好的锂嵌入稳定性和热稳定性。高容量源于富含镍的内核LiNi0.9Co0.05Mn0.05O2,通过外表面构筑的低镍层来提高稳定性。Lee 等[81]还通过共沉淀方法合成全浓度梯度正极材料,以该正极组装的全电池可连续工作2500 个循环,容量保持率为83.3%。优化过渡金属浓度梯度,降低循环过程中产生的微应变,可以进一步提高浓度梯度正极材料的电化学性能。通过不同的浓度梯度策略可以有效提升材料的容量和稳定性,表1是近年研究中的几种不同的浓度梯度改性方法,通过不同的浓度梯度策略对于电池容量和循环稳定性均有一定程度提升。此外,Feng 等[82]还采用了一种简便的机械熔融制备方法,合成的Ni 梯度结构高镍正极材料在1 C 下循环200次后仍具有80%以上的容量保持率,为高性能浓度梯度结构高镍正极材料的大规模合成提供了可行的方法。全浓度梯度改性对于高镍正极材料在极端放电条件下的性能和稳定性也能起到一定提升作用,由内及外镍含量的减少及锰含量的增加赋予了正极材料优异的循环稳定性,即使在高温高倍率条件下仍可保持较高的放电容量和良好的循环稳定性。值得注意的是,在正极材料的循环稳定性方面,浓度梯度改性策略往往可以通过调节不同组分的分布,稳定高镍正极材料表面和内部结构,对于增强高镍正极材料在不同使用条件下的稳定性具有重要作用。

表1 近年研究中的浓度梯度设计应用Table 1 Application of concentration gradient design in recent years
2.3 元素掺杂优化
元素掺杂是指向高镍正极材料中引入少量杂原子,有别于此前的本征元素浓度梯度的控制,尤其是一些能够改善Li+电导率的Na[86]、F[87]等元素,能够增加结构稳定性的Mg[88]、Ti[89]、Mo[90]等元素,常被用于改善高镍正极材料的性能和稳定性,概括来说,掺杂主要通过以下几个因素来影响电极材料的性能:大尺寸原子的掺杂增加锂层高度进而促进Li+的传输,掺杂离子对元素价态的调控以降低Ni2+比例或通过静电力抑制Ni2+的迁移进而抑制阳离子混排的发生。此外通过合理的元素掺杂能够增强M—O键的键合强度,抑制晶格氧的释放,进而达到稳定晶格的作用,同时较少的晶格O释放会显著减少副反应的发生,提高正极材料的循环稳定性[91]。按照掺杂的元素电性的不同,可分为阳离子掺杂、阴离子掺杂以及多离子共掺杂。
常见的掺杂方法之一是阳离子掺杂,当向高镍正极材中掺杂等价的阳离子时,可以抑制离子混排和相变,提供离子通道、改善材料的离子电导率、增加材料的稳定性,提升倍率性能。采用不等价阳离子掺杂时,会使过渡金属离子的价态升高或降低,产生相应的载流子、改变材料能带结构,从而提高其本征电子电导率,进而改善其电化学性能。在 以 往 的 研 究 中,Al[92]、Zr[93-94]、Ti[95-96]、W[97-98]、Mg[99-100]、B[101]等都被尝试作为掺杂元素加入高镍正极材料中,以提升其电化学性能和结构稳定性。Du[102]在LiNi0.8Co0.1Mn0.1O2中掺入Ti元素,获得了在4.5 V截止电压下稳定的正极材料,其在0.1 C下容量达到205.7 mAh/g,且在200 次充放电循环后,容量保持率为86.9%。Xie 等[99]通过Mg 掺杂合成Li0.98Mg0.02Ni0.94Co0.06O2,其中Mg2+占据了Li 位点作为支撑离子,减少了循环过程中的各向异性晶格畸变,从而大大提高了正极材料的循环稳定性和热稳定性(见图8)。掺杂后比容量可达到214 mAh/g,并且制备的软包全电池充放电500次后依然有80.1%的容量保持率,远超过未改性的高镍正极。除此之外,为了提高元素掺杂的效率与合理性,研究人员还利用人工智能技术对掺杂元素进行合理筛选,Zhou 等[103]利用第一性原理对不同d0区阳离子掺杂的插层电位、氧空位等参数进行了系统的分析,指出d0元素的掺杂可以提高Li嵌入电压,进而提高材料的比容量,对于嵌脱Li过程中晶格的变化研究显示,d0阳离子的掺杂可以有效抑制晶格c的拉伸,提高电池稳定性,其中Mo6+表现最为出色,对后续研究具有一定指导意义。Kim等[104]还对比了多种掺杂元素对高镍正极材料次级粒子微观结构的影响,通过实验证明了掺杂不同元素的次级粒子形状具有明显差异,当掺杂元素价态大于3时,可以促进Ni/Li的有序排列,增加锂化层状结构的稳定性,为高镍正极材料掺杂改性的研究提供了理论指导。
其次是阴离子掺杂。主要使用的元素是F 元素,F取代材料晶体中的O,会获得比TM—O键更强的TM—F 键,键能更强的结合键会提高材料的稳定性,抑制晶格O 的析出,增强材料的安全性。然而结合力强的化学键会使Li的嵌脱受到阻碍,所以容量会略有下降。Woo 等[106]采用F 掺杂LiNi0.8Co0.1Mn0.1O2,相比于未掺杂样品,掺杂F 后样品的结构和性能都十分稳定,未掺杂样品在充放电循环后很快就在表面形成了无序的岩盐相,而F掺杂的材料表面依旧保持着层状结构,并且热稳定性明显提升,产热明显减少。
对比使用正电性离子(如Ga3+、Mg2+、Ti4+等)与负电性离子(如F-、S2-等)掺杂时不同的作用与影响,正电性离子掺杂时,阳离子主要通过抑制氧空位形成或抑制晶型结构改变来提高材料稳定性,同时有些阳离子可以将Ni氧化还原进而增加电池充放电容量;负电性离子掺杂时,主要通过抑制O的析出来提高材料循环稳定性。表2显示了几种不同掺杂离子的特征参数及其掺杂效果。根据表中显示,随着掺杂离子的半径增加,改性后的正极容量、循环稳定性呈现出不断增加的趋势,相比于Li+(0.76 Å)的半径,较大的掺杂离子半径可以有效拓宽晶格间距,提升Li+的迁移速率,起到抑制阳离子混排的作用,因而表现出更高的比容量和稳定的循环性能。此外,负离子与过渡金属所形成的强结合力化学键对正极的循环稳定性也起着重要作用。
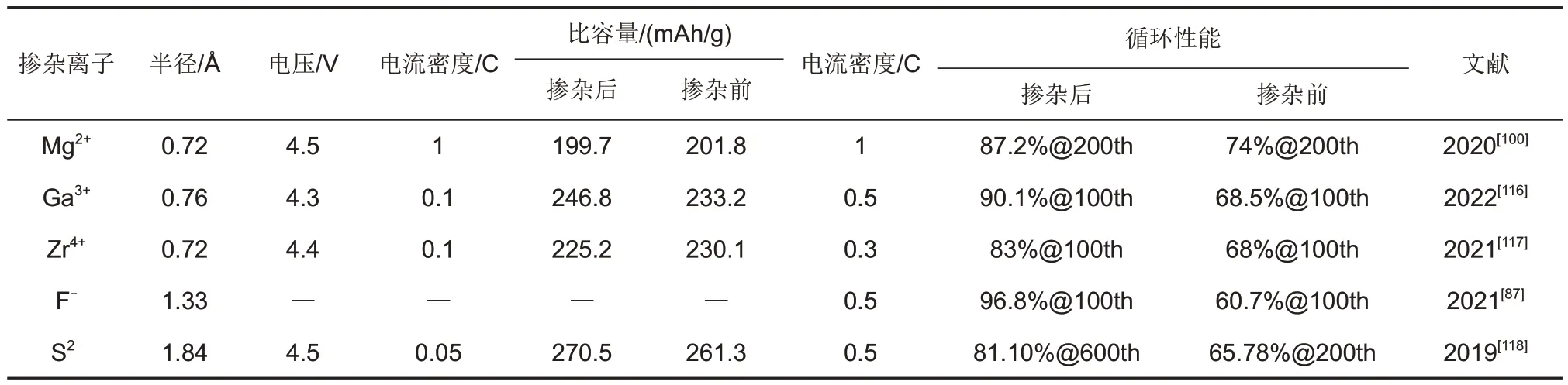
表2 近年研究中的几种不同离子掺杂应用Table 2 Several different ion doping applications in recent years
此外,鉴于单一离子掺杂对高镍正极材料性能改善的局限性,一些研究人员将研究重点聚焦在多离子共掺杂上[107]。目前Zr-Ti[108]、Mg-Ti[109]、P-F[110]、Na-Al[111]等共掺杂已被证明对正极材料性能及结构稳定性具有重要作用。其优化效果要强于单独的元素掺杂的效果,可以很好地结合两种元素的优点。如Mn4+掺杂LiNi0.8Co0.15Al0.05O2虽能够通过支柱层的形成提升正极材料的结构稳定性[112],但是高价Mn4+的引入难以避免会增加Ni2+的比例,加剧阳离子混排。但是,通过引入异种电荷则可以有效缓解该问题,Qiu等[113]通过共掺杂制备了具有优异放电容量和循环稳定性的高镍正极材料,在发挥Mn4+层支柱作用的同时,引入PO43-来缓解因高价正离子掺杂引起的Ni2+含量升高,此外,PO43-的掺杂还能够抑制Ni2+向锂位的迁移[114],增加了材料结构的循环稳定性,在55 ℃的工作条件下循环100 次后仍具有80%以上的容量保持率。在Mn2+和PO43-协同作用下改性效果得到显著增强。研究人员还利用熵稳定性质,通过掺杂多种元素,制备出了一系列高熵正极材料,Zhang等[115]将元素Mn、Ti、Mg、Nb、Mo同时引入高镍正极材料中,结合共沉淀法制备了具有稳定晶格结构的高熵正极材料LiNi0.8Mn0.13Ti0.02Mg0.02Nb0.01Mo0.02O2,元素掺杂引起的“钉扎效应”使得该正极材料在循环时的结构稳定性得到显著增强,循环期间体积应变仅为0.3%,有利于正极在长期循环甚至极端条件下的结构稳定。这种高熵多元素掺杂策略有效缓解了高镍正极材料循环过程中的体积应变问题,为锂离子电池高镍正极的稳定化研究提供了新思路。
2.4 包覆结构设计
高镍正极材料虽具有较高的可逆容量,但同时也带来了更高的表面催化活性,在空气中和电解液中都容易发生副反应。包覆改性可以对高镍正极表界面进行必要保护,避免其和空气以及电解液直接接触,抑制表面副反应的发生;除此之外,部分包覆层还可以增强离子迁移率和电子电导率以改善电极材料的电化学性能,也可以依托紧密而坚固的包覆层来抑制充放电过程中正极材料的体积膨胀变化以减少材料的晶间裂纹,进而提高正极材料的循环稳定性。按照包覆的物质类别不同,可以分为氧化物(Al2O3[119]、TiO2[120-121]、V2O5[122]、Li2ZrO3[93]等)、盐 类(AlF3[123]、LaF3[124]、Li3PO4[125]、AlPO4[126]、ZrP2O7[127]等)和聚合物(聚吡咯[128]、PVP[129]、硅氧烷[130]等)的包覆。表3 列举了近年来几种不同包覆材料的典型应用,随着包覆材料种类的改变,产生的改性效果也相应有所变化,包覆材料的性质一定程度上决定了正极材料改性的效果。
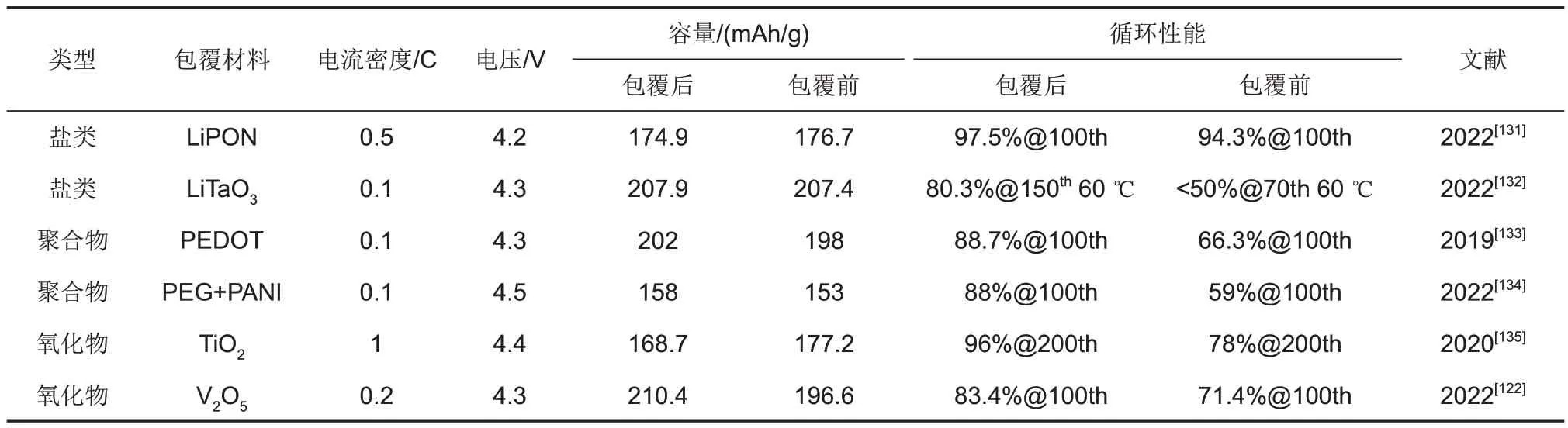
表3 近年研究中几种不同包覆材料的典型应用Table 3 Application of several different coating materials in recent years
氧化物包覆通常起到保护层的作用,防止正极材料直接暴露在电解质中,通过阻止正极材料与电解液之间的副反应,维持材料界面稳定性,提高电化学性能和循环稳定性。然而,氧化物层本质上也是一个电阻层,会导致电池极化增大。Cho等[136]通过湿法在LiNi0.6Mn0.2Co0.2O2表面包覆纳米级SiO2(如图9),电极由于惰性氧化物层的包覆表现出较低的倍率能力,但其在60 ℃高温下的循环性能大大增强,电化学阻抗图谱(Electrochemical Impedance Spectroscopy,EIS)表明SiO2包覆能降低材料的阻抗。此外,SiO2包覆层还能够吸收电池体系中的HF,保护正极材料免受腐蚀。除了常用的氧化物以外,一些快离子导体氧化物也被用于包覆电极材料。相比于一般的氧化物,快离子导体能够提供离子通道以保证电极的倍率性能。Qian 等[137]使用Li0.125La0.625TiO3/Li0.35La0.55TiO3(LLTO)快离子导体包覆LiNi0.8Co0.15Al0.05O2正极材料,能为电极提供较低的Li迁移活化势垒。与空白样品相比,包覆样品中的Li离子扩散系数(2×10-12,3.5 V)几乎比未包覆的空白样品(2×10-13,3.5 V)高一个数量级,正极的界面电荷转移阻抗和锂离子输运阻抗降低了50%,因此包覆后材料的倍率和循环性能获得显著提升。同样地,具有优异电子传导能力的石墨烯也被用在高镍正极材料的包覆改性中,Chen 等[138]首先将能够促进Li+传导的磺酸基团(—HSO3)嫁接于石墨烯结构,并对石墨烯磺酸官能化的量进行优化控制,再将磺酸化的石墨烯包覆在LiNi0.5Mn1.5O4材料表面,基于该改性材料制备出的电池具有较为优异的循环性能,其在1000 次循环后仍具有98%的容量保持率,此外,得益于较高的Li+扩散动力学,电池在10 C的高倍率下仍具有78.5 mAh/g的放电比容量,表现出优异的倍率性能。

图9 SiO2包覆的LiNi0.6Mn0.2Co0.2O2颗粒 (a) 表面SEM图(b) SEM-EDS 元素分布图[136]Fig.9 FESEM results of P-NCM and S-NCM: (a) SEM images, (b) SEM-EDS mapping of S-NCM[136]
盐类包覆常采用离子或电子导体的盐类作为包覆层材料,这类包覆能够改变表面性质,提升正极材料的倍率性能,最常采用的包覆物是氟化物和磷酸盐。AlF3是典型的惰性包覆物,能有效提升高镍正极材料体系在高电压下的稳定性。Lee等[139]采用简单的固相包覆工艺,在LiNi0.8Co0.15Al0.05O2表面包覆50 nm 厚的AlF3。在全电池(石墨负极)中,AlF3包覆的LiNi0.8Co0.15Al0.05O2正极在循环55 ℃下循环500次后仍具有55.9%的容量保持率,而未包覆的空白正极材料仅有11.7%的容量保持率,循环性能显著提高。可见,纳米级AlF3的包覆可以有效提高材料的热稳定性。并且优良的电化学性能可能是因为包覆的AlF3阻止了过渡金属离子在HF中的溶解。磷酸盐由于具有较强的PO4共价键和隔离功能,是一种具备商业化前景的高镍正极材料涂层,可以提高材料的热稳定性和过充性能。Sattar等[140]将高镍正极表面的残余锂化合物转化为Li3PO4,在去除残余锂的同时完成磷酸盐包覆,在之后的循环中降低了电极极化,在5 C高倍率下仍具有94.6 mAh/g的放电比容量,相比未改性原始正极材料的33.4 mAh/g显示出显著提高的倍率性能。Wu 等[141]还利用新型成膜工艺将金属离子配位化合物AlPO4包覆在正极材料上,基于这种新的成膜包覆工艺,获得了厚度均匀且可控的超薄分子尺度涂层,在4.5 V 的截止电压下,全电池(石墨负极)在100 次循环后的容量保持率较未包覆原始正极材料提高17%,循环稳定性大幅提升,此外,该正极材料还表现出优异的热稳定性和安全性,显示出了AlPO4包覆对于改善高镍正极材料循环稳定性和安全性的重要作用。
聚合物包覆往往有特殊的目的。例如,高镍正极材料表面包覆导电聚合物能够提升电极材料的电化学性能,并且由于聚合物本身的弹性,可以抵消充放电过程中产生的应力,避免其产生微裂纹。此外还可以在材料表面包覆超薄的疏水聚合物,解决高镍材料的高碱性吸水及残余锂的问题,同时也能在电解液中保护正极,减少和电解液或水的副反应。Chen 等[142]使用(NH4)2HPO4处理正极材料,将不利的残余锂转化为具有良好Li+传输能力的Li3PO4。在提高表面稳定性的同时,也提高了离子传导速率,表面均匀包覆的导电聚合物聚吡咯也起到了提高电子导电性的作用。此外,聚吡咯外壳的弹性还可以抵抗内部应力,减少晶间裂纹的出现,在0.1 C下循环50次后容量保持率比未改性原始材料提高了9.1%,10 C 下的放电比容量也提升了27%。我们先前的工作[38]则通过一种快速简便的湿化学方法,通过材料浸入将厚度约为5个分子层的聚二甲基硅氧烷包覆到LiNi0.8Co0.1Mn0.1O2上。这种分子层级的包覆方法与其他同等尺度的包覆方法[143-144]相比不需要后期的加热,而且没有对LiNi0.8Co0.1Mn0.1O2前驱体进行破坏污染,在提高材料耐久性和环境稳定性的同时尽可能地保持了电池材料的性能。这种分子层级的涂层具有强疏水性,通过抑制阳极表面锂化物产生及生长,提升材料在极端条件下的循环稳定性,在潮湿的环境下放置120 h后仍具有190.1 mAh/g的高放电比容量(空白LiNi0.8Co0.1Mn0.1O2167.9 mAh/g)和90.1%(空白LiNi0.8Co0.1Mn0.1O278.75%)的高容量保持率。该方法为电极的疏水处理提供了一种方便快捷的通用途径,具有重要的现实意义。
2.5 多方法耦合联用
目前,单一的改性手法虽对容量和循环寿命的研究越来越成熟,但为了达到安全性、高比容量和长循环寿命兼顾的目的,一些研究人员尝试通过多种改性方法联用来提升改性效果或实现多方面性能改善。Luo 等[145]还通过引入H3BO3来去除残留的LiOH 和LiCO3实现B3+掺杂并在表面形成Li2B4O7涂层,B3+在过渡金属离子位点或氧四面体间隙位点的掺杂通过调节材料表面价态分布抑制过渡金属的迁移,减少Li/Ni 混排的发生,进而提高了循环稳定性,难溶于有机电解质的Li2B4O7涂层同时也有效减弱了循环过程中正极表面的副反应发生,与原始正极材料相比,其循环寿命和放电比容量显著提高。Zhang等[146]还通过控制煅烧温度与两步烧结操作,将掺杂、包覆、优化浓度梯度三种改性策略相结合,制备了Ti掺杂的全浓度梯度LiNi0.75Co0.15Mn0.10O2正极材料,并且为了优化正极表面,还使用Li+导电性和耐腐蚀性优异的Li2ZrO3(LZO)作为表面涂层(如图10),具有261.5 ℃的高热释放温度,在55 ℃状态下进行200 次循环后仍具有88.1%的高容量保持率,不仅如此,得益于电极表面的LZO涂层,电极具有更高的Li+电导率和更大的晶格,能够有效减轻电解液向正极内部的侵蚀,阻止本征层状结构向尖晶石相或岩盐相的转变。
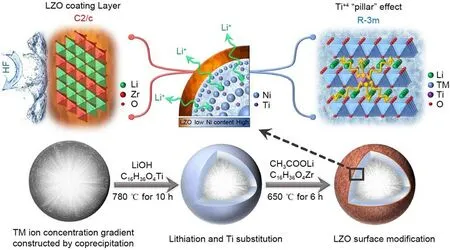
图10 改性高镍浓度梯度正极材料合成工艺及结构示意图[146]Fig.10 Schematic illustration of synthesis process and structural description for the modified Ni-rich concentration gradient CAM[146]
多种改性方法的联用,能够对单一改性方法起到综合利用,如掺杂改性虽然能够有效减少Li/Ni混排,但其对正极表面副反应的抑制却报道较少,通过合理联用其他改性方法如表面包覆涂层则可以显著缓解正极与电解液的副反应问题[147]。表4是几种不同的改性方法联用研究,研究中通过联用多种改性方法对高镍正极的性能和稳定性等进行了针对性的改进,充放电过程中的相变常常造成晶面间的应力不均,从而引起晶间裂纹的产生;Jamil 等[148]为了提升高镍正极循环稳定性,合成了具有单晶结构、Nb2+掺杂的LiNi0.8Co0.1Mn0.1O2材料,Nb2+的掺杂拉长了晶胞c轴,进而提升了电池的放电容量,联用两种改性方法使改性后的高镍正极在极端放电条件下也能具有优异的性能,在55 ℃的放电条件

表4 近年研究中多种改性方法联用的应用Table 4 Application of multiple modification methods in recent years
下循环100 次后仍具有86.7%的高容量保持率。Mo等[149]通过浓度梯度和Ti4+掺杂的方法,制备了具有全浓度梯度的高镍正极材料,并且在Ti4+掺杂下各元素不同价态的组成得到优化,从中心LiNi0.91Co0.06Mn0.03O2到表面LiNi0.55Co0.16Mn0.29O2,这种优化的梯度分布可以有效增加材料在高SOC 下的结构稳定性,TiO2的引入同时调节了结构内过渡金属的浓度梯度,尤其是外层较低的Ni含量有效减少了正极材料与电解液之间的副反应,有利于正极材料表-界面稳定,在150 次循环后容量保持率提升18%,达到了96%,提高了正极的循环稳定性。此外,Ti与O形成的强Ti—O键可以有效抑制高镍正极材料中晶格O的释放,有助于保持层状的结构稳定性。但随着不同改性策略的联用,由其带来的操作复杂性也愈发明显,因此迫切需要探索更加简便的多方法联用改性方法,在最大化发挥改性效果的同时,避免因复杂的改性操作带来的不必要性能损失。
3 结语与展望
本文从高镍正极材料存在的阳离子混排、贮存/使用过程中残余的锂化物、循环过程中的界面稳定性、结构稳定性以及热稳定性和安全性等问题出发,阐述了本征组分调控与结构优化、浓度梯度控制、元素掺杂优化、包覆结构设计,以及多方法耦合联用等稳定化改性方法,梳理了各种方法的特性及研究现状。经分析认为,在众多的高镍正极材料改性策略中,更小尺度,更加精细化的改性策略逐渐成为研究的趋势,通过纳米级,甚至原子级结构优化来实现更好的结构稳定性。在包覆涂层的选择上,兼顾高的离子扩散率和电子导电率的超薄的涂层在抑制界面副反应、增强高镍正极结构和热稳定性的同时,又能最小化涂层结构对材料性能的负面影响,在改善锂离子电池高镍正极材料的循环稳定性和温度稳定性的过程中受到越来越多的关注。在高镍正极材料稳定化改性研究中,应结合应用场景和使用工况进行定制化加工和精准设计,合理运用不同改性方法,对高镍正极材料的特性进行针对性改性,虽然对此已有大量研究,但是一般工艺较为复杂,改性效果也难以满足预期,未来还需针对定制化改性工艺的简化以及改性策略的优化进行深入研究。
