前胡总香豆素对高糖诱导人脐静脉内皮细胞损伤的保护作用*
2023-06-14房小钰葛廷雨常文莉黄和平徐国兵汪电雷
房小钰,葛廷雨,刘 森,常文莉,黄 鹏,黄和平,徐国兵,2,汪电雷
(1.安徽中医药大学药学院,安徽 合肥 230031;2.安徽省食品药品检验研究院,安徽 合肥 230051)
糖尿病是一种常见的内分泌系统疾病,其病因是胰岛素分泌不足或机体对胰岛素抵抗。血管病变是糖尿病患者可能出现的最严重疾病之一,其起因是高糖诱导使血管内皮细胞受到损伤[1]。糖尿病的发病时间较长,而长时间处于高血糖状态会给身体的各种组织和器官造成慢性损害,从而导致身体功能性损害[2-4]。糖尿病的发病率和氧化应激有着密切的关联。若机体发生氧化应激反应,微循环就会遭到损坏,继而累及人体内的血管内皮细胞,而且长时间处于高血糖状态将会对血管内皮细胞造成严重的损伤[5]。
前胡始载于《名医别录》中,主要采集于伞形科白花前胡(Peucedanum praeruptorumDunn)的干燥根,具有降气化痰、疏散风热等功效[6]。前胡主要成分为香豆素类化合物。目前有研究发现香豆素类化合物具有保护血管、抗氧化、抗HIV、抗肿瘤等药理作用[7-9],而且香豆素类化合物有着多靶点调节,疗效温和、持久,以及副作用较小等优点。韩莹等[10]研究发现3-溴-4,7-二甲基-6-磺酰脲香豆素可明显降低小鼠血糖。前胡总香豆素能降低2型糖尿病大鼠血糖[11]。为了进一步探究其降糖作用机制,本研究采用人脐静脉内皮细胞建立高糖诱导的HUVECs损伤模型,观察前胡总香豆素对氧化应激和细胞凋亡的影响,以期为前胡总香豆素降糖效果研究提供参考。
1 材料
1.1 细胞株 HUVECs(批号:CRL-1730)由安徽省食品药品检验研究院提供。
1.2 药物与试剂 前胡总香豆素(批号:20201206)由安徽省食品药品检验研究院提供;胎牛血清(批号:42Q0682K)购自美国Gibco公司;DMEM低糖培养基(批号:AG29694193)购自美国HyClone公司;CCK-8(批号:71011000)购自Biosharp;GSH-Px检测试剂盒(批号:S0056)、SOD活性检测试剂盒(批号:S0101S)、NO检测试剂盒(批号:S0021S)、LDH毒性检测试剂盒(批号:C0016)、Hoechst 33258染色试剂盒(批号:C003)均购自碧云天生物技术研究所;MDA检测试剂盒(批号:BL904A)购自Biosharp;人TNF-α酶联免疫分析试剂盒(批号:202110)、人IL-1β酶联免疫分析试剂盒(批号:202110)均购自江苏酶免实业有限公司;Bcl-2抗体(批号:AF6139)、Bax抗体(批号:AF0120)均购自Affinity Biosciences;cleaved Caspase-3抗体(批号:R23727)购自Zenbio;GAPDH抗体(批号:210040421)、辣根酶标记山羊抗小鼠IgG(批号:216790201)、辣根酶标记山羊抗兔IgG(批号:210830419)均购自北京中杉金桥生物技术有限公司。
1.3 主要仪器 CLM-170B-8-CN型CO2细胞培养箱(新加坡艺思高科技有限公司);SW-CJ-1D型超净工作台(苏州博莱尔净化设备有限公司);SC-3610型低速离心机(科大创新股份有限公司中佳分公司);IX71型倒置显微镜(日本Olympus公司);MS-1500型酶标仪(美国Thermo公司);AI-600型超灵敏多功能成像仪(美国CE Amersham Imager公司)。
2 方法
2.1 HUVECs培养 人脐静脉内皮细胞置于10%胎牛血清DMEM低糖培养基中,在培养箱中进行孵育,条件为37 ℃,5%CO2。2 d换一次培养基,待细胞生长到80%左右,加入胰酶消化传代,取对数生长期细胞进行实验。
2.2 前胡总香豆素对高糖诱导HUVECs损伤模型的浓度筛选将细胞以密度为5×104个/mL接种在96孔板内,100 μL/孔,在培养箱放置过夜使之贴壁,然后吸尽培养液,随机分成8组。正常对照组加入新的培养液;高糖模型组及给药组分别加入100 μL高糖培养基培养48 h后,高糖模型组加入完全培养基,给药组分别加入不同浓度的前胡总香豆素(5、10、20、40、80、160 μg/mL),放入培养箱孵育,24 h后向培养板加入CCK-8试剂,10 μL/孔,继续放培养箱内孵育45 min,酶标仪检测450 nm处的OD值,计算细胞增殖活力。
2.3 细胞分组与给药 将HUVECs随机分成正常对照组、高糖模型组、前胡总香豆素低剂量组、前胡总香豆素中剂量组、前胡总香豆素高剂量组。正常对照组:加入5.5 mmol/L葡萄糖;高糖模型组:加入35 mmol/L葡萄糖;前胡总香豆素低剂量组:先加入35 mmol/L葡萄糖培养48 h,再加入10 μg/mL的前胡总香豆素;前胡总香豆素中剂量组:先加入35 mmol/L葡萄糖培养48 h,再加入20 μg/mL的前胡总香豆素;前胡总香豆素高剂量组:先加入35 mmol/L葡萄糖培养48 h,再加入40 μg/mL的前胡总香豆素。然后各组放培养箱内继续培养24 h,以备后续指标检测。
2.4 倒置显微镜观察HUVECs形态 将细胞以密度为8×103个/mL接种在6孔板内,按“2.3”项下分组分别给药培养后,使用倒置显微镜观察各组细胞的形态变化并拍照。
2.5 GSH-Px、SOD活性及MDA含量检测
2.5.1 GSH-Px活性检测 依照操作说明往96孔板中按顺序加入各种试剂溶液,轻缓摇晃使之混匀。即刻使用酶标仪测各孔在340 nm处的OD值,此时记录为0 min数值。待酶标仪温度达到25 ℃时再测定OD340值,此后每隔1 min记录一次,连续5次,可获得6个点的数据,计算GSH-Px活性。
2.5.2 SOD活性检测 依照说明书配制所需溶液,设置待测样品组、空白对照组1、空白对照组2,按顺序放待测样品及其余各种溶液,最后放反应启动工作液并使之充分混匀,37 ℃静置30 min,使用酶标仪测450 nm处的OD值,计算SOD活性。
2.5.3 MDA含量测定 按照说明书配制所需溶液,设置空白对照组、标准品组、待测样品组。并按照说明书操作步骤依次加样,最后酶标仪上测定532 nm波长下的吸光度。对应的试样浓度由标准曲线和吸光度进行计算,再根据用BCA试剂盒检测出的蛋白浓度计算各组细胞的MDA含量。
2.6 HUVECs培养上清液中NO、LDH含量检测 将细胞以密度为8×103/mL接种在6孔板内,按“2.3”项下分组分别给药培养后,取上清液,严格依照各说明书进行操作,检测其上清液中NO、LDH含量。
2.7 Hoechst染色检测HUVECs凋亡 将细胞以密度为8×103个/mL接种在6孔板内,按“2.3”项下分组分别给药培养后,弃培养液,用PBS清洗3次。滴加4%多聚甲醛,1 mL/孔,固定20 min,弃去,PBS冲洗3次。每孔加Hoechst 33258染色液1 mL,染色10 min(摇床),弃去,PBS冲洗3次。每孔加0.5 mL抗荧光淬灭剂,使用荧光倒置显微镜观察并拍照。
2.8 ELISA法检测各组细胞上清液中TNF-α和IL-1β水平 收集各组干预后的细胞培养液,3 000 r/min(4 ℃)离心10 min,取上清液,严格按照ELISA试剂盒说明书操作步骤,进行样品及标准品的稀释、加样、孵育抗体、加显色剂等操作,酶标仪450 nm波长下测OD值。将标准品浓度作为横坐标,各孔OD值作为纵坐标,绘制标曲。再根据标曲线计算样品浓度。
2.9 Western blotting法检测Bcl-2、Bax、cleaved Caspase-3蛋白相对表达量 收集5组细胞提取总蛋白,用BCA法测定各组细胞蛋白浓度,然后在每组中加入5倍上样缓冲液用100 ℃沸水煮13 min,之后蛋白上样、凝胶电泳(115 V,1.5 h)、转膜(100 V,45 min),用5%脱脂奶粉对其密封2 h,用TBST洗膜3次,10 min/次。加入一抗,4 ℃下静置一夜,摇床孵育30 min,保持4 ℃恒温下静置一夜,再用TBST洗膜3次,每次清洗10 min,换二抗再孵育2 h,在使用TBST洗膜3次,10 min/次,涂抹ECL,使用超灵敏多功能成像仪检测样品灰度值,该实验需要独立并重复3次。
2.10 统计学方法 使用GraphPad Prism 8进行数据分析,计量资料以“均数±标准差”表示,采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
3 结果
3.1 前胡总香豆素对高糖诱导HUVECs损伤模型的有效浓度筛选 高糖模型组细胞存活率明显低于正常对照组(P<0.05);前胡总香豆素各浓度组(5、10、20、40、80 μg/mL)均可提高细胞存活率(P<0.05或P<0.01)。160 μg/mL组细胞存活率低于高糖模型组。综合结果,选择10、20、40 μg/mL的前胡总香豆素浓度作为给药的低、中、高剂量。(见图1)
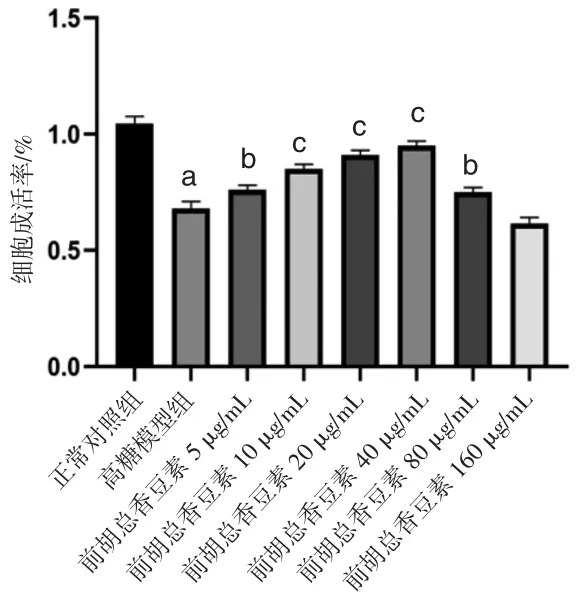
图1 各组细胞存活率比较 (±s,n=6)
3.2 各组HUVECs形态学比较 正常对照组细胞生长及其贴壁情况良好,细胞间连接十分紧密,界线清晰;高糖模型组细胞生长情况差,形态各异,细胞的两端增长或拉丝,界线模糊;前胡总香豆素低、中、高剂量组细胞形态逐渐恢复。(见图2)

图2 各组HUVECs 形态学比较 (×200)
3.3 各组HUVECs的GSH-Px、SOD活性及MDA、NO含量比较 高糖模型组HUVECs的GSH-Px、SOD活性及NO含量均明显低于正常对照组(P<0.01);前胡总香豆素低、中、高剂量组HUVECs的GSH-Px、SOD活性及NO含量均高于高糖模型组(P<0.05或P<0.01)。高糖模型组HUVECs的MDA含量明显高于正常对照组(P<0.01);前胡总香豆素低、中、高剂量组HUVECs的MDA含量均低于高糖模型组(P<0.05或P<0.01)。表明前胡总香豆素能降低高糖诱发的HUVECs氧化应激水平。(见图3)
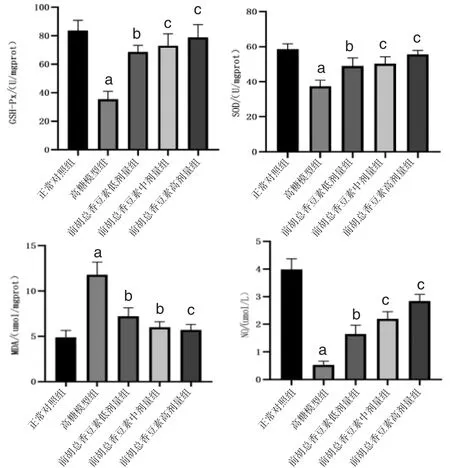
图3 各组HUVECs 的GSH-Px、SOD 活性及MDA、NO含量比较 (±s,n=3)
3.4 各组HUVECs的LDH释放量比较 高糖模型组HUVECs的LDH的释放量明显高于正常对照组(P<0.01);前胡总香豆素低、中、高剂量组HUVECs的LDH释放量明显低于高糖模型组(P<0.05或P<0.01)。(见图4)

图4 各组HUVECs 的LDH 释放量比较 (±s,n=3)
3.5 各组HUVECs凋亡情况 正常对照组HUVECs细胞核呈现均一蓝色,且细胞核形状完整;高糖模型组HUVECs细胞核呈致密浓染,颜色发白;前胡总香豆素低、中、高剂量组HUVECs细胞凋亡情况改善明显。(见图5)

图5 各组HUVECs 凋亡情况 (×200)
3.6 各组HUVECs的TNF-α、IL-1β水平比较 高糖模型组HUVECs的TNF-α和IL-1β水平均明显高于正常对照组(P<0.01);前胡总香豆素低、中、高剂量组HUVECs的TNF-α和IL-1β水平均明显低于高糖模型组(P<0.05或P<0.01)。(见图6)

图6 各组HUVECs 的TNF-α、IL-1β 水平比较 (±s,n=3)
3.7 各组HUVECs的Bcl-2、Bax、cleaved Caspase-3蛋白相对表达量比较 高糖模型组HUVECs的Bcl-2蛋白相对表达量低于正常对照组(P<0.01);前胡总香豆素低、中、高剂量组HUVECs的Bcl-2蛋白相对表达量高于高糖模型组(P<0.05或P<0.01),并且呈剂量依赖性。高糖模型组HUVECs的Bax、cleaved Caspase-3蛋白相对表达量及Bax/Bcl-2明显高于正常对照组(P<0.01);前胡总香豆素低、中、高剂量组HUVECs的Bax、cleaved Caspase-3蛋白相对表达量及Bax/Bcl-2均低于高糖模型组(P<0.05或P<0.01),并且呈剂量依赖性。(见图7~8)

图7 各组HUVECs 中Bcl-2、Bax、cleaved Caspase-3蛋白相对表达量及Bax/Bcl-2 比较 (±s,n=3)
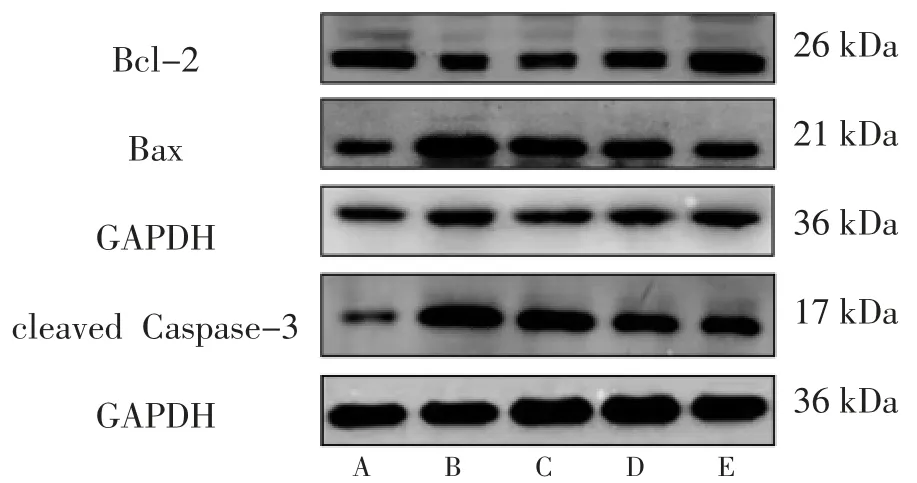
图8 各组HUVECs 中Bcl-2、Bax、cleaved Caspase-3 蛋白表达Western blotting 图
4 讨论
高糖会导致血管内皮细胞增加活性氧的生成量,进而产生氧化应激。应激会产生多种炎症因子,从而损坏血管内皮细胞,造成其功能障碍[12]。高糖刺激后,细胞发生的氧化损伤和炎症损伤是引发糖尿病的重要机制[13]。内皮细胞本身就拥有氧化及抗氧化系统,且一般情况下两者维持着动态平衡。内皮细胞受到病理刺激后,其动态平衡会遭到破坏,导致细胞组织损伤。GSH-Px、SOD及过氧化氢酶(CAT)作为酶系统主要的酶,属于抗氧化系统;SOD是人体中最常见的一种抗细胞损害的酶,能催化超氧自由基生成双氧水和分子氧[14-15]。研究表明,提高SOD的活性能够提高血管的内皮机能[16],因此将SOD、GSH-Px的活力值作为人体氧化应激水平高低的判断条件,具有重要的意义。MDA是膜脂过氧化后的分解产物,其含量可以反映细胞膜的结构和作用受伤害程度[17-18]。同时血管内皮还可以分泌NO,维持血液的动态均衡。此外,氧化应激往往伴随有炎症反应,氧化应激状态下内皮细胞能够产生TNF-α、IL-1β和IL-6等一系列炎症因子[19]。上述炎症因子能够进一步加剧内皮细胞的功能紊乱,从而诱发细胞炎症损伤。本研究发现,前胡总香豆素低、中、高剂量组HUVECs的GSH-Px、SOD活性及NO含量明显上升,MDA、LDH含量下降,TNF-α和IL-1β水平降低,说明前胡总香豆素可能通过抑制氧化应激和炎症反应来保护高糖造成的HUVECs损伤。
细胞凋亡即细胞程序性死亡,可清除有害细胞,而异常的细胞凋亡则会导致一系列疾病[20]。Bcl-2和Bax是细胞凋亡中重要的调节蛋白;Bcl-2能够降低或者阻断DNA裂解、细胞皱缩及染色质浓缩,在凋亡早期作用重大[21];Bax的促细胞凋亡作用则是通过其本身形成的Bax同源二聚体造成的,它还可以与Bcl-2形成Bax-Bcl-2异源二聚体从而抑制细胞凋亡[22]。正常情况下Bcl-2与Bax结合后可阻断Bax、Bax异源二聚体的形成。Bax/Bcl-2表达比率对于诱导细胞凋亡至关重要,该比率对细胞凋亡速度有一定决定性作用[23]。Bax/Bcl-2比率太高将会导致细胞色素C从线粒体快速进入细胞质,从而激活Caspase-3。Caspase-3是细胞凋亡的执行因子,通常作为酶原出现;Caspase-3一旦被活化则以其切割形式cleaved Caspase-3存在,从而促进细胞凋亡[24-25]。研究表明,高渗环境损伤和氧化损伤可以激发线粒体的凋亡途径,调节Bc1-2家族成员活性,并通过活化胞质中促凋亡蛋白Bax或Bax二聚体,抑制抗凋亡蛋白Bc1-2表达,从而调节细胞凋亡[26]。本研究发现,前胡总香豆素低、中、高剂量组HUVECs的Bcl-2蛋白相对表达量升高,Bax、cleaved Caspase-3蛋白相对表达量及Bax/Bcl-2显著降低,说明前胡总香豆素能通过抑制细胞凋亡对高糖损伤HUVECs产生一定的保护作用,且低、中、高剂量前胡总香豆素对HUVECs的保护作用存在一定的剂量依赖性,即剂量越高对HUVECs的保护作用越明显。
综上所述,前胡总香豆素能够通过降低细胞内MDA、LDH含量及提高GSH-Px、SOD、NO活性,改善高糖导致的HUVECs氧化应激损伤;前胡总香豆素能有效控制TNF-α和IL-1β等炎症因子,抑制炎症反应;同时前胡总香豆素可以增强抗凋亡因子Bcl-2的蛋白表达,下调凋亡因子Bax、cleaved Caspase-3的蛋白表达,降低Bax/Bcl-2,从而控制细胞凋亡。本研究验证了前胡总香豆素能够通过调节氧化应激和细胞凋亡两条途径共同达到保护细胞的功效,为后续进一步探讨前胡总香豆素对高糖导致HUVECs的保护机制提供了研究基础。
