南亚热带河流底栖硅藻β多样性及其对空间距离与环境梯度的响应
——基于广义非相似性模拟的分析
2023-06-14朱昆鹏韩博平
谭 琳,陈 慈,朱昆鹏,韩 诺,王 璐,韩博平,*
1 暨南大学生态学系/水生生物研究中心,广州 510632
2 广东省水文局广州水文分局,广州 510150
β多样性指一定区域内不同生境上生物群落组成的差异或变化[1—5]。β多样性主要由物种替换和物种丧失或增加两个过程产生,两个生境之间物种发生替换也称为周转,物种非随机性的丢失导致物种组成的嵌套结构[6—8]。Baselga提出了将β多样性分解为周转和嵌套的框架[8],为认识β多样性的格局提供了生态解读。周转与嵌套对β多样性相对贡献的差异,反映了生物多样性维持的生态过程和随机灭绝的作用[9—10]。
在集合群落中,环境选择和扩散被认为是维持β多样性两个主要过程[11]。物种都有其适合的生境及其环境因子耐受范围,环境选择指环境对迁入该生境的物种进行筛选和影响的过程[12],环境差异越大,其群落组成的差异就越大[1,13—14]。扩散的作用主要体现在数量效应和扩散限制。数量效应是指扩散能力强的物种在适合生境大量繁殖后,迁入不适合的生境,从而使物种在不利生境中持续存在[15]。扩散限制是指扩散能力较弱的物种,物种没有机会拓殖至所有适合的生境,在一定程度上也能减弱环境作用的表现[16—17]。这两种机制均会影响β多样性,快速地传播或扩散作用会产生数量效应导致群落的均质化,降低β多样性[15],扩散限制使β多样性增加[18—19]。环境筛选和扩散均能导致物种替换,而嵌套则主要与非随机性灭绝及拓殖动态有关[8,20]。
与α多样性不同,β多样性反映了研究群落组成的变化,其对环境梯度的响应可由用“距离方法”进行分析,如Mantel检验和partial-Mantel检验,利用群落相异矩阵与环境距离矩阵进行线性回归,识别出对群落组成变化影响较大的环境梯度[21—24]。通常使用相异性系数度量不同生境之间群落物种组成的变化,自然群落相异程度是由多复杂过程影响,主要涉及两类非线性,即所有的群落相异系数本身具有非线性以及群落变化随环境梯度的非线性。广义非相似性模拟(generalized dissimilarity modelling,GDM)方法采用广义线性模型和样条函数,相对合理地处理了这两种非线性,从而更有效地揭示β多样性对环境梯度的响应,预测区域内群落组成的变化[25—26]。Xu等使用广义非相似性模拟方法揭示了热带水库丰水期和枯水期浮游植物群落对相关环境和空间变量的非线性响应差异[24]。
底栖硅藻是中小型河流生态系统中的最重要初级生产者,因其固着生活且对环境响应敏感,是河流生物多样性评估和水质评价的重要生物类群[27—30]。河流是一个单向水流系统,从上游至下游生境和生态过程具高度异质性,导致底栖硅藻的组成有着明显的空间差异[31—32]。此外,南亚热带地区受季风气侯影响,丰水期降雨量增加,水流作用增强,水流作用可能增加底栖硅藻的被动扩散能力,数量效应可能使底栖硅藻群落的空间异质性降低。上述特征为研究环境筛选和数量效应对底栖硅藻空间分布的相对作用提供了理想条件。本研究中,我们以典型南亚热带中小型河流—广东省流溪河为例,运用广义非相似性模拟方法,识别底栖硅藻β多样性对环境和空间的非线性响应,了解底栖硅藻β多样性组分格局及其维持机制,为河流生物监测与生态系统管理提供依据。
1 材料与方法
1.1 流溪河概况及采样设置
流溪河流域地处亚热带地区,位于广州市北部,珠江三角洲的中北部(图1),干流长154.53 km,流域面积约2300 km2。受季风气侯影响,降雨量具有明显的季节差异,分为丰水期(4月—9月)和枯水期(10月—3月),平均年降雨量在1729—2050 mm之间,汛期降雨约占年雨量的80%。流溪河起源于从化桂峰山,从北至南,经珠江三角洲河网流入珠江,流溪河水库以上的上游河道,河道较窄,河床比降较大,水流湍急;中下游河道(良口镇以下)河床比降较小,水流逐渐缓慢。营养盐水平具有明显时空差异,枯水期总氮浓度高于丰水期总氮浓度,总磷浓度在丰水期更高,从上游至下游的营养盐浓度总体呈上升趋势[33]。

图1 流溪河20个采样点位置Fig.1 Locations of 20 sampling sites in Liuxihe RiverS:采样点Sampling site
在流溪河水系中设置20个样点,其中10个样点位于流溪河水库以上的上游河段,10个位于流溪河水库以下的下游河段,样点位置、所处河段及底质类型(图1和表1)。于2018年的丰水期(6月和9月)和枯水期(3月和12月)共进行4次调查。采样点经纬度跨度在113.2636°E—114.0164°E和 23.2919°N—23.9317°N,海拔在76.8—456 m。

表1 流溪河样点地理坐标、所处河段及底质类型Table 1 Spatial coordinates,locations and main substrate types of sampling sites in Liuxihe River
1.2 样品采集与处理
用GPS获取采样点的经度、纬度和海拔;用YSI 6600水质分析仪现场测定水温(Temp)、pH、电导率(Cond)、溶解氧(DO);开阔水域采集1 L水样,参考《水和废水监测分析方法》测定浊度(Turbidity)、总氮(TN)、总磷(TP)、可溶性硅(SiO2)浓度[34]。使用圆球形悬浮物估算河流表面流速(Vel)[35]。
硅藻样品的采集参考刘静等[36]建议的方法。每个采样点随机挑选3 cm×4 cm大小的鹅卵石至少5块,在没有鹅卵石的地方,尽可能选择坚硬的底质,使用牙刷刷取基质向阳面底栖硅藻,将样品装入100 mL的透明瓶中,加入甲醛溶液至终浓度为4%。使用浓硝酸除去底栖硅藻样品中的有机质和难溶性盐,去除上清液,用去离子水冲洗至中性,用去离子水将硅藻重悬,使用封片胶(Naphrax,折射率1.703)制成永久玻片。使用相差显微镜对硅藻进行鉴定和计数,每个至少计数600个个体。底栖硅藻种类参考Krammer和Lange-Bertalot的《欧洲硅藻鉴定系统》[37]和《珠江水系东江流域底栖硅藻图集》[38]。
1.3 数据处理与统计分析
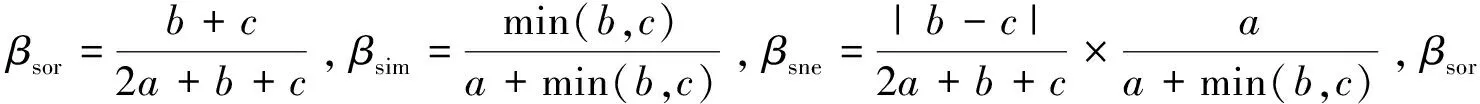
通过GDM分析环境和空间在维持β多样性及其组分格局的作用,了解β多样性随空间和环境梯度的变化速率。在GDM分析中,分别以Sørensen成对相异性系数计算的β多样性及其组分的矩阵为响应变量,以样点间环境距离和空间距离为解释变量。为处理β多样性的两类非线性,使用最大似然估计和单调递增的样条函数对解释变量进行转换,并模拟样点间β多样性与环境梯度和空间距离的响应关系。样点间的环境距离或空间距离的线形组合通过连接函数进行转换[25]。本文选用3个I型样条基函数(mp=3)对环境因子进行非线性拟合,详见方法介绍[26]。样条函数的最大值表示,保持其他变量不变的情况下,该变量对β多样性变化的相对大小。环境变量的样条函数横坐标为原始环境变量,纵坐标表示经样条基函数转换后的环境变量,环境变量样条函数的斜率表示β多样性随单位环境梯度的变化速率。空间变量的样条函数横坐标为样点间的空间距离,纵坐标为样条基函数转换后的空间距离,样条函数的形状反映β多样性随空间距离的变化。
所有的统计分析均在R语言(版本4.1.1)平台中完成,β多样性的计算使用betapart包[39]中的beta.pair函数完成;GDM通过gdm包中formatsitepair、gdm函数完成。
2 结果与分析
2.1 环境因子
流溪河主要物理和化学因子具有明显季节特征。由图2可知,流溪河全年水温范围在8.15—34.48 ℃之间,丰水期水温显著高于枯水期水温。浊度范围在0.05—124.80 NTU(散射浊度单位)之间,4个月份中,3月份浊度均值最高。流速范围在0.01—1.5 m/s之间,流速的季节差异不显著。总氮浓度范围在0.46—11.34 mg/L之间,均值为1.91 mg/L;总磷浓度范围在0.007-0.744 mg/L之间,均值为0.099 mg/L;硅酸盐浓度在6.71—23.90 mg/L之间,均值为15.28 mg/L;总氮、总磷和可溶性硅浓度季节差异不显著。电导率范围在26.10—421.00 μS/cm之间,丰水期电导率均值低于枯水期电导率均值。pH值在5.05—8.15之间,pH均值呈现:12月>9月>6月>3月。溶解氧浓度在2.08—11.49 mg/L,枯水期溶解氧均值高于丰水期溶解氧均值。

图2 流溪河水温、浊度、流速、总氮、总磷、可溶性硅、电导率、pH和溶解氧浓度的季节变化Fig.2 Seasonal variation of temperature,turbidity,velocity,total nitrigen,total phosphorus,soluble silica,conductivity,pH,dissolved oxgyen concentration in Liuxihe RiverNTU:散射浊度单位;箱形图箱体高度表示四分位距,中间横线表示中位数,黑点表示异常值;小提琴图中曲线包围的区域宽度反映数据的分布密度
2.2 种类组成
全年共检出底栖硅藻9科55属276种,每个样点检出的种类数在10—78之间,样点平均物种丰富度为39。流溪河底栖硅藻种类组成情况如图3,从目水平来看,双壳缝目(Biraphidinales,155种)、管壳缝目(Aulonoraphidinales,48种)、单壳缝目(Monoraphidinales,30种)、圆筛藻目(Coscinodiscales)、无壳缝目(Araphidinales)和短壳缝目(Raphidionales)内的种类数分别为18、15和10。科内的种类多样性依次为:舟形藻科(Naviculaceae,113种),菱形藻科(Nitzschiaceae,38种)、曲壳藻科(Achnanthaceae,30种),桥弯藻科(Cymbellaceae,23种)、圆筛藻科(Coscinodisceae,18种)、异极藻科(Gomphonemaceae,19种)、脆杆藻科(Fragilariaceae,15种)、双菱藻科(Surirellaceae,10种)和短壳缝科(Eunotiaceae,10种)。菱形藻属(Nitzschia)和舟形藻属(Navicula)是种类数量最高的两个的属,分别为32种和31种;有18个属仅检出1种,如环冠藻属(Cyclostephanos)、直链藻属(Melosira)和冠盘藻属(Stephanodiscu)等。
4个月份,累计检出的底栖硅藻物种数存在季节变化,丰水期累计检出的物种数(均值193)高于枯水期累计检出的物种数(均值164)(图4)。从目的水平来看,双壳缝目在丰水期的种类数显著高于枯水期的种类数,其他5个目种类数无明显季节差异。从科的水平看,舟形藻科在丰水期的种类数均值(72)明显高于枯水期的种类数均值(60)。菱形藻属、舟形藻属和桥弯藻属内的种类数具有明显的季节变化,丰水期检出的种类数要高于枯水期检出的种类数。
图4 流溪河底栖硅藻种类数季节变化Fig.4 Seasonal variation of species numbers of benthic diatoms in Liuxihe River
2.3 β多样性及其组分的季节变化
4个月份的底栖硅藻多样性均以物种周转组分为主,物种嵌套组分对底栖硅藻β多样性的贡献很小(图5)。以3月底栖硅藻β多样性为例,共有190个配对样点,配对样点之间的底栖硅藻β多样性(均值为0.618,标准差为0.123),主要由物种周转组分(均值为0.473,标准差为0.146)贡献,占比为76.6%,物种嵌套组分(均值为0.144,标准差为0.124)对底栖硅藻β多样性的占比为 23.4%。流溪河底栖硅藻β多样性、周转和嵌套组分均无明显季节差异。4个月份流溪河底栖硅藻β多样性中位数在0.56—0.63之间,周转组分中位数范围是0.42—0.47,嵌套组分中位数范围是0.09—0.11。

图5 流溪河底栖硅藻β多样性及其组分的季节变化Fig.5 Seasonal variation of β diversity and its components of benthic diatoms in Liuxihe River箱形图箱体高度表示四分位距,中间横线表示中位数,黑点表示异常值;小提琴图中曲线包围的区域宽度反映数据的分布密度
2.4 β多样性及其组分与环境因子的关系
2.4.1β多样性与环境因子的关系
4个月份底栖硅藻群落β多样性变化的影响因子见表2。GDM方法识别出的重要变量梯度对β多样性变化总解释率分别为51.41%(3月)、51.42%(6月)、34.32%(9月)和47.76%(12月)。4个月份的空间距离对β多样性变化均有贡献,但9个环境梯度的累计解释率大于空间距离的解释率。3月份,空间距离、pH梯度、溶解氧浓度和可溶性硅浓度梯度对β多样性变化的相对解释率较高,总解释率为41.19%。6月份,总氮浓度梯度对β多样性变化的相对解释率最高,解释率为18.42%。9月份,空间距离、总氮梯度、pH梯度及总磷梯度解释了26.74%的β多样性变化。12月份,影响β多样性变化的主要变量为空间距离、pH梯度、浊度梯度和电导率梯度,累计解释率为39.62%。
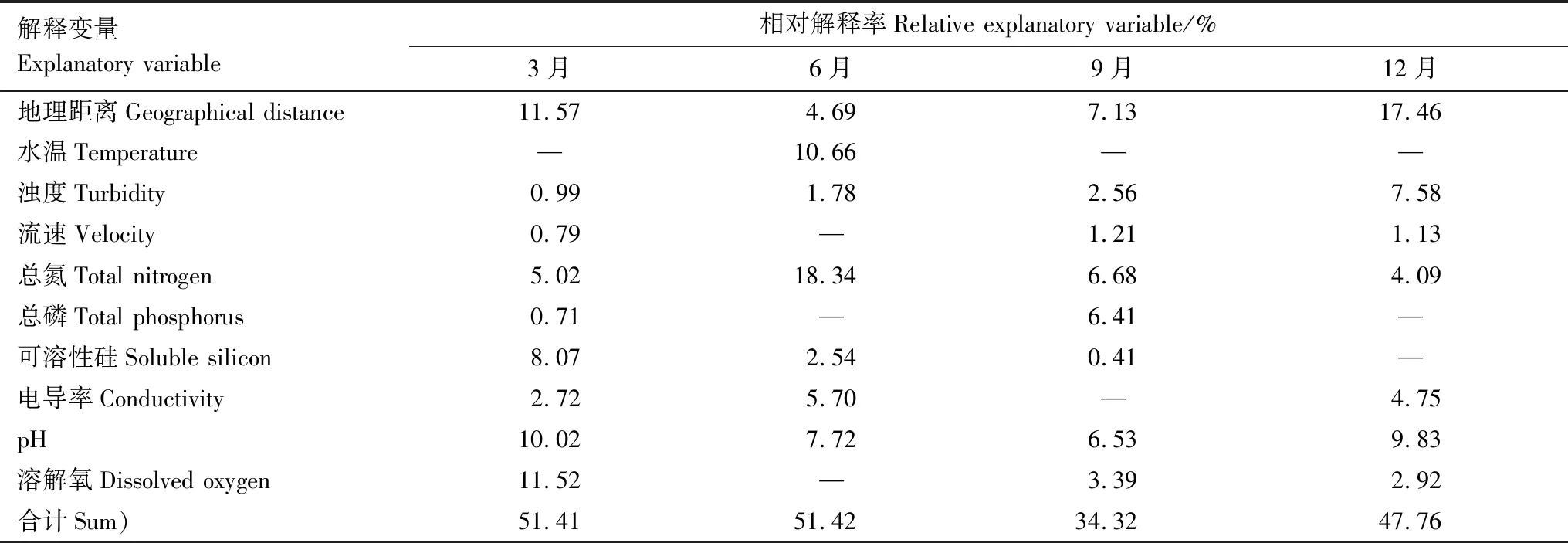
表2 GDM识别出的影响底栖硅藻群落β多样性变化的显著重要变量梯度Table 2 Generalized dissimilarity modelling (GDM) revealed the important environmental variables whose gradients explained variation of β diversity of benthic diatom communities
4个月份,空间距离和环境梯度对β多样性的影响见图6。4个月份的底栖硅藻β多样性均随空间距离的增加而增加,这种变化趋势在3月、9月和12月比较明显。3月份,β多样性变化速率随溶解氧浓度增加而降低,随pH增加呈先降低后增加的趋势;6月份,β多样性变化速率随总氮浓度和pH的增加呈先降低后增加的趋势,随水温增加而降低;9月份,β多样性变化速率随总氮浓度增加呈降低趋势,随pH值增加呈先降低后增加的趋势;12月份,β多样性变化速率随着pH增加而增加,随着浊度的增加而降低。

图6 基于GDM所揭示的流溪河底栖硅藻β多样性对空间距离和环境梯度的响应Fig.6 Generalized dissimilarity modelling (GDM) revealed the responses of benthic diatoms in the β diversity to geographical distance and environmental gradients in Liuxihe River in March,June,September and Decemberx轴为解释变量,Geo:地理距离Geographical distance;Temp:水温Temperature;Turbidity:浊度Turbidity;Vel:流速Velocity;TN:总氮Total nitrogen;TP:总磷Total phosphorus;SiO2:可溶性硅Soluble silicon;Cond:电导率Conductivity;DO:溶解氧Dissolved oxygen;y轴为样条基函数转换后的解释变量,单位为群落相异性的连接单位,即-ln(1-dij)
2.4.2周转组分及嵌套组分与环境因子的关系
4个月份底栖硅藻群落周转和嵌套组分变化的影响因子见表3。GDM方法识别出的重要变量梯度对周转组分变化总解释率分别为39.82%(3月)、41.71%(6月)、19.33%(9月)和32.55%(12月)。重要变量梯度对嵌套组分变化总解释率分别为34.12%(3月)、7.72%(6月)、39.43%(9月)和14.74%(12月)。4个月份的空间距离对周转组分变化的相对解释率均低于9个环境梯度累计解释率,空间距离仅解释9月底栖硅藻嵌套组分变化的3.01%。3月份,空间距离、溶解氧浓度和可溶性硅浓度梯度对周转组分变化的相对解释率较高,总解释率为29.74%;pH和可溶性硅浓度梯度对嵌套组分变化的相对解释率较高,总解释率为24.03%。6月份,总氮浓度梯度对周转组分变化的相对解释率最高,解释率为14.22%;溶解氧浓度梯度对嵌套组分变化的相对解释率最高,解释率为2.93%。9月份,浊度梯度对周转组分变化的相对解释率最高(5.54%),其次为溶解氧浓度梯度(5.06%);总氮、总磷和pH梯度对嵌套组分变化总的解释率为33.53%。12月份,7个环境梯度均影响周转组分,其中pH梯度解释率最高(10.84%);4个环境梯度解释嵌套组分变化,浊度梯度解释率最高(10.37%)。

表3 GDM识别出的影响底栖硅藻群落周转和嵌套组分变化的重要变量梯度Table 3 Generalized dissimilarity modelling (GDM) revealed the important environmental variables whose gradients explained variation of turnover and nestedness component of the β diversity for the benthic diatom communities
空间距离和环境梯度对物种周转组分的影响见图7,3月份,底栖硅藻周转组分随空间距离的增加而增加,周转组分变化速率随溶解氧浓度增加而降低,随可溶性硅的增加呈先降低后增加趋势。6月份,周转组分的变化速率随总氮和可溶性硅浓度增加呈先降低后增加趋势,随pH浓度增加而降低。9月份,周转组分的变化速率随浊度的增加呈先降低后增加趋势;随溶解氧和pH梯度的增加而降低。12月份,周转组分的变化速率随pH增加呈先降低后增加趋势,随着总磷浓度增加,先降低后保持不变;随流速增加而降低。

图7 基于GDM所揭示的流溪河底栖硅藻周转组分对空间距离和环境梯度的响应Fig.7 Generalized dissimilarity modelling (GDM) revealed the responses of benthic diatoms in the turnover component of the β diversity to geographical distance and environmental gradients in Liuxihe River in March,June,September and Decemberx轴为解释变量;y轴为样条基函数转换后的解释变量,单位为群落相异性的连接单位,即-ln(1-dij)
空间距离和环境梯度对物种嵌套组分的影响见图8,3月份,底栖硅藻嵌套组分的变化速率随pH和可溶性硅浓度的增加而增加,随浊度的增加呈先减少后增加趋势。6月份,嵌套组分的变化速率随溶解氧和总氮的增加而降低,随水温的增加呈先增加后降低的趋势。9月份,嵌套组分的变化速率随总氮和总磷浓度增加呈降低趋势;随pH的增加而增加。12月份,嵌套组分的变化速率随浊度增加而降低;随可溶性硅浓度和pH增加呈增加趋势。

图8 基于GDM所揭示的流溪河底栖硅藻嵌套组分对环境梯度的响应Fig.8 Generalized dissimilarity modelling (GDM) revealed the responses of benthic diatoms in the nestedness component of the β diversity to environmental gradients in Liuxihe River in March,June,September and December
3 讨论
3.1 β多样性的周转和嵌套组分的相对贡献及其季节变化
本研究中,在4个月份中,流溪河底栖硅藻β多样性两个组份中,物种周转组分均为主要组分,这表明流溪河底栖硅藻β多样性是由物种周转组分所主导,即样点间的物种组成差异主要来源于样点之间的物种替换,且样点之间没有很大程度上的物种丧失或增加,样点之间的物种丰富度变化相对较小。这可能是因为流溪河从上游到下游环境梯度明显,有利于样点之间物种的替换,人类干扰程度增加,改变了流域内河流生境,底栖硅藻适应策略的不同导致群落组成的变化。许多淡水生物β多样性组分的分解具有类似的占比特点[40—43]。对细菌、鱼类、鸟类等多个生物类群的分析发现,不同生物类群的物种周转组分通常是β多样性的主要构成[44]。对浑太河流域的底栖硅藻群落研究发现,基于底栖硅藻分类学的β多样性主要是由周转驱动,但基于底栖硅藻性状的β多样性更多的是由嵌套驱动[45]。
不同的季节环境异质性和扩散限制格局不同,从而影响着群落中的物种组成。研究发现,河流水环境的季节变化导致底栖硅藻群落组成表现出明显的季节差异[46—49]。在丰水期,强降雨事件使河流水体流速增加,水流冲刷作用可能使上游底栖硅藻种类出现在下游生境中,从而导致群落同质化[50—51]。因此,与枯水期相比,丰水期的底栖硅藻群落β多样性理论上应该更低。然而,本研究中流溪河底栖硅藻β多样性并无明显季节变化,枯水期底栖硅藻β多样性中位数为0.60,丰水期底栖硅藻β多样性中位数为0.56。丰水期降雨量的增加并未使底栖硅藻β多样性明显降低,表明水流冲刷作用不足以使流溪河底栖硅藻群落趋于均质化。这可能与流溪河水系建有流溪河水库、黄龙带水库等14个的梯级电站有关,水利调蓄改变了河流水文的自然季节性,增加硅藻在水库内的沉降率,减弱了数量效应对下游底栖硅藻群落的影响[52—53]。
3.2 β多样性对环境和空间梯度的响应及其季节变化
环境选择和扩散限制是维持β多样性格局的两个重要机制[54—55]。基于GDM的分析表明,4个月份流溪河底栖硅藻β多样性和物种周转组分格局是环境筛选和扩散限制共同塑造,环境筛选是维持β多样性格局的主要过程。这可能是流溪河流域内水环境因子(如流速、总氮浓度、总磷浓度、硅酸盐浓度和pH)具有明显的空间异质性,对底栖硅藻种类形成了环境压力差异。研究表明,同一物种库内,环境异质性是决定β多样性格局的主要驱动因子[11,17]。扩散限制对维持河流底栖硅藻β多样性及周转组分格局也发挥一定的作用。与丰水期相比,枯水期扩散限制的相对重要性增加,这可能是因为随水流进行扩散是底栖硅藻主要的扩散途径[53]。在丰水期,降雨量大,流速大且较为稳定,扩散限制的作用较弱[51,56]。对底栖硅藻物种嵌套组分分析发现,4个月份,空间距离仅在9月份显著解释了3.01%的嵌套组分变化,环境解释了嵌套组分的绝大部分变异,这表明环境筛选是流溪河物种嵌套组分格局形成的主要驱动力,但6月和12月份的环境对该组分的解释率均较低,有超过85%的变异未被解释,可能是因为其他生态过程是驱动物种嵌套格局的潜在驱动力,如物种间的相互作用等[57]。
本研究中,空间距离对β多样性和周转组分的影响相对较小,β多样性和周转组分随着空间距离的增加而明显增加。GDM识别出多个环境变量影响β多样性及其组分变化,流溪河底栖硅藻β多样性随环境变量的变化趋势呈现出三种响应模式:(1)β多样性变化速率逐渐增加,如β多样性的变化速率对电导率浓度的响应;(2)β多样性变化速率逐渐降低,如β多样性的变化速率对水温和总磷浓度的响应;(3)β多样性变化速率先降低后增加,如β多样性的变化速率对pH的响应。
本研究中,空间距离和环境梯度显著解释底栖硅藻群落β多样性变化,解释率较高(>34%),Wu等[45]使用db-RDA和方差分解等线性方法量化环境变量、地理气候和空间因素对底栖硅藻基于分类β多样性的解释率较低(<25%)。分析生物群落多使用线性方法,如李明家等[58]、董建宇等[59]使用基于矩阵的多元线性回归分析西藏横断山区溪流细菌、莱州湾东岸潮下带底栖动物β多样性的驱动因素。在分析环境梯度和空间距离对β多样性的影响时,线性矩阵回归方法(如Mantel)假设β多样性随环境梯度的变化速率是恒定的,但实际上群落组成的变化对环境梯度的响应存在不一致的非线性[25]。基于GDM的β多样性及其组分对环境梯度的偏响应关系,不仅能反映变量对β多样性及其组分的相对作用大小,还能进一步了解β多样性及其组分变化速率对变量的响应[26,60]。
综上所述,在区域尺度上,环境选择与扩散限制共同驱动流溪河底栖硅藻物种周转组分和嵌套组分差异,物种周转是底栖硅藻β多样性的主要组分。与枯水期相比,丰水期的扩散作用增强,其对物种周转组分变化的相对重要性降低。GDM提供了一种非线性方法来揭示物种组成变化的驱动因素,可以作为底栖硅藻β多样性分析的有力工具。
