基于JAK1/STAT3通路的寿胎丸对复发性流产小鼠细胞自噬的影响
2023-06-13牟珍妮申思楠唐丽刘莹蝶周紫薇雷磊
牟珍妮 ,申思楠 ,唐丽 ,刘莹蝶 ,周紫薇 ,雷磊
1.湖南中医药大学中西医结合学院,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007
复发性流产(recurrent spontaneous abortion,RSA)是指与同一性伴侣在妊娠28周之前发生3次或以上的妊娠丢失[1],是妊娠常见的并发症之一,给妊娠妇女造成极大身心痛苦。RSA的防治已成为国内外生殖领域研究的重点。因此,探索更加准确、安全、有效的RSA诊疗方法是临床亟需解决的难题。
RSA病因复杂,除染色体异常、解剖结构异常、内分泌紊乱、免疫因素等已知原因外,目前仍有40%~60%患者病因不明[2]。细胞自噬是一种高度保守的细胞行为,可以为细胞修复损伤的细胞器提供能量,参与生物体发育、免疫反应、代谢调节、细胞凋亡和衰老等多种过程[3]。越来越多研究表明,细胞自噬与RSA密切相关[4-8],但细胞自噬与RSA的具体作用关系尚存在争议,且其参与RSA 的具体机制尚不清晰。JAK/STAT信号通路是RSA重要的信号转导通路,该通路中转录因子信号转导和转录激活因子3(STAT3)与细胞自噬密切相关。
寿胎丸出自《医学衷中参西录》,具有补肾安胎功效,寿胎丸联合西药治疗不明原因RSA临床疗效显著优于单纯西药治疗[9-10]。基础研究表明,寿胎丸具有改善黄体功能[11],增强滋养层细胞增殖、侵袭、迁移能力[12],减少细胞凋亡等作用[13-17]。本研究通过建立RSA小鼠模型,观察寿胎丸对RSA小鼠的妊娠保护作用,并从JAK1/STAT3信号通路和自噬角度探讨其可能作用机制,为临床治疗RSA提供实验依据。
1 实验材料
1.1 动物
40 只SPF 级雌性CBA/J 小鼠及15 只SPF 级雄性DBA/2小鼠,体质量(20±2)g,均购于北京华阜康生物科技股份有限公司,动物许可证号SCXK(京)2019-0008;5只雄性BALB/c小鼠,体质量(20±2)g,购于湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004。动物饲养于湖南中医药大学SPF 级实验动物中心,温度(22±2)℃,湿度(50±5)%,自由摄食饮水,光照/黑暗周期12 h。本实验经湖南中医药大学动物伦理委员会审批(LL2021032501)。
1.2 药物及制备
寿胎丸(菟丝子12 g,桑寄生6 g,续断6 g,阿胶6 g),饮片购自湖南中医药大学第一附属医院药剂科。取菟丝子、续断、桑寄生饮片,加6~8倍量蒸馏水煎煮2 次,每次1.5 h,合并滤液,浓缩至相对密度为1.1~1.2(50~60 ℃)。加入乙醇使含醇量达65%,冷藏24 h,过滤,回收乙醇至无醇味。阿胶烊化,与浓缩后药液合并,过滤,加蒸馏水稀释至原药材浓度为1.5 g/mL。地屈孕酮片,荷兰Abbott Biologicals B.V.,批号364221,10 mg/片。取10 mg 地屈孕酮片溶于20 mL蒸馏水中,配制成0.5 mg/mL溶液。
1.3 主要试剂与仪器
小鼠孕酮、β-人绒毛膜促性腺激素(β-HCG)ELISA试剂盒(上海抚生实业有限公司,批号分别为A119292-96T、A105057-96T),HE 染色液(白鲨生物,批号BL700B),BCA蛋白浓度测定试剂盒(武汉伊莱瑞特,批号E-BC-K318-M),Janus 激酶1(JAK1)、p-JAK1、STAT3、p-STAT3 抗体(Affinity Biosciences,批号分别为AF5012、AF2012、AF6294、AF3293),ATG5抗体(成都正能生物技术有限公司,批号381320),Beclin1、LC3抗体(Proteintech,批号分别为11306-1-AP、14600-1-AP),超纯总RNA提取试剂盒(杭州新景生物,批号5003050),反转录试剂盒、SYBR染料(苏州近岸蛋白,批号分别为E047、E096)。
Gel Doc XR+凝胶成像系统(美国Bio-Rad公司),Heraeus Fresco 17 型超速冷冻离心机(美国Thermo Fisher Scientific公司),Cytation3型多功能酶标仪(美国BioTek 公司),HM355S 型石蜡切片机(美国Thermo Fisher Scientific公司),T100TMThermal Cycler型RT-PCR 扩增仪(美国Bio-Rad 公司),Mini-PROTEAN Tetra型电泳槽、Mini Trans-Blot型转印槽(美国Bio-Rad公司),SW-CJ-1FD型超净工作台(苏州安泰空气技术有限公司)。
2 实验方法
2.1 造模
40只雌性CBA/J小鼠分别与15只雄性DBA/2小鼠和5只雄性BALB/c小鼠按2∶1合笼交配,前者建立RSA小鼠模型(30只),后者建立正常妊娠小鼠模型(10只)。于合笼次日早晨对雌鼠进行阴道涂片,涂片出现大量精子或见阴道栓,记为妊娠第0日。
2.2 分组及给药
将30只RSA模型小鼠随机分为模型组、地屈孕酮组和寿胎丸组,每组10只;10只正常妊娠模型小鼠为空白组。妊娠第0日开始给药,寿胎丸组予寿胎丸药液12 g/kg灌胃,地屈孕酮组予地屈孕酮溶液4.55 mg/kg灌胃(相当于60 kg成人等效剂量),模型组和空白组予等量生理盐水灌胃,每日1次,连续12 d。
2.3 取材
给药结束后麻醉小鼠,摘眼球取血,静置1 h,3 500 r/min离心15 min,取血清,于-20 ℃冰箱保存备用。采血后将小鼠固定于鼠板,腹部做“U”形切口,打开腹腔,钝性分离子宫,用眼科剪自宫角处打开子宫壁,小号弯镊剥离胚胎及胎盘,分离着床部位蜕膜组织,每只小鼠取3个胚胎蜕膜组织和胎盘组织固定于多聚甲醛,余下蜕膜组织分装于冻存管和离心管中,置于-80 ℃冰箱保存。
2.4 指标检测
2.4.1 胚胎丢失率
观察胚胎形态,以胚胎体积明显缩小,胎盘单位有明显出血或坏死为胚胎丢失标准[18],计算胚胎丢失率。胚胎丢失率(%)=丢失胚胎数÷总胚胎数×100%。
2.4.2 子宫脏器系数
称量小鼠体质量,分离子宫后称量子宫质量,计算子宫脏器系数。子宫脏器系数(%)=子宫质量÷体质量×100%。
2.4.3 HE染色
将蜕膜组织和胎盘组织从多聚甲醛中取出,梯度乙醇脱水后石蜡包埋,切片(厚度3 μm),烤片,脱蜡,苏木素染色5 min,伊红染色3 min,流水返蓝,梯度乙醇复水,二甲苯透明后中性树脂封片。采用显微成像系统采集图像。
2.4.4 ELISA检测
按试剂盒说明书配制标准品及样品,依次加入样品、酶标试剂、洗涤液、显色剂A、显色剂B、终止液等试剂,酶标仪波长450 nm检测各孔OD值。根据标准曲线回归方程计算血清孕酮和β-HCG含量。
2.4.5 Western blot检测
将蜕膜组织制成匀浆,用含蛋白酶抑制剂及磷酸酶抑制剂的RIPPA裂解液裂解,4 ℃、12 500 r/min离心15 min,取上清液,BCA法测定蛋白浓度,配制浓度为20 μg/μL的蛋白上样液,依次进行电泳、转膜、封闭、洗膜,加入JAK1一抗(1∶2 000)、p-JAK1一抗(1∶2 000)、STAT3一抗(1∶2 000)、p-STAT3一抗(1∶2 000)、ATG5一抗(1∶2 000)、Beclin1一抗(1∶5 000)、LC3一抗(1∶3 000),4 ℃震荡孵育过夜。洗膜,二抗37 ℃震荡孵育60 min。加ECL荧光底物显色,曝光并采集图片,分析蛋白表达量。
2.4.6 实时荧光定量PCR检测
将蜕膜组织加入Trizol 研磨后用氯仿萃取RNA,反转录成cDNA。RT-PCR 反应条件:95 ℃、3 min;95 ℃、10 s,58 ℃、5 s,共40个循环。生成扩增曲线及熔解曲线,得出Ct 值,各目的基因的表达量以GAPDH为内参基因进行标准化,采用2-ΔΔCt法计算各基因相对表达量。引物序列见表1。

表1 各基因PCR引物序列
3 统计学方法
4 结果
4.1 寿胎丸对模型小鼠胚胎丢失率的影响
正常组小鼠子宫体颜色淡红,胚胎大小均匀、如串珠,胚胎无明显瘀血及出血情况;模型组小鼠子宫颜色黯红,胚胎发育不均匀,部分胚胎出现瘀血、坏死、吸收情况;地屈孕酮组和寿胎丸组小鼠胚胎发育情况较模型组明显改善,仅个别胚胎出现瘀血。见图1。
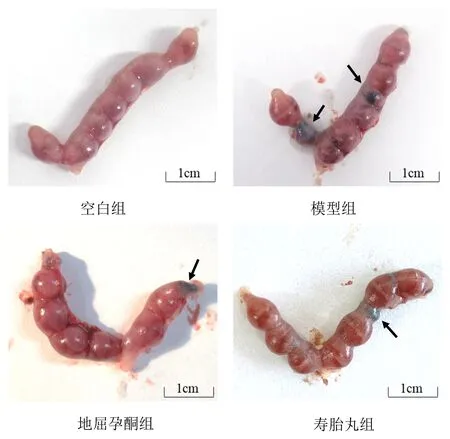
图1 各组小鼠胚胎形态
除地屈孕酮组1只小鼠见阴栓而未妊娠外,其余小鼠均成功妊娠。与正常组比较,模型组小鼠胚胎丢失率显著升高(P<0.01);与模型组比较,地屈孕酮组和寿胎丸组小鼠胚胎丢失率显著降低(P<0.01)。见表2。

表2 各组小鼠胚胎丢失率比较
4.2 寿胎丸对模型小鼠子宫脏器系数的影响
与空白组比较,模型组小鼠子宫脏器系数降低,差异有统计学意义(P<0.01);与模型组比较,地屈孕酮组和寿胎丸组小鼠子宫脏器系数升高,差异有统计学意义(P<0.01)。见表3。
表3 各组小鼠子宫脏器系数比较(±s)

表3 各组小鼠子宫脏器系数比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,▲▲P<0.01
组别空白组模型组地屈孕酮组寿胎丸组子宫脏器系数/%10.66±2.85 6.01±2.48**9.15±2.25▲▲9.38±2.17▲▲只数10 10 9 10体质量/g 25.30±2.04 23.18±0.87 25.25±2.39 25.98±1.44子宫质量/g 2.67±0.59 1.39±0.57 2.33±0.73 2.43±0.52
4.3 寿胎丸对模型小鼠蜕膜组织和胎盘组织病理形态的影响
正常组小鼠蜕膜组织细胞呈卵圆形,排列紧密,胞质丰富,核仁明显,血管分布均匀,管壁完整;模型组小鼠蜕膜组织细胞排列杂乱,胞核固缩、部分消失,胞质水肿,部分呈空泡样变,血管分布较少;地屈孕酮组和寿胎丸组小鼠胎盘组织细胞排列相对有序,细胞形态较规则,仅有少量细胞水肿坏死,血管分布较均匀,管壁完整。见图2。
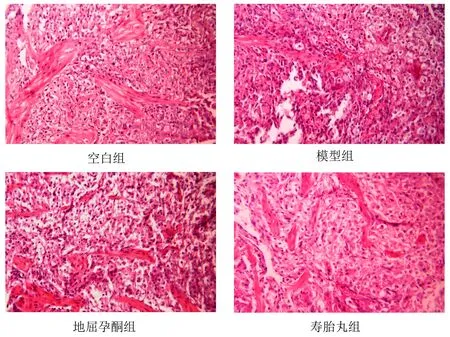
图2 各组小鼠蜕膜组织形态(HE染色,×200)
正常组小鼠胎盘组织致密,细胞排列整齐,形态规则,细胞核呈椭圆形,胞质充盈,血管丰富,分布均匀,管壁完整;模型组小鼠胎盘组织疏松,细胞排列杂乱,部分细胞增生肥大,胞核固缩,胞浆广泛空泡样变,大量炎性细胞浸润,血管分布较少;地屈孕酮组和寿胎丸组小鼠胎盘组织细胞排列较整齐,细胞形态较规则,仅少量细胞出现水肿、核固缩,血管分布较均匀。见图3。

图3 各组小鼠胎盘组织形态(HE染色,×200)
4.4 寿胎丸对模型小鼠血清孕酮、β-人绒毛膜促性腺激素含量的影响
与空白组比较,模型组小鼠血清孕酮、β-HCG含量显著减少(P<0.01);与模型组比较,地屈孕酮组和寿胎丸组小鼠血清孕酮、β-HCG 含量显著增加(P<0.01,P<0.05)。见表4。
表4 各组小鼠血清孕酮、β-HCG含量比较(±s)

表4 各组小鼠血清孕酮、β-HCG含量比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01
β-HCG/(pg/mL)1 996.89± 85.24 1 766.33± 58.41**1 903.74±139.35▲1 894.48± 95.19▲组别空白组模型组地屈孕酮组寿胎丸组只数6666孕酮/(ng/mL)2.78±0.04 2.54±0.08**2.67±0.06▲▲2.71±0.09▲▲
4.5 寿胎丸对模型小鼠蜕膜组织JAK1/STAT3 通路蛋白及自噬相关蛋白表达的影响
与空白组比较,模型组小鼠蜕膜组织p-JAK1、p-STAT3、ATG5、Beclin1蛋白表达及LC3-Ⅱ/LC3-Ⅰ比值显著降低,差异有统计学意义(P<0.01,P<0.05);与模型组比较,地屈孕酮组和寿胎丸组小鼠蜕膜组织p-JAK1、p-STAT3、ATG5、Beclin1 蛋白表达及LC3-Ⅱ/LC3-Ⅰ比值显著升高,差异有统计学意义(P<0.01,P<0.05)。见图4、表5。
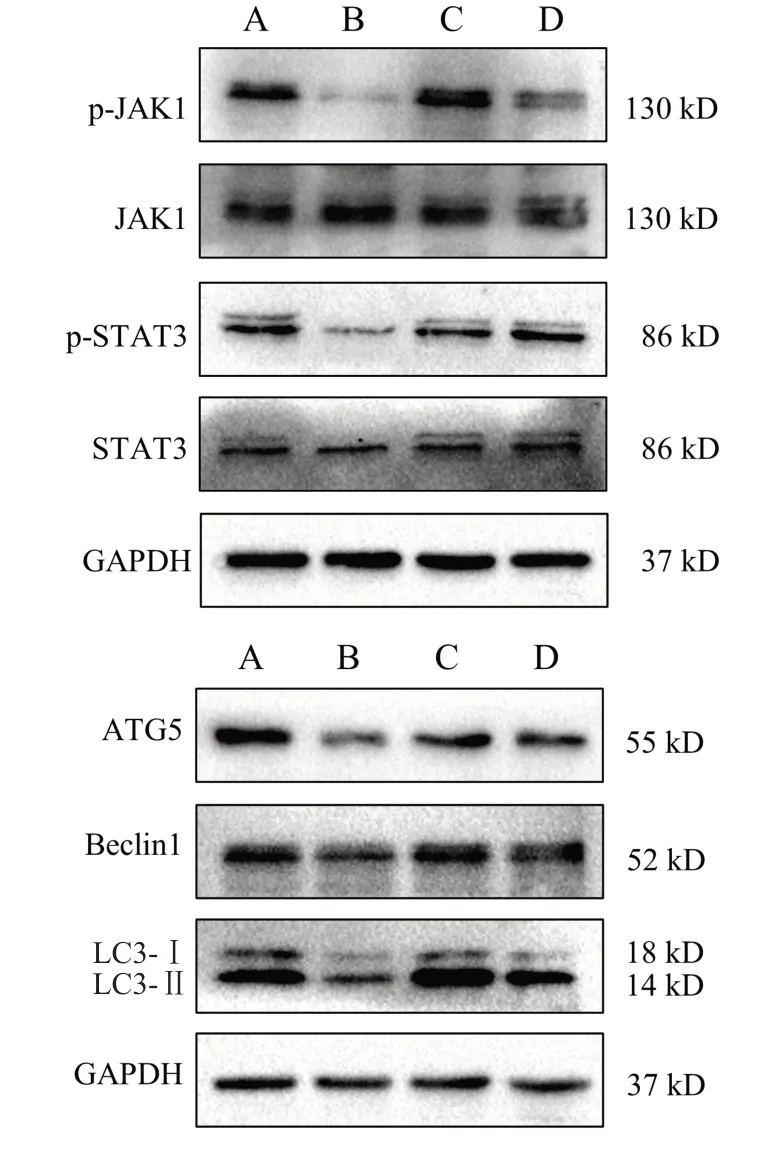
图4 各组小鼠蜕膜组织JAK1、p-JAK1、STAT3、p-STAT3、ATG5、Beclin1、LC3蛋白免疫印迹
表5 各组小鼠蜕膜组织JAK1、p-JAK1、STAT3、p-STAT3、ATG5、Beclin1、LC3蛋白表达比较(±s)

表5 各组小鼠蜕膜组织JAK1、p-JAK1、STAT3、p-STAT3、ATG5、Beclin1、LC3蛋白表达比较(±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01
LC3-Ⅱ/LC3-Ⅰ1.98±0.54 0.91±0.25*2.05±0.72▲2.01±0.60▲组别空白组模型组地屈孕酮组寿胎丸组只数3333 p-JAK1/JAK1 0.94±0.07 0.52±0.07**0.92±0.15▲▲0.87±0.11▲▲p-STAT3/STAT3 0.72±0.16 0.26±0.10**0.64±0.06▲▲0.65±0.17▲▲ATG5/GAPDH 1.43±0.26 0.57±0.27*1.36±0.48▲1.42±0.34▲Beclin1/GAPDH 1.46±0.20 0.91±0.27*1.52±0.31▲1.45±0.27▲
4.6 寿胎丸对模型小鼠蜕膜组织JAK1、STAT3、ATG5、Beclin1 mRNA表达的影响
与空白组比较,模型组小鼠蜕膜组织JAK1、STAT3、ATG5、Beclin1 mRNA表达降低,差异有统计学意义(P<0.05,P<0.01);与模型组比较,地屈孕酮组和寿胎丸组小鼠蜕膜组织JAK1、STAT3、ATG5、Beclin1 mRNA 表达升高,差异有统计学意义(P<0.05,P<0.01)。见表6。
表6 各组小鼠蜕膜组织JAK1、STAT3、ATG5、Beclin1 mRNA表达比较(±s)

表6 各组小鼠蜕膜组织JAK1、STAT3、ATG5、Beclin1 mRNA表达比较(±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01
组别空白组模型组地屈孕酮组寿胎丸组Beclin1 1.00±0.09 0.13±0.02**0.81±0.05▲▲0.77±0.22▲▲只数3333 JAK1 1.02±0.23 0.26±0.12*0.70±0.05▲0.74±0.06▲STAT3 1.00±0.10 0.23±0.01*0.75±0.01▲▲0.76±0.04▲▲ATG5 1.02±0.25 0.23±0.03**0.77±0.10▲▲0.78±0.04▲▲
5 讨论
RSA是女性妊娠常见的并发症之一,发病率约为1%~5%[1]。RSA 属中医学“滑胎”“数堕胎”范畴,具有屡孕屡堕及应期而下的特点。肾主生殖,胞络系于肾,中医学认为滑胎本于肾虚所致冲任虚衰,胎失所养,胎结不实。《医学衷中参西录》寿胎丸是治疗RSA的经典方剂,由菟丝子、桑寄生、续断、阿胶四药组成。菟丝子滋补肝肾,益阴而固阳;桑寄生补肝肾,养血而固冲任,安胎;续断甘温助阳,补益肝肾、调理冲任、固本安胎;阿胶滋阴养血,止血。四药合用,共奏补肾安胎功效。临床和实验研究均表明,寿胎丸能改善RSA的妊娠结局[19-20]。本研究结果显示,寿胎丸干预能明显提高RSA小鼠的胚胎丢失率、子宫脏器系数,并能改善RSA小鼠蜕膜及胎盘组织病理状态,提示寿胎丸对RSA 小鼠具有明显的妊娠保护作用。
自噬通过泛素蛋白酶系统维持细胞内稳定,由双层膜性结构对细胞内成分进行包裹,之后通过与溶酶体结合从而将包裹的内容物进行分解、再利用[21-22]。研究发现,自噬反应活性失调对妊娠期并发症的发生存在不可忽视的影响[23]。卵母细胞受精、胚胎植入前后的发育,以及妊娠期并发症均涉及自噬的诱导,当滋养细胞早期处于炎症、缺氧和营养有限的环境下,自噬对其有重要的保护作用,利于其适应早期发育的微环境[24-25]。有研究显示,与正常妊娠孕妇胎盘绒毛组织相比,流产、子痫前期、胎儿生长受限、妊娠期糖尿病等病理妊娠的孕妇胎盘绒毛组织均出现自噬过程受损[4,26-28]。ATG5、Beclin1、LC3是自噬过程中3种标志性分子,其中ATG5和Beclin1是自噬体形成必需的蛋白,ATG5通过组成泛素化系统ATG5-ATG12-ATG16L介导自噬体的形成[29],Beclin1通过参与组成PI3K复合体诱导细胞自噬[30]。当自噬发生时,胞浆型LC3-Ⅰ会酶解掉一小段多肽转变为膜型LC3-Ⅱ,其转化率增加与自噬小体数量增加有关,因此,LC3-Ⅱ/LC3-Ⅰ比值大小可反映自噬水平高低[31]。本研究结果表明,RSA模型小鼠自噬相关分子ATG5、Beclin1蛋白及mRNA表达显著降低,且LC3-Ⅱ/LC3-Ⅰ比值明显下调,而寿胎丸组及地屈孕酮组均升高,说明RSA与自噬过程受到抑制相关,而寿胎丸可能通过激活自噬起到妊娠保护作用。
自噬受多种信号通路调控,JAK/STAT通路是参与自噬的重要通路[32-33]。STAT3 是STAT 家族的重要成员,有研究显示,在小鼠妊娠的胚胎着床期,p-STAT3在胚泡植入部位的子宫内膜腺上皮和间质组织高表达,并且随着胚胎着床过程的进行,STAT3的表达及活化过程主要在蜕膜细胞内,推测STAT3可能在子宫内膜蜕膜化及胚胎着床过程中起关键作用。而敲除STAT3基因的小鼠在妊娠第7日胚胎即死亡[34]。本研究发现,RSA小鼠蜕膜组织p-JAK1、p-STAT3蛋白及mRNA表达降低,说明JAK1/STAT3通路激活被抑制,而寿胎丸组和地屈孕酮组p-JAK1、p-STAT3蛋白及mRNA表达较模型组均显著升高,表明寿胎丸可激活JAK1/STAT3通路,从而改善RSA小鼠的妊娠结局。
综上所述,寿胎丸可能通过调控JAK1/STAT3信号通路激活自噬,改善RSA蜕膜组织及胎盘组织病理状态、提高血清激素水平、降低胚胎丢失率,从而起到与地屈孕酮相似的保胎效果。但目前细胞自噬在RSA方面的研究仍处于起步阶段,对细胞自噬涉及的相关通路及具体机制仍不完全明确,且细胞自噬在RSA方面的研究仍存在一定争议,今后将进一步通过体外实验验证细胞自噬在RSA中的作用机制及寿胎丸的干预作用。
