细叶勾儿茶部分化合物抗炎活性的实验研究
2023-06-13刘军洋滕红丽赵金妹
刘军洋,滕红丽,赵金妹,洪 精
(1.广西中医药大学,广西 南宁 530001;2.广西国际壮医医院,广西 南宁 530201)
细叶勾儿茶[Berchemia lineata(L.)DC.]是铁包金基源药材之一,又名乌龙根,马口仔,老鼠耳,是鼠李科勾儿茶属植物,以其根和带叶藤茎入药[1]。铁包金(壮药名:Gaeuhouznou 勾吼耨)首载于《岭南采药录》,为壮医常用药材[2,3]。其作为壮医临床常用抗炎药物,广泛应用于治疗类风湿关节炎(RA)的复方中,但报道较少且多为年代久远的临床文献[4]。研究显示,铁包金总提取物具有明显抗炎作用且对小鼠耳廓肿胀有一定疗效[5,6]。主要化学成分有黄酮类、醌类、二聚体、苯丙素类、萜类、苷类以及有机酸类等结构类型[7,8]。虽然临床及动物实验均证明铁包金具有良好抗炎效果,但具体何种铁包金单体化合物具有抗炎活性未见相关报道,分子水平上对细叶勾儿茶的认识限制了对该药材的推广和使用。课题组从细叶勾儿茶茎叶的正丁醇和乙酸乙酯提取物中共分离及鉴定了23 个化合物,化学成分结构类型呈现多样性,包括新型骨架、萘骈α-吡喃酮类、萘骈γ-吡喃酮类、黄酮苷类、联苄类、黄酮及二氢黄酮类、蒽醌类、萜类、简单酚类化合物,涵盖了新化合物和首次从该植物中分离的化合物。通过对其进行药物毒性及其抗炎活性筛选,初步筛选出具有抗炎活性的铁包金单体化合物并对药量相对充足的21 号酚类化合物的作用机制进行初步探究,以期在分子水平对细叶勾儿茶有进一步认识,为进一步探究提供实验依据。
1 材料与方法
1.1 相关试剂及仪器
DMEM 高糖培养基(Gibco)、胎牛血清(FBS;青木)、青霉素链霉素(Gibco)、脂多糖(Sigma)、地塞米松(源叶)、CCK-8(ABclonal)、NO 检测试剂盒(碧云天)、ELISA 试剂盒(四正柏、睿信)、酶标仪(美国Thermo Scientific 公司)、CO2培养箱(美国Thermo Scientific 公司)。
1.2 细胞株
RAW264.7(武汉普诺赛生命科技有限公司)。
1.3 铁包金单体化合物
铁包金单体化合物来源:由课题组从细叶勾儿茶地上部分提取[9],共23 个,新化合物(1~8)、已知化合物(9~23)。其中,1 号是新骨架化合物;2、3 号是天然产物中较为罕见的α 型萘骈吡喃酮类化合物,此前只从海洋生物中发现过,这是首次在植物中发现该类成分;4 号和5 号为角型的萘骈γ-吡喃酮,8 号为联苄类化合物,均为首次从该植物中分得的结构类型;除14、15、19 号外的已知化合物也均是首次从该植物中分离得到的。化合物名称、分子式及结构式详见表1、图1。

图1 分类和化学结构式Fig 1 Classification and chemical structure formula

表1 化合物名称和分子式Tab 1 Compound name and molecular formula
1.4 细胞培养
RAW264.7 使用完全培养液(DMEM+10%FBS+1%P/S),在温度为37 ℃、CO2浓度为5%的潮湿培养箱中培养。RAW264.7 细胞每隔24 h 进行传代培养,选择对数生长期细胞进行实验。
1.5 造模
LPS 诱 导RAW264.7 细 胞12 h,建 立 细 胞 炎 症模型。
1.6 CCK-8 法测定其对RAW264.7 细胞增值活性的影响
将RAW264.7 细胞均匀接种于96T 板,每孔100 μL,待细胞贴壁,弃上清。设空白对照组和药物组,空白对照组和药物组分别加入细胞培养液、50 μmol/L 或75 μmol/L 的 单 体 化 合 物100 μL,孵 育24 h,弃上清液。严格按照CCK-8 说明书进行操作,于450 nm 波长测吸光度,计算细胞存活率。
1.7 Griess 法测定RAW264.7 细胞NO 释放量
RAW264.7 细胞接种于96T 板,每孔100 μL,待细胞贴壁,弃上清。设定空白对照组(Con)、模型组(LPS)、阳性对照组(DXM)、细叶勾儿茶单体化合物组。给药:空白对照组:DMEM 培养液;模型组:终浓度为0.5 μg/mL 的LPS;阳性对照组:终浓度为0.5 μg/mL 的LPS 和终浓度为10 μmol/L 的DXM,共孵育;细叶勾儿茶单体化合物组:终浓度为0.5 μg/mL 的LPS 和50 μmol/L 的 细 叶 勾 儿 茶 单 体 化合物,共孵育。96T 板置于37 ℃,CO2浓度为5%的培养箱中孵育12 h,取50 μL 细胞上清液,严格按照NO 检测试剂盒说明书操作,于540 nm 波长测吸光度,计算NO 释放量和NO 抑制率。
1.8 抗炎活性梯度检测(化合物2、15、16、18、21)
选取抗炎活性较好且提取量相对多的单体化合物进行抗炎活性梯度检测。给药:模型组:0.5 μg/mL 的 LPS;阳性对照组:终浓度为0.5 μg/mL的LPS 和终浓度为10 μmol/L 的DXM 共孵育;细叶勾儿茶单体化合物组为0.5 μg/mL 的LPS 和不同浓度细叶勾儿茶单体化合物共孵育。2、21 号设置浓度梯度:6.25、12.5、25、50、75 μmol/L;15、16、18设置浓度梯度:6.25、12.5、25、50 μmol/L。严格按照NO 检测试剂盒说明书操作,于540 nm 波长测吸光度,计算NO 释放量和NO 抑制率。
1.9 ELISA 法检测TNF-α、IL-6、NF-κB、COX-2、iNOS 的含量
RAW264.7 细胞接种于6T 板中,待细胞贴壁。设定空白对照组、模型组、阳性药物组和细叶勾儿茶单体化合物组。待细胞贴壁,弃上清。给药:空白 对 照 组:DMEM 培 养 液;模 型 组:0.5 μg/mL 的LPS;阳性对照组:0.5 μg/mL 的LPS 和10 μmol/L的DXM,共孵育;细叶勾儿茶单体化合物组为0.5 μg/mL 的LPS 和25、50、75 μmol/L 的 细 叶 勾 儿 茶单体化合物,共孵育。于37 ℃,CO2浓度为5%的培养箱中孵育12 h。收集细胞上清液,按ELISA 试剂盒的说明检测。
1.10 统计学处理
应用GraphPad prism 9.0 软件对数据进行分析,采 用(±s)表 示,P<0.05 表 示 差 异 具 有 统 计 学意义。
2 结果
2.1 细叶勾儿茶单体化合物对RAW264.7 细胞的毒性作用
结 果 显 示,给 药24 h(50 μmol/L),19 号 对RAW264.7 细胞产生药物毒性作用,细胞存活率为59.25%,其他化合物对RAW264.7 细胞均无明显毒性,细胞存活率大于80%。75 μmol/L 的2、21 号化合物细胞存活率为117%和108%。化合物浓度为50 μmol/L 时,RAW264.7 细胞存活率,见表2。
表2 细胞存活率(n=3,±s)Tab 2 Cell survival rate(n=3,±s)
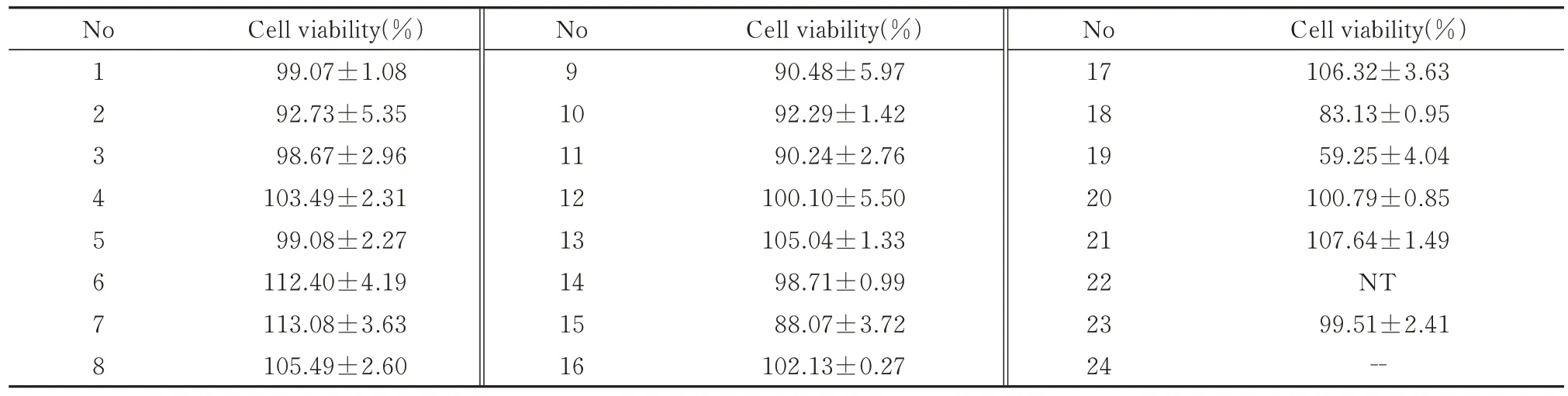
表2 细胞存活率(n=3,±s)Tab 2 Cell survival rate(n=3,±s)
注:NT: not test。
Cell viability(%)106.32±3.63 83.13±0.95 59.25±4.04 100.79±0.85 107.64±1.49 NT 99.51±2.41--No 12345678 Cell viability(%)99.07±1.08 92.73±5.35 98.67±2.96 103.49±2.31 99.08±2.27 112.40±4.19 113.08±3.63 105.49±2.60 No 9 10 11 12 13 14 15 16 Cell viability(%)90.48±5.97 92.29±1.42 90.24±2.76 100.10±5.50 105.04±1.33 98.71±0.99 88.07±3.72 102.13±0.27 No 17 18 19 20 21 22 23 24
2.2 细叶勾儿茶单体化合物对LPS 诱导的RAW264.7 细 胞 释 放NO 的 影 响
结果显示,给药12 h,分离提取到的细叶勾儿茶单体化合物可不同程度的抑制NO 释放。9 号联苄类化合物以及15 号黄酮类化合物、19 号蒽醌类化合物NO 抑制率均达到90%以上,具有较强的抗炎活性。该浓度下的19 号化合物可以降低细胞存活率,影响NO 的检测结果。1 号新型骨架化合物,6、7 号黄酮苷类,8 号联苄类,16、17 号二氢黄酮类,18 号蒽醌类、21 号简单的酚类化合物的NO 抑制率范围在54.65%~80.57% 之间。其中1 号新骨架化合物,NO 抑制率为70.81%,不但有较好抗炎效果且无明显药物毒性,具有进一步探究的价值。NO 抑制率结果,见表3。
表3 一氧化氮抑制率(n=3,±s)Tab 3 Nitric oxide inhibition ratio (n=3,±s)

表3 一氧化氮抑制率(n=3,±s)Tab 3 Nitric oxide inhibition ratio (n=3,±s)
注:NT: not test。
NO inhibition ratio (%)No NO inhibition ratio (%)No NO inhibition ratio(%)No 80.57±3.87 57.61±3.23 101.73±2.25 20.48±1.21 58.81±7.64 NT 18.09±3.50-1 2 3 4 5 6 7 8 70.81±0.79 41.82±2.98 15.15±1.49 27.81±3.10 38.32±6.04 54.65±6.42 56.87±2.49 63.12±0.19 9 10 11 12 13 14 15 16 90.02±0.48 5.41±1.38 0.90±1.11 NT NT NT 99.07±1.82 71.22±1.78 17 18 19 20 21 22 23 24
2.3 抗炎活性梯度检测结果
结果显示,细叶勾儿茶单体化合物可以不同程度抑制NO 释放且呈剂量依赖性。02 号萘骈-α 吡喃酮类、15、16 号黄酮及二氢黄酮类、18 号蒽醌类、21号简单的酚类化合物皆剂量依赖性抑制NO 释放。其 中,21 号 化 合 物,浓 度 为6.25、12.5、25、50、75 μmol/L 时,NO 抑 制 率 分 别 为22.15%、28.61%、30.57%、52.45%、61.22%,可剂量依赖性抑制LPS诱导的RAW264.7 释放NO,见表4。
表4 化合物对LPS 诱导RAW264.7 细胞NO 释放量的影响 (n=3,±s)Tab 4 Effects of compound on production of NO in RAW264.7 cells induced by LPS(n=3,±s)

表4 化合物对LPS 诱导RAW264.7 细胞NO 释放量的影响 (n=3,±s)Tab 4 Effects of compound on production of NO in RAW264.7 cells induced by LPS(n=3,±s)
注:NT: not test; ##P<0.01 表示与空白对照组相比; **P<0.01 表示和模型组相比。
组别Con LPS DXM 6.25 12.5 25 50 75 FP 21 2.51±0.12 19.01±0.48##3.99±0.58**15.36±0.83**14.29±0.71**13.97±0.81**10.36±0.09**8.91±0.26**310.7<0.000 1 02 2.19±0.06 17.45±1.12##3.52±0.23**16.79±0.11 16.10±0.50 14.74±0.21**12.56±0.60**10.66±0.56**372.0<0.000 1 15 2.48±0.36 16.52±1.14##5.10±0.51**14.55±0.93 12.76±1.06**12.20±0.80**5.71±0.36**NT 137.8<0.000 1 16 0.84±0.03 22.19±0.60##5.32±0.23**20.95±0.92 17.61±1.00**14.05±0.71**7.94±0.51**NT 465.1<0.000 1 18 1.86±0.27 27.69±0.32##15.75±0.22**26.46±0.18**22.53±0.28**17.36±0.15**9.93±0.27**NT 4230.0<0.000 1
2.4 ELISA 法检测化合物21 对RAW264.7 分泌IL-6、TNF-α、NF-κB、iNOS、COX-2 的影响
ELISA 结果显示,与空白对照组相比,模型组细胞上清液中IL-6、TNF-α、NF-κB、COX-2、iNOS水平显著增高;与模型组相比21 号化合物剂量依赖性抑制IL-6、TNF-α、NF-κB、COX-2、iNOS 分泌,见表5。
表5 化合物21 对RAW264.7 细胞IL-6、TNF-α、NF-κB、iNOS、COX-2 分泌的影响(n=3,±s)Tab 5 Effects of compound 21 of IL-6,TNF-α,NF-κB,iNOS and COX-2 in RAW264.7 cells(n=3,±s)
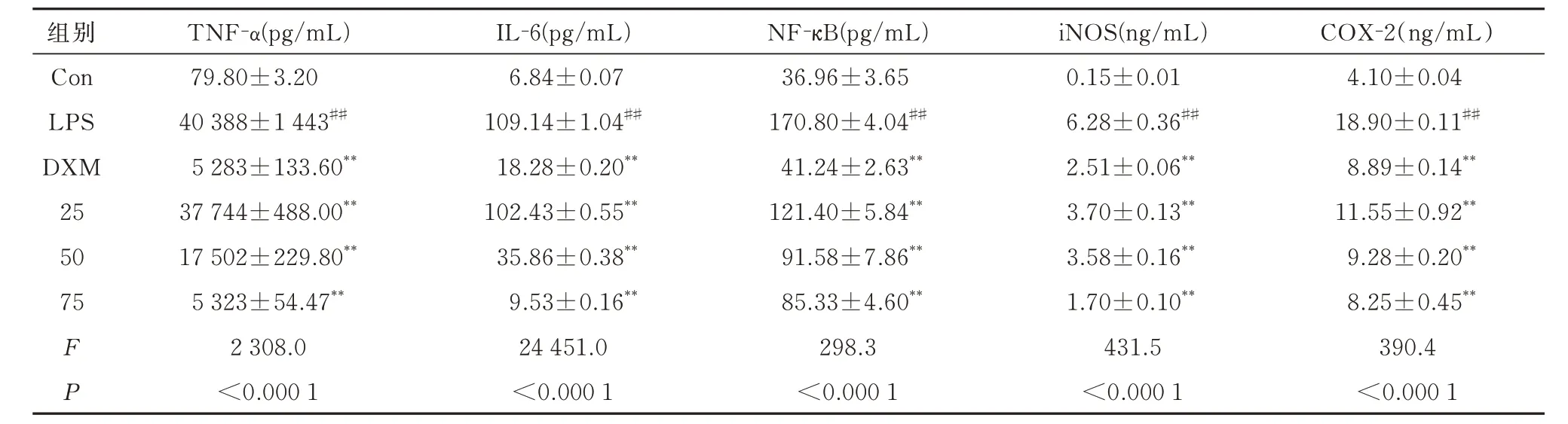
表5 化合物21 对RAW264.7 细胞IL-6、TNF-α、NF-κB、iNOS、COX-2 分泌的影响(n=3,±s)Tab 5 Effects of compound 21 of IL-6,TNF-α,NF-κB,iNOS and COX-2 in RAW264.7 cells(n=3,±s)
注:##P<0.01 表示与空白对照组相比,**P<0.01 表示和模型组相比。
组别COX-2(ng/mL)TNF-α(pg/mL)IL-6(pg/mL)NF-κB(pg/mL)iNOS(ng/mL)Con LPS DXM 25 50 75 FP 4.10±0.04 18.90±0.11##8.89±0.14**11.55±0.92**9.28±0.20**8.25±0.45**390.4<0.000 1 79.80±3.20 40 388±1 443##5 283±133.60**37 744±488.00**17 502±229.80**5 323±54.47**2 308.0<0.000 1 6.84±0.07 109.14±1.04##18.28±0.20**102.43±0.55**35.86±0.38**9.53±0.16**24 451.0<0.000 1 36.96±3.65 170.80±4.04##41.24±2.63**121.40±5.84**91.58±7.86**85.33±4.60**298.3<0.000 1 0.15±0.01 6.28±0.36##2.51±0.06**3.70±0.13**3.58±0.16**1.70±0.10**431.5<0.000 1
3 讨论
基于铁包金临床上主要用于抗RA 的治疗,NF-κB 信号通路与RA 的发生紧密相关以及课题组前期研究发现铁包金(细叶勾儿茶和光枝勾儿茶)总提取物可在RAW264.7 细胞内剂量依赖性地下调细胞内基本水平的NF-κB 活性,并能够阻断炎症因子TNF-α 或LPS 诱导的NF-κB 活性的增加的事实,该实验对细叶勾儿茶单体化合物进行抗炎活性筛选并基于NF-κB 信号通路探究其作用机制。又因动物实验需要的化合物的量大,从传统药物中分离提取的单体化合物往往不够的事实,因此,选择LPS 诱导RAW264.7 细胞建立经典体外炎症模型,在细胞水平筛选铁包金中可能具有抗炎活性的单体化合物,这样,使用少量的化合物就能为后续研究指明正确的方向。
NO 作为重要的继发性炎症介质,NO 的形成与iNOS 密切相关[10,11],是炎症反应重要指标[12]。NFκB 信号通路为调控多种炎症反应的经典通路[13]。NF-κB 二聚体活化后,加剧IL-6、TNF-α 等炎症因子分泌的同时可促进NF-κB 表达,构成正反馈机制,形成恶性循环[14]。TNF-α 引起炎症反应的同时可促进巨噬细胞生成大量NO 加剧IL-6 的分泌进而促进炎症反应[15-18]。另外,NF-κB 信号通路受到炎症因子被激活并磷酸化后,进一步诱导核内iNOS与COX-2 分泌。iNOS 和COX-2 在炎症反应的过程中,对炎症介质的产生起关键作用,过度表达可加剧炎症反应[19-22]。COX-2 通过调节炎症介质NO和iNOS 的合成与释放,加重炎症反应[23-25]。
实验结果显示,给药24 h(50 μmol/L),细叶勾儿茶单体化合物(除19 号)对RAW264.7 细胞均无明显药物毒性,对细胞存活率无明显影响。Griess法抗炎活性筛选结果显示,50 μmol/L 的细叶勾儿茶单体化合物作用12 h 可以不同程度地抑制LPS诱导的RAW264.7 细胞释放NO,说明其具有一定的抗炎活性。其中,9 号联苄类、15 号黄酮类及19号蒽醌类化合物都有较强的抗炎活性,说明这些化合物可能是细叶勾儿茶临床抗炎治疗的药效物质基础。然而,50 μmol/L 的19 号单体化合物对细胞存活率有一定影响,干扰抗炎活性检测结果。9、15号不但有良好抗炎效果且药物毒性小,为进一步抗炎研究提供新思路。抗炎活性梯度检测结果显示,细叶勾儿茶单体化合物(2、15、16、18、21 号)抗炎活性具有剂量依赖性。另外,21 号简单酚类单体化合物可降低RAW264.7 细胞NF-κB、COX-2、iNOS、TNF-α、IL-6 的分泌。
综上,实验结果提示细叶勾儿茶中联苄类(09)、黄酮类成分(15)单体化合物抗炎活性尤佳,可能是其发挥抗炎活性的药效物质基础。1 号作为新骨架化合物有必要进行进一步探究。21 号简单酚类化合物可降低LPS 诱导的炎症模型的炎症因子水平,其作用机制可能与抑制NF-κB 通路异常激活有关。
所有作者声明不存在利益冲突关系。
