镉胁迫下深色有隔内生真菌对樟子松1年生苗生长及根际土壤环境的影响
2023-06-13邵鹏王铮钟斯文宋小双马玲宋瑞清邓勋
邵鹏 王铮 钟斯文 宋小双 马玲 宋瑞清 邓勋


摘要:探究重金屬镉(Cd)胁迫下深色有隔内生真菌(Dark septate endophytes, DSE)对樟子松生长和土壤环境的影响,为重金属污染土地的有效治理和生物修复提供参考。采用盆栽试验法,研究不同浓度Cd胁迫下,接种A041对樟子松(Pinus sylvestris var. mongolica)幼苗生长指标、生理指标、根际土壤养分含量和土壤酶活性的变化影响。研究表明,与不接种相比,在土壤Cd浓度为5.0 mmol/L时DSE对樟子松的促生作用最显著,使樟子松的株高、地径分别提高了12.59%和13.13%;在Cd胁迫下,DSE不同程度提高幼苗过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)和谷胱甘肽(GSH)含量,最高分别可达217.95%、43.06%、100.00%和235.38%;接种DSE可显著降低丙二醛(MDA)、可溶性糖(SS)和游离脯氨酸(PRO)含量,最高分别为150.00%、8.05%和73.78%;DSE能提高土壤有机质(OM)、土壤全氮(TN)、有效氮(AN)、全磷(TP)、有效磷(AP)、全钾(TK)和有效钾(AK)含量,最高分别增加25.41%、32.39%、17.46%、50.92%、77.97%、46.22%和30.87%;DSE还能不同程度地提高脲酶(S-UE)、蔗糖酶(S-SC)和过氧化氢酶(S-CAT)的含量,最高分别可达80.94%、43.45%和10.75%。结果表明,接种DSE能显著促进樟子松苗木生长,增强土壤养分利用性,提高植物对重金属Cd的抵抗能力和抗逆性。
关键词:深色有隔内生真菌;樟子松;镉胁迫;抗性生理指标;土壤酶活性
中图分类号:S763.15文献标识码:A文章编号:1006-8023(2023)02-0001-11
Effects of Dark Septate Endophytic Fungi on Growth and Rhizosphere
Soil of Annual Seedlings of Pinus sylvestris var. mongolica under Cd Stress
SHAO Peng1,2, WANG Zheng1,2, ZHONG Siwen1,2, SONG Xiaoshuang2,3, MA Ling1, SONG Ruiqing1, DENG Xun2,3*
(1.School of Forestry, Northeast Forestry University, Harbin 150040, China; 2.Heilongjiang Provincial Key
Laboratory of Forest and Grassland Fire and Pest Control, Harbin 150081, China;
3.Heilongjiang Forest Protection Research Institute, Harbin 150081, China)
Abstract:To explore the effects of dark septate endophytic (DSE) on growth of plant and soil environments under Cd stress, it provided a reference for the effective treatment and bioremediation of heavy metal contaminated land. The pot experiment was used to study the effects of A041 inoculation on the growth indexes, physiological indexes, rhizosphere soil nutrient content and soil enzyme activity of seedlings P. sylvestris var. mongolica under different concentrations of Cd stress. Compared with no inoculation, the growth promotion effect of DSE was the most significant at 5.0 mmol/L soil Cd concentration, which increased plant height and ground diameter by 12.59% and 13.13%, respectively. Under Cd stress, the contents of catalase (CAT), peroxidase (POD), superoxide dismutase (SOD) and glutathione (GSH) of seedlings were increased by DSE to 217.95%, 43.06%, 100.00% and 235.38%, respectively. Inoculation with DSE could significantly reduce the content of malondialdehyde (MDA), soluble sugar (SS) and determination of free proline by ninhydrin method (PRO) with the highest of 150.00%, 8.05% and 73.78%, respectively. DSE could increase the contents of soil organic matter (OM), total nitrogen (TN), available nitrogen (AN), total phosphorus (TP), available phosphorus (AP), total potassium (TK) and available potassium (AK) by 25.41%, 32.39%, 17.46%, 50.92%, 77.97%, 46.22% and 30.87%, respectively. DSE could also increase S-UE, S-SC and S-CAT to 80.94%, 43.45% and 10.75%, respectively. The results showed that inoculation of DSE significantly promoted plant growth, increased soil nutrient availability, improved the resistance and stress resistance of plants to heavy metal Cd.
Keywords:Dark septate endophytic; Pinus sylvestris var. mongolica; Cd stress; physiological indicators of resistance; soil enzyme activities
收稿日期:2022-06-22
基金项目:国家自然科学基金项目(31670649、31700564、31200484)
第一作者简介:邵鹏,硕士研究生。研究方向为林木益生菌。Email: shaopeng419@163.com
*通信作者:邓勋,博士,研究员。研究方向为林木益生菌互作机制。Email: dxhappy@126.com
引文格式:邵鹏,王铮,钟斯文,等. 镉胁迫下深色有隔内生真菌对樟子松1年生苗生长及根际土壤环境的影响[J]. 森林工程, 2023,39(2):1-11.
SHAO P, WANG Z, ZHONG S W, et al. Effects of dark septate endophytic fungi on growth and rhizosphere soil of annual seedlings of Pinus sylvestris var. mongolica under Cd stress[J]. Forest Engineering, 2023,39(2):1-11.
0引言
隨着工业、农业、制造业的发展,矿山开采挖掘工作强度增大,随之产生大量废渣、废气、废水及其他含有重金属的废弃垃圾,这些重金属会不断渗透到土壤中,造成矿山地区土壤质量的下降,破坏生态环境[1]。农业生产中大量使用农药、化肥,产生的重金属进入土壤,流入地下水,会造成生态环境污染。2014年《全国土壤污染状况调查公报》显示,重金属总超标率为16.1%,其中Cd污染最为严重,污染点位的超标率达到了7.0%[2]。Cd污染严重,主要与其物理性质和化学性质相关。Cd属于亲硫元素,容易替换其他元素以硫化物形式存在于矿产中,Cd的沸点为767 ℃,可通过燃煤取暖发电、冶炼金属和焚烧垃圾等方式排放到大气中,造成空气中Cd含量上升[3]。Cd在环境中不能被降解,进入土壤中会通过吸附、沉降和络合等方式形成难溶物,固结在土壤中产生毒性[4]。有研究表明,Cd胁迫能显著抑制植物生长,轻度胁迫条件下降低植物对营养元素的吸收,阻碍其叶片及根茎的生长,重度胁迫条件下能破坏细胞结构,甚至导致植物死亡[5]。
内生菌在植物体中存在非常广泛,深色有隔内生真菌(Dark septate endophytes, DSE)是内生菌的主要类群之一,具有隔膜和深色菌丝,少数不具有隔膜,主要定殖于植物根细胞、细胞间隙和表皮内,其明显特征是形成“微菌核”结构[6-7]。DSE定殖优势明显,寄主范围广泛,不会引起植物病变,与寄主植物互惠共生,DSE依附于寄主植物生长,从植物中获取自身生长发育所需要的营养物质,同时增大寄主植物与土壤的接触面积,促进植物生长,提高其抗病能力,增强其抵抗生物胁迫和非生物胁迫的能力[8-10]。有研究表明,DSE能改善土壤养分环境,将土壤中难溶的N、P元素转化为可溶状态,提高植物对矿质营养元素的积累能力,促进植物对N、P等必需元素的吸收,为植物生长发育提供更多养分[11-13]。DSE通过提高植物体内抗氧化酶活力、降低苗木渗透调节物质的积累,起到促生抗逆的作用,尤其是在提高植物抗病虫害能力和对高温、干旱、盐碱和重金属等逆境胁迫能力方面有显著作用[14-16]。刘加强等[17]在Cd胁迫下接种DSE发现,DSE显著提高玉米(maize)生理指标,降低MDA的积累以提高玉米的抗逆性;滕秋梅等[18]发现在镉胁迫下接种DSE显著增加芦竹(Arundo donax)生理指标,提高植物营养和镉含量,以此来缓解植物镉胁迫。
本研究以樟子松为材料,通过盆栽实验对樟子松进行不同浓度Cd胁迫,研究不同浓度Cd胁迫下1年生苗的生长指标、生理指标、土壤理化性质和土壤酶活性。1年生苗是在无菌土中栽培,无菌室中生长,其目的是排除其他菌种对苗木生长造成影响,采用控制变量方式探究DSE对樟子松幼苗抗重金属Cd胁迫能力的影响。
1材料与方法
1.1菌株来源
供试菌种为菊异茎点霉(Paraphoma chrysanthemicola)A041,基因登录号MW449617,分离自帽儿山实验林场樟子松人工林樟子松根系,保存于黑龙江省森林保护研究所森林微生物实验室。
1.2方法
种子处理:用0.5%高锰酸钾(体积分数)将樟子松种子浸泡消毒30 min,无菌水冲洗数次后包裹在灭菌的湿纱布中,放置在人工气候箱内25 ℃下催芽,每天早晚用无菌水冲洗一次,直至出芽。
无菌土制备及播种:将草炭土、蛭石、河沙体积比为2∶1∶1的混合土装入灭菌袋中,121 ℃灭菌2 h,冷却后装入营养钵内。每钵放入30粒发芽的种子,覆盖2 cm厚的无菌土,幼苗出土后每钵定苗20株,进行常规管护。
菌剂制备:用无菌打孔器切取直径为5 mm的菌饼,接种到250 mL PD培养基中,每瓶接种3块菌饼,25 ℃、150 r/min振荡培养7 d得到液体菌剂,使用前对菌丝体做匀浆处理。
接种:出苗1个月后采用打孔灌根的方式接种菌剂,每钵接种50 mL菌剂,每处理10个重复,对照组接种等量PD培养基。继续生长2个月后每钵浇灌100 mL CdCl2溶液,继续生长1个月测定相关指标。试验分为接菌和不接菌两组,共10个处理,各处理如下。
(1)CK:不施加菌剂和CdCl2;
(2)Cd(0.5):施加浓度为0.5 mmoL/L CdCl2;
(3)Cd(1.0):施加浓度为1.0 mmoL/L CdCl2;
(4)Cd(2.0):施加浓度为2.0 mmoL/L CdCl2;
(5)Cd(5.0):施加浓度为5.0 mmoL/L CdCl2 ;
(6)DSE:DSE菌剂接种处理;
(7)Cd(0.5)+DSE:同时施加DSE菌剂和浓度为0.5 mmol/L CdCl2;
(8)Cd(1.0)+DSE:同时施加DSE菌剂和浓度为1.0 mmol/L CdCl2;
(9)Cd(2.0)+DSE:同时施加DSE菌剂和浓度为2.0 mmol/L CdCl2;
(10) Cd(5.0)+DSE:同时施加DSE菌剂和浓度为5.0 mmol/L CdCl2。
1.31年生苗生长指标及根际土壤指标的测定
1.3.1苗木生长指标测定
每处理随机选取10株苗,3次重复,用直尺和游标卡尺分别测定苗高、地径,用天平称量苗木鲜重,置于烘箱中85 ℃烘干8 h,测量苗木的干重。
1.3.2苗木生理指标测定
参考尹大川等[19]的方法进行樟子松苗生理指标测定,其中过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性使用南京建成试剂盒测定,谷胱甘肽(GSH)含量使用二硫代硝基苯甲酸法测定,苗木渗透调节物质中使用蒽酮比色法测可溶性糖(SS)含量、硫代巴比妥酸法测丙二醛(MDA)含量、水合茚三酮法测游离脯氨酸(PRO)含量,每处理3次生物学重复。
1.3.3根际土壤理化性质和酶活性的测定
取风干后的根际土壤过筛处理,其中过60目筛处理后测定土壤酶活性,过100目筛处理后测定土壤养分指标。采用重铬酸钾外加热法测定土壤有机质(OM)含量、凯氏定氮法测定土壤全氮(TN)、碱性水解扩散法测定有效氮(AN)、硫酸消解法测定全磷(TP)、碳酸氢钠浸提法测定有效磷(AP)、火焰光度法测定全钾(TK)和有效钾(AK)。采用南京建成试剂盒测土壤蔗糖酶(S-SC)、过氧化氢酶(S-CAT)和脲酶(S-UE)活性,每处理3次生物学重复。
1.4数据处理
使用Microsoft Excel对测定数据进行整理,使用SPSS 22.0进行数据差异显著性(P<0.05)和相关性分析。
2结果与分析
2.1DSE对Cd胁迫下苗木生长指标影响
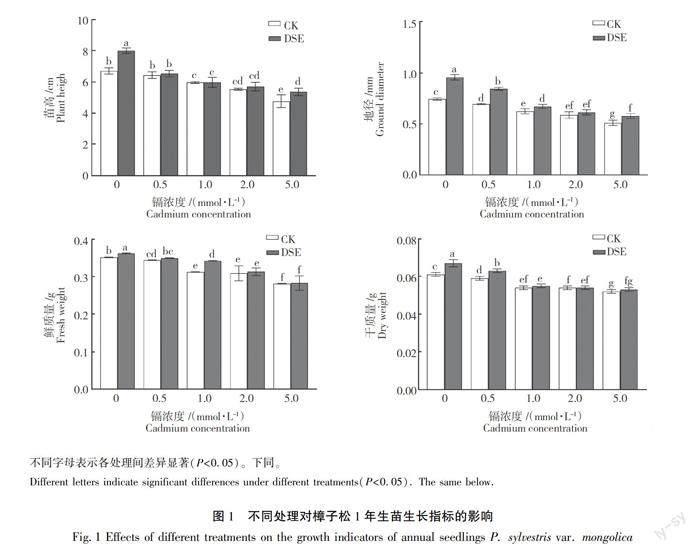
接种DSE且Cd浓度0 mmol/L时苗高、地径、鲜质量和干质量达到最高,分别为8.000 cm、0.843 mm、0.362 g和0.067 g。不同镉浓度处理后樟子松幼苗苗高、地径、鲜质量和干质量均有不同程度的降低,在Cd浓度为5.0 mmol/L时,同对照相比分别降低了42.55%、45.67%、24.91%和17.31%。同不接种组相比,接种DSE樟子松幼苗,Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时苗高分别提高19.40%、1.55%、0%、3.07%和12.59%,其中在0和5.0 mmol/L时对苗高提高显著;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时地径分别提高27.46%、21.65%、7.54%、4.43%和13.13 %,其中在0、0.5、5.0 mmol/L时对地径提高顯著;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时,鲜质量分别提高了3.13%、1.45%、9.61%、1.29%和0.71%,其中在1.0 mmol/L时对鲜质量提高最显著;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时干质量分别提高了9.84%、6.78%、1.85%、0%和1.92%,其中在0和0.5 mmol/L时对干质量提高显著,如图1所示。
双因素方差分析结果表明,接种DSE和镉胁迫处理均影响1年生樟子松苗的苗高、地径、鲜质量和干质量,见表1。Cd胁迫下接种深色有隔内生真菌A041显著促进樟子松1年生苗生长,如图1所示。与对照相比,随着Cd浓度升高,接菌组和不接菌组幼苗苗高、地径、干质量和鲜质量均呈逐渐降低趋势,说明Cd对幼苗具有毒害作用,抑制其生长。在同一Cd浓度下,接菌组各指标均大于不接菌组,且大部分具有显著差异性(P<0.05)。
2.2Cd胁迫下苗木生理指标分析
CAT活性在接种DSE且Cd浓度为0 mmol/L时达到最大值为111.71 U/g;POD活性、SOD活性和GSH含量在接种DSE且Cd浓度为1.0 mmol/L时达到最高值,分别为439.67 U/g、681.62 U/g和5.48 mg/L;MDA、可溶性糖和PRO含量在接种DSE且Cd浓度为0 mmol/L时达到最小值,分别为0.18 nmol/mg、22.67 μg/g和56.13 μg/g。同不接种组相比,接种DSE A041樟子松幼苗,Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时 CAT活性分别提高63.44%、10.42%、23.19%、34.19%和217.95%, 5.0 mmol/L时对CAT活性提高显著;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L POD活性分别提高43.06%、14.76%、11.59 %、10.95%和42.12%,其中0和5.0 mmol/L时对POD活性提高显著;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时SOD活性分别提高11.05%、19.48%、100.00%、0.70%和17.69%,其中1.0 mmol/L时对SOD活性提高最显著;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时GSH含量分别提高147.71%、104.67%、88.97%、49.73%和235.38%,其中在Cd浓度5.0 mmol/L时GSH含量提高最多;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时MDA含量分别降低150.00%、3.77%、14.55%、16.44%和38.09%,0 mmol/L时MDA含量降低最显著;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时可溶性糖含量分别降低3.66%、1.54%、0.12%、2.02%和8.05%;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时PRO时含量分别降低52.59%、73.78%、12.62%、16.80%和69.07%,其中Cd浓度为5.0 mmol/L时PRO含量降低最显著。
双因素方差分析结果表明,接种DSE和镉胁迫处理均影响樟子松苗生理指标,其交互作用显著影响1年生苗的CAT、POD、SOD活性以及GSH和PRO含量,见表2。由图2可知,随着Cd浓度升高,1年生苗不同组内CAT、POD、SOD3种抗氧化酶活性均呈先降低、后升高、再降低的趋势,且组内差异显著(P<0.05)。说明当苗木初始受到低质量浓度Cd胁迫时,生理代谢过程受到抑制,表现出抗氧化酶活性降低。随着Cd胁迫程度不断增加,苗木需要逆转重金属所造成的生理代谢受抑制现象,因此抗氧化酶活性增加,但是当Cd达到一定浓度时,苗木自身无法抵御高浓度胁迫,苗木所受毒性加强,抗氧化酶活性会再次降低。在同一浓度Cd胁迫下,接菌组的抗氧化酶活性显著大于不接菌组,证明接种A041能够提高樟子松幼苗内抗氧化酶活性。谷胱甘肽作为植物体内重要的抗氧化剂,在受到重金属胁迫时,同样也表现出了抵抗性。Cd浓度增加,各组内GSH含量先升高后降低,说明低浓度Cd胁迫下,樟子松通过产生GSH螯合细胞内处于游离态的重金属,降低毒害。与抗氧化酶相同,接菌组GSH含量显著高于不接菌组,同样证明接种A041能提高樟子松抗重金属Cd能力。MDA、可溶性糖、PRO这3种渗透调节物质含量变化趋势一致,与Cd浓度呈正相关,说明当Cd胁迫程度加强,会加剧植物细胞脂质过氧化程度,造成渗透调节物质积累,毒害作用加强。对比2组数据,发现接种A041能减少植物内渗透调节物质含量,缓解胁迫。以上均能证明接种A041能提高樟子松1年生幼苗对重金属Cd的耐受性,缓解重金属对植物造成的毒害作用。
2.3Cd胁迫下苗木根际土壤理化性质分析
未接种DSE组中随着镉胁迫浓度的增加,如图3所示,土壤OM、TN、AN、TP、AP、TK和AK含量均显著降低,镉胁迫下与对照组的OM、TN、AN、TP、AP、TK和AK分别降低14.41%~43.64%、102.23%~158.57%、0%~25.37%、14.71%~47.73%、0.80%~31.02%、32.83%~95.09%和11.11%~51.50%(P<0.05);与未接种相比,DSE接种樟子松幼苗,Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时土壤OM分别增加19.19%、15.73%、25.41%、23.51%和15.01%;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时TN分别增加25.83%、32.39%、22.07%、0.66%和12.10%;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时土壤AN分别增加17.46%、9.92%、7.83%、3.60%和1.49%;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时土壤TP含量分别增加38.46%、40.58%、50.92%、11.04%和31.06%;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时土壤AP含量分别增加77.97%、78.44%、38.94%、40.22%和31.34%;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时土壤TK分别增加46.22%、41.43%、11.85%、41.42%和22.76%;Cd濃度为0、0.5、1.0、2.0、5.0 mmol/L时土壤AK含量分别增加30.87%、13.02%、4.96%、12.74%和24.97%(P<0.05)。
双因素方差分析结果表明(表3),接种DSE和镉胁迫处理均影响樟子松苗土壤因子,其交互作用显著影响1年生苗的OM、TP、AP、TK、AK含量。由图3可知,樟子松1年生苗接种DSE与不接种DSE间土壤养分含量差异显著(P<0.05)。随着Cd浓度增加,2组土壤中OM、TN、AN、TP、AP、TK、AK含量均呈下降趋势,表明Cd胁迫会降低土壤养分含量,从而抑制植物生长。在相同浓度Cd胁迫下,接菌组各项土壤理化性质指标均大于不接菌组,差异显著(P<0.05),证明接种DSE能增加土壤养分含量,促进植物生长发育。其中接菌组高浓度Cd胁迫处理土壤中OM和AP含量依然高于不接菌低浓度Cd胁迫处理,说明接种DSE能在一定程度上缓解高浓度重金属胁迫,对提高樟子松抗重金属能力作用较大。
2.4Cd胁迫下苗木根际土壤酶活性分析
Cd胁迫下,对照组的S-UE、S-SC和S-CAT活性分别降低了46.93%~101.11%、26.36%~140.97%和2.11%~17.93%(P<0.05);与未接种相比,DSE接种樟子松幼苗,Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时土壤S-UE活性分别增加37.97%、80.94%、23.91%、0.02%和20.32%;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时土壤S-SC活性分别增加了17.74%、26.71%、21.03%、7.75%和43.45%;Cd浓度为0、0.5、1.0、2.0、5.0 mmol/L时土壤S-CAT活性分别增加了6.69%、1.65%、10.75%、7.13%和6.89%。
DSE与Cd胁迫处理及二者交互作用显著影响土壤因子,见表4。由图4可知,1年生苗根际土壤脲酶、蔗糖酶、过氧化氢酶活性随Cd胁迫程度加强基本呈降低趋势。土壤脲酶含量与土壤中可利用N含量呈正相关,常用脲酶活性揭示土壤肥力情况。同组间Cd胁迫加强,脲酶活性降低,同浓度Cd胁迫下,接菌组脲酶含量大于不接菌组,这与土壤理化性质测定结果相吻合。接种DSE显著提高土壤蔗糖酶和过氧化氢酶活性,活性与Cd胁迫呈负相关,表明接种DSE能够在缓解植物根部所受的氧化胁迫。
2.5土壤因子与植物生长指标相关性分析
相关性分析结果表明,1年生樟子松苗苗高、地径、鲜质量、干质量与土壤因子及根际土壤酶活呈显著正相关,MDA、PRO及可溶性糖含量与土壤因子及根际土壤酶活呈显著负相关(P<0.05),见表5。
3结论与讨论
3.1结论
综上所述,接种DSE A041能提高樟子松在重金属镉胁迫条件下的生长能力,该DSE菌株可用于重金属污染地区幼苗的生物菌剂;该结果可为重金属污染地区樟子松培育、生长及改良重金属污染土壤工作的开展提供理论依据。
3.2讨论
植物-微生物联合修复重金属污染土壤已成为研究热点,有研究表明,植物根际促生菌能增强植物对重金属的抗性,提高土壤养分含量,修复污染土壤[20]。真菌和细菌已经在重金属污染土壤修复工作中发挥了重要的作用,丛枝菌根菌能产生Fe载体,促进植物对铁的吸收,修复Fe污染土壤[21]。熊智慧等[22]发现,接种产碱菌(Alcaligenes sp.qz-1)显著提高玉米对土壤Cr的吸收量,降低土壤中Cr含量,促进玉米生长发育。本研究中随着Cd浓度升高,接菌组和不接菌组幼苗苗高、地径、干质量和鲜质量均呈逐渐降低趋势,说明Cd对幼苗具有毒害作用,抑制其生长。在同一Cd浓度下,接菌组各指标均大于不接菌组,Cd胁迫下接种DSE显著促进樟子松1年生苗生长。一方面证明接种DSE对苗木有促生作用,另一方面证明DSE能提高植物对逆境胁迫的适应能力。
重金属污染会破坏植物细胞结构,发生氧化作用,改变次生结构和蛋白质结构,进而干扰植物对必需金属的吸收、运输和代谢,对植物生长造成严重影响[23]。诸多研究证明DSE具有提高植物对重金属耐受性的作用,在重金属胁迫条件下,DSE可通过提高细胞壁中的黑色素含量抵抗重金属对细胞的侵扰,保护真菌菌丝体免受伤害[24]。在重金属污染土壤中,DSE可以通过吸附重金属、限制根与地上部之间重金属离子的迁移、增加叶绿素浓度并提高蒸腾速率,促进植物生长并限制金属对宿主植物产生毒性[25]。为了探索DSE影响富集植物积累重金属镉的作用机制,任晋彤等[26]通过土壤培养和盆栽实验,证明接种DSE使土壤重金属Cd由活性较强形态向稳态转化,与富集植物形成联合修复体系,修复污染土壤。DSE自身具有抵抗重金属胁迫的能力,菌丝和分泌物能够螯合土壤中的重金属,降低植物体内重金属的含量,对植物起到保護作用[27]。当植物受到胁迫时,会产生大量活性氧,损害植物细胞结构,为了应对胁迫,植物体会产生抗氧化酶,消除细胞中的活性氧,以此来降低所受到的伤害[28-29]。有研究表明,番茄幼苗接种DSE后,过氧化物酶和超氧化物歧化酶含量明显增加[29]。在本研究中,重金属Cd胁迫下不接菌组1年生苗抗氧化酶活性先升高、后降低,说明当苗木初始受到低浓度Cd胁迫时,生理代谢过程受到抑制,当胁迫程度加强时,苗木通过提高抗氧化酶含量抵抗重金属的胁迫,接菌组与不接菌组变化趋势相同,但是无论在高浓度胁迫还是低浓度胁迫条件下,接菌组苗木抗氧化酶活性持续高于不接菌组。随着Cd胁迫程度的加强,接菌组和不接菌组苗木渗透调节物质含量持续升高,说明Cd胁迫时苗木所受毒害作用增强,比较同一浓度下接菌组和不接菌组苗木渗透调节物质含量,发现接种DSE能显著降低植物体内苗木渗透调节物质的积累。
土壤养分含量是影响植物生长发育的关键因素,DSE可通过提高土壤肥力,为植物生长提供更多所需营养元素,从而增强其在胁迫环境中的生存能力。本研究也证明了这一点,在重金属胁迫条件下,接种DSE显著提高了土壤中有机质、TN、AN、TP、AP、TK、AK的含量,同时提高土壤酶活性,说明接种DSE能在一定程度上提高土壤肥力。
【参考文献】
[1]HU H J, HAN L, LI L Z, et al. Soil heavy metal pollution source analysis based on the land use type in Fengdong District of Xi'an, China[J]. Environmental Monitoring and Assessment, 2021, 193(10): 1-14.
[2]环境保护部, 国土资源部. 全国土壤污染状况调查公报(2014年4月17日)[J]. 环境教育, 2014(6): 8-10.
Ministry of Ecology and Environment of the People's Republic of China, Ministry of Land and Resources of the People's Republic of China. Bulletin of the national survey on soil pollution (April 17, 2014)[J]. Environmental Education, 2014(6): 8-10.
[3]陈能场, 郑煜基, 何晓峰, 等. 《全国土壤污染状况调查公报》探析[J]. 农业环境科学学报, 2017, 36(9): 1689-1692.
CHEN N C, ZHENG Y J, HE X F, et al. Analysis of the Report on the national general survey of soil contamination[J]. Journal of Agro-Environment Science, 2017, 36(9): 1689-1692.
[4]郭振, 汪怡珂. 镉在环境中的分布、迁移及转化研究进展[J]. 环境保护前沿, 2019(3): 365-370.
GUO Z, WANG Y. Research advances on the distribution, migration and transformation of cadmium in the environment[J]. Advances in Environmental Protection, 2019(3): 365-370.
[5]SKORZYNSKA-POLIT E, DRAZKIEWICZ M, KRUPA Z. Lipid peroxidation and antioxidative response in Arabidopsis thaliana exposed to cadmium and copper[J]. Acta Physiologiae Plantarum, 2010, 32(1): 169-175.
[6]TERHONEN E, SIPARI N, ASIEGBU F O. Inhibition of phytopathogens by fungal root endophytes of Norway spruce[J]. Biological Control, 2016, 99: 53-63.
[7]GRUNIG C R, QUELOZ V, SIEBER T N, et al. Dark septate endophytes (DSE) of the Phialocephala fortinii s.l.-Acephala applanata species complex in tree roots: classification, population biology, and ecology[J]. Botany, 2008, 86(12): 1355-1369.
[8]YUAN Z L, DRUZHININA I S, GIBBONS J G, et al. Divergence of a genomic island leads to the evolution of melanization in a halophyte root fungus[J]. The ISME Journal, 2021, 15(12): 3468-3479.
[9]YAN L, ZHU J, ZHAO X X, et al. Beneficial effects of endophytic fungi colonization on plants[J]. Applied Microbiology and Biotechnology, 2019, 103(8): 3327-3340.
[10]HE C, WANG W Q, HOU J L. Characterization of dark septate endophytic fungi and improve the performance of liquorice under organic residue treatment[J]. Frontiers in Microbiology, 2019, 10: 1364.
[11]MONICA I F D, SAPARRAT M C N, GODEAS A M, et al. The co-existence between DSE and AMF symbionts affects plant P pools through P mineralization and solubilization processes[J]. Fungal Ecology, 2015, 17: 10-17.
[12]SURONO, NARISAWA K. The dark septate endophytic fungus Phialocephala fortinii is a potential decomposer of soil organic compounds and a promoter of Asparagus officinalis growth[J]. Fungal Ecology, 2017, 28: 1-10.
[13]DE MESQUITA C P B, DEL RIO C M M, SUDING K N, et al. Rapid temporal changes in root colonization by arbuscular mycorrhizal fungi and fine root endophytes, not dark septate endophytes, track plant activity and environment in an alpine ecosystem[J]. Mycorrhiza, 2018, 28(8): 717-726.
[14]OUSMANE D, NOBUO S, KAZUHIKO N. The role of dark septate endophytic fungal isolates in the accumulation of cesium by Chinese cabbage and tomato plants under contaminated environments[J]. PLoS One, 2014, 9(10): e109233.
[15]BERTHELOT C, BLAUDEZ D, LEYVAL C. Differential growth promotion of poplar and birch inoculated with three dark septate endophytes in two trace element-contaminated soils[J]. International Journal of Phytoremediation, 2017, 19(12): 1118-1125.
[16] BERTHELOT C, LEYVAL C, FOULON J, et al. Plant growth promotion, metabolite production and metal tolerance of dark septate endophytes isolated from metal-polluted poplar phytomanagement sites[J]. FEMS Microbiology Ecology, 2016, 92(10): 144.
[17]刘加强, 左易灵, 贺学礼, 等. 镉胁迫下深色有隔内生真菌对玉米生长和根际土壤养分的影响[J]. 菌物研究, 2021, 19(3): 153-162.
LIU J Q, ZUO Y L, HE X L, et al. Effects of dark septate endophytic fungi on maize growth and soil nutrient under cadmium stress[J]. Journal of Fungal Research, 2021, 19(3): 153-162.
[18]滕秋梅, 张中峰, 徐广平, 等. 深色有隔内生真菌对镉胁迫下芦竹生长、光合和矿质营养的影响[J]. 生态学杂志, 2021, 40(6): 1723-1733.
TENG Q M, ZHANG Z F, XU G P, et al. Effects of dark septate endophyte on the growth, photosynthesis and mineral nutrition of Arundo donax under cadmium stress[J]. Chinese Journal of Ecology, 2021, 40(6): 1723-1733.
[19]尹大川, 邓勋, 宋小双, 等. Cd胁迫下外生菌根菌对樟子松生理指标和根际土壤酶的影响[J]. 生态学杂志, 2017, 36(11): 3072-3078.
YIN D C, DENG X, SONG X S, et al. Effects of ectomycorrhizal fungi on physiological indexes of Pinus sylvestris var. mongolica seedlings and soil enzyme activities under cadmium stress[J]. Chinese Journal of Ecology, 2017, 36(11): 3072-3078.
[20]沈甜, 王琼瑶, 崔永亮, 等. 植物根际促生细菌对蒲儿根富集铜及土壤理化性质的影响[J]. 农业环境科学学报, 2020, 39(3): 572-580.
SHEN T, WANG Q Y, CUI Y L, et al. Effects of plant growth-promoting rhizobacteria on the copper enrichment ability of Sinosenecio oldhamianus and physicochemical properties of soil[J]. Journal of Agro-Environment Science, 2020, 39(3): 572-580.
[21]MISHRA V, GUPTA A, KAUR P, et al. Synergistic effects of Arbuscular mycorrhizal fungi and plant growth promoting rhizobacteria in bioremediation of iron contaminated soils[J]. International Journal of Phytoremediation, 2016, 18(7): 697-703.
[22]熊智慧, 朱莹莹, 周清, 等. 产碱菌Alcaligenes sp. qz-1对铬污染土壤中玉米生长和铬累积的影响研究[J]. 生态科学, 2018, 37(4): 52-58.
XIONG Z H, ZHU Y Y, ZHOU Q, et al. Effects of chromium (Ⅵ) tolerant bacteria Alcaligenes sp. qz-1 on growth and uptake of chromium (Ⅵ) in maize Zea mays L[J]. Ecological Science, 2018, 37(4): 52-58.
[23]王媛媛,劉百超,姜波,等.Th2CysPrx基因提高酿酒酵母多种胁迫耐受性研究[J].南京林业大学学报(自然科学版),2022,46(4):87-94.
WANG Y Y, LIU B C, JIANG B, et al.Th2CysPrx gene enhanced abiotic stress tolerances of Saccharomyces cerevisiae[J].Journal of Nanjing Forestry University (Natural Science Edition), 2022, 46(4): 87-94.
[24]BERTHELOT C, PERRIN Y, LEYVAL C. Melanization and ageing are not drawbacks for successful agro-transformation of dark septate endophytes[J]. Fungal Biology, 2017, 121(8): 652-663.
[25]ZHU L L, LI T, WANG C J, et al. The effects of dark septate endophyte (DSE) inoculation on tomato seedlings under Zn and Cd stress[J]. Environmental Science and Pollution Research, 2018, 25(35): 35232-35241.
[26]任晉彤, 赵金莉. 深色有隔内生真菌对土壤镉赋存形态和龙葵富集镉的影响[J]. 河北农业大学学报, 2020, 43(1): 55-61.
REN J T, ZHAO J L. Effects of dark septate endophytes on cadmium transformation in soil and accumulation by Solanum nigrum[J]. Journal of Hebei Agricultural University, 2020, 43(1): 55-61.
[27]BERTHELOT C, BLAUDEZ D, LEYVAL C. Differential growth promotion of poplar and birch inoculated with three dark septate endophytes in two trace element-contaminated soils[J]. International Journal of Phytoremediation, 2017, 19(12): 1118-1125.
[28]刘亚勤. 四种外生菌根真菌对油松耐铅性的影响[D]. 杨凌: 西北农林科技大学, 2020.
LIU Y Q. Effects of four ectomycorrhizal fungi on lead resistance of Pinus tabulaeformis[D]. Yangling: Northwest A & F University, 2020.
[29]谢德志, 魏子璐, 朱峻熠, 等. 水禾对镉胁迫的生理响应[J]. 浙江农林大学学报, 2020, 37(4): 683-692.
XIE D Z, WEI Z L, ZHU J Y, et al. Physiological responses of Hygroryza aristata to cadmium stress[J]. Journal of Zhejiang A & F University, 2020, 37(4): 683-692.
[30]ZHAN F D, HE Y M, LI T, et al. Tolerance and antioxidant response of a dark septate endophyte (DSE), Exophiala pisciphila, to cadmium stress[J]. Bulletin of Environmental Contamination and Toxicology, 2015, 94(1): 96-102.
