自花授粉花柱提取物对澳洲坚果品种间杂交亲和性的影响
2023-06-12孔广红余文才柳觐
孔广红 余文才 柳觐
摘要:【目的】明确澳洲坚果品种间杂交的亲和性,为快速鉴定品种间杂交亲和程度和授粉品种配置提供理论依据和实践支撑。【方法】以澳洲坚果13 个品种为母本试材,10 个品种为父本试材,设置115 个杂交组合,利用母本自交花柱提取液培养基培养父本花粉,测定杂交组合的花粉萌发率及花粉管生长情况,结合花粉萌发受影响程度指数(pollengermination,PG)与花粉管生长受影响程度指数(pollen tube growth,PTG),判定品种间杂交亲和性程度。【结果】明确了115 个杂交组合的亲和性程度,筛选出54 个强杂交亲和性组合,其中有9 对杂交组合可互为亲本;另外筛选出28个中等杂交亲和性组合和33 个弱杂交亲和性组合。品种HAES863、O.C、HAES820 可以作为杂交育种父本材料,在果园构建中可以作为13 个参试母本的授粉树;品种HAES863、D4、HAES951、HAES816、HAES842 为极好的杂交育种母本材料。【结论】建立了澳洲坚果品种间杂交亲和性室内鉴定标准,将杂交亲和性划分为强(PG值≤0.5,PTG值≤0.2)、中(0.5<PG值≤0.7;0.2<PTG值≤0.4)和弱(0.7<PG值<1;0.4<PTG值<1)3 种类型,用于澳洲坚果杂交亲和性的快速鉴定,为澳洲坚果种植园品种配置提供参考。
关键词:澳洲坚果;花柱提取液;花粉萌发率;花粉管长度;花粉萌发受影响程度指数;花粉管生长受影响程度指数
中图分类号:S664.9 文献标志码:A 文章编号:1009-9980(2023)04-0615-15
杂交亲和性是果树杂交育种中合理选配亲本的关键科学问题。澳洲坚果具有部分自交不亲和性(partially self-incompatibility, PSD)及花粉直感效应(xenia effect)r研究其品种间杂交亲和性对高产优质杂种选育至关重要,能为澳洲坚果产业健康揭续发展提供实践保障。澳洲坚果(Macadamia spp.)是大量开花树种,分品种每株树年产为20-40 万朵小花“”,但最终坐果率非常低。部分自交不亲和性”"和花粉直感效应”“是导致最终坐果率低的重要因素。研究表明,人工补充授粉能够显著提高澳洲坚果产量和品质*"。目前,相关研究普追采用田间授粉试验鉴定同一物种不同品种间的杂交亲和性"·i。通过采用此方法,国内外学者获得了澳洲坚果部分主裁品种的授粉树"-。澳洲坚果品种繁多品种间杂交亲和性机制研究较为缺乏,而且大田利植中品种搭配混乱。通过田间授粉研究品种间杂交亲和性需要耗费大量人力物力,而且受限于果树“大小年”及环境因素,短期内难以获得准确数据陈腾土等网、张绍铃等m、齐国辉、丁一鸣等闻、覃屏生等的分别在沙田柚、梨、鸭梨、玫瑰等作物中利用花柱提取液培养基(母本)培养离体花粉(父本)的方法开展了室内杂交亲和性的鉴定研究,主要研究原理是如果花柱提取液培养基(母本)与离体花粉(父本)杂交亲和,花粉萌发及花粉管生长得到促进反之则被抑制。目前,国内外未阅通过澳洲坚果花柱提取液培养离体花粉研究品种间杂交亲和性的报道。因此,笔者在本研究中采用此方法开展澳洲坚果品种间杂交亲和性评价,为快速鉴定品种间杂交亲和性和选择杂交育种亲本材料提供技术支持。本研究以澳洲坚果的 13个品种为供试材料,通过统计分析花粉萌发率及花粉管生长情况,研究花粉前发及花粉管生长在不同品种培养基条件下的受影响租度,并根据花粉萌发率的高低和花粉管生长速率的快慢鉴定品种间的杂交亲和性筛选出亲和性较强的杂交组合。本研究结果将为澳洲坚果杂交亲和性机制研究奠定科学基础,并为澳洲坚果种植园品种配置推荐授粉品种提供实践支撑。
1 材料和方法
1.1 材料
供试材料见表 1.选择来源于云南省热带作物科学研究所澳洲坚果新品种比较试验基地中同一年种植、管理一致、长势比较一致且无病虫害的植株。供试品种背景信息参考贺熙勇”的研究1.2 法
1.2.1 花柱采集自交花柱采集方法:于花序开放前 1 d.将母本花序套上特制的滤膜级网袋(网袋孔径为25 m,透光、透气、透水、隔离传粉者及其他花序花粉:花粉粒直径为34-40 um)。花序开放2 d后的早晨8:00一10:00取下膜袋,采集花柱,此时花尊雄蕊已经凋落,带裸花柱的子房在花序上继续保持,柱头上没有花粉堆积,采集的花柱长度为雌蕊总长度的2/3,不带子房;迅速放入2.5 mL EP 管中,立即进行液氮速冻,带回实验室保存于-80 ℃冰箱,备用。
1.2.2 花柱提取液制备 称取保存于-80 ℃超低温冰箱的花柱0.5 g,用液氮研磨至粉末放入10 mL EP管中,加入4.5 mL 预冷超纯水,震荡混匀3 min,2500 r ·min-1,离心10 min,取出冰上静置30 min,上清液即为花柱提取液,收集混匀分装,于-20 ℃冰箱保存备用。
1.2.3 培养基制备 试验采用液体培养法培养离体花粉,标准(对照,CK)培养基参照王文莉[28]的方法,略有改动,超纯水中加入10%(w,后同)蔗糖、0.01%硼酸即为标准培养基;花柱培养基参照丁一鸣等[25]的方法,略有改动,使用1.2.2 中各品种的花柱提取液与标准培养基按体积比1∶5 的比例混合,即为花柱提取液培养基。现配现用。
1.2.4 花粉采集 于各父本品种盛花期采集开放前1 d 的花序,采集时间为晴朗上午10:00—11:00,带回实验室,将小花蕾剥去花萼,取出花药,使花粉散出于硫酸纸上。开放前1 d 的花粉已经成熟,而且环境条件对花粉活力影响显著[29-30],所以需要当天采集当天检测。根据不同品种的盛花期分批次培养,每次培养均使用对照进行调节。
1.2.5 花粉培养 用移液枪将花柱提取液培养基和标准培养基分别滴至干净的单凹载玻片上,用量为100 μL,标记;用小排刷蘸取备好的花粉,镊子轻轻敲击均匀点播花粉至不同培养基表面(不能攪拌);将载玻片放入覆盖有3 层湿滤纸的培养皿中,盖上盖子,培养皿无需封口;置于25 ℃、黑暗条件的光照培养箱中,培养3 h,每处理3 次重复。
1.2.6 镜检 镜检时用移液枪吸出单凹载玻片中的部分液体培养基,使液面处于同一平面,在莱卡DM6B显微镜100×下进行观测、拍照。每重复观察3 个视野以上,总计不少于300 粒花粉;用显微镜自带的显微尺测量花粉管长度,每重复不少于10 根花粉管。
1.2.7 花粉管长度、花粉萌发率、花粉萌发受影响程度指数、花粉管生长受影响程度指数的测定 以花粉管长度(pollen tube length, PTL)大于花粉粒直径作为花粉萌发的标准统计花粉萌发率(pollen germinationrate,PGR),花粉萌发受影响程度指数(indexof influence degree ofmacadamia pollen germination)用PG 值表示,花粉管生长受影响程度指数(indexof influence degree ofmacadamia pollen tube growth)用PTG值表示。按照下列公式分别计算各个指标:PGR(%)= 萌发花粉粒数总花粉粒数×100;PG=(对照花粉萌发率-处理花粉萌发率)/对照花粉萌发率;PTG=(对照花粉管平均长度-处理花粉管平均长度)/对照花粉管平均长度。1.2.8 统计分析采用Microsoft Excel 2010 进行数据处理及统计;采用SPSS 12.0 检验进行显著性分析;采用Origin2023 绘图。
2 结果与分析
2.1 澳洲坚果不同品种自交花柱提取液对品种HY离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种HY花粉萌发的影响结果见图1-A。对照的花粉萌发率最高(26.10%),各品种花柱提取液培养基不同程度地抑制HY花粉萌发,与对照相比存在显著性差异,且花粉萌发受影响程度指数PG值均较大。花粉管生长情况见图1-B。对照的花粉管平均长度最长,其次是HAES816,它们之间无显著性差异;其他培养基条件下,花粉管生长受到不同程度的抑制作用,与对照相比存在显著性差异。结果表明,HY与12 个参试母本之间杂交亲和性弱,因此不建議利用这些品种进行田间试验选配杂交组合。
2.2 澳洲坚果不同品种自交花柱提取液对品种
A16 离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种A16 花粉萌发的影响结果见图2-A。对照的花粉萌发率最高(38.25%),各品种花柱提取液对A16 花粉萌发产生不同程度的抑制作用。培养基D、HAES951、HAES863、A4、O.C 的抑制程度比较低,花粉萌发受影响程度指数PG值较小,说明它们与品种A16 的杂交亲和性较好;而HAES695、HAES246 培养基对品种A16 花粉萌发具有强抑制作用,花粉萌发受影响程度指数PG 值分别达0.78 和0.81。花粉管生长情况见图2-B。在HAES863 培养基条件下,花粉管平均长度最长(89.45 μm),显著高于对照;其他品种培养基不同程度地抑制花粉管生长,其中在HAES951、O.C、D4、A4、D、HAES820 培养基条件下花粉管平均长度与对照相比无显著性差异。在HAES816、HY、HAES695、HAES246、HAES842 培养基条件下花粉管平均长度显著低于对照,说明它们对品种A16 花粉管生长具有强抑制作用。不同培养基条件下,通过对花粉萌发率及花粉管生长情况对比研究发现,A16 花粉与品种D、HAES951、HAES863、A4、O.C 之间杂交亲和性高,可利用这些品种搭配杂交组合,进行田间杂交试验验证。
2.3 澳洲坚果不同品种自交花柱提取液对品种A4离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种A4 花粉萌发的影响结果见图3-A。D培养基的花粉萌发率最高(17.67%),其次为对照和HAES695 培养基,它们处于同一影响水平,无显著性差异;HAES695、D4、HAES951、A16、HAES246 处于同一影响水平,萌发率无显著性差异;HAES863 培养基的花粉萌发率最低,仅为3.56%,花粉萌发受影响程度指数PG 值达到0.79,说明HAES863 培养基对A4 花粉萌发具有强抑制作用;O.C、HAES820、HAES842、HAES816与HAES863 处于同一水平,它们之间相比无显著性差异。花粉管生长情况见图3- B。HAES863、HAES816、HAES842、HAES695 和D5 种培养基促进A4 花粉管生长,长度均大于CK,但无显著性差异,说明5 种培养基与对照处于同一影响水平。花粉管生长受影响程度指数PTG 值小于0,直接判定组合具强杂交亲和性。其他6 种培养基与对照相比表现为抑制作用,但抑制程度无显著性差异,说明6种培养基对花粉管的影响程度与对照也处于同一影响水平。根据A4 花粉在不同培养基条件下的PG值和PTG 值判定组合的杂交亲和性,结果表明A4品种可作为11 个参试母本的授粉树,但是品种A4开花晚,花期短,存在花期不遇问题,杂交育种中可作为父本使用,在生产中则需谨慎使用。
2.4 澳洲坚果不同品种自交花柱提取液对品种
HAES695 离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种HAES695 花粉萌发的影响结果见图4-A。HY培养基的花粉萌发率最高(52.13%),显著高于对照2 倍多,说明HY培养基促进HAES695 花粉萌发,该组合具强杂交亲和性;其他培养基的花粉萌发率高低排序依次为CK>HAES816>O.C>D4>A16>HAES820>HAES842>A4>HAES951>HAES246>D>HAES863,其中CK、HAES816、O.C、D4 对花粉萌发影响处于同一水平,花粉萌发受影响程度指数PG 值较小;HAES246、D、HAES863 处于同一水平,PG 值较大。花粉管生长情况见图4-B。在HY培养基条件下花粉管最长,平均长度达82.61 μm,比对照生长快,无显著性差异;在其他培养基条件下的花粉管平均长度与对照相比,均受到不同程度的抑制作用,花粉管生长受影响程度指数PTG 值表明,在O.C、D4 培养基条件下的花粉管生长受影响程度较低,但HAES863 培养基条件下的花粉管受影响程度最高,而且A16、HAES246、A4、HAES951、HAES820、HAES842 与HAES863 处于同一影响水平。综合分析花粉萌发率及花粉管生长情况,发现品种HAES695 与HY具有强杂交亲和性,与O.C 和D4 之间杂交亲和性中等,可进行田间杂交验证筛选;而品种HAES695 与HAES863 具有杂交不亲和性。
2.5 澳洲坚果不同品种自交花柱提取液对品种HAES816 离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种HAES816 花粉萌发的影响结果见图5-A。对照花粉萌发率最高(31.57%),显著高于其他培养基。在D4、O.C、HAES951、D培养基条件下,花粉萌发率处于同一影响水平;在HAES246、HAES820、A16、HAES842、HAES863、HY、A4、HAES695 培养基条件下,花粉萌发率处于同一水平。花粉管生长情况见图5-B。对照花粉管最长,其他培养基对品种HAES816 花粉管产生不同程度的抑制作用。在CK、HAES863、HAES951、D4 培养基条件下,它们之间的花粉管平均长度无显著性差异;而HAES863、HAES951、D4、O.C、HAES842、HAES820 处于同一水平,它们之间无显著性差异,花粉管生长受影响程度指数PTG值较小;在HAES695 和A4 培养基条件下,PTG值分别为0.31和0.34,说明这2个品种的培养基对HAES816花粉管生长具有较强的抑制作用。综合分析花粉萌发率与花粉管生长情况,发现品种HAES816 与母本D4、O.C、HAES951 之间具有强杂交亲和性,可进行田间杂交试验筛选;与母本A4、HAES695 杂交亲和显著性差异:在其他培养基条件下的花粉管平均长度与对照相比,均受到不同程度的抑制作用。花粉管生长受影响租度指数PTG值表明,在O.C、D4培养基条件下的花粉管生长受影响程度较低,但HAES863 培养基条件下的花粉管受影响程度最高而 且 A16、HAES246、A4、HAES951、HAES820.HAES842与HAES863 处于同一影响水平。综合分析花粉萌发率及花粉管生长情况,发现品种HAES695与HY具有强杂交亲和性,与0.C和D4之间杂交亲和性中等,可进行田间杂交验证筛选:而品种HAES695与HAES863 具有杂交不亲和性。2.5 澳洲坚果不同品种自交花柱提取液对品种HAES816离体花粉萌发及花粉管生长的影响不同品种自交花柱提取液对品种 HAES816 花粉萌發的影响结果见图5-A。对照花粉萌发率最高(31.57%),显著高于其他培养基。在 D4、0.C、HAES951、D培养基条件下,花粉萌发率处于同一影响水平:在 HAES246、HAES820、A16、HAES842.HAES863、HY、A4,HAES695培养基条件下,花粉萌发率处于同一水平。花粉管生长情况见图5-B。对照花粉管最长,其他培养基对品种HAES816 花粉管产生不同程度的抑制作用。在 CK、HAES863.HAES951、D4 培养基条件下,它们之间的花粉管平均长重无显著性差异:而 HAES863、HAES951、D4.0.C、HAES842、HAES820 处于同一水平,它们之间无显著性差异,花粉管生长受影响程度指数PTG值较小:在HAES695和A4培养基条件下,PTG值分别为0.31和0.34,说明这2个品种的培养基对HAES816花粉管生长具有较强的抑制作用。综合分析花粉萌发率与花粉管生长情况,发现品种HAES816与母本D4、O.C、HAES951之间具有强杂交亲和性,可进行田间杂交试验筛选;与母本A4,HAES695杂交亲和性较弱;与其他品种的杂交亲和性中等。
2.6 澳洲坚果不同品种自交花柱提取液对品种HAES863 离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种HAES863 花粉萌发的影响结果见图6-A。HAES842、HAES951、HAES820培养基促进HAES863花粉萌发,效果好于对照,花粉萌发受影响程度指数PG值≤ 0,无显著性差异;其他培养基则抑制花粉萌发,但抑制作用均不明显,除了HY。花粉管生长结果见图6- B。
HAES816、HAES951、HAES842、D4、HAES820 培养基促进HAES863 花粉管生长,花粉管平均长度显著高于对照,花粉管生长受影响程度指数PTG值<0;其他培养基不同程度抑制花粉管生长,但PTG值较小,表明10 种培养基对花粉管生长的抑制作用不强。综合分析花粉萌发率及花粉管生长结果,以及HAES863 品种开花早、花期长、花量大、花粉多的特性,品种HAES863 可作为10个参试品种的父本。
2.7 澳洲坚果不同品种自交花柱提取液对品种HAES820 离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种HAES820 花粉萌发的影响结果见图7-A。在HAES816 培养基条件下,促进花粉萌发,萌发率高于对照,花粉萌发受影响程度指数PG值<0;其他培养基不同程度地抑制HAES820 花粉萌发,其中HY、HAES246 抑制作用最强,PG 值较大。花粉管生长结果见图7-B。与对照相比,有11个花柱提取液培养基促进花粉管生长,花粉管生长受影响程度指数PTG 值<0,只有HY抑制花粉管生长,但PTG值较小,表明抑制作用不强。综合分析花粉萌发及花粉管生长结果,表明11 个组合杂交亲和性强,1 个组合杂交亲和性中等。HAES820 品种具有开花早、花期长、花量大、花粉多的特性,可以将其作为12 个参试品种的父本。
2.8 澳洲坚果不同品种自交花柱提取液对品种HAES951 离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种HAES951花粉萌发的影响结果见图8-A。HAES816、A4 培养基促进品种HAES951 花粉萌发,其他品种不同程度地抑制花粉萌发,其中HAES863、D4、HAES820、HAES246、HAES842、HY 的花粉萌发受影响程度指数PG 值较小,说明抑制作用较低,与对照相比,无显著性差异;O.C 培养基的花粉萌发率小,PG 值较大,说明抑制作用较强。花粉管生长情况见图8-B。与对照相比,所有参试品种的花柱提取液培养基均不同程度地抑制HAES951 花粉管生长,其中HAES863、HAES816、D4、HAES842 培养基的花粉管生长受影响程度指数PTG 值较小;在A16、A4、D、O.C 培养基条件下PTG 值>0.3,说明这些培养基对HAES951 花粉管生长具有较强的抑制作用。综合分析PG值和PTG值,HAES951 花粉与品种HAES816、HAES863、D4、HAES842 之间杂交亲和性强,与品种HY、HAES695、HAES820、HAES246 之间杂交亲和性中等,与品种A16、A4、D、O.C之间杂交亲和性弱。
2.9 澳洲坚果不同品种自交花柱提取液对品种D离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种D花粉萌发的影响结果见图9- A。对照花粉萌发率最高(37.11%),与对照相比,其他培养基不同程度地抑制花粉萌发,其中O.C、HAES695、HAES842、D4、HAES816 萌发率较低,花粉萌发受影响程度指数PG值较大,说明它们对D花粉萌发抑制作用较强。花粉管生长结果见图9-B。对照花粉管平均长度最长,达146.84 μm,与对照相比,其他培养基不同程度地抑制花粉管生长,其中O.C、HAES695、HAES842、A16 培养基对D花粉管生长抑制作用最强,花粉管生长受影响程度指数PTG>0.3;尤其在HAES695培养基条件下,PTG 值高达0.62,说明D 花粉与HAES695 之间可能存在杂交不亲和性。综合分析花粉萌发率和花粉管生长情况,发现品种D与参试品种HAES863、HAES820 之间杂交亲和性强;与品种HAES816、HAES951、HAES246 之间杂交亲和性中等;与剩余品种杂交亲和性弱。D花粉在参试的所有父本中花粉萌发率最高,花粉管生长最快,是研究澳洲坚果花粉管生长的良好材料。
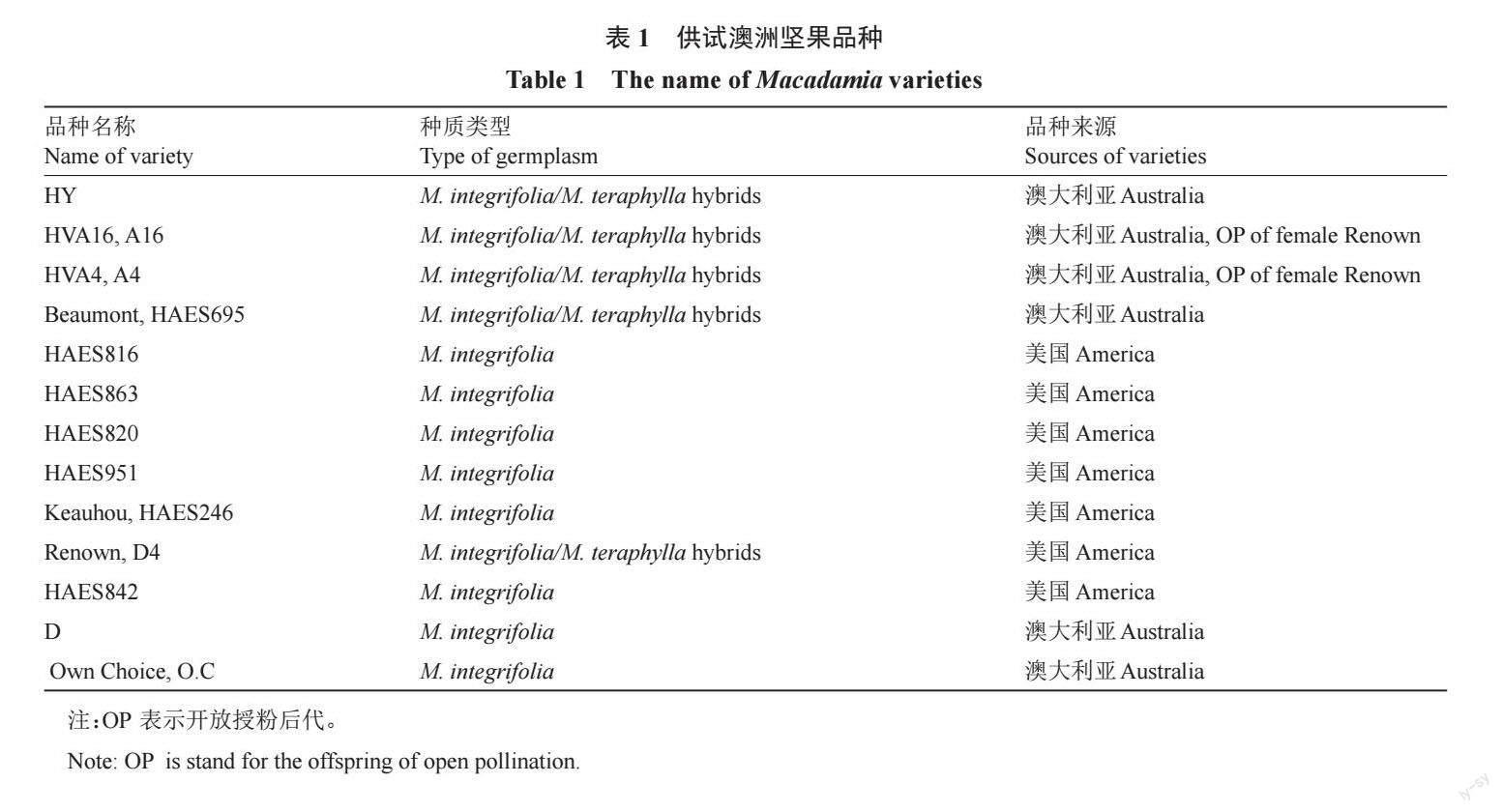
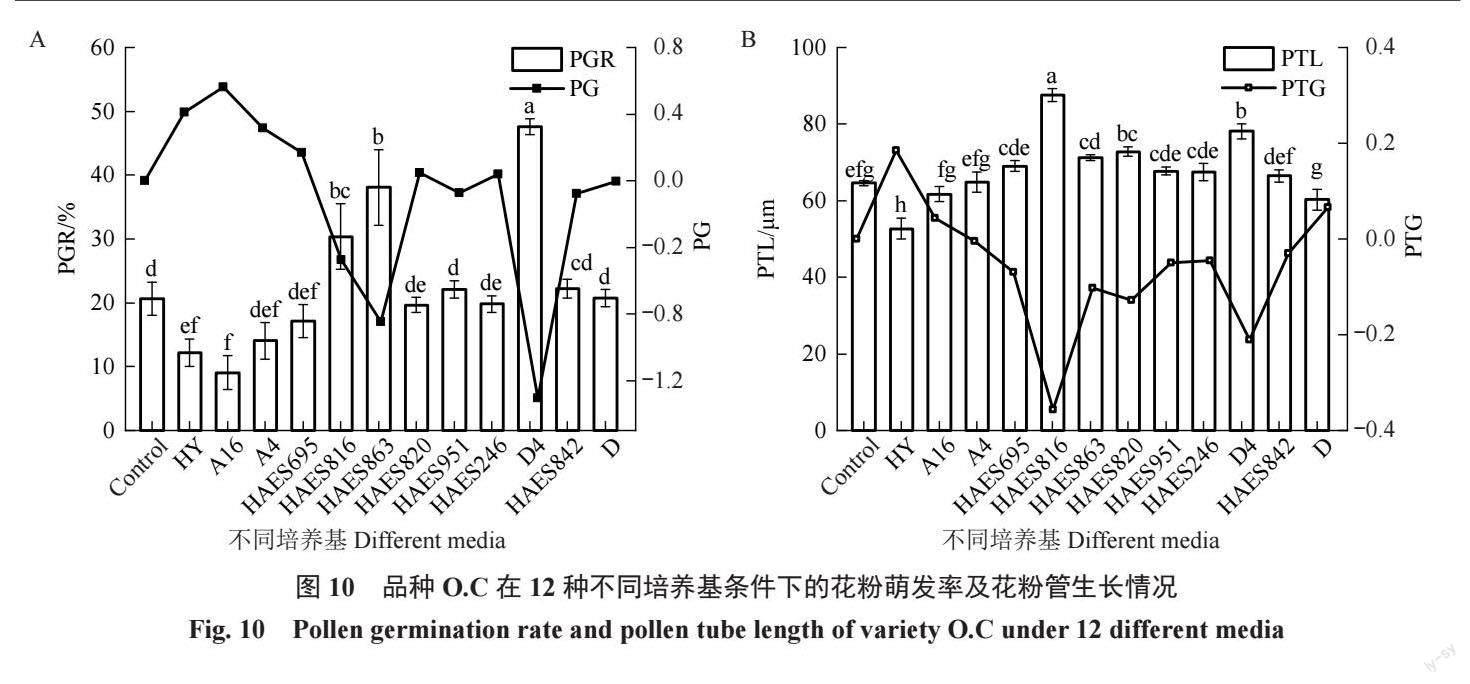
2.10 澳洲坚果不同品种自交花柱提取液对品种O.C离体花粉萌发及花粉管生长的影响
不同品种自交花柱提取液对品种O.C花粉萌发的影响结果见图10-A。与对照相比,D4、HAES863、HAES816、HAES842、HAES951、D培养基促进花粉萌发,萌发率高于对照,PG值<0;在其他培养基条件下,对花粉萌发呈现不同程度抑制作用,但只有HY、A16 显著低于对照,其他培养基与对照相比不存在显著性差异。花粉管生长情况见图10-B。与对照相比,A16、D、HY培养基中花粉管长度低于对照,其他培养基花粉管长度显著高于对照或者与对照处于同一水平。综合分析O.C 花粉的花粉萌发及花粉管生长结果,表明品种O.C 花粉在参试自交花柱培养基条件下,花粉萌发率高,花粉管生长快速,适合与所有参试父本进行杂交组合选配,特别是与HAES816、HAES863、D4 之间存在极强的杂交亲和性。
2.11 澳洲坚果品种间杂交亲和性评价标准
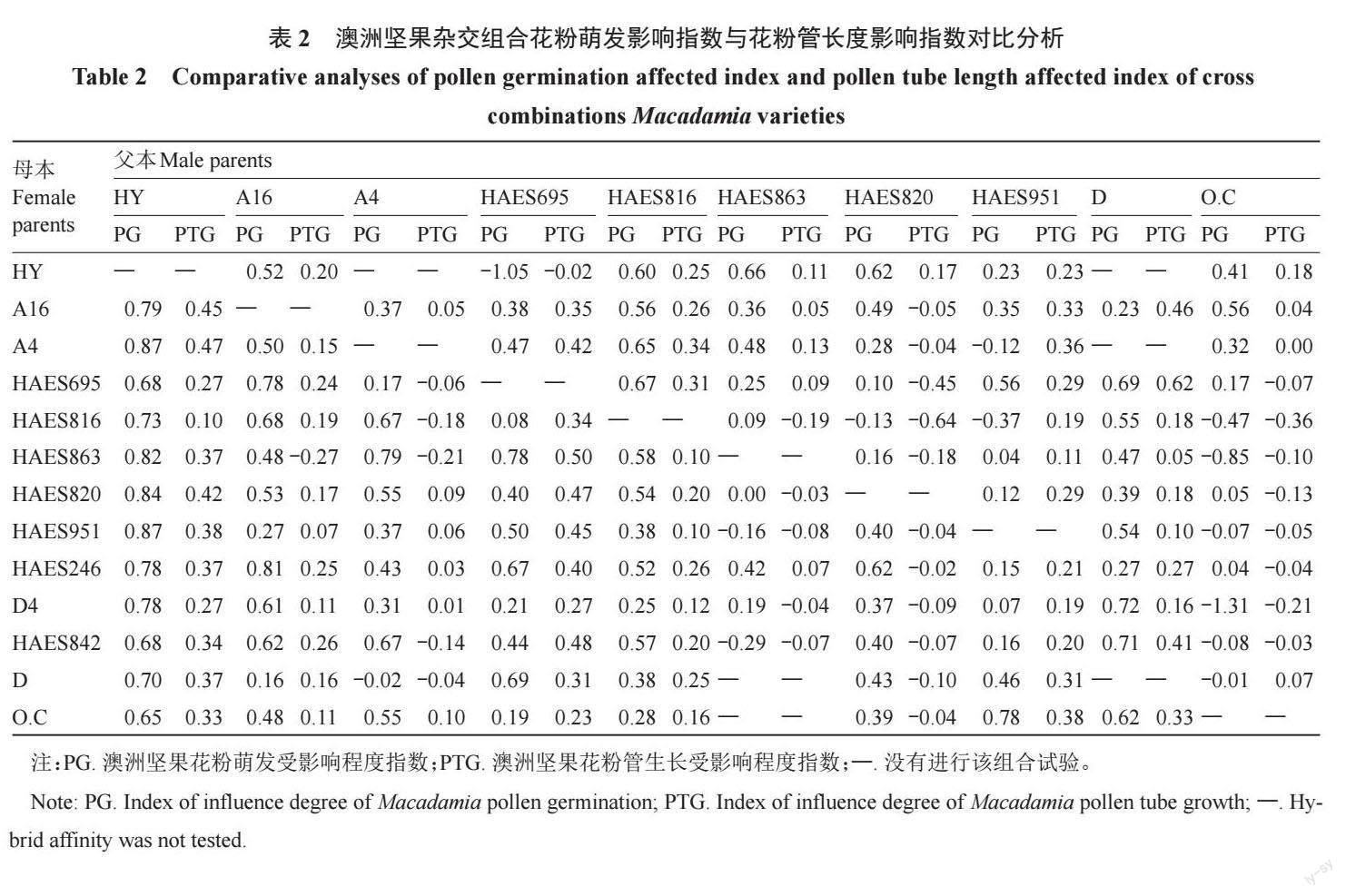
本研究中澳洲坚果杂交组合花粉萌发受影响程度指数PG值与花粉管生长受影响程度指数PTG值见表2。115 个杂交组合中PG 值的区间为-1.31~0.87,PTG 值的区间为-0.64~0.62。PG 值和PTG 值越大,表明品种间杂交亲和性越弱;PG值和PTG值越小,表明品种间杂交亲和性越强。澳洲坚果属于配子体自交不亲和类型,柱头抑制花粉萌发的作用较弱,所以花粉管生长情况是判定品种间杂交亲和性的重要指标。本研究结果表明,同一品种花粉在不同自交花柱提取液培养基条件下,花粉萌发率高时,花粉管生长速率较快;花粉萌发率低,花粉管长度短,萌发率与花粉管长度呈正相关。因此,将花粉管生长受影响指数PTG 值作为判定品种间杂交亲和性的主要指标,将花粉萌发受影响程度指数PG值作为判定品种间杂交亲和性的辅助指标。首先分析PTG值,当PTG值<0 时,可以不考虑PG值,判定该组合具有强杂交亲和性;当PTG值>0.4 时,也不必考虑PG 值,直接判定该组合的杂交亲和性为弱。综合分析PG 值和PTG 值,能够更加准确地判定澳洲坚果品种间杂交亲和程度。根据115 个杂交组合的花粉萌发率、花粉管长度、花粉管生长受影响程度指数PTG 值及花粉萌发受影响程度指数PG值,经全面比对和综合分析后,将澳洲坚果品种间的杂交亲和性程度划分为强(PG≤0.5;PTG≤0.2)、中(0.5<PG≤0.7;0.2<PTG<0.4)、弱(0.7≤PG<1;0.4 ≤PTG<1)3 种类型(表3)。
2.12 澳洲坚果不同组合的杂交亲和性程度
依据品种间杂交亲和性评价标准,本研究中10个父本、13 个母本间杂交组合选配分析结果见表3。结果表明,115 个杂交组合中有54 个组合杂交亲和性强,其中有9 对杂交组合可互为亲本(表3相同背景颜色标识);另外有28 个组合杂交亲和性中等,33 个组合杂交亲和性较弱。本研究的10 个参试父本中,品种HAES863、O.C、HAES820、A4與大部分参试母本组合具强杂交亲和性,杂交育种中可作为父本使用,果园中可作为授粉树搭配种植;但是品种A4 开花较晚,花期较短,使用时需要考虑花期相遇因素。13 个参试母本中,品种HAES863、D4、HAES951、HAES816、HAES842 与大部分参试父本杂交亲和性强,是极好的杂交育种母本材料。
部分不同澳洲坚果花粉在不同培养基条件下花粉萌发及花粉管生长结果见图11-A~D。图11-A是品种D花粉在标准培养基(对照)条件下的萌发及生长结果,其花粉萌发率高,花粉管生长快,该品种花粉适合作为澳洲坚果花粉管生长的研究材料。图11-B是品种D花粉在HAES695 花柱提取液培养基条件下的萌发及生长结果,与对照图11-A相比,花粉萌发率显著降低,花粉管生长受抑制,HAES695 花柱提取液培养基对D花粉萌发及生长起抑制作用。图11-C、图11-D 分别是品种O.C 花粉在标准培养基(对照)和D4 花柱提取液培养基条件下的萌发及花粉管生长结果。二者对比发现,D4 培养基促进O.C花粉萌发及花粉管生长,花粉萌发率和花粉管长度均显著高于对照。
3 讨论
3.1 不同品种田间杂交亲和性与本研究结果的一致性分析
前期,笔者课题组[20]以品种HAES951为母本进行田间杂交试验,结果表明11个杂交组合中,坐果率高低顺序依次为HAES951 ×D>HAES951 × HAES863>HAES951 × HAES842>HAES951 × HAES816>HAES951 × O.C>HAES951 ×D4>HAES951 ×A4>HAES951×HAES294>HAES951×HAES900>开放授粉>自花授粉。该研究中坐果率高的杂交组合与本研究母本HAES951品种推荐杂交组合一致。陶丽等[19]以7个澳洲坚果品种进行授粉组合选配,发现品种HAES842 可推荐为HAES863、O.C、HAES816 的母本;该研究结论与本研究结论一致。本研究进一步表明HAES842 可推荐为5 个参试父本的母本,是良好的母本材料。贺熙勇等[17]对澳洲坚果品种Kau 的授粉品种选配及结果性状进行研究,发现O.C 和HAES918 适宜做Kau 的授粉树;陶丽等[18]对品种HAES246 授粉源开展的田间授粉研究结果表明,HAES951、O.C 和Pahala 为其授粉品种;本研究中HAES951和O.C这2个品种适合为父本材料,与上述研究结论一致。综上所述,本研究验证了前期澳洲坚果杂交亲和性田间研究结果的准确性,而且克服了环境条件造成的不同年份间的坐果率误差,能够为澳洲坚果品种间杂交亲和性评价提供技术支撑。
3.2 研究自交花柱提取液培养花粉萌发及花粉管生长的意义
只有外界环境条件适宜时,具有活力的成熟花粉才能正常萌发,花粉管才能快速生长。适量蔗糖和酮酸为花粉萌发及花粉管生长提供了最佳条件mm,笔者在本研究中参考前人研究结果..9及前期不同试验条件摸索,确定了促进澳洲坚果花粉萌发及花粉管生长的最佳液体培养基蔗糖和硼酸浓度,以此作为对照,然后在对照培养基中添加等量的不同品种的自交花柱提取液作为处理培养基。同一物种不同品种间花柱提取液的成分和含量存在差异,使用自交花柱提取液可以保证花柱提取液培养基中无其他品种成分,且自交花柱中含有能够抑制自交花粉萌发及花粉管生长的S糖蛋白~.s。所以,笔者采用自交花柱制作提取液,可以减少培养基之间的差异。在果树中,有许多品种存在杂交不亲和现象,而最终坐果率高低是亲和性强弱的直接表现响。采用田间杂交授粉研究杂交亲和性,工作量巨大,同一年内很难完成多品种间杂交,成效低下。本研究在短期内快速准确地完成了10个父本与13 个母本共 115 个配置组合的杂交亲和性初筛,能够极大地提高工作效率,节约大量人力物力。
3.3 研究澳洲坚果杂交亲和性判定标准的意义
澳洲坚果是大量开花树种,总状花序,单花小,花期花量大,开花时间持续 1-3 个月,但最终坐果率极低,极大地限制了澳洲坚果产业健康发展;而且澳洲坚果具有花粉直感效应,父本控制果实品质,为澳洲坚果选配杂交亲和性强的授粉品种不仅可以提高产量,还可以改善果实品质,提高果实营养成分pT。因此,为澳洲坚果园主裁品种配置具有强杂交亲和性的授粉品种在种植业中便显得十分重要。澳洲坚果已经有 160多年的驯化裁培历史,品种繁多,根据不同的气候环境,各地区适宜裁培的主裁品种不尽相同。目前,主裁品种的授粉树仍然按照传统的田间授粉试验进行搭配,需要进行多次田间杂交试验才能得到结果:或者按先前经验配置多个授粉品种,这样又极大地阻碍着果园构建的时效性和科学性。区域性品种或者新引进及自主研发新品种授粉树搭配问题也一直存在。针对以上问题笔者在本研究中探索澳洲坚果自交花柱提取液培养不同品种离体花粉技术,进行澳洲坚果品种间杂交亲和性搭配初步筛选,制定澳洲坚果杂交亲和性判定标准,即花粉萌发受影响租度指数PG 值、花粉管生长受影响程度指数PTG值的评价区间,在今后的试验中,不需要再次进行大规模试验,只需针对目的品种进行验证即可。所以,本研究获得的杂交亲和性判定标准能够为快速鉴定澳洲坚果品种间杂交亲和性程度提供可信性与可靠性参考
4结论
本研究结果明确了澳洲坚果 10个父本与 13 个母本共 115个配置杂交组合的亲和性租度,建立了澳洲坚果品种间杂交亲和性室内鉴定标准,并划分为强(PG值≤0.5,PTG值s0.2),中(0.5 [1] TRUEMAN S J,K?MPER W,NICHOLS J,OGBOURNE S M,HAWKES D,PETERS T,HOSSEINI B S,WALLACE H M.Pollen limitation and xenia effects in a cultivated mass- floweringtree,Macadamia integrifolia (Proteaceae)[J]. Annals of Botany,2021,129(2):135-146. [2] 贺熙勇,陶丽,倪书邦,陈丽兰,张海文,孔广红. 花粉直感对澳洲坚果‘O.C果实形态和品质性状的影响[J]. 经济林研究,2016,34(1):76-82. HE Xiyong,TAO Li,NI Shubang,CHEN Lilan,ZHANG Haiwen,KONG Guanghong. Effects of pollen xenia on nut morphologicalcharacteristics and quality of‘O.Ccultivar inMacadamiaspp.[J]. Nonwood Forest Research,2016,34(1):76-82. [3] STEPHENSON R.Macadamia:Domestication and commercialization[J]. Chronica Horticulture,2005,45(2):11-15. [4] MONCUR M W,STEPHENSON R A,TROCHOULIAS T. Floraldevelopment ofMacadamia integrifolia Maiden & Betcheunder Australian conditions[J]. Scientia Horticulturae,1985,27(1/2):87-96. [5] GRASS I,MEYER S,TAYLOR P,FOORD S,HAJEK P,TSCHARNTKE T. Pollination limitation despite managed honeybeesin South AfricanMacadamia orchards[J]. Agriculture,Ecosystems & Environment,2018,260:11-18. [6] SEDGLEY M. Pollen tube growth in Macadamia[J]. ScientiaHorticulturae,1983,18(4):333-341. [7] SEDGLEY M,BLESING M A,VITHANAGE H I M V. A developmentalstudy of the structure and pollen receptivity of theMacadamia pistil in relation to protandry and self-incompatibility[J]. Botanical Gazette,1985,146(1):6-14. [8] SEDGLEY M,BELL F D,BELL H D,WINKS C W. Self- andcross-compatibility ofMacadamia cultivars[J]. Journal of HorticulturalScience,1990,65(2):205-213. [9] WALLACE H M,VITHANAGE V,EXLEY E M. The effectof supplementary pollination on nut set ofMacadamia (Proteaceae)[J]. Annals of Botany,1996,78(6):765-773. [10] MEYERS N M,HUETT D O,MORRIS S C,MCFADYEN LM,MCCONCHIE C A. Investigation of sampling procedures todetermineMacadamia fruit quality in orchards[J]. AustralianJournal of Experimental Agriculture,1999,39(8):1007. [11] MCFADYEN L M,ROBERTSON D,SEDGLEY M,KRISTIANSENP,OLESEN T. Post-pruning shoot growth increasesfruit abscission and reduces stem carbohydrates and yield inMacadamia[J]. Annals of Botany,2011,107(6):993-1001. [12] 魏雅君,徐業勇,冯贝贝,李雯雯,王明,杨红丽,牛莹莹,廖康.杏李品种授粉亲和性研究[J]. 果树学报,2017,34(2):204-214.WEI Yajuan,XU Yeyong,FENG Beibei,LI Wenwen,WANGMing,YANG Hongli,NIU Yingying,LIAO Kan. A study on thepollination compatibility of different cultivars ofPrunus salicina×Armeniaca with different pollenizers[J]. Journal of FruitScience,2017,34(2):204-214. [13] 彭晓莉,廖康,贾杨,刘欢,马微,徐乐. 9 个新疆杏品种间杂交亲和性研究[J]. 果树学报,2015,32(2):192-199. PENG Xiaoli,LIAO Kan,JIA Yang,LIU Huan,MA Wei,XULe. Study on the cross compatibility among 9 apricot cultivarsin Xinjiang[J]. Journal of Fruit Science,2015,32(2):192-199. [14] HOWLETT B G,NELSON W R,PATTEMORE D E,GEE M.Pollination ofMacadamia:Review and opportunities for improvingyields[J]. Scientia Horticulturae,2015,197:411-419. [15] PISANU P C,GROSS C L,FLOOD L. Reproduction in wildpopulations of the threatened treeMacadamia tetraphylla:Interpopulationpollen enriches fecundity in a declining species[J].Biotropica,2009,41(3):391-398. [16] K?MPER W,TRUEMAN S J,OGBOURNE S M,WALLACEH M. Pollination services in aMacadamia cultivar depend onacross- orchard transport of cross pollen[J]. Journal of AppliedEcology,2021,58(11):2529-2539. [17] 贺熙勇,陶丽,倪书邦,陈丽兰,张海文. 澳洲坚果Kau 的授粉品种选配及结果性状研究[J]. 中国南方果树,2016,45(2):38-42. HE Xiyong,TAO Li,NI Shubang,CHEN Lilan,ZHANG Haiwen.Selection of pollinators and their bearing character forMacadamia Kau[J]. South China Fruits,2016,45(2):38-42. [18] 陶丽,陈丽兰,陶亮,倪书邦,张海文,贺熙勇. 授粉源对澳洲坚果‘Keauhou坐果率和果实性状的影响[J]. 北方园艺,2016(16):9-13. TAO Li,CHEN Lilan,TAO Liang,NI Shubang,ZHANG Haiwen,HE Xiyong. Effect of pollination sources on fruit setting rate andfruit characteristics ofMacadamia cultivars‘Keauhou'[J]. NorthernHorticulture,2016(16):9-13. [19] 陶丽,陈丽兰,杨帆,陶亮,倪书邦,张海文,贺熙勇. 7 个澳洲坚果品种的授粉组合选配与自花结实性研究[J]. 中国南方果树,2018,47(1):55-58. TAO Li,CHEN Lilan,YANG Fan,TAO Liang,NI Shubang,ZHANG Haiwen,HE Xiyong. Study on pollination combinationselection and self- pollination of sevenMacadamia varieties[J].South China Fruits,2018,47(1):55-58. [20] 陈丽兰,陶丽,倪书邦,贺熙勇,肖晓明,孔广红. 澳洲坚果品种‘HAES951为母本的杂交试验[J]. 热带农业科技,2017,40(1):14-16. CHEN Lilan,TAO Li,NI Shubang,HE Xiyong,XIAO Xiaoming,KONG Guanghong. Primary experiments on cross breeding ofMacadamia cultivar‘HAES951[J]. Tropical Agricultural Science& Technology,2017,40(1):14-16. [21] 李柱存. 云南省澳洲坚果产业发展现状及建议[J]. 内蒙古林业调查设计,2020,43(5):65-67. LI Zhucun. Development status and suggestions ofMacadamianut industry in Yunnan province[J]. Inner Mongolia Forestry Investigationand Design,2020,43(5):65-67. [22] 陳腾土,杨小华,薛妙男. 沙田柚花柱蛋白对花粉管生长的影响[J]. 广西植物,1998,18(2):160-164. CHEN Tengtu,YANG Xiaohua,XUE Miaonan. Effects of thestylar proteins on the pollen tube growth of Shatianyou[J]. Guihaia,1998,18(2):160-164. [23] 张绍铃,徐义流,陈迪新,徐国华,赵彩平. 梨内源与外源核糖核酸酶对花粉萌发及花粉管生长的影响[J]. 中国农业科学,2004,37(6):891-895. ZHANG Shaoling,XU Yiliu,CHEN Dixin,XU Guohua,ZHAOCaiping. Effects of stylar RNase and exogenous RNase on pollengermination and tube growth in Japanese pear (Pyrus pyrifoliaNakai)[J]. Scientia Agricultura Sinica,2004,37(6):891-895. [24] 齐国辉. 鸭梨自交不亲和与亲和变异的生理生化特性及分子机理研究[D]. 保定:河北农业大学,2005. QI Guohui. Physiological and biochemical characteristics,molecularmechanism of self incompatible Yali pear and its selfcompatiblemutations[D]. Baoding:Hebei Agricultural University,2005. [25] 丁一鸣,赵兰勇,张玲,孙华彩,王新刚. 玫瑰花柱提取液对玫瑰及月季花粉管离体生长的影响[J]. 中国农业科学,2012,45(9):1791-1797. DING Yiming,ZHAO Lanyong,ZHANG Ling,SUN Huacai,WANG Xingang. Effect of the extracted solution from the styleofRosa rugosa on the growthin vitro of pollen tube ofR. rugosaandR. chinensis[J]. Scientia Agricultura Sinica,2012,45(9):1791-1797. [26] 覃屏生,张瑜,侯丽霞,杨孝文,秦新民. 沙田柚花柱蛋白对其花粉萌发及生长的影响[J]. 北方园艺,2014(3):88-91. QIN Pingsheng,ZHANG Yu,HOU Lixia,YANG Xiaowen,QIN Xinming. Effect ofCitrus grandis‘ShatianyouHort. styleprotein on its pollen germination and growth[J]. Northern Horticulture,2014(3):88-91. [27] 贺熙勇. 澳洲坚果种质资源遗传多样性分析[D]. 重庆:西南大学,2008. HE Xiyong. Studies on genetic diversity of macadamia (Macadamiaspp.) germplasm resources[D]. Chongqing:SouthwestUniversity,2008. [28] 王文莉. 玫瑰花粉形态学及生活力研究[D]. 泰安:山东农业大学,2004. WANG Wenli. Studies on the pollen morphology and viabilityofRosa rugosa[D]. Taian:Shandong Agricultural University,2004. [29] 陶丽,贺熙勇,倪书邦,陈丽兰,孔广红. 澳洲坚果开花授粉特性的研究[J]. 热带作物学报,2010,31(3):349-354. TAO Li,HE Xiyong,NI Shubang,CHEN Lilan,KONGGuanghong. Flowering and pollinating characteristics ofMacadamia[J]. Chinese Journal of Tropical Crops,2010,31(3):349-354. [30] 曾黎明,陈显国,林玉虹,崔明勇,蔡元保. 澳洲坚果花粉活力、柱头可授性比较研究[J]. 江苏农业科学,2012,40(3):123-125. ZENG Liming,CHEN Xianguo,LIN Yuhong,CUI Mingyong,CAI Yuanbao. Comparative study of pollen viability and stigmautilization inMacadamia [J]. Jiangsu Agricultural Sciences,2012,40(3):123-125. [31] 佟莉蓉,王娟,宋雨,倪顺刚. 达乌里胡枝子花粉萌发特性研究[J].草地学报,2021,29(3):457-464. TONG Lirong,WANG Juan,SONG Yu,NI Shungang. Study onpollen germination characteristics ofLespedeza davurica[J]. ActaAgrestia Sinica,2021,29(3):457-464. [32] 王玉林,胡位荣,刘顺枝,潘玉珠,易干军,孙清明. 硼酸、蔗糖和pH 值对火龙果花粉离体萌发和花粉管伸长的影响[J]. 分子植物育种,2018,16(1):240-247. WANG Yulin,HU Weirong,LIU Shunzhi,PAN Yuzhu,YI Ganjun,SUN Qingming. Effects of boric acid,sugar and pH onin vitropollen germination and pollen tube length of pitaya[J]. MolecularPlant Breeding,2018,16(1):240-247. [33] 蔡昭艷,苏伟强,董龙,邱文武,施平丽,刘业强,黄辉晔,黄章保,任惠,王小媚. 钙、镁、钾浓度及光照、温度对西番莲花粉离体萌发的影响[J]. 果树学报,2022,39(1):86-94. CAI Zhaoyan,SU Weiqiang,DONG Long,QIU Wenwu,SHIPingli,LIU Yeqiang,HUANG Huiye,HUANG Zhangbao,RENHui,WANG Xiaomei. Effects of calcium,magnesium,potassium,light and temperature on pollen germination and pollen tubeelongation of passion fruitin vitro[J]. Journal of Fruit Science,2022,39(1):86-94. [34] 李千惠,姜文龙,徐同乐,武启飞,张往祥,王改萍. 日本海棠花粉最佳离体萌发培养基筛选及萌发过程研究[J]. 经济林研究,2018,36(2):154-160. LI Qianhui,JIANG Wenlong,XU Tongle,WU Qifei,ZHANGWangxiang,WANG Gaiping. Selection of pollenin vitro germinationmedia and pollen germination process ofMalus floribunda[J]. Nonwood Forest Research,2018,36(2):154-160. [35] 张绍铃,杨记磙,李秀根,平塚伸,WOLUKAU J N. 梨自交不亲和强度不同品种花柱S 糖蛋白含量的差异[J]. 园艺学报,2002,29(2):165-167. ZHANG Shaoling,YANG Jigun,LI Xiugen,SHIN H,WOLUKAUJ N. Differences ofS- glycoprotein content in the stylesamong pear cultivars differing in self- incompatible strength[J].Acta Horticulturae Sinica,2002,29(2):165-167. [36] 吴少华,沈德绪,林伯年,陈晓浪,陈懋森. 黄花梨授粉品种选配的研究[J]. 果树科学,1986,3(2):20-24. WU Shaohua,SHEN Dexu,LIN Bonian,CHEN Xiaolang,CHEN Maosen. Study on selection of pollenizers for‘Hwanghuapear[J]. Journal of Fruit Science,1986,3(2):20-24.
