ω-3多不饱和脂肪酸对急性肝功能衰竭小鼠肝细胞保护机制研究
2023-06-12张玉荣李高峰章美元
张玉荣,李高峰,汤 彦,章美元
(复旦大学附属中山医院青浦分院急诊科,上海 201700)
目前,脓毒症是一种致命性器官功能障碍综合征,感染是引发脓毒症的源头,是临床急危重患者常见病死原因之一。临床脓毒症患者往往存在高分解代谢和免疫紊乱,而机体免疫功能紊乱参与了脓毒症相关性肝损伤甚至急性肝衰竭的发生与发展过程,即使有效抗生素能够及时清除病原体,也需要免疫调节使促炎和抗炎恢复平衡,减少细胞因子风暴导致多器官功能障碍综合征(MODS)发生,故免疫调节治疗成为研究热点[1]。目前,ω-3 多不饱和脂肪酸在脓毒症中治疗效应已得到越来越多的关注,但治疗效果不一致,还存在许多不确定问题[2-3]。因此,有必要进一步研究ω-3 多不饱和脂肪酸对脓毒症相关性的急性肝衰竭是否存在抗炎、修复等保护作用。
1 材料与方法
1.1 实验动物与分组
选取BLAB/C 小鼠100 只,雌雄各半,均6~8周龄,体质量(21±2.6)g,由扬州大学比较医学中心提供[许可证号:SCXK(苏)2021-0009]。遵循有关实验动物管理和使用的规定,本研究经复旦大学附属中山医院青浦分院批准(EC-C-015-A01-V03)。空白组8 只,造模后随机分成4 组:模型组 20 只,乌司他丁组 24 只,3-PUFA 组24 只,促肝细胞生长素组24 只。各组在造模和干预治疗后6、12、24 h 时间点留取标本。动物6 只,笼饲养,自由饮水和饮食。
1.2 动物模型制备和干预治疗措施
小鼠自由饲养1 周,禁食1 天,自由饮水,先予以D-氨基半乳糖800 mg·kg-1(南京市生物有限公司)加脂多糖(8 mg·kg-1,批号:I4319,sigma)腹腔注射造模,随后2 h 予以乌司他丁(0.5万·kg-1,国药准字:H19990134)腹腔注射,3-PUFA(0.2 g·kg-1,国药准字:J20100092)加无菌注射10% 糖水稀释后尾部静脉注射,促肝细胞生长素(20 mg·kg-1,国药准字:H20046249)腹腔注射。
1.3 血清标本采集和相关检测
按照干预后时间点6、12、24 h 采集标本,留取静脉血,3 000 r·min-1,离心10 min 后,分离出血清放置-70℃冰箱存放,统一检测。采取ELISA检测血清降钙素原(PCT)、肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、谷丙转氨酶(ALT)、谷草转氨酶(AST)和胆碱酯酶(CHE),严格按照说明书操作。
1.4 肝组织标本采集
采集血清标本后,留取肝组织(生理盐水冲洗后),肝组织放置预先留有2%甲醛溶液的标本瓶,用于做病理HE 染色观察,另为无菌干燥瓶,分别放入组织标本,统一称质量1 g,然后加入0.9%生理盐水2 mL,制作组织均浆,4 000 r·min-1离心10 min 后,留取上清液1 mL,在 miRBase 上查寻目的基因序列,由美国Invitrogen 公司设计合成引物,提取上清液中miRNAs,合成cDNA。以U6 作为内参,在9700 型基因扩增仪中扩增 miRNAs。RT-PCR反应条件:95℃预变性10 min,95℃变性10s,60℃退火60 s,共37 个循环。采用2-ΔΔCT(Livak)法计算肝组织microRNA-122a 的相对表达量。
1.5 统计学方法
采用SPSS 20.0 软件进行数据分析处理,TN F-α、IL-6 、PCT、ALT、AST、CHE、microRNA-122a 水平等计量资料以均数±标准差(±s)表示,组间、组内结果比较采用t检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组小鼠变化比较
空白组小鼠表现正常饮食活跃,造模后2 h 内各组累计死亡18 只:模型组6 只,乌司他丁组4 只,3-PUFA 组5 只,促肝细胞生长素组3 只。造模后各组存活小鼠表现为体毛松散,活动明显减少,进食量少;乌司他丁组、3-PUFA 组和促肝细胞生长素组均表现为卷曲明显,活动减少,能够勉强自由采食和饮水。
2.2 各组小鼠血清ALT、AST 与CHE 比较
造模后6 h 后小鼠血清ALT 与AST 水平升高,CHE 水平明显下降,且模型组与空白组的ALT、AST和CHE 水平比较,差异具有统计学意义;3-PUFA 组、乌司他丁组、促肝细胞生长素组的ALT、AST 和CHE水平比模型组明显下降,且2 组比较,差异有统计学意义;3-PUFA 组与乌司他丁组的ALT、AST 和CHE水平比较,差异无统计学意义;3-PUFA 组与促肝细胞生长素组的ALT、AST 比较,差异有统计学意义,CHE 水平差异无统计学意义。见表1。
表1 各组小鼠治疗后的血清ALT、AST 与CHE 比较(± s ) U·L-1
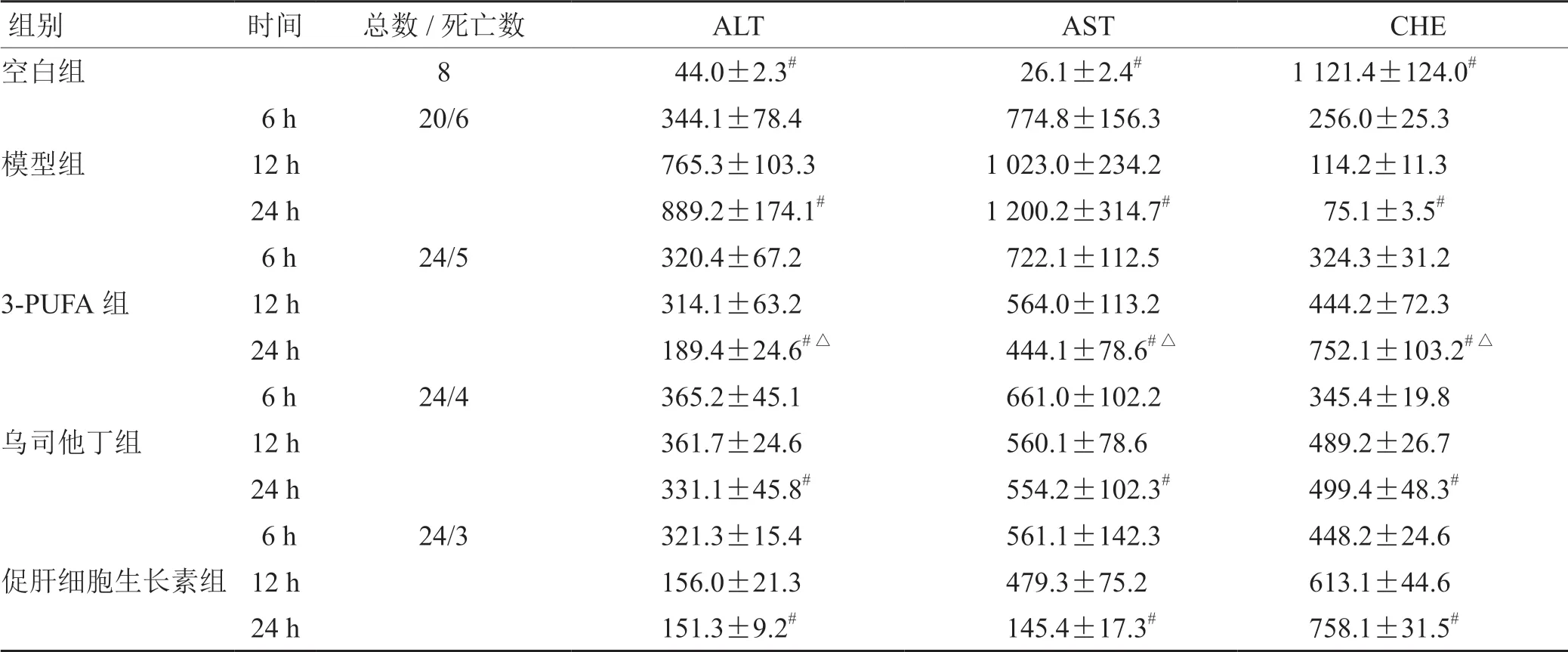
表1 各组小鼠治疗后的血清ALT、AST 与CHE 比较(± s ) U·L-1
注:与空白组比较,# P <0.05;与促肝细胞生长素组比较,△P <0.05
组别时间总数/死亡数ALT AST CHE空白组8 44.0±2.3# 26.1±2.4#1 121.4±124.0#模型组3-PUFA 组乌司他丁组6 h20/6344.1±78.4 774.8±156.3256.0±25.3 12 h765.3±103.31 023.0±234.2114.2±11.3 24 h889.2±174.1#1 200.2±314.7# 75.1±3.5#6 h24/5320.4±67.2 722.1±112.5324.3±31.2 12 h314.1±63.2 564.0±113.2444.2±72.3 24 h189.4±24.6#△ 444.1±78.6#△752.1±103.2#△6 h24/4365.2±45.1 661.0±102.2345.4±19.8 12 h361.7±24.6 560.1±78.6489.2±26.7 24 h331.1±45.8# 554.2±102.3#499.4±48.3#促肝细胞生长素组6 h24/3321.3±15.4 561.1±142.3448.2±24.6 12 h156.0±21.3 479.3±75.2613.1±44.6 24 h151.3±9.2# 145.4±17.3#758.1±31.5#
2.3 各组小鼠的血清TNF-α、IL-6 与PCT 水平比较
造模后小鼠血清TNF-α、IL-6 和PCT 水平明显升高,且模型组与空白组的TNF-α、IL-6 和PCT 水平比较,差异具有统计学意义;3-PUFA 组、乌司他丁组、促肝细胞生长素组的TNF-α、IL-6 和PCT 水平比模型组明显下降,差异有统计学意义;3-PUFA组比乌司他丁组的TNF-α、IL-6 和PCT 水平更高,差异有统计学意义;3-PUFA 组与促肝细胞生长素组的TNF-α、IL-6 和PCT 水平比较,差异不具有统计学意义,见表2。
表2 各组小鼠治疗后血清TNF-α、IL-6 与PCT 水平比较(± s ) pg·mL-1

表2 各组小鼠治疗后血清TNF-α、IL-6 与PCT 水平比较(± s ) pg·mL-1
注:与空白组比较,# P <0.05;与乌司他丁组比较,△P <0.05
组别时间 总数/死亡数TNF-α IL-6 PCT空白组8 14.1±1.2 24.2±1.5 0.1±0.0模型组3-PUFA 组6 h20/61 556.0±191.2 663.3±86.010.2±1.5 12 h2 006.4±203.9 953.0±121.124.2±4.2 24 h3 156.3±421.0#1 022.1±115.3#57.2±9.4#6 h24/51 224.3±155.4 660.5±71.1 10.0±2.1 12 h 986.4±112.3 512.2±86.2 11.1±2.5 24 h 453.2±75.3#△ 324.1±54.6#△ 7.2±1.09#△6 h24/4 365.4±45.1 661.0±102.234.5±2.0 12 h 361.1±24.6 560.4±78.648.9±2.7 24 h 331.3±45.8# 554.2±102.3#△49.9±4.8#促肝细胞生长素组 6 h24/3 678.2±141.3 401.3±79.3 9.1±2.0 12 h 622.4±101.4 332.2±14.3 6.1±1.2 24 h 426.1±97.9# 396.4±20.1# 6.0±0.9#乌司他丁组
2.4 各组小鼠肝组织的microRNA-122a 水平比较
造模后小鼠血清microRNA-122a 水平明显升高,且模型组与空白组的microRNA-122a 水平比较,差异具有统计学意义;3-PUFA 组、乌司他丁组、促肝细胞生长素组的microRNA-122a 水平比模型组明显下降,差异有统计学意义;3-PUFA 组比乌司他丁组的microRNA-122a 水平更高,差异有统计学意义;3-PUFA 组与促肝细胞生长素组的microRNA-122a水平比较,差异无统计学意义。见表3和图1。
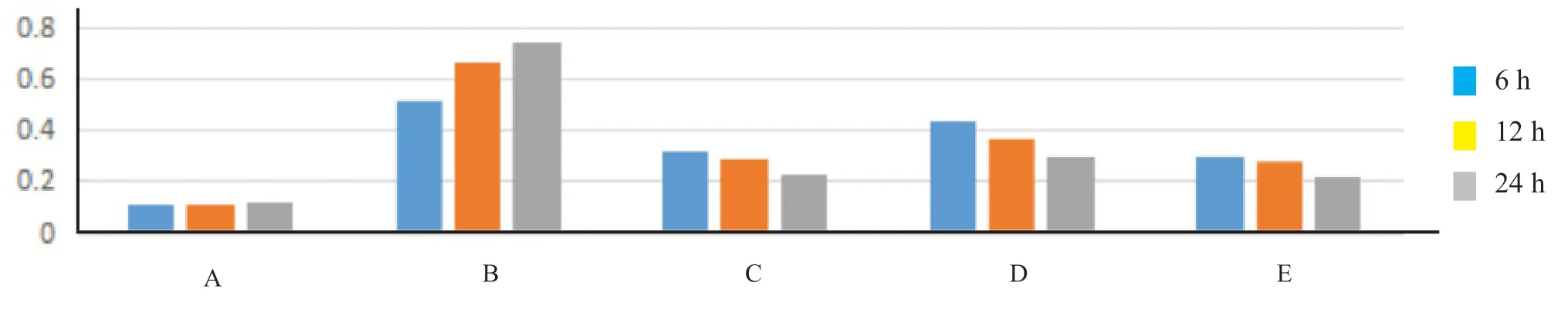
图1 各组的microRNA-122a 随时间变化
表3 各组小鼠肝组织的microRNA-122 a 水平比较(± s )
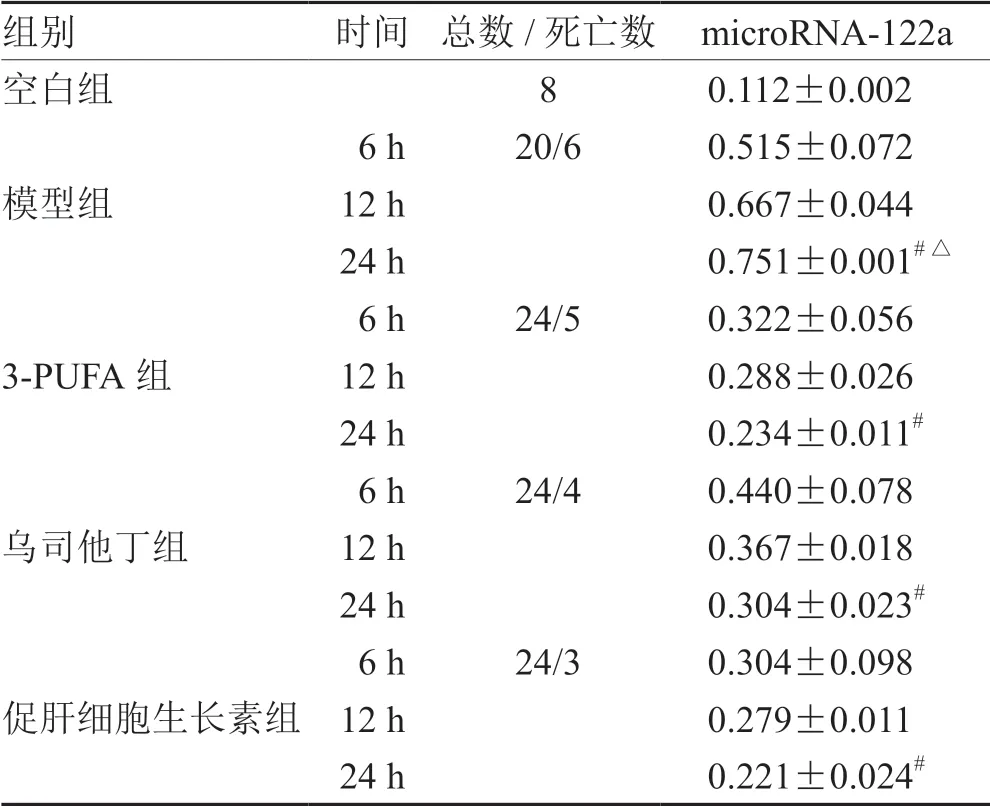
表3 各组小鼠肝组织的microRNA-122 a 水平比较(± s )
注:与空白组比较,# P <0.05;与乌司他丁组比较,△P <0.05
组别时间 总数/死亡数 microRNA-122a空白组80.112±0.002模型组6 h20/60.515±0.072 12 h0.667±0.044 24 h0.751±0.001#△3-PUFA 组6 h24/50.322±0.056 12 h0.288±0.026 24 h0.234±0.011#乌司他丁组6 h24/40.440±0.078 12 h0.367±0.018 24 h0.304±0.023#促肝细胞生长素组6 h24/30.304±0.098 12 h0.279±0.011 24 h0.221±0.024#
2.5 各组小鼠肝组织的病理变化比较
光镜下HE 染色观察(40×10:放大400 倍),空白组肝组织中少量的中性粒细胞浸润,无明显的细胞水肿;模型组表现为在肝组织的大量浆细胞和淋巴细胞浸润,弥漫性细胞水肿变性,肝组织切片中在汇管区尤其明显淤血;与模型组比较,各治疗组肝组织充血明显和肝细胞水肿,浆细胞浸润程度减轻,其中3-PUFA 组浆细胞和淋巴细胞浸润明显减少,促肝细胞生长素组次之,乌司他丁组居后,各组炎症程度变化也随着时间推移逐步减轻。见图2。
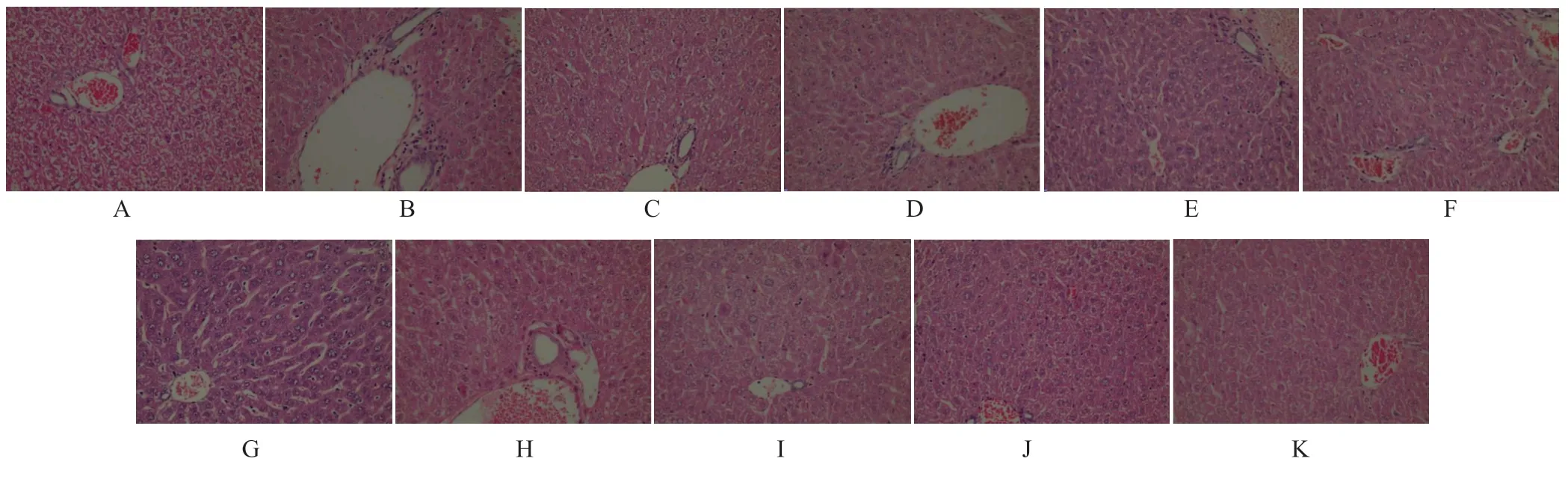
图2 各组小鼠肝组织的病理变化比较(HE 染色,×400)
3 讨论
虽然临床采用多种免疫调节治疗措施,但是脓毒症并发急性肝衰竭的免疫状态的调节机制网络比较复杂,临床病死率仍高达11.1%~40.7%[4],其中炎症介质释放及免疫功能紊乱是脓毒症内皮细胞损伤的主要因素,随着产生大量的活性氧(Reactive oxygen species,ROS),产生过量的自由基导致氧化应激和线粒体DNA 损伤,导致线粒体功能障碍的发生,故脓毒症相关性肝损伤甚至肝衰竭可出现在脓毒症的各个病程阶段,是发生MODS 和死亡的独立预警危险因素[5],脓毒症患者早期肝功能障碍是预后不良的高危因素,尽早发现和干预脓毒症相关性肝损伤可以改善患者预后,故如何免疫调节恢复免疫平衡是阻止脓毒症相关肝损伤的发生发展的关键[6]。此外,在脓毒症形成发展过程中由于应激消耗大量营养物质和炎症介质的形成,故除病因处理之外,在治疗上既需要营养支持又要免疫调节,既往研究提示及时予以如ω-3多不饱和脂肪酸,可以直接为机体提供能量和营养物质,促进内皮细胞修复,还可以具有抗微血栓、调节微循环、调控基因表达等作用,可能起到减少炎症反应、恢复和调节免疫平衡等的治疗作用,进而有助于控制感染发展,改善预后[7]。
脓毒症相关性肝损伤已经在基因组学、表观遗传学、蛋白组学和代谢组学取得很大进展,但是具体病生理机制尚未完全揭示,免疫紊乱导致肝内皮细胞损伤是其主要内容,级联瀑布样细胞因子风暴导致多器官功能障碍发生。对于脓毒症相关性肝损伤和急性肝功能衰竭,控制炎症因子释放,减少免疫介质损伤成为关键手段之一,故免疫营养治疗成为必然需要且需把握给药时机。
免疫损伤引起线粒体功能障碍常导致脓毒症相关性肝损伤或者急性肝衰竭发生,临床表现为肝脏是脓毒症中能量代谢障碍发生最早、程度最严重的器官,在脓毒症发生时出现微循环障碍、能量代谢障碍、氧化应激、炎症反应、肝细胞凋亡或坏死等病理生理特点[8]。研究发现在脓毒症相关性肝损伤甚至急性肝衰竭中,蛋白质合成功能受到影响均表现为凝血功能障碍和代谢紊乱以及胆红素代谢受损等[9],而且动物实验进一步证实,脓毒症相关性急性肝衰竭可通过AMPK 通路影响线粒体生物合成和激活线粒体自噬反应,其中肝细胞线粒体作为机体重要的能量代谢中心,在脓毒症应激病理状态下,肝细胞线粒体损伤可引起肝脏能量代谢和解毒功能障碍,导致急性肝功能不全,甚至发生急性肝衰竭[10-11]。因此脓毒症相关性肝病发病机制错综复杂,各因素之间相互影响,目前尚无特效的治疗手段[12],加上脓毒血症高消耗特点和免疫异常反应的特点,故目前营养免疫成为治疗脓毒症相关性肝病的重要辅助方法之一[13-14]。
既往研究表明,ω-3PUFA 不仅能满足机体代谢所需的能量需求,在脓毒症以分解代谢为主时减少白蛋白的消耗,还能促进内皮细胞膜损伤的修复,进一步影响中性粒细胞和巨噬细胞的活性,激活其细胞内酶系统,从而影响细胞表面受体活性变化、激素的释放和调节基因表达,最终激活中性粒细胞、淋巴细胞以及巨噬细胞等免疫活性细胞,减少炎症因子释放,减少ROS 产生,改善组织微循环,起到抗微循环血栓形成等,减少花生四烯酸产生类花生酸,并减少组织炎症,对抗白三烯来抗血小板聚集,降低细胞表面黏附因子水平等作用[15-16],然而脓毒血症患者补充ω-3PUFA 的获益疗效缺乏足够证据[17]。
血清ALT、AST 是肝功能损伤早期临床表现的指标,在反映急性肝损伤时具有很高的灵敏度及特异性,其含量常与肝细胞损伤程度成正比[18]。本实验结果显示,模型组小鼠血清中ALT 和AST 含量与空白组比较显著升高,HE 染色提示肝细胞水肿、坏死和浆细胞浸润等,而ω-3PUFA 干预组可明显降低脓毒症小鼠血清中ALT 和AST 含量,并改善肝脏病理变化,初步说明ω-3PUFA 对脓毒症引发的肝损伤具有保护作用。MicroRNA-122a 是一种肝脏特异性miRNAs,在肝脏中高度表达,在维持肝细胞正常功能和紧急启动肝细胞修复中起着十分重要的作用[19]。研究[20]表明,在肠道细胞体外培养实验中,LPS 可刺激MicroRNA-122a 表达,促进TNF-a、IL-6 释放,从而促进炎症过度反应。本研究发现,模型组MicroRNA-122a 表达明显升高,而3-PUFA、乌司他丁和促肝细胞生长素干预后,其表达明显下降,差异具有统计学意义,由此表明,ω3-PUFA 可能存在通过下调MicroRNA-122a 表达起到抗炎和肝细胞保护作用,具体的作用通路及机制有待进一步研究。
综上所述,营养与免疫的关系已经突破了营养缺乏、营养过度和营养失衡的范畴,从宏观上讲,营养与免疫的关系是相互的,营养是免疫的基础。ω-3PUFA 不但提供了能量支持,减少血清白蛋白消耗,而且在减轻脓毒症相关性肝病的全身炎症、内毒素血症和脓毒症的肝外其他器官保护方面安全有效。本研究证实,ω-3PUFA 可能通过下调MicroRNA-122a 的表达,起到对急性肝衰竭起到抗炎和保护作用,而且为在脓毒症早期就可以启动给药提供了实验依据。
