干眼患者与非干眼患者眼表微生物菌群差异分析
2023-06-12宋瑜齐赟张明康前雁黎黎
宋瑜 齐赟 张明 康前雁 黎黎
西安交通大学第一附属医院眼科,西安 710061
干眼是影响视觉和生活质量的常见眼表疾病,DEWS Ⅱ报道指出干眼的患病率为5%~50%[1]。2020年中国干眼专家共识提出,干眼为多因素引起的慢性眼表疾病,并明确提出眼表微环境失衡是造成干眼的原因之一[2]。研究眼表微环境的改变对于探索干眼的发病机制以及治疗具有重要意义[3-5]。2011年,Dong等[6]首次使用16S rRNA高通量测序技术确定健康人群眼表微生物菌群,发现假单胞菌属、丙酸菌属、棒状杆菌、葡萄球菌、水杆菌、链球菌等在人结膜囊普遍存在,并且核心菌群由共生菌、环境致病菌和机会致病菌共同组成。通过高通量测序技术(宏基因组或16S rRNA)对正常人群和眼表疾病患者眼表微生物菌群进行对比研究发现,眼表微生物菌群对于维持眼表及视功能的健康起着重要作用,并参与部分眼部疾病的发生和发展,如真菌性角膜炎、结膜炎、睑缘炎、眼内炎、视网膜炎[7-13]。眼表微生物菌群是眼表微环境的重要组成部分,可能在干眼的发病中发挥重要作用,但是目前该领域研究很少。本研究拟探讨干眼与非干眼患者结膜拭子微生物菌群差异,为深入了解眼表菌群在干眼发病和治疗中的作用及机制提供参考依据。
1 材料与方法
1.1 材料
1.1.1标本来源 纳入2020年6—11月于西安交通大学第一附属医院确诊的干眼患者42例42眼作为干眼组,其中男16例16眼,女26例26眼,平均年龄(47.5±15.3)岁,屈光不正患者占7.1%;同期纳入在眼科门诊查体的非干眼患者37例37眼作为非干眼组,其中男14例14眼,女23例23眼,平均年龄(41.4±15.5)岁,屈光不正患者占8.1%。双眼均符合纳入标准时,右眼入组。干眼组与非干眼组患者年龄、性别构成以及屈光不正患者比例差异均无统计学意义(t=-1.615,P=0.111;χ2=3.457,P=0.063;χ2=0.026,P=0.872)。干眼的诊断依据2020年中国干眼专家共识[14]。所有患者均由同一位有经验的眼表专家进行检查和评估。干眼组纳入标准:(1)年龄≥18岁;(2)具有眼部烧灼感、异物感、畏光、眼干、眼痒等不适症状,眼表疾病指数评分(Ocular Surface Disease Index,OSDI)≥13分;(3)泪液分泌试验Schirmer试验Ⅰ(无麻醉)≤5 mm,或荧光素染色泪膜破裂时间(fluorscein tear film breakup time,FBUT)≤5 s,或非侵入泪膜破裂时间(non-invasive tear film breakup time,NIBUT)<10 s;若5 mm/5 min
1.1.2主要试剂及仪器 盐酸奥布卡因滴眼液(日本参天制药株式会社);QIA Stool Mini Kit(德国QIAGEN公司);异丙醇、醋酸钠(美国Sigma-Aldrich公司)。超微量分光光度计(美国Multiskan SkyHigh公司);PCR仪(美国赛默飞公司)。
1.2 方法
1.2.1样品采集与保存 严格按照无菌方式取材。采样前用盐酸奥布卡因滴眼液点受检眼进行表面麻醉,点眼后3 min嘱受检者向上注视,向下拉开下眼睑,用无菌干棉签拭子,轻微按压擦拭下方的球结膜表面3次,擦拭时避免棉签拭子接触眼睑和睫毛。将结膜拭子置于1.5 ml无菌管中,迅速转至-80 ℃冰箱冻存备用。
1.2.2DNA提取、扩增和16S rRNA基因扩增测序 按照华大基因公司的标准实验流程进行(参照文献[15-16]中方法),根据QIA Stool Mini Kit试剂盒说明书将棉签拭子前端转移至EP管中,研磨5 min,65 ℃裂解13 min,室温下离心力14 000×g离心10 min。取上清液至离心管中,加入-20 ℃预冷的异丙醇和100 g/L醋酸钠3 ml混匀,于-20 ℃冰箱中过夜;离心力14 000×g离心3次,晾干后溶于适量缓冲液。采用10 g/L琼脂糖凝胶检测样本中DNA提取的质量。取30 ng DNA样品,用341F(5'-ACTCCTACGGGAGGCAG CAG-3')和806R(5'-GGACTACHVGGGT WTCTAAT-3')通用区引物对16S rRNA基因V3-V4可变区进行PCR扩增;采用Agencount AMPure XP磁珠进行纯化并溶于洗脱缓冲液,完成建库。采用Agilent 2100 Bioanalyzer软件检测文库的片段范围及浓度,采用IIIumina的MiseqPE301+8+8+301平台对检测合格的文库进行双端测序。
1.2.3测序数据的生物信息学分析 设定Cut off值,过滤采集数据,清除低质量数据,将过滤后数据用于后期分析。采用FLASH软件对测序数据进行拼接、过滤及嵌合体去除,采用USE-ARCH(v7.0.1090)软件进行种属分类,进行可操作分类种属(operational taxonomic species,OTUs)聚类分析,相似性>97%的标签聚集成1个OTUs。根据OTUs聚类分析结果以及物种注释结果进行各组间物种差异分析和样品物种复杂度分析。采用R(v3.2.1)软件的mixOmics包对样本进行Alpha多样性分析,包括observed species指数、Chao指数、Ace指数、Shannon指数、Simpson指数等,以评估单个样本的物种丰富度;基于bray-curtis矩阵分析Beta多样性,在门水平上评估菌群构成的差异性。采用GreenGene数据库对测序数据进行注释。
1.3 统计学方法

2 结果
2.1 各组眼表微生物菌群OTUs比较
干眼组和非干眼组受检眼中共获得18 586个OTUs,其中干眼组13 310个OTUs,非干眼组8 950个OTUs,2个组共有OTUs为3 674个(图1)。
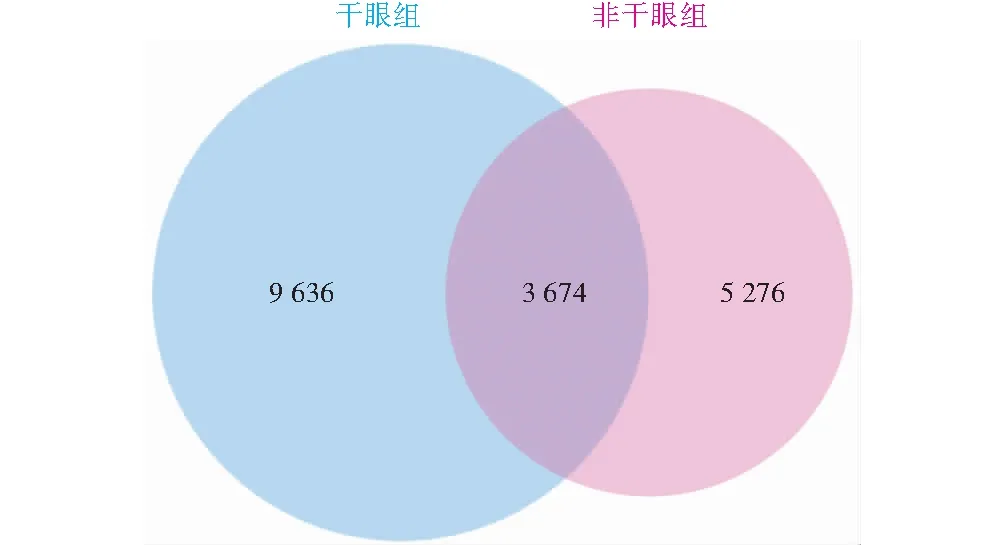
图1 OTUs聚类分析维恩图
2.2 各组眼表微生物菌群多样性分析
2.2.12个组间Alpha多样性比较 干眼组与非干眼组间observed species指数、Chao指数、Ace指数、Shannon指数和Simpson指数比较,差异均无统计学意义(均P>0.05)(表1)。
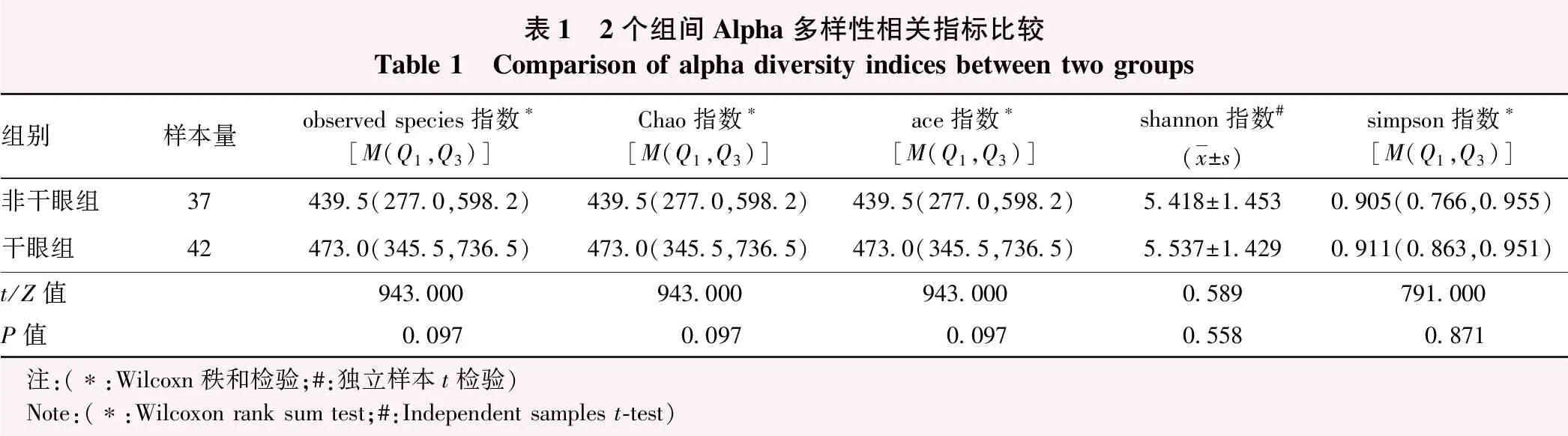
表1 2个组间Alpha多样性相关指标比较Table 1 Comparison of alpha diversity indices between two groups组别样本量observed species指数∗[M(Q1,Q3)]Chao指数∗[M(Q1,Q3)]ace指数∗[M(Q1,Q3)]shannon指数#(x±s)simpson指数∗[M(Q1,Q3)]非干眼组37439.5(277.0,598.2)439.5(277.0,598.2)439.5(277.0,598.2)5.418±1.4530.905(0.766,0.955)干眼组42473.0(345.5,736.5)473.0(345.5,736.5)473.0(345.5,736.5)5.537±1.4290.911(0.863,0.951)t/Z值943.000943.000943.0000.589791.000P值0.0970.0970.0970.5580.871 注:(∗:Wilcoxn秩和检验;#:独立样本t检验) Note:(∗:Wilcoxon rank sum test;#:Independent samples t-test)
2.2.22个组间Beta多样性比较 Beta多样性PCoA分析显示,2个组的距离矩阵置换多元方差分析,差异有统计学意义(R2=0.039,F=3.100,P=0.022)(图2)。
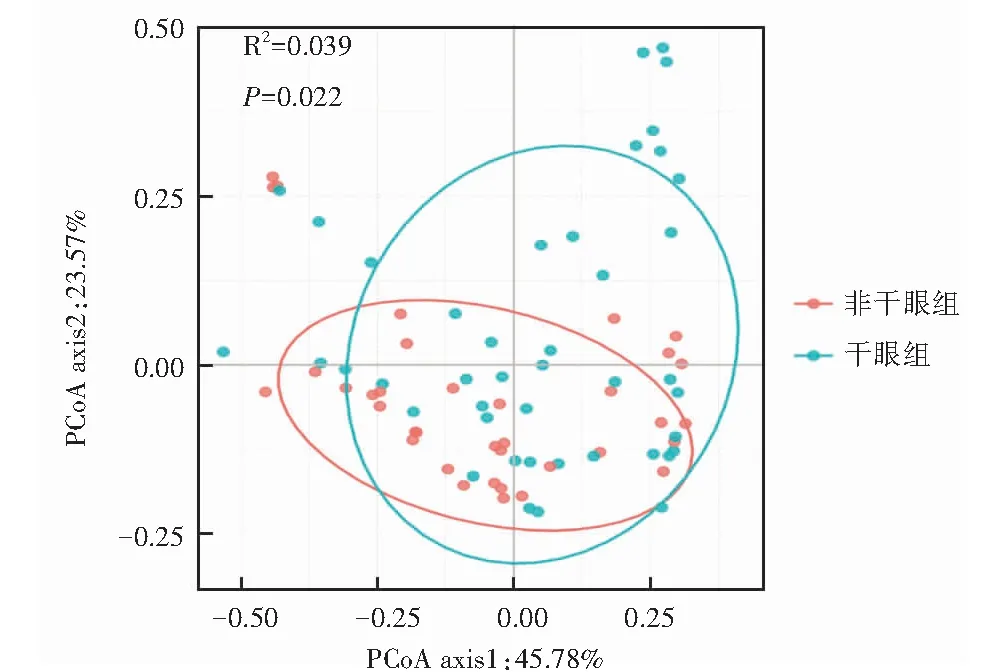
图2 基于Bray-Curtis矩阵的Beta多样性(PCoA分析)结果 圆圈代表95%置信区间,每个坐标轴百分数代表解释变量百分比
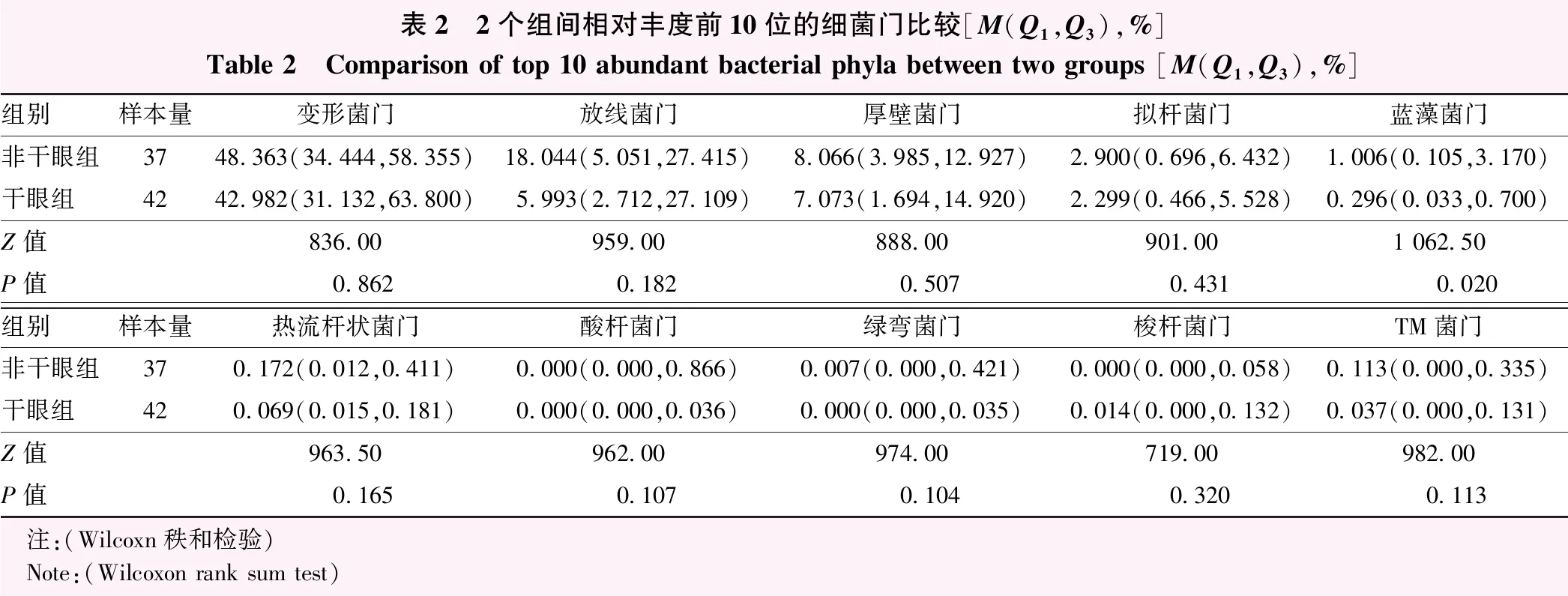
表2 2个组间相对丰度前10位的细菌门比较[M(Q1,Q3),%]Table 2 Comparison of top 10 abundant bacterial phyla between two groups [M(Q1,Q3),%]组别样本量变形菌门放线菌门厚壁菌门拟杆菌门蓝藻菌门非干眼组3748.363(34.444,58.355)18.044(5.051,27.415)8.066(3.985,12.927)2.900(0.696,6.432)1.006(0.105,3.170)干眼组4242.982(31.132,63.800)5.993(2.712,27.109)7.073(1.694,14.920)2.299(0.466,5.528)0.296(0.033,0.700)Z值836.00959.00888.00901.001 062.50P值0.8620.1820.5070.4310.020组别样本量热流杆状菌门酸杆菌门绿弯菌门梭杆菌门TM菌门非干眼组370.172(0.012,0.411)0.000(0.000,0.866)0.007(0.000,0.421)0.000(0.000,0.058)0.113(0.000,0.335)干眼组420.069(0.015,0.181)0.000(0.000,0.036)0.000(0.000,0.035)0.014(0.000,0.132)0.037(0.000,0.131)Z值963.50962.00974.00719.00982.00P值0.1650.1070.1040.3200.113 注:(Wilcoxn秩和检验) Note:(Wilcoxon rank sum test)
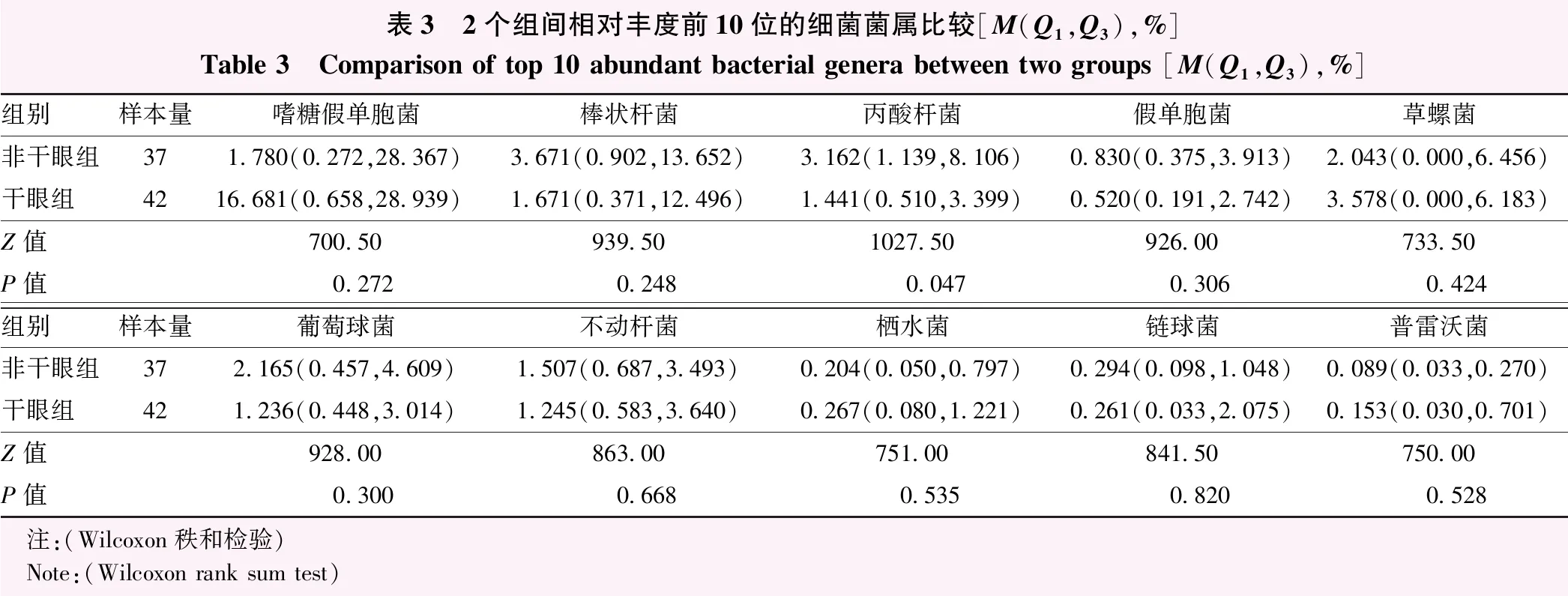
表3 2个组间相对丰度前10位的细菌菌属比较[M(Q1,Q3),%]Table 3 Comparison of top 10 abundant bacterial genera between two groups [M(Q1,Q3),%]组别样本量嗜糖假单胞菌棒状杆菌丙酸杆菌假单胞菌草螺菌非干眼组371.780(0.272,28.367)3.671(0.902,13.652)3.162(1.139,8.106)0.830(0.375,3.913)2.043(0.000,6.456)干眼组4216.681(0.658,28.939)1.671(0.371,12.496)1.441(0.510,3.399)0.520(0.191,2.742)3.578(0.000,6.183)Z值700.50939.501027.50926.00733.50P值0.2720.2480.0470.3060.424组别样本量葡萄球菌不动杆菌栖水菌链球菌普雷沃菌非干眼组372.165(0.457,4.609)1.507(0.687,3.493)0.204(0.050,0.797)0.294(0.098,1.048)0.089(0.033,0.270)干眼组421.236(0.448,3.014)1.245(0.583,3.640)0.267(0.080,1.221)0.261(0.033,2.075)0.153(0.030,0.701)Z值928.00863.00751.00841.50750.00P值0.3000.6680.5350.8200.528 注:(Wilcoxon秩和检验) Note:(Wilcoxon rank sum test)
2.3 各组眼表微生物菌群的分类
2个组样本鉴定出细菌隶属40门473属。
2.3.12个组菌门水平比较 干眼组与非干眼组检出的相对丰度较高的前10位细菌门种类相似,干眼组和非干眼组检出的变形菌、放线菌、厚壁菌、拟杆菌、热流杆状菌、酸杆菌、绿弯菌、梭杆菌、TM菌门相对丰度比较差异均无统计学意义(均P>0.05),干眼组蓝藻菌相对丰度低于非干眼组,差异有统计学意义(Z=1 062.50,P=0.020)(表2)。
2.3.22个组菌属水平比较 干眼组和非干眼组检出的噬糖假单胞菌、棒状杆菌、丙酸杆菌、假单胞菌、草螺菌、葡萄球菌、不动杆菌、栖水菌、链球菌、普雷沃菌相对丰度比较差异均无统计学意义(均P>0.05)。干眼组丙酸杆菌属的相对丰度低于非干眼组,差异有统计学意义(Z=1 027.50,P=0.047)(表3)。
2.4 2个组微生物标志物分析
LEfSe分析显示,干眼组的优势菌群为泰氏菌属、栖水菌属和芬戈尔德菌属;非干眼组的优势菌群为柄杆菌属和弯钩菌属(图3,表4)。

图3 干眼组与非干眼组菌属水平优势菌群LEfSe分析(LDA>3) LDA:线性判别分析

表4 优势菌属LEfSe分析Table 4 LEfSe analysis result of dominant bacterial genera种属组别LDA值P值柄杆菌属Caulobacter非干眼组3.4700.003弯钩菌属Curvibacter非干眼组3.2490.018芬戈尔德菌属Finegoldia干眼组3.5190.004栖水菌属Enhydrobacter干眼组3.7550.017泰氏菌属Tissierellaceae干眼组3.8780.015 注:LDA:线性判别分析 Note:LDA:linear discriminant analysis
3 讨论
眼表微生物菌群参与眼表微环境的调节,因此探讨干眼患者眼表组织中细菌菌群的变化对于探索干眼的发病机制有潜在的临床意义。研究发现,干眼患者眼表微生物菌群较非干眼者发生一定程度的改变[4],但是该领域研究有限,且因所用的测序方法学不同(宏基因组与16S rRNA技术)、取材环境不统一等,造成研究结果不一致。本研究对干眼及非干眼患者结膜囊拭子样本进行16S rRNA基因测序,对比2个组受检眼眼表细菌的Alpha多样性、Beta多样性,探索干眼与非干眼患者的优势菌群区别,拟寻找可能对干眼诊断有提示作用的眼表菌群。
本研究结果显示,干眼组和非干眼组受检眼眼表菌群Alpha多样性相关指标无统计学差异,而Beta多样性PCoA分析结果存在不同,提示干眼眼表菌群的丰度无明显变化而菌群的构成发生了改变。Li等[3]针对中国人群的研究发现干眼组与非干眼组眼表菌群在Alpha与Beta多样性上均具有显著性差异,可能与研究入组标准、受试人群差异有关。
本研究发现干眼组与非干眼组眼表微生物菌群中相对丰度排名前3位菌门分别是变形菌、放线菌和厚壁菌,三者为构成眼表菌群的核心菌门,与Zhang等[17]研究发现变形菌、厚壁菌、放线菌是糖尿病干眼患者眼表菌群中丰度排名前3位菌群的结果基本相同。然而,Li等[3]研究显示,干眼及非干眼眼表菌门水平排名前3位微生物菌群分别是变形菌、厚壁菌和拟杆菌,与本研究结果存在部分差异,可能与研究所用的干眼诊断标准不同有关。
本研究发现,各组患者菌属水平排名前10位眼表微生物菌群分别为噬糖假单胞菌、棒状杆菌、丙酸杆菌、假单胞菌、草螺菌、葡萄球菌、不动杆菌、栖水菌、链球菌、普雷沃菌,干眼患者眼表丙酸杆菌相对丰度较非干眼患者显著下降。但一项针对干燥综合征患者口腔微生物菌群的研究显示,丙酸杆菌在干燥综合征患者中的相对丰度显著升高,与本研究结果不一致,推测可能由于不同部位微生物菌群存在差异,同时也证明丙酸杆菌可能是关键的差异菌属[18]。
干眼组的优势菌群为泰氏菌属、栖水菌属和芬戈尔德菌属,非干眼组的优势菌群为柄杆菌属和弯钩菌属。本研究中LEfSe分析干眼组优势菌群中栖水菌属相对丰度较高,与Andersson等[19]采用16S rRNA测序技术发现德国水样缺乏型干眼患者眼表的优势菌属为栖水菌属的研究结果一致。同样,Lee等[10]研究发现,睑缘炎患者眼表微生物菌群中栖水菌属丰度较正常对照组显著升高。因此推测,栖水菌属在干眼中的作用可能与炎症相关,但其具体机制还需要进一步研究证实。
本研究基于我国最新干眼专家共识的标准[14]纳入干眼患者,与既往以DEWS或者日本干眼诊断标准有所不同。本研究发现干眼与非干眼患者之间眼表微生物菌群构成存在差异,为眼表微生物标志物的探索研究提供数据支持,同时为进一步研究干眼发病机制提供了新的角度。但本研究也存在一定的局限性:(1)16S rRNA与宏基因组测序的原理与物种鉴定深度不同,16S rRNA基因测序在细菌种水平分析和功能学分析上都不占优势[20];(2)本研究未考虑干眼的类型和严重程度,未来需要进一步扩大样本量,并针对干眼性质和严重程度进行分层研究;(3)本研究未排除全身药物、免疫疾病程度和环境等混杂因素,可能导致结果受到一定影响;(4)由于样本量较小,可能会存在一定程度的选择偏倚;(5)本研究在纳入干眼组及非干眼组患者时,并未将屈光不正作为排除标准,仅2个组内屈光不正患者占比保持可比性。
综上所述,本研究结果表明干眼和非干眼受检者眼表微生物菌群构成具有一定差异,为干眼的发病机制研究提供了新的线索。未来需进一步研究特定菌属是否可作为生物标志物用于干眼诊断。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明宋瑜:参与研究实施、数据采集、分析、论文撰写;齐赟:参与患者招募、研究实施;张明:参与研究实施、数据采集及分析;康前雁:参与实验设计、患者诊断及招募、数据验证及论文修改;黎黎:参与实验设计、对文章智力性内容的审阅和修改及论文最终定稿
