Box-Behnken响应面法优化超声提取皱皮木瓜总黄酮工艺
2023-06-11刘岩吕宗凯刘连芬钱关泽
刘岩 吕宗凯 刘连芬 钱关泽
摘要 以蔷薇科中的皱皮木瓜为研究对象,以其叶片为试验材料,分别进行料液比、提取时间、提取温度、乙醇浓度单因素试验探究总黄酮提取最适范围,通过响应面法(RSM)和Box-Behnken试验设计结合二次回流优化超声辅助提取总黄酮工艺。结果表明,不同因素对木瓜叶片总黄酮提取率的影响顺序为提取时间>乙醇浓度>料液比;最佳工艺条件为提取时间52 min、乙醇浓度74%、料液比1∶41(g∶mL)时,总黄酮为156.65 mg/g,提取率达到15.67%。
关键词 皱皮木瓜;总黄酮;响应面法;提取工艺优化
中图分类号 R284.2 文献标识码 A 文章编号 0517-6611(2023)10-0144-05
doi:10.3969/j.issn.0517-6611.2023.10.032
Abstract Taking Chaenomeles speciosa in the Rosaceae as the research object and its leaves as the experimental material,the single factor experiments were conducted to explore the optimal range of total flavonoids extraction, including solidliquid ratio, extraction time, extraction temperature and ethanol concentration. Response surface methodology (RSM) and BoxBehnken experimental design were combined with secondary reflux to optimize the ultrasonic assisted extraction process of total flavonoids.The results showed that the order of influence of different factors on the extraction rate of total flavonoids from papaya leaves was extraction time>ethanol concentration>solidliquid ratio;the optimal process conditions were extraction time 52 minutes, ethanol concentration 74% and solidliquid ratio 1∶41(g∶mL),the total flavonoids were 156.65 mg/g, and the extraction rate reached 15.67%.
Key words Chaenomeles speciosa;Total flavonoids;Response surface methodology (RSM);Optimization of extraction process
皱皮木瓜(Chaenomeles speciosa(sweet)Nakai)又称楙、贴梗木瓜、贴梗海棠、铁脚梨等,是蔷薇科木瓜属植物,在安徽、浙江、陕西、甘肃、广东、云贵川及缅甸等均有分布,为常见的栽培及药用植物,花色有乳白色、粉红色、大红色且有重瓣及半重瓣品种,早春先花后叶[1]。皱皮木瓜含有大量的有机酸、三萜类、黄酮类化合物、熊果酸、多糖及超氧化物歧化酶(SOD)等成分,被稱为“百益之果”,是一种药食同源的植物[2]。中医认为木瓜味酸性温,入肝、脾经,有健脾开胃、去湿舒筋之功效,药理学上认为这些物质具有抗癌、抑制肿瘤、抗炎杀菌、抗氧化等功效[3]。
目前对于皱皮木瓜的研究多集中在栽培技术[4]和药用价值[5]方面,对其活性物质的研究包括对皂苷、熊果酸、齐墩果酸及有机酸等物质的提纯技术及功能效果方面[6-7];仅少量学者报道了皱皮木瓜中黄酮类物质的提纯方法及总黄酮含量,指出了由于皱皮木瓜分布区的差异,其含有的总黄酮含量也不尽相同[8-9],对木瓜中黄酮类物质的提取工艺优化的研究还鲜见报道。黄酮类化合物的传统提取方法主要包括水提法、溶剂萃取法、树脂吸附法等,近年来国内外新开发的提取方法有超声辅助提取法[10]、超临界流体萃取法[11]、微波萃取法[12]、酶提取法[13]等,其中超声辅助提取法具有用时短、成本低、提取率高、无试剂残留污染环境等优点[14],它亦可结合其他提取方式共同使用,是一种广泛应用的有极大发展前景的物质提取方式。为发掘皱皮木瓜叶片的潜在利用价值,减少枯枝败叶对环境造成的污染和压力,该试验采用Box-Behnken响应面法研究料液比、乙醇浓度、提取温度、提取时间4个因素对总黄酮提取效果的影响,优化超声冷凝回流法提取皱皮木瓜叶片中总黄酮的工艺参数,以期为皱皮木瓜叶片的深度开发利用及其中活性物质的研究提供理论和技术支持。
1 材料与方法
1.1 试验材料
1.1.1 试材。皱皮木瓜春季4月新鲜幼嫩叶片,采自山东省聊城大学植物园,挑选大小、幼嫩程度相似、无病虫害、完整新鲜的叶片。
1.1.2 试剂。
亚硝酸钠、氢氧化钠、九水硝酸铝、芦丁标准品(纯度≥98%),购自天津市大茂化学试剂厂;无水乙醇购自国药集团化学试剂有限公司;所有试剂均为分析纯(AR)。
1.1.3 仪器与设备。
DGX-9053B-1型电热鼓风干燥箱,上海优浦科学仪器有限公司;
仙桃xt-200型高速多功能粉碎机,浙江省永康市红太阳机电有限公司;
FA1004电子分析天平,上海越平科学仪器有限公司;
SB-4200 DTD数控加热超声波清洗机,宁波新芝生物科技股份有限公司;
SHK-Ⅲ循环水式多用真空泵,郑州科泰实验设备有限公司;
UV紫外可见分光光度计,上海佑科仪器仪表有限公司。
1.2 试验方法
1.2.1 试验材料的处理。
将采摘的新鲜皱皮木瓜叶片洗净晾干,放于70 ℃烘干箱中恒温烘干至恒重,后用粉碎机粉碎、过筛得粉末,储存于干燥袋中于4 ℃冰箱密封保存备用。
1.2.2 芦丁标准曲线建立。
根据卞京军等[15]的方法稍作改良建立标准曲线。以芦丁作为标准品,精确称取1 g样品,60%乙醇500 mL溶解,并用60%乙醇定容至1 000 mL,得浓度为1 mg/mL的芦丁标准溶液。取6支试管,分别加入 0、0.2、0.4、0.6、0.8、1.0 mL 标准溶液,之后加入60%乙醇至体积为1 mL,先加入10%亚硝酸钠溶液0.5 mL,振荡摇匀并静置5 min,之后加入10%硝酸铝溶液0.5 mL,振荡并摇匀,静置5 min,最后加入4%氢氧化钠溶液4 mL,振荡并摇匀,静置10 min,以第一管为空白对照,测定510 nm处的吸光度,以吸光度为纵坐标(y)、芦丁质量浓度为横坐标(x)建立芦丁标准曲线。
1.2.3 总黄酮提取及含量测定。
准确称量木瓜粉末1 g于圆底烧瓶中,分别在不同料液比、乙醇浓度、提取时间、提取温度条件下,遵循单一变量原则进行超声冷凝回流提取。考虑到高温溶剂易挥发导致提取不充分等问题,该研究根据宋璇等[16]的方法稍作改良,在第一次提取结束后,另加入同等体积乙醇进行二次回流提取,合并提取液,定容于100 mL容量瓶,后转移至125 mL棕色广口瓶保存。
采用硝酸铝比色法对总黄酮含量进行测定。取200 μL样品至试管中,对照中加入同体积蒸馏水,各加入800 μL对应体积的乙醇,加10% NaNO2溶液1 mL,振荡摇匀后反应5 min;加10% Al(NO3)3溶液1 mL,振荡摇匀反应5 min;加入4% NaOH溶液5 mL,振荡摇匀反应10 min,测510 nm处的OD值。参照芦丁标准品计算皱皮木瓜中总黄酮含量,求得总黄酮的提取率,计算公式如下:
E=C×V×nm×100%(1)
式中,E为总黄酮提取率(%);C为含有的总黄酮质量浓度(g/mL);V为加入的提取液体积(mL);n为稀释倍数;m为木瓜粉末的质量(g)。
1.2.4 单因素试验。
1.2.4.1 提取温度对总黄酮提取率的影响。
精确称取皱皮木瓜叶片粉末1 g,以料液比1∶50(g∶mL)、乙醇浓度60%、提取时间40 min条件下,提取温度分别为室温(30)、40、50、60、70 ℃进行回流提取,计算总黄酮提取率,重复3次。
1.2.4.2 提取时间对总黄酮提取率的影响。
精确称取皱皮木瓜叶片粉末1 g,以料液比1∶50、乙醇浓度60%、提取温度50 ℃条件下,提取时间分别为20、30、40、50、60 min进行回流提取,计算总黄酮提取率,重复3次。
1.2.4.3 料液比对总黄酮提取率的影响。
精确称取皱皮木瓜叶片粉末1 g,以乙醇浓度60%、提取时间40 min、提取温度50 ℃条件下,料液比分别为1∶30、1∶40、 1∶50、1∶60、1∶70进行回流提取,计算总黄酮提取率,重复3次。
1.2.4.4 乙醇浓度对总黄酮提取率的影响。
精确称取皱皮木瓜叶片粉末1 g,以料液比1∶50 、提取时间40 min、提取温度50 ℃条件下,乙醇浓度分别为50%、60%、70%、80%、90%进行回流提取,计算总黄酮提取率,重复3次。
1.2.5 响应面优化试验设计。
根据单因素试验的结果,且由于试验材料采集时间原因,选取3因素3水平的响应面分析法对超声辅助提取工艺进行优化,以料液比、乙醇浓度、提取时间3个因素为自变量,以总黄酮提取率为响应值,将获得
数据导入软件Design-Expert,以其中的Box-Behnken设计原理得到17组试验设计,分析多因素交互作用,优化提取条件,建立回归模型,最后确定最佳提取参数及验证试验分析。
2 结果与分析
2.1 建立芦丁标准曲线
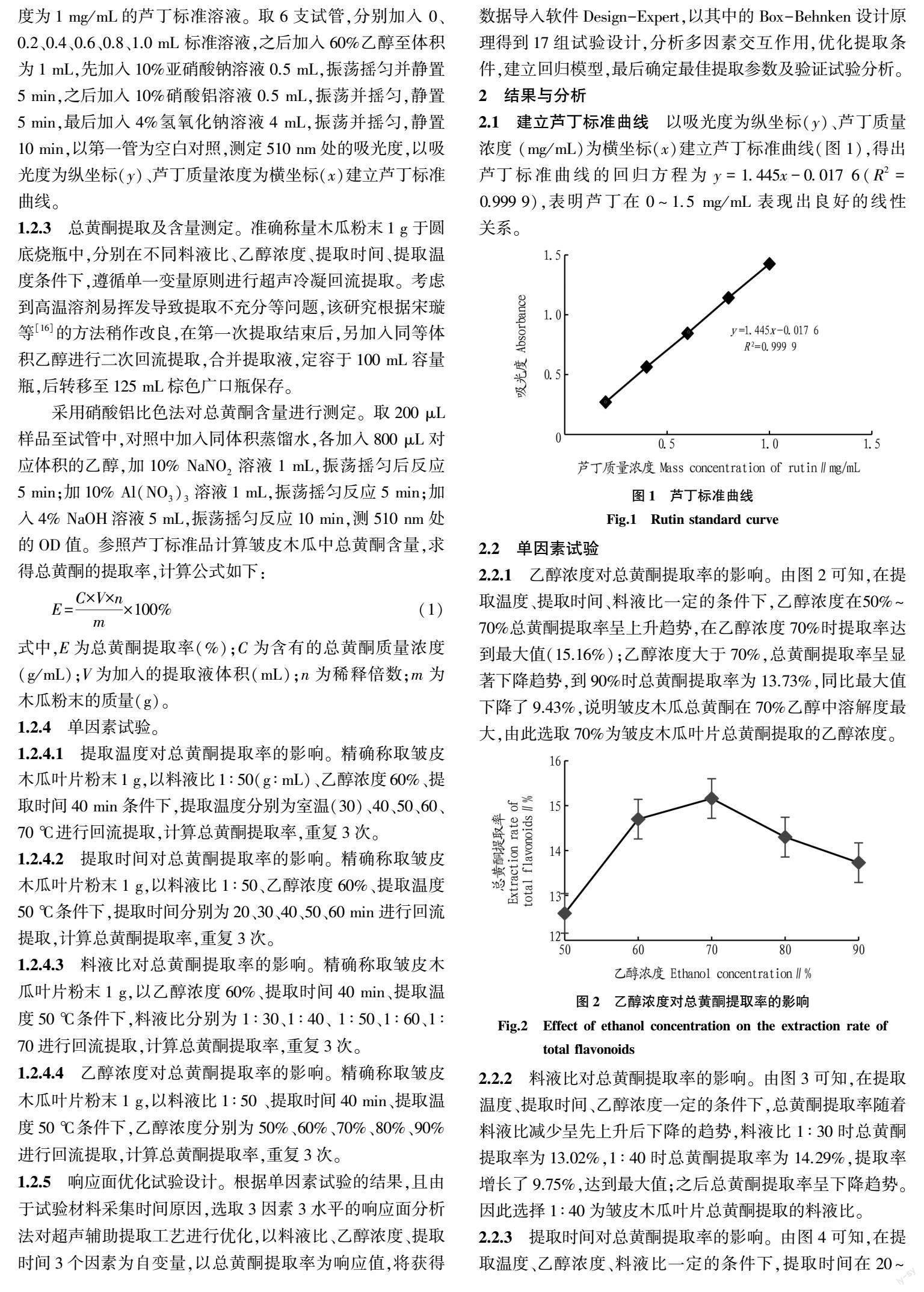
以吸光度为纵坐标(y)、芦丁质量浓度 (mg/mL)为横坐标(x)建立芦丁标准曲线(图1),得出芦丁标准曲线的回归方程为y=1.445x-0.017 6(R2=0.999 9),表明芦丁在0~1.5 mg/mL表现出良好的线性关系。
2.2 单因素试验
2.2.1 乙醇浓度对总黄酮提取率的影响。
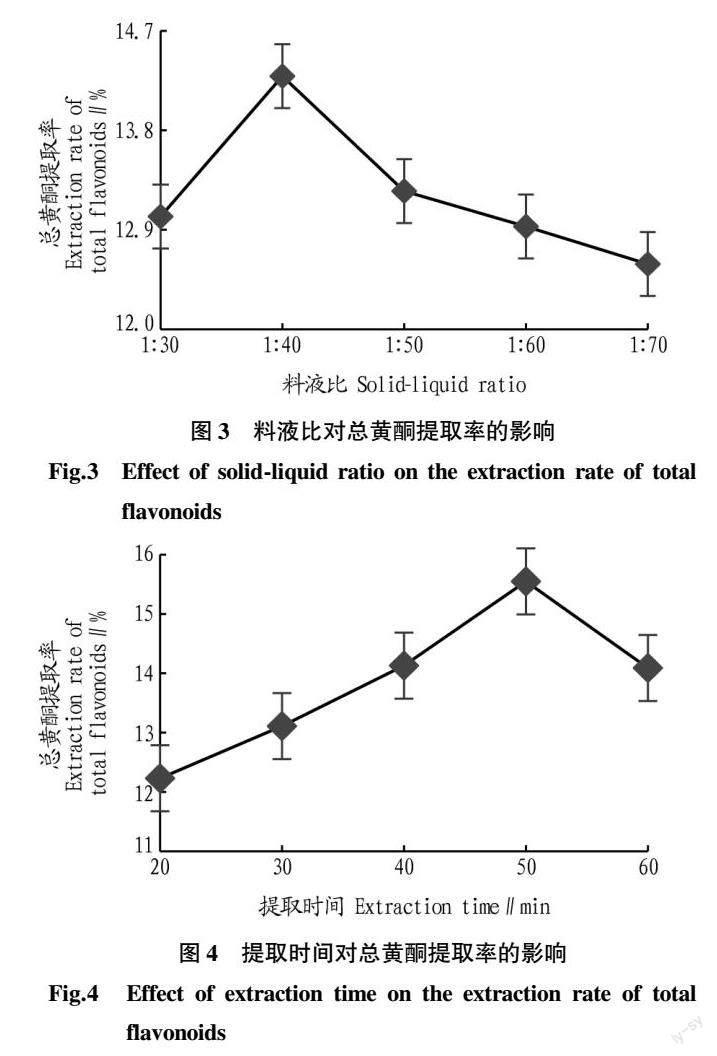
由图2可知,在提取温度、提取时间、料液比一定的条件下,乙醇浓度在50%~70%总黄酮提取率呈上升趋势,在乙醇浓度70%时提取率达到最大值(15.16%);乙醇浓度大于70%,总黄酮提取率呈显著下降趋势,到90%时总黄酮提取率为13.73%,同比最大值下降了9.43%,说明皱皮木瓜总黄酮在70%乙醇中溶解度最大,由此选取70%为皱皮木瓜叶片总黄酮提取的乙醇浓度。
2.2.2 料液比对总黄酮提取率的影响。
由图3可知,在提取温度、提取时间、乙醇浓度一定的条件下,总黄酮提取率随着料液比减少呈先上升后下降的趋势,料液比1∶30时总黄酮提取率为13.02%,1∶40时总黄酮提取率为14.29%,提取率增长了9.75%,达到最大值;之后总黄酮提取率呈下降趋势。因此选择1∶40为皱皮木瓜叶片总黃酮提取的料液比。
2.2.3 提取時间对总黄酮提取率的影响。
由图4可知,在提取温度、乙醇浓度、料液比一定的条件下,提取时间在20~50 min,总黄酮提取率先平缓后急剧增加,提取时间50 min时总黄酮提取率达到最高值,为15.55%;随着提取时间延长,总黄酮提取率急剧下降,60 min时,总黄酮提取率为14.09%。结果表明随着提取时间的增加,总黄酮提取率提高,当时间超过一定限值后总黄酮提取率下降,在工业生产中延长提取时间会增加生产成本和消耗,为节约时间和经济成本,选择50 min为皱皮木瓜叶片总黄酮提取时间。
2.2.4 提取温度对总黄酮提取率的影响。
由图5可知,在乙醇浓度、提取时间、料液比一定的条件下,提取温度低于40 ℃,随着提取温度的增加总黄酮提取率逐渐增加;提取温度40 ℃时总黄酮提取率达到峰值,为16.01%;高于40 ℃后总黄酮提取率呈急速下降趋势。结果表明随着提取温度的增加,总黄酮提取率提高,而当温度超过一定限值后总黄酮提取率下降,可能是由于温度过高导致部分黄酮类化合物结构遭到破坏或是达到溶剂沸点后溶剂挥发损失,最终导致总黄酮提取率降低,因此选取40 ℃为皱皮木瓜叶片总黄酮提取温度。
2.3 响应面试验
根据单因素试验结果,对影响皱皮木瓜叶片总黄酮提取率的不同因素(料液比、提取时间、乙醇浓度)进行Box-Behnken试验设计,表1为不同因素及水平组合条件下皱皮木瓜叶片总黄酮提取率,结果表明,提取时间50 min、乙醇浓度70%、料液比1∶40时,皱皮木瓜叶片总黄酮提取率最高,为15.77%。
以Design Expert 8.05软件对表1数据进行统计分析,建立料液比(A)、提取时间(B)、乙醇浓度(C)3个因素与皱皮木瓜叶片总黄酮提取率 (Y) 的二次回归方程:Y=15.74+0.036A+0.059B+0.045C-0.010AB+0.018AC-0.012BC-0.220A2-0.130B2-0.060C2(R2=0.999 4)。
方差分析(表2)显示,模型显著而失拟项不显著,说明试验误差小,具有统计学意义;决定系数(R2)大于0.9,说明模型具有较高的拟合度,可用于皱皮木瓜叶片总黄酮提取的条件优化。
回归模型显著性检验结果(表2)表明,模型中料液比(A)不显著(P>0.05),提取时间(B)、乙醇浓度(C)均显著(P<0.05),表明料液比对皱皮木瓜叶片总黄酮提取率的影响不显著,提取时间、乙醇浓度对提取率的影响显著;A2、B2表现为极显著(P<0.01),C2表现为显著(P<0.05),说明乙醇浓度、料液比、提取时间对皱皮木瓜叶片总黄酮提取率的影响是较为复杂的二次关系,影响顺序为提取时间>乙醇浓度>料液比。
2.4 响应面多因素交互作用分析
由图6~8可知,在料液比、提取时间、乙醇浓度两两因素一定的条件下,总黄酮提取率都随着第3个因素的增大而先上升后下降。料液比和提取时间的等高线形状偏圆形,说明两者交互作用较缓和;乙醇浓度与料液比的等高线呈椭圆形,表明两者交互作用显著;乙醇浓度和提取时间的等高线呈椭圆形,表明两者交互作用显著。
从响应面的3D图可知,料液比和提取时间、料液比和乙醇浓度、乙醇浓度和提取时间的曲线均较陡,说明两者的交互作用对总黄酮提取率的影响较大。
2.5 总黄酮最佳提取参数的确定及验证性试验
经过分析回归方程,选择Maximize模式对总黄酮提取工艺进行参数优化,得到最优提取总黄酮的条件为提取时间52 min、乙醇浓度73.64%、料液比1∶40.94,此时,皱皮木瓜叶片总黄酮提取率的理论值为15.75%。
为验证回归方程,以提取时间52 min、乙醇浓度74%、料液比1∶41进行皱皮木瓜叶片总黄酮提取率验证试验,进行3组平行试验,回流提取2次,结果发现总黄酮提取率实际均值为15.67%,RSD小于5%,与理论值基本一致,说明Box-Behnken响应面优化设计得到的各因素水平条件组合比较可靠,可以用于实际操作以及优化提取参数。
3 结论与讨论
前人研究报道,一般皱皮木瓜果实总黄酮含量在6~40 mg/g[17],皱皮木瓜皮渣总黄酮得率为0.2%~0.5%[15]。唐浩国[18]研究表明,超声波具有空化作用,该作用可加速植物有效成分溶解出来,进而提高活性成分的提取率。该研究利用超声冷凝回流提取法提取皱皮木瓜叶片中总黄酮,结合二次回流提取并利用Box-Behnken响应面试验设计对提取条件进行优化,结果表明在提取时间52 min、乙醇浓度74%、料液比1∶41条件下总黄酮得率最高,总黄酮提取率达到15.67%,总黄酮含量为156.65 mg/g,比文献报道的总黄酮得率显著提高[19-22]。究其原因,或是由于采样时间处于春季,叶片较嫩,总黄酮含量更高,且一次提取后又加入溶剂进行了二次回流,补充了溶剂,保证总黄酮的大部分能够提取出来。由此可见,Box-Behnken响应面法优化及二次回流的应用使得总黄酮提取率更高。该研究结果最大程度提高了皱皮木瓜叶片总黄酮得率,证明了以响应面法优化提取皱皮木瓜叶片总黄酮工艺的可行性,充分挖掘出木瓜的潜在利用价值,在控制成本、提高效率、保护环境、减少污染方面有着巨大的优势,从而实现了皱皮木瓜原料更为高效利用,为扩大皱皮木瓜工业生产及产品的开发利用提供了可靠依据。
参考文献
[1] 中国科学院中国植物志编辑委员会.中国植物志:第36卷[M].北京:科学出版社,1974:400-402.
[2] 陈红,王关祥,郑林,等.木瓜属(贴梗海棠)品种分类的研究历史与现状[J].山东林业科技,2006,36(5):70-71,78.
[3] 国家中医药管理局《中华本草》编辑委员会.中华本草:第4卷[M].上海:上海科学技术出版社,1999:111.
[4] 郭建全,刘春华,黄金铭,等.皱皮木瓜栽培技术要点[J].江西农业,2019(12):15.
[5] 程翔.皱皮木瓜均一多糖的分离纯化、结构鉴定及抗肿瘤活性研究[D].上海:上海中医药大学,2019
[6] 刘世尧.不同产区皱皮木瓜有机酸组成及主要活性成分分离纯化研究[D].重庆:西南大学,2012.
[7] 王志芳.皱皮木瓜中齐墩果酸和熊果酸测定、提取及抗肿瘤活性研究[D].武汉:华中农业大学,2006.
[8] 王文平,蒋朝晖.木瓜中总黄酮的提取分离及含量测定[J].食品工业科技,2004,25(3):81-82.
[9] 李娜,姜洪芳,金敬宏,等.不同采收期的宣木瓜总黄酮含量分析[J].食品研究与开发,2011,32(2):112-114.
[10] 周胜男,褚翠翠,陆宁.食用仙人掌中黄酮类物质的提取研究[J].食品工业科技,2008,29(2):228-230.
[11] DUGO P,MONDELLO L,DUGO G,et al.Rapid analysis of polymethoxylated flavones from citrus oils by supercritical fluid chromatography[J].Journal of agricultural and food chemisry,1996,44(12):3900-3905.
[12] 孙萍,李艳,成玉怀.甘草总黄酮的微波提取及含量测定[J].时珍国医国药,2003,14(5):266-267.
[13] WU M L,ZHOU C S,CHEN L S,et al.Study on the extraction of total flavonoids from Gingoleaves by enzyme hydrolysis [J].Natural product research and development,2004,16(6):557-560.
[14] 代彩玲,王萍,王静,等.籽瓜瓜皮果胶提取方法的优化与评价[J].中国瓜菜,2018,31(10):13-18.
[15] 卞京军,程密密,刘世尧,等.皱皮木瓜皮渣齐墩果酸、熊果酸和总黄酮连续提取工艺研究[J].西南大学学报(自然科学版),2015,37(3):158-165.
[16] 宋璇,王汝华,于建丽,等.山楂叶黄酮分离纯化及抗氧化活性[J].食品研究与开发,2022,43(4):57-63.
[17] 郑璇,申国明,高林,等.不同产区皱皮木瓜总黄酮含量与土壤主要化学指标的关系[J].江苏农业科学,2018,46(17):202-205.
[18] 唐浩国.黄酮类化合物研究[M].北京:科学出版社,2009:64-65.
[19] 王有为,何敬胜,范建伟,等.木瓜道地起源与道地产区形成研究[C]//中國中西医结合学会中药专业委员会.2009年全国中药学术研讨会论文集.北京:中国中西医结合学会,2009:163-168.
[20] 郭锡勇,唐修静,郭莉莉.木瓜不同炮制品中总黄酮含量测定[J].贵阳中医学院学报,2000,22(4):61-62.
[21] 陈翠,熊德琴,李春晖.木瓜中总黄酮提取最佳工艺的研究[J].广东石油化工学院学报,2012,22(1):15-17,25.
[22] 严睿文,丁毅.宣木瓜中黄酮的提取分离及含量的测定[J].生物学杂志,2008,25(3):62-64.
