3D 打印器官源脱细胞外基质血管支持补片重建腹壁的组织工程方法
2023-06-11张海光胡庆夕
张海光, 汪 辉, 胡庆夕
(上海大学机电工程与自动化学院快速制造工程中心, 上海 200444)
腹壁缺损如切口疝是外科手术中最常见的问题之一, 对腹壁缺损的治疗也有不同的方法[1]. 生物材料, 特别是不可吸收的生物材料, 常用于疝修补. 聚丙烯、聚四氟乙烯、聚乳酸(polylactic acid, PLA) 等高分子材料具有优异的力学性能[2]. 然而, 由于感染(2%∼3%)、肠瘘(1%∼2%) 和肠梗阻(2%∼5%) 等并发症的风险, 这些高分子材料容易导致伤口的感染或污染[3]. 此外, 由于植入物缺乏组织再生, 一些患者需要再次手术来解决缺损的复发[4].
生物来源的生物材料因具有良好的生物相容性和组织再生性能而被广泛应用于组织重建. 猪小肠黏膜下层(porcine small intestinal submucosa, PSIS) 是目前常用的生物补片支架, 其优点是具有较好的生物性能, 缺点是力学性能较差, 易发生组织粘连. 脱细胞真皮基质(acellular dermal matrix, ADM) 是一种具有良好生物相容性和力学性能的胶原样细胞外基质材料[5-9], 不同形式的脱细胞真皮基质已被广泛应用于烧伤、整形外科、创伤修复等方面[10-12].然而, ADM 表面结构致密, 植入后血管和新组织难以生长, 随着材料的降解, 机械强度降低,导致疝复发. 因此, 不能单独使用ADM 来修复大块的腹壁缺损[13-15].
3D 打印作为一种新型制造技术, 能够借助计算机辅助绘图(computer aided drafting,CAD) 和计算机辅助制造(computer aided manufacturing, CAM) 软件对组织工程支架的空间形状和特性进行精确控制和设计[16-18]. 值得注意的是, 3D 打印的应用可以在很大程度上减少材料的浪费, 并根据体内缺陷的不同结构制备出合适形状的组织工程支架[19-21]. 孔径和纤维直径的控制对于3D 空间支架非常重要. 已有研究发现, 孔径大小在细胞黏附、分化、迁移和新组织形成中起着重要作用[22-24].
基于以上观点, 本工作尝试利用ADM-PLA-ADM 制备适合腹壁缺损重建的3D 打印血管支持补片. 测试了3D 打印补片的物理和机械性能、体外细胞培养条件下的细胞响应性能以及体内条件下的组织再生性能.
1 材料和方法
1.1 3D 打印ADM-PLA-ADM 生物补片支架
ADM 粉(江苏联合生物医药有限公司, 中国) 与冰醋酸(Sigma, 美国) 以1∶10 的质量体积比充分混合(见图1(a)). 用3D 打印机(上海先锋电子科技有限公司, 中国) 打印混合溶液. 将混合溶液在室温下从23 号针的注射器中挤出, 气压泵的挤出压力保持在4 MPa.接收平台在G-code 命令开发的运动控制程序下沿着规定的路径移动. ADM 层的制作工艺如图1(b)∼(c) 所示.
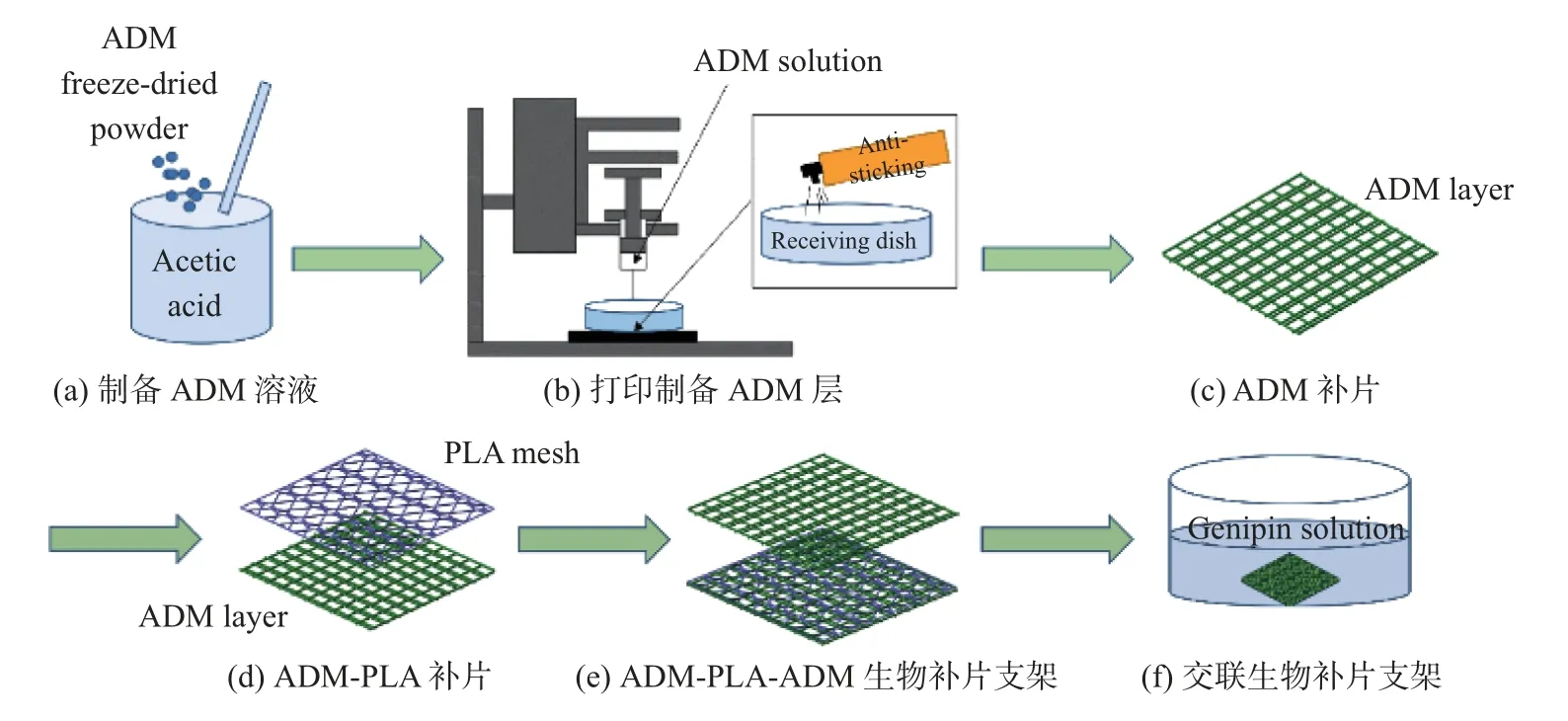
图1 制备多层ADM-PLA-ADM 生物补片支架示意图Fig.1 Schematic diagram of manufacturing multi-layer ADM-PLA-ADM biological mesh scaffold
ADM 层打印完成后, 将商用PLA 编织网放置在ADM 层上(见图1(d)), 然后在PLA 编织网上再打印一层ADM, 形成多层补片. 最后, 将多层补片从接收平台移出, 置于京尼平溶液中. 京尼平溶液(MedChem Express, 美国) 作为交联剂溶于去离子水中配置成浓度为0.625%的交联溶液. ADM-PLA-ADM 生物补片支架的制作过程如图1(e) 所示. 将所制备的支架在室温下放置20 min, 然后在4◦C 下放置交联完成12 h (见图1(f)).
本工作选取临床常用的PSIS 补片和PLA 补片作为对照样本, 与所制备的ADM-PLAADM 生物补片支架的特性进行比较.
1.2 机械性能
为了探究所制备的ADM-PLA-ADM 生物补片支架的力学性能, 记录每个样品从测试开始到完全断裂点的轴向力学数据. 使用WDW-1 材料试验机(中国松盾机械设备有限公司) 对每个样件以0.5 mm/min 的恒定速度进行测试, 直至补片断裂, 上下夹距为10 mm. 两种样品的尺寸均为30 mm×10 mm. 用足够强度的缝线在距离边缘2 mm 的短端穿过补片, 缝线另一端固定在夹具上. 每组测试6 个样品, 记录样品被缝线破坏时的缝合强度.
1.3 接触角测量
ADM-PLA-ADM 生物补片支架的亲水性由接触角测角仪(中国承德试验机厂) 测量. 用微注射器在补片表面加入5 µL 蒸馏水, 分别在沉积后0 s 和60 s 记录ADM 层表面的水接触角. 每种样品重复测试6 次. 用测角仪对接触角进行直接显微测量.
1.4 降解特性
通过监测ADM-PLA-ADM 生物补片支架在RPMI 1640 介质(Thermo Fisher, 美国)、磷酸盐缓冲溶液(phosphate buffered solution, PBS) (GE Healthcare, 美国) 和人工血浆(artificial plasma, AP) (湖州InnoReAgents 生物技术有限公司, 中国) 中浸泡前后的重量变化来测试3D 打印补片的降解性能. 首先, 对ADM-PLA-ADM 生物补片支架、PLA 补片和PSIS 补片进行称重; 然后, 将称重的样品放在37◦C 的二氧化碳温箱中孵化, 直到设定的时间.在每个降解阶段取出标本, 用蒸馏水彻底清洗并干燥. 试验组和对照组在真空干燥后称量支架重量(每组n=3 个), 并记录支架重量.
1.5 细胞毒性
研究大鼠肌原细胞(L6, 中国科学院捐赠) 在多生物补片支架和对照样品上的增殖情况.采用CCK-8 试剂(Sigma, 美国) 测量ADM-PLA-ADM 生物补片支架、PLA 补片和PSIS 补片在不同时间点(1、3、5 d) 的细胞毒性. 将样品(20 mm×20 mm) 浸泡在含10% 胎牛血清和1% 青霉素链霉素培养基中, 在培养箱中摇动24 h, 之后收集释放的培养基.
成纤维细胞在100 µL 培养基中以2 000 细胞/孔的密度培养. 在37◦C 的5% CO2培养箱中培养24 h 后, 用释放的培养基替换成纤维细胞培养基. 再培养24 h 后, 每孔加入10 µL CCK-8 溶液, 用96 孔板再孵育1.5 h. 用微板阅读器(Infinite 200 Pro, Tecan Group Ltd., 瑞士) 在450 nm 处用荧光法测定吸光度.
1.6 动物实验
雄性SD 大鼠6 只(200 g, 上海交通大学医学院附属上海第九人民医院动物实验中心), 吸入异氟醚, 麻醉后消毒腹壁, 在腹壁中部造25 mm×25 mm 的腹壁肌肉组织缺损. 选择PLA补片作为对照组, 使用ADM-PLA-ADM 生物补片支架进行桥接修复, 修复后闭合皮肤. 4 周后处死大鼠, 观察腹壁修复及腹壁粘连情况[25].
1.7 统计分析
采用Origin 2017 软件进行统计分析. 所有数据均以均数± 标准差(standard deviation,SD) 表示, 并采用单因素方差分析(analysis of variance, ANOVA), 以确定哪些群体存在显著差异. 当p<0.05 时, 认为差异有统计学意义.
2 实验结果
2.1 3D 打印补片的形貌特征
本工作制备的ADM-PLA-ADM 生物补片支架的形态如图2 所示. 支架的多孔结构使支架内的微观结构更加丰富多样(见图2(b)), 这可以促进培养液的灌流, 维持较高的细胞存活率. ADM 层的表面比PLA 支架表面粗糙得多(见图2(c)), 这有利于细胞附着和增殖. 复合材料支架的横断面图像显示了多层结构, 层与层之间没有空隙(见图2(d)), 这证明采用本工作提出的方法制备具有结构稳定、粘连层充足的复合材料支架的可行性. 根据ADM 层表面和内部的扫描电子显微镜图片, 利用Origin 软件定量测量支撑材料中的纤维直径和孔径. 结果表明, 3D 打印工艺制备的ADM 层的纤维直径和孔径分布具有以下特点: 大约80% 的ADM 纤维直径在300∼360 µm 之间, 92% 的孔洞直径在300∼500 µm 之间, 这可能有利于细胞附着增殖[26-27].

图2 3D 打印生物补片支架形貌特征图Fig.2 3D printing biological mesh scaffold morphology feature map
2.2 机械性能
ADM-PLA-ADM 生物补片支架的缝合和拉伸性能是临床组织重建的关键参数. 良好的缝合强度保证了支架植入后不会与自体组织分离, 也保证了支架在初始阶段的稳定性. 采用载荷-位移曲线和应力-应变曲线来确定试样的力学性能, 结果如图3 所示. 由图可知, 由于ADM-PLA-ADM 补片支架的横截面积较大, 使得其应力小于其他补片, 平均缝合载荷为18.05 N, 可以满足临床公认的抗拉强度标准[28].

图3 支架力学性能测试结果Fig.3 Mechanical property test results of support
2.3 接触角测量
图4 为液滴在沉积时刻的瞬间形态. 由于ADM-PLA-ADM 生物补片支架孔隙率大,接触角为0◦, 沉积0 s 后ADM 层的平均接触角为61◦±4◦, 沉积60 s 后降为42◦±6◦. PSIS 补片沉积0 s 后平均接触角为78◦±3◦, 沉积60 s 后平均接触角为58◦±5◦. PLA 补片沉积0 s 后平均接触角为113◦±3◦, 沉积60 s 后平均接触角为111◦±4◦. 接触角越小, 亲水性越好, 上述结果证实了ADM 材料的亲水性优于PSIS 材料, 进一步证明ADM 层可能更适合细胞附着[8].

图4 液滴在支架上的沉积瞬间形态Fig.4 Instantaneous morphology of droplet deposition on the support
2.4 降解特性
在1640 培养基(culture medium, CM)、磷酸盐缓冲溶液(PBS) 和人工血浆(AP) 的培养过程中, ADM-PLA-ADM 生物补片支架和对照样品的降解率基本相同(见图5). 生物补片支架的降解率略高于PSIS 补片, 这是因为生物补片支架具有较高的比表面积和更多的互相连通的孔隙结构. 30 d 内, PLA 补片的质量没有明显变化, 说明PLA 补片的降解性较差. 在前14 d, 生物补片支架在AP 中的降解曲线较为平坦. 而在14∼21 d, 生物补片支架在CM、PBS和AP 中的降解趋势基本相同, 都发生了较大变化, 说明在这一阶段生物补片支架外层中的ADM 发生了大量降解, 体现了较好的生物相容性, 有助于在植入前期促进细胞的增殖、长入以及加快组织修复的速度. 在21 d 后, 生物补片支架的降解速率逐渐趋于平稳, 同时后期腹壁组织的再生将伴随生物补片支架的缓慢降解, 这会保证生物补片支架植入体内后, 在完成组织修复前不会完全降解, 说明其降解率基本满足现有商用支架性能的要求[13-14].
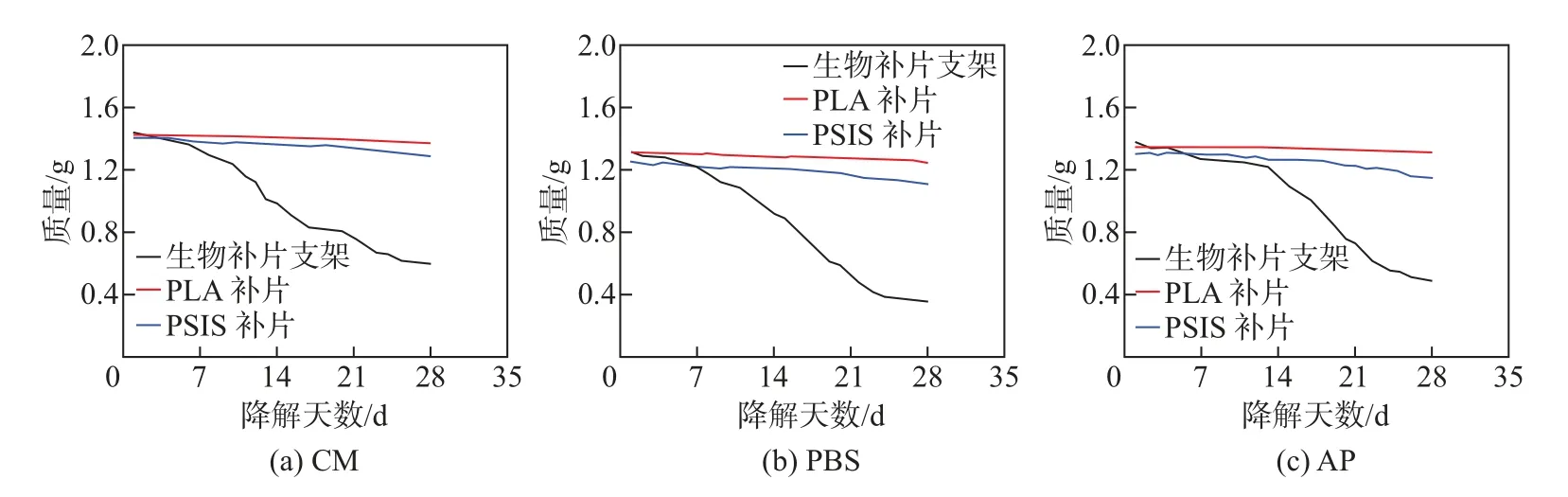
图5 各支架在不同溶液中的质量变化曲线Fig.5 Mass change curve of each support in different solutions
2.5 细胞毒性
用CCK-8 进行细胞毒性测定, 实验结果如图6 所示. ADM-PLA-ADM 生物补片支架组第1、3、5 d 的吸光度(optical density,OD)值(450 nm 处) 分别为0.984±0.052、2.749±0.213、3.523±0.284. PLA 组第1、3、5 d 的OD 值分别为0.969±0.035、2.589±0.126、3.353±0.285.对照组第1、3、5 d 的OD 值分别为0.942±0.065、2.520±0.292、3.470±0.252. 由实验数据可以看出, ADM-PLA-ADM 生物补片支架、PLA 支架和对照组样品在第1、3、5 d 无显著差异(p>0.05), 说明所制备的支架对细胞无毒. 第3 d 后, 生物补片支架上的细胞存活率逐渐高于PLA 补片组和对照组.
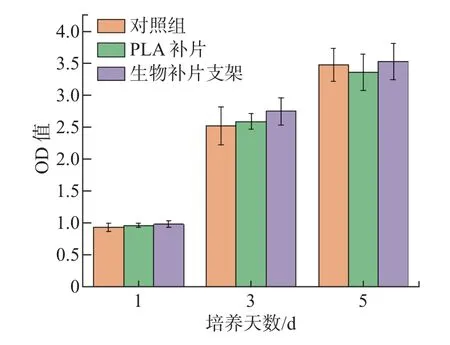
图6 细胞毒性测试结果Fig.6 Cytotoxicity test results
2.6 动物研究
实验中, 植入后4 周, 所有大鼠均未出现肠瘘复发等并发症(见图7), 对照组(见图7(a))和多层复合补片组(见图7(b)) 缺损区域皮下组织修复良好(见图7(a) 和(b) 中黑色箭头所指), 未见感染、血清肿、血肿等情况. 腹部表面观察, ADM-PLA-ADM 生物补片支架修复良好, 覆盖组织完整(见图7(c)), 对照组PLA 补片粘连较为严重(见图7(d)), 生物补片支架组粘连较少(见图7(e)), 平均粘连评分为3.0±1.1. 苏木精-伊红(hematoxylin-eosin, HE) 染色图(见图8) 中, 红色箭头所指为PLA 补片, 蓝色箭头所指为周围炎性组织, 绿色箭头所指为ADM 材料及其中新生的血管组织. 可以发现生物补片支架的HE 染色结果(见图8(a)) 显示其周围炎性细胞包裹明显较少, ADM 材料内已经可见新生血管长入. 而对照组PLA 补片的HE 染色结果(见图8(b)) 显示其补片周围炎性包裹较为严重, 组织结构紊乱, 未见新生血管.

图7 补片植入28 d 时的修复情况Fig.7 Repair condition at 28 days after mesh implantation

图8 HE 染色显微镜切片Fig.8 HE staining microscope sections
3 讨 论
腹壁重建的组织工程方法往往要求修复支架在植入时必须对细胞和组织有响应, 才能有效、快速地使腹壁缺损愈合. 尽管有多种生物材料和制造技术可用于组织支架的制作, 但器官来源的脱细胞基质因其结构和生物相容性而被认为是一种良好的来源材料, 而3D 打印最近被认为是用于组织工程应用的最先进的支架制造技术之一, 特别是腹壁重建.
本工作利用3D 打印技术, 结合生物源性生物材料(ADM) 和合成源性生物材料(PLA),制备适合组织重建的生物补片支架. 与临床手术中常用的PSIS 补片和PLA 补片相比, 3D 打印生物补片支架具有更加多样化的空间结构. 这些结构具有孔隙尺寸多样、通道结构复杂、机械强度强、生物相容性好等特点, 使得制备出的生物补片支架在临床组织器官研究中具有很大的潜力. 此外, 3D 打印工艺制备的支架结构尺寸相对均匀, 不仅简化了制备工艺, 而且可以保证支架的纤维直径和孔径. 较多的300∼500 µm 孔径能刺激细胞表现出更好的活性, 实现更好的生长和增殖, 适合组织构建和修复[23].
ADM 具有良好的生物相容性, 已被广泛应用于支架材料的制备. 此外, ADM 制备的支架在体内外均表现出较高的生物稳定性和小孔隙的特点, 能够支持细胞的增殖和生长[9]. 利用ADM 粉末, 借助3D 打印技术, 可以制作出具有复杂结构的组织工程支架. 本工作所制备的生物补片支架的显微镜图像显示了打印纤维的空间结构和粗糙表面(见图2), 表明所提出的制备方法具备可行性. CCK-8 测量结果表明, 3D 打印ADM-PLA-ADM 生物补片支架在制备过程中没有产生细胞毒性, 京尼平交联剂也没有产生新的细胞毒性.
但目前重建的ADM 层仍存在机械强度较弱等问题. 力学性能在组织工程中起着重要作用, 如果支架在完全降解前具有足够的机械强度防止疝的发生, 则会显著降低疝复发率. 因此,本工作采用PLA 补片来提高生物补片支架的机械强度. PLA 补片已广泛应用于腹壁再生领域, 考虑到PLA 补片在应用过程中可能会发生粘连现象, 可以将其放置在两个生物相容性好的ADM 层之间, 形成通道结构复杂、力学性能优异的生物补片支架. 通过实验研究发现, 生物补片支架在补片修复过程中粘连较为轻微, 缝合载荷值为18.05 N(见图3), 基本可以满足腹壁修复补片的缝合强度[28]. 应用生物补片支架修复大鼠腹壁缺损模型, 4 周后所有大鼠均未复发, 生物补片支架具有相对稳定的机械强度. 这些结果清楚地表明, 所制备的生物补片支架具有适合组织再生的力学性能.
支架植入后的降解也是组织再生成功的关键因素. 如图5 所示, ADM-PLA-ADM 生物补片支架的降解率略高于PSIS 补片, 这是因为ADM 具有良好的生物活性, 生物降解能力强.虽然ADM-PLA-ADM 生物补片支架降解速率较快, 但其良好的生物活性可帮助细胞在完全降解前进行重建和繁殖. 根据HE 结果(见图8), ADM-PLA-ADM 生物补片支架植入4 周后腹膜组织完全修复, 腹部表面快速修复导致的粘连较为轻微(见图7). 同时降解的ADM 支架之间可见大量新生血管和纤维组织, 进一步证明富含血管内皮生长因子(vascular endothelial growth factor, VEGF) 等血管因子的ADM 材料可以促进支架内血管生成和组织再生.
4 结束语
本工作利用ADM 和PLA 生物材料, 采用3D 打印技术设计和制造夹层式血管支持补片. 3D 打印ADM-PLA-ADM 生物补片支架的物理和机械性能明显高于对照组PLA 补片和PSIS 补片. CCK-8 实验证明了3D 打印生物补片支架无毒. 动物实验结果表明, 3D 打印ADM-PLA-ADM 生物补片支架具备重建腹壁的能力,且腹壁缺损区域修复良好,无明显感染、血清肿和血肿. 上述实验数据表明, 3D 打印ADM-PLA-ADM 生物补片支架可用于腹壁重建.
