Wnt/β-连环蛋白通路在免疫检查点抑制剂耐药中作用的研究进展
2023-06-11王晨越吴莉沙汤承博
王晨越, 吴莉沙, 汤承博, 王 进, 解 伟,4
(1. 上海理工大学健康科学与工程学院, 上海 200093; 2. 上海健康医学院药学院, 上海 201318;3. 上海健康医学院上海市分子影像学重点实验室, 上海 201318; 4. 上海理工大学研究生院, 上海 200093)
免疫检查点阻断疗法可通过激活或重新激活肿瘤免疫循环治疗癌症, 因此是一种利用免疫系统(如肿瘤特异性细胞毒性T 细胞) 的细胞毒性潜力治疗恶性肿瘤的策略[1], 已经被广泛应用于经手术、放疗、化疗及靶向治疗后的肿瘤患者治疗, 其中以程序性死亡受体1(programmed cell death protein 1,PD-1)及其配体PD-L1 抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitors, ICIs) 在肿瘤免疫治疗中取得了突破性进展, 尤其是在肺癌、肾癌和黑色素瘤的治疗中[2]. 临床数据表明, 可有效响应ICIs 的瘤种较少, 一些常见的癌症类型(如乳腺癌、前列腺癌和结肠癌) 对ICIs 反应率较低, 即使对于反应率相对较高的黑色素瘤,如非小细胞肺癌(non-small cell lung cancer, NSCLC)、膀胱癌等, 随着药物使用时间的延长,大部分患者均不可避免地出现耐药性并伴随肿瘤的复发. 研究表明, 肿瘤浸润T 细胞的缺失会导致ICIs 治疗的失败, 耐药及反应率低[3], 其中以PD-1/PD-L1 抑制剂为代表的ICIs 更是面临肿瘤患者响应率低以及耐药性等问题. 新出现的临床数据显示, 患者对PD-1/PD-L1 治疗的应答率差异较大, 仅有不到20% 的患者会对PD-1/PD-L1 免疫治疗进行有效应答[1]. 肿瘤组织浸润T 细胞的缺失及免疫抑制肿瘤微环境(tumor microenvironment, TME) 可能是制约ICIs 的重要原因, 而肿瘤内源性促癌信号通路会造成非T 细胞浸润(non-T cell-inflamed)TME, 其中Wnt/β-连环蛋白信号通路是最典型和最重要的促癌信号通路. 越来越多的研究表明, 肿瘤Wnt/β-连环蛋白通路的异常激活是免疫治疗失败的原因[1]. 本工作主要探讨以PD-1/PD-L1 和细胞毒性T 淋巴细胞抗原4 (cytotoxic T lymphocyte antigen-4, CTLA-4) 为代表的免疫检查点与Wnt/β-连环蛋白通路的相互关系, 并对联合使用ICIs 与Wnt/β-连环蛋白抑制剂治疗恶性肿瘤的研究进展进行综述.
1 Wnt/β-连环蛋白信号通路与PD-1/PD-L1
目前, PD-1 的配体PD-L1(B7-H1, CD274) 在多种人类癌症(包括乳腺癌、宫颈癌、肺癌、结直肠癌、黑色素瘤等) 中高表达. 肿瘤细胞中PD-L1 的高表达可导致细胞毒性T 细胞功能障碍和耗竭, 从而逃避免疫监视, 阻止肿瘤细胞的清除, 是癌症患者临床不良预后的原因之一[1-2]. 越来越多的证据表明, 肿瘤内源性促癌信号通路的活化或抑瘤基因的缺失均会通过促进T 细胞排斥, 驱动免疫抑制表型从而削弱抗肿瘤免疫应答. 其中Wnt/β-连环蛋白信号通路是最为典型的肿瘤内源性促癌信号通路. Wnt/β-连环蛋白异常激活的肿瘤, 往往伴有T 细胞肿瘤浸润水平低下, 且对ICIs 耐药[4].
1.1 Wnt/β-连环蛋白信号通路调节PD-L1 的表达
Wnt/β-连环蛋白通路可以阻断肿瘤免疫的多个环节, 包括肿瘤抗原释放、抗原提呈、T细胞激活与浸润、肿瘤细胞消除等[3]. Wnt/β-连环蛋白信号通路在阻断肿瘤免疫的过程中可通过转录复合物β-连环蛋白/T 细胞因子/淋巴增强因子(T-cell factor/lymphoid enhancing factor, TCF/LEF) 或转录因子MYC 与PD-L1 的启动子结合进而影响其转录.
PD-L1 的表达与β-连环蛋白-AKT 轴也密切相关. Du[5]等发现在胶质瘤、前列腺癌和肺癌细胞中由Wnt 配体或AKT 介导活化的Wnt/β-连环蛋白信号通路会诱导β-连环蛋白在S552 位的磷酸化和β-连环蛋白的核聚集, 并与肿瘤细胞PD-L1 的表达呈正相关, 但与肿瘤组织CD8+T 细胞的浸润程度呈负相关. 经进一步研究发现, 激活的Wnt/β-连环蛋白信号会促进β-连环蛋白入核, 与转录因子TCF/LEF 形成复合物, 并与CD274 的启动子区域结合, 诱导PD-L1 的表达; β-连环蛋白敲除或AKT 抑制剂会下调肿瘤细胞PD-L1 的表达, 增强肿瘤组织中CD8+T 细胞的浸润和活化. 将经典的Wnt 通路抑制剂或AKT 抑制剂与靶向PD-1/PD-L1 抗体联合用药可以有效克服肿瘤免疫逃逸并显著抑制肿瘤生长.
大规模测序揭示了编码Wnt/β-连环蛋白通路蛋白的基因在许多癌症(如结直肠癌、甲状腺癌、卵巢癌和皮肤癌等) 细胞中频繁突变. 大多数突变会导致β-连环蛋白的异常积累, 这种积累会导致转录复合物β-连环蛋白/TCF/LEF 的形成, 并结合到Wnt 靶基因的启动子上[3].腺瘤样结肠息肉癌蛋白(adenomatous polyosis coli, APC) 功能丧失是结肠癌患者中常见的突变,大约80%的结直肠癌中都存在APC 基因的突变.APC 基因的突变和丢失可以诱导PD-L1的表达, 而β-连环蛋白是APC 诱导PD-L1 所依赖的关键蛋白[6-7]. APC 的缺失会抑制β-连环蛋白降解复合物的形成, 诱导β-连环蛋白的积累及入核, 当β-连环蛋白入核后与TCF4 形成复合物并结合PD-L1 启动子区域, 增强其表达. Cen 等[8]证明了在野生型APC 和β-连环蛋白基因的结直肠癌细胞和正常人结肠上皮细胞中APC 的缺失会通过诱导β-连环蛋白/TCF4复合物的形成并与PD-L1 启动子的TBE3 (−467 至−460) 结合来诱导PD-L1 转录.
转录因子MYC 是Wnt/β-连环蛋白信号通路下游的一个靶点, 调节许多Wnt 相关基因的表达[9]. 癌细胞中Wnt/β-连环蛋白信号通路组分的突变可诱导MYC 过表达, 导致肿瘤的发生和发展. 此外, MYC 过表达也是肿瘤上调免疫检查点表达从而逃避免疫监视的一种普遍机制. MYC 可直接与PD-L1 基因的启动子结合, 调节PD-L1 的表达. 在人肝癌细胞系HEPG2 与肝癌的转基因小鼠模型中, MYC 抑制剂会下调PD-L1 的mRNA 和蛋白质水平.同时, 研究发现, 在人黑色素瘤及NSCLC 细胞中, 使用shRNA 对MYC 敲减或MYC 抑制剂都能降低PD-L1 mRNA 和蛋白的表达, 诱导T 细胞和巨噬细胞在肿瘤病灶的聚集, 增强抗肿瘤免疫应答[10].
多羟基二磷寡糖-蛋白糖基转移酶亚基(STT3) 是诱导PD-L1 所必须的诱导因子. Hsu等[11]发现, 上皮间充质转化(epithelial mesenchymal transition, EMT) 通过EMT/β-连环蛋白/STT3/ PD-L1 信号轴富集了肿瘤干细胞(cancer stem-like cells, CSCs) 中的PD-L1, 其中β-连环蛋白在细胞中异常积累并转移到细胞核中, 激活了STT3 亚型的启动子, 进而转录诱导STT3, 随后STT3 促进PD-L1 糖基化并上调PD-L1. 这项研究还显示, 依托泊苷通过拓扑异构酶ⅡB(topoisomerase ⅡB, TOP2B) 途径减少核β-连环蛋白而抑制EMT/β-连环蛋白/STT3/PD-L1 轴, 逆转EMT, 下调PD-L1 表达, 并提高肿瘤对T 细胞免疫球蛋白黏蛋白-3 (T cell immunoglobulin mucin-3, Tim-3) 抑制剂的敏感性.
另一项关于三阴性乳腺癌(triple negative breast cancer, TNBC) 的研究表明[12], PD-L1高表达肿瘤细胞大多伴有干细胞表型, 并且参与TNBC 相关的免疫逃逸的复杂机制. 在PD-L1 高表达的TNBC 中观察到, Wnt 上游负调控因子的下调和下游效应因子的上调, 且在PD-L1 高表达的TNBC 中, 与PD-L1 低表达的TNBC 相比, Wnt 相关基因的表达显著升高.进一步研究表明, 使用经典Wnt 信号通路特异性抑制剂会下调PD-L1 的表达, 从而有效逆转肿瘤浸润T 细胞的失活状态, 为靶向Wnt/β-连环蛋白通路抑制剂联合PD-1/PD-L1 抑制剂的临床使用提供了依据.
综上, 肿瘤内源性Wnt/β-连环蛋白信号通路的活化会介导β-连环蛋白/TCF/LEF 转录复合物的形成, 并上调下游靶点MYC 的表达, β-连环蛋白/TCF/LEF 及MYC 均可与PD-L1的启动子区域结合, 增强其转录. 另外, β-连环蛋白在细胞中异常积累并转移到细胞核后会诱导STT3 的转录, 而STT3 促进PD-L1 糖基化并上调PD-L1, 从而诱导肿瘤免疫逃逸(见图1).
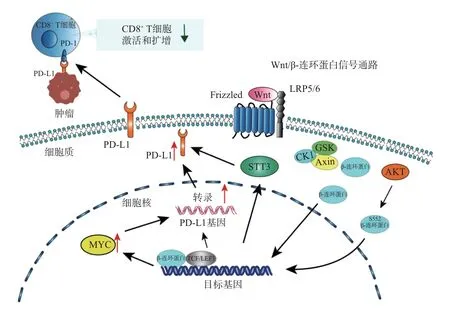
图1 肿瘤内源性Wnt/β-连环蛋白信号通路调控PD-L1 的表达Fig.1 Tumor endogenous Wnt/β-catenin signaling pathway regulates the expression of PD-L1
AKT/Wnt/β-连环蛋白信号通路的激活会诱导MYC 介导的PD-L1 表达上调, 另外β-连环蛋白入核后会通过诱导STT3 转录来上调PD-L1.
1.2 Wnt/β-连环蛋白介导PD-1/PD-L1 抑制剂耐药
Wnt/β-连环蛋白信号通路在阻断肿瘤免疫的过程中除可通过转录复合物β-连环蛋白/TCF/LEF 或转录因子MYC 与PD-L1 的启动子结合影响其转录外, 还可通过Wnt/β-连环蛋白信号通路的激活抑制趋化因子C-C 配体4 (chemokine (C-C motif) ligand 4, CCL4)、树突状细胞(dendriticcell, DC) 的聚集等影响T 细胞的招募, 诱导非T 细胞浸润TME, 进而削弱PD-1/PD-L1 抑制剂的治疗效果(见图2).
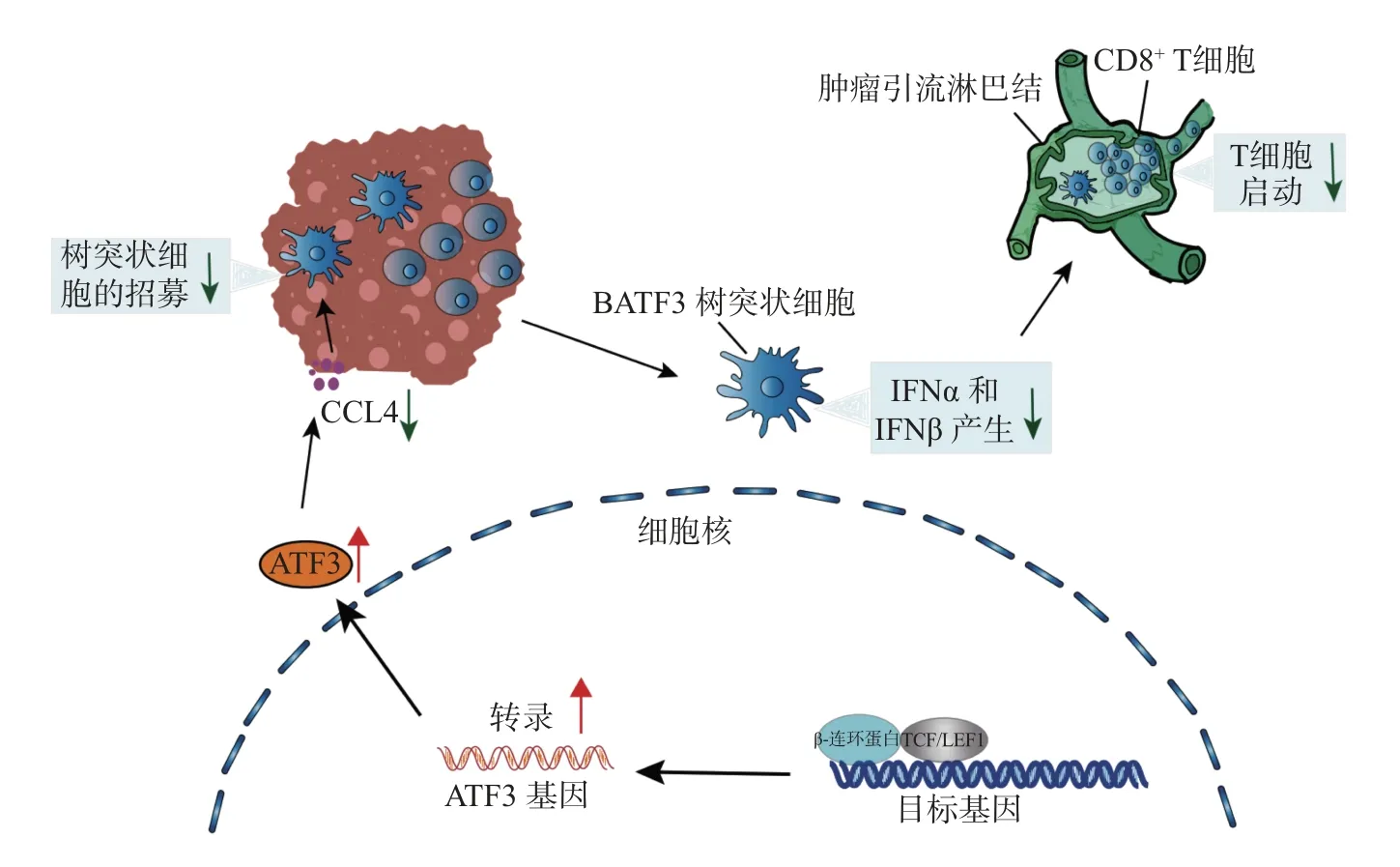
图2 肿瘤内源性Wnt/β-连环蛋白信号通路诱导非T 细胞浸润TMEFig.2 Tumor endogenous Wnt/β-catenin signaling pathway induces non-T cell-inflamed TME
Luke 等[13]通过癌症基因组图谱(the cancer genome atlas, TCGA) 对肝癌、胃癌、膀胱癌、肾癌和肺癌等31 种恶性肿瘤中T 细胞炎症相关基因和Wnt/β-连环蛋白通路分子突变、靶基因及β-连环蛋白蛋白表达水平进行分析, 发现非T 细胞浸润肿瘤组织中的Wnt/β-连环蛋白通路分子突变富集程度是T 细胞浸润肿瘤的3 倍, 90% 瘤种中Wnt/β-连环蛋白信号的活化与T 细胞浸润相关基因表达呈负相关. 同时Trujillo 等[14]在基因工程小鼠模型中发现,Wnt/β-连环蛋白信号活化的黑色素瘤中缺乏肿瘤浸润T 细胞, 这可能是由于特异性DC 未能募集到肿瘤中, 从而影响T 细胞向TME 的募集, 与黑色素瘤患者中观察到的浸润表型相似.
免疫排斥和Wnt/β-连环蛋白通路之间的关系在转移性黑色素瘤中被首次确认[15].Spranger 等[16]在β-连环蛋白信号传导活跃的基因工程黑色素瘤小鼠模型中发现, β-连环蛋白信号激活与TME 中低水平的肿瘤浸润CD8+T 细胞相关; 相反, β-连环蛋白信号缺失的小鼠伴有高水平的CD8+T 细胞浸润. 进一步的研究表明, 激活的β-连环蛋白会通过诱导转录抑制因子ATF3 的表达, 使得趋化因子CCL4 表达下调, 进而导致碱性亮氨酸拉链ATF 样转录因子(basic leucine-zipper ATF-like transcription factor 3, Batf3) 依赖性CD103+DC 细胞浸润和活化受损, CD8+T 细胞浸润和激活减少, 从而减弱对ICIs 的响应, 该结果与Ding等[17]在黑色素瘤小鼠模型中观察到的结果一致. Spranger 等[16]的进一步研究发现, 在黑色素瘤中抗PD-1 和抗CTLA-4 抗体在Wnt 激活小鼠中无效, 但在Wnt 失活小鼠中有效, 表明β-连环蛋白上调确实可能诱导ICIs 抵抗, 该结果为联合使用Wnt/β-连环蛋白通路抑制剂与ICIs 提供了理论支持.
活化的Wnt 信号通路会诱导转录抑制因子ATF3 的表达, 并下调CCL4 的表达, 进而导致Batf3 依赖性的DC 招募受损, 抑制CD8+T 细胞的启动和肿瘤浸润.
1.3 Wnt/β-连环蛋白抑制剂增强PD-1/PD-L1 抑制剂的抗肿瘤效果
β-连环蛋白激活在肿瘤免疫逃避中具有重要的临床意义. 考虑到Wnt/β-连环蛋白通路可以调节Batf3 依赖性CD103+DC 细胞介导的CD8+T 细胞激活与肿瘤浸润, 以及β-连环蛋白/TCF/LEF 可特异性结合CD274 的启动子区域并诱导PD-L1 的转录, 因此阻断β-连环蛋白可能会提高抗PD-1/PD-L1 单药在相同剂量给药下的疗效[6].
在Huang 等[1]的研究中发现, 骨髓来源的癌相关成纤维细胞BMFs 中Wnt/β-连环蛋白信号通路的激活可诱导PD-L1 过表达, 从而对抗PD-L1 抗体产生耐药性. β-连环蛋白信号通路选择性抑制剂XAV-939 和Wnt-C59 可显著降低肿瘤细胞中PD-L1 的表达. 在对荷瘤小鼠进行进一步的研究发现, Wnt 信号通路抑制剂XAV-939 与抗PD-L1 抗体的联合使用可显著增强抗PD-L1 抗体的治疗效果, 可逆转TME 中的免疫抑制状态. 可见, Wnt/β-连环蛋白是重建肿瘤对抗PD-L1 免疫疗法敏感性的潜在靶点. E7386 可选择性地抑制β-连环蛋白和环磷腺苷效应元件(cAMP-response element binding protein, CREB) 结合蛋白(一种调节基因转录的蛋白) 之间的相互作用, 且调节β-连环蛋白信号通路. Yamada等[18]证明, 在小鼠乳腺肿瘤病毒(mouse mammary tumor virus, MMTV)-Wnt1 小鼠肿瘤模型中, E7386 与抗PD-1 抗体的联合治疗与各单药治疗相比显示出协同抗肿瘤的作用. 最近, Feng 等[19]开发了一种针对β-连环蛋白/B 细胞淋巴瘤(B-cell lymphoma, BCL9) 相互作用的强效选择抑制剂hsBCL9CT-24, 该抑制剂可通过促进免疫细胞的瘤内浸润, 减少调节性T 细胞(regulatory cell, Treg) 比例, 增加DCs 比例, 抑制BCL9/BCL9L 和转化生长因子, 从而克服肿瘤对ICIs的耐药性, 与抗PD-1 抗体联用, 显著降低了肿瘤的生长速度, 为其他不可治的癌症提供协同抗肿瘤的作用.
DKN-01 是一种针对Dickkopf-1 (DDK-1) 的单克隆抗体, 可调节Wnt 信号. 在一项DKN-01 联合Pembrolizumab 治疗胃食管癌患者的Ⅰb 期研究中, 联合治疗后疾病控制率明显提高, 且无明显毒性. 由于DKK1 通常在Wnt 信号通路被激活的转移性结直肠癌(metastaticcolorectal, mCRC) 中过表达, 因此在临床上DKN-01 与抗PD-L1 联合治疗可能适用于微卫星稳定(micro satellite stability, MSS) 型mCRC 的治疗[20]. 在MSS 型mCRC 中, ICIs 单药治疗无效, STAT/β-连环蛋白/PD-L1 信号轴是诱导发生免疫逃逸的驱动因素. 临床实验结果表明[21], STAT/β-连环蛋白信号转导抑制剂BBI608 与抗PD-L1 抗体Pembrolizumab 联合使用可增强抗PD-L1 抗体治疗效果.
尽管ICIs 的使用彻底改变了抗肿瘤的治疗策略, 但大多数患者(约80%) 对ICIs 产生不同程度的耐药, 尤其是在β-连环蛋白异常激活的肿瘤中[1,4]. 因此, 阻断Wnt 信号通路可以通过解除免疫抑制来促进免疫细胞肿瘤浸润和增强免疫治疗效果等提高临床治疗效果. 表1 对处于不同临床阶段的Wnt/β-连环蛋白抑制剂和ICIs 联合用药进行了总结.
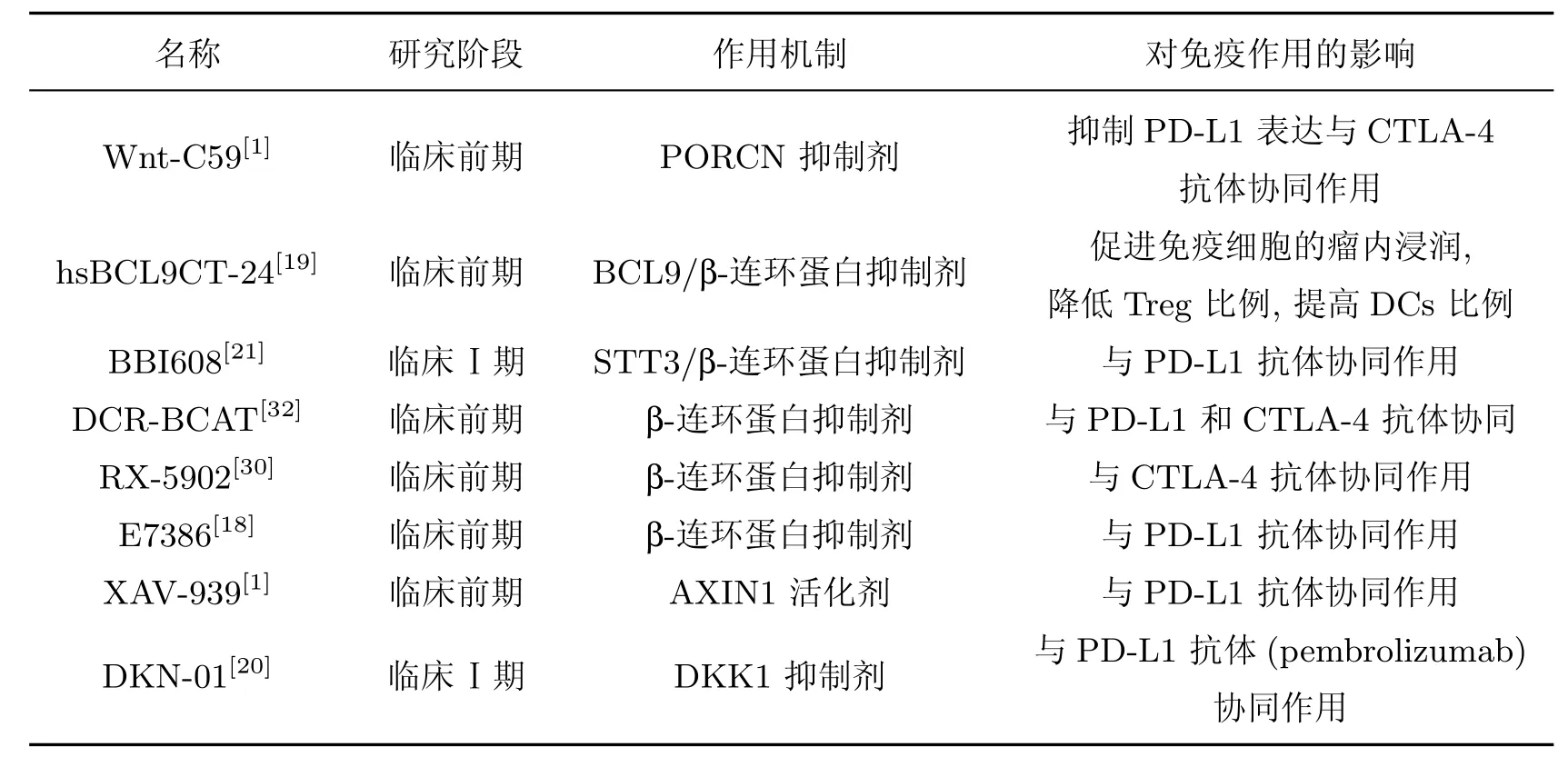
表1 Wnt/β-连环蛋白抑制剂联合ICIs 治疗作用研究进展Table 1 Progress in treatment of Wnt/β-catenin inhibitors combined with ICIs
2 Wnt/β-连环蛋白信号通路与CTLA-4
CTLA-4 也称CD152, 主要在活化的CD4+、CD8+T 细胞以及肿瘤浸润Treg 上表达,能够与配体CD80/CD86 结合[22-23], 中止激活的T 细胞的反应以及介导Treg 的抑制功能[24].此外,CTLA-4 还可直接介导DC 结合CD80/CD86 并诱导吲哚胺2,3 双加氧酶(indoleamine 2, 3-dioxygenase, IDO) 的表达, 从而导致T 细胞受体(T cell receptor, TCR) 的抑制[25-26],促进TME 的免疫抑制. 越来越多的研究表明, Wnt/β-连环蛋白信号通路的激活不仅能调控CTLA-4 的表达, 还能通过调控DCs 参与CTLA-4 抑制剂的耐药[27], 且其抑制剂能通过增加CD8+T 细胞的浸润来增强CTLA-4 抑制剂的抗肿瘤效果.
2.1 Wnt/β-连环蛋白信号通路在CTLA-4 介导免疫逃逸中的作用
CTLA-4 是Wnt/β-连环蛋白信号的直接靶点, 由Wnt/β-连环蛋白途径转录调节.CTLA-4 启动子区域的β-连环蛋白应答需要TCF1/LEF1 存在于转录起始位点. Shah等[24]在β-连环蛋白激活的黑色素瘤中发现, CTLA-4 的表达量明显上升, 并通过RT-PCR 和流式细胞术进一步证明Wnt/β-连环蛋白信号在转录和翻译水平诱导黑色素瘤细胞中CTLA-4的表达. 在CTLA-4 转录起始位点发现存在4 个潜在的TCF/LEF 转录应答元件, 通过PCR技术分离这些区域可以发现, 与分离区域相比, 未分离区域加入Wnt3a 后, Wnt3a 通过TCF/LEF 结合位点以剂量依赖性增加CTLA-4 启动子的活性, 且此过程可被Wnt 信号转导抑制剂DDK-1 阻断.
2.2 Wnt/β-连环蛋白抑制剂增强CTLA-4 抑制剂的抗肿瘤效果
目前, 靶向CTLA-4 的单克隆抗体包括伊匹单抗和曲美木单抗, 阻断CTLA-4 和CD80/CD86 的相互作用[28]. 解除抑制T 细胞活化的信号, 从而维持T 细胞激活状态.但抗CTLA-4 单药治疗范围在很大程度上仅限于黑色素瘤[29].
RX-5902 是一种新型的β-连环蛋白小分子抑制剂, 在临床前模型中可降低β-连环蛋白的核聚集. Tenlter 等[30]证明在TNBC 小鼠模型中, 与RX-5902 单药治疗相比, 较低剂量的RX-5902 和抗CTLA-4 联合治疗对肿瘤生长的抑制作用更强. 膜结合O-酰基转移酶(PORCN) 是Wnt 生物合成的关键酶. C59 是一种PORCN-Wnt/β-连环蛋白信号通路抑制剂, 在黑色素瘤模型[31]中发现, 与抗CTLA-4 抗体联合使用可增强肿瘤浸润CD8+T 细胞的活化和肿瘤抗原特异性CD8+T 细胞的扩增, 显著抑制黑色素瘤的生长, 增强抗肿瘤免疫的协同作用. DCR-BCAT 是一种纳米颗粒药物产品, 可靶向CTNNB1 (编码β-连环蛋白的基因) 的RNAi 触发器, 选择性沉默肿瘤中的CTNNB1 在各种Wnt 依赖性临床前模型中能快速抑制肿瘤生长. Ganesh 等[32]证明, 在黑色素瘤的乳腺癌神经母细胞瘤和肾腺癌中, 用DCR-BCAT 抑制β-连环蛋白显著增加了T 细胞浸润及抗原提呈细胞和趋化因子的表达, 并增强了肿瘤对PD-1/PD-L1、CTLA-4 抑制剂的敏感性. 当在MMTV Wnt1 转基因小鼠中(一种自发性Wnt driven 肿瘤的遗传模型), DCR-BCAT 与抗CTLA-4 抗体联合使用时, 接受治疗的小鼠实现了肿瘤的完全消退. 表1 对处于不同临床阶段的Wnt/β-连环蛋白抑制剂和ICIs 联合用药进行了总结.
3 Wnt/β-连环蛋白信号通路与其他免疫检查点
Tim-3 是活化和耗尽T 细胞上的抑制性受体[30], 主要在T 细胞、Treg 细胞、先天免疫细胞表面表达[33]. Tim-3 配体半乳糖凝集素9 (galectin 9, Gal9) 与Tim-3 结合后导致T 细胞功能下调, 形成抑制肿瘤免疫的负反馈调节机制. 淋巴细胞活化基因-3 (lymphocyte activation gene 3, LAG-3) 主要表达在活化的T 淋巴细胞、B 淋巴细胞、自然杀伤细胞和浆细胞样树突状细胞(plasma cytoid dendritic cells, pDCs) 中, 与主要组织相容性复合体Ⅱ类分子和Gal3结合, 并负调控T 细胞功能[34-35]. 一直以来, 肿瘤中LAG-3 表达水平和LAG-3+细胞浸润与肿瘤进展、预后不良和各种类型的人类肿瘤相关[36]. T 细胞免疫球蛋白和ITIM 结构蛋白(T cell immunoglobulin and ITIM domain protein, TIGIT), 在原始T 细胞弱表达. TIGIT 和竞争性共刺激受体CD226 竞争结合配体CD155 和CD113[33]. 在癌症中, TIGIT 与PD-1 在小鼠、人类肿瘤抗原特异性CD8+T 细胞和CD8+肿瘤浸润淋巴细胞上共表达[37].
基因敲除和荷瘤小鼠抗体治疗实验结果显示[38], 与抗CTLA-4 和抗PD-1 抗体相比,Tim-3 抗体自身没有明显的免疫毒副作用, 具有良好的临床应用前景. 上文中提到, Hsu等[11]已经证明依托泊苷可通过TOP2B 降解依赖性核β-连环蛋白, 抑制EMT/β-连环蛋白/STT3/PD-L1 轴. 在间质样小鼠癌基因模型中, 依托泊苷与抗Tim-3 抗体联合应用时可诱导肿瘤CD8+T 细胞群的浸润活化, 从而增强Tim-3 阻断治疗对肿瘤的抑制能力. LAG-3 的表达与Wnt/糖原合成酶激酶-3 (glycogen synthase kinase 3, GSK-3)/Tbet-LAG-3 轴密切相关, GSK-3 可诱导β-连环蛋白磷酸化, 从而降解β-连环蛋白, 抑制其进入细胞核, 进一步Wnt信号通路的激活被抑制. Issa 等[39]的研究表明GSK-3 的激活可调节转录因子(nuclear factor of activated T cell, NFAT) 的表达, NFAT 又可反过来抑制LAG-3 的转录, 减少LAG-3 的表达. 该课题组还发现抗LAG-3 和GSK-3 抑制剂联合用药可进一步阻止肿瘤的生长, 并延长小鼠的存活期.GSK-3 增强抗肿瘤作用主要是通过GSK-3 的抑制来增加转录因子Tbet (Tbx21)的表达, Tbet 又可反过来抑制LAG-3 的转录. 使用GSK-3 小分子抑制剂(SMI) 或SiRNA抑制GSK-3 的表达, 会导致LAG-3 表达减少, 并显著增加CD8+T 细胞的活性, 抑制肿瘤的生长.
4 总结与展望
免疫治疗技术是过去十年肿瘤治疗领域中具有实质性的突破之一, 改变了癌症医疗设备. 本工作讨论了Wnt/β-连环蛋白与负性调节免疫检查点介导的免疫逃逸的关系, 并介绍了Wnt/β-连环蛋白抑制剂与免疫检查点联合用药的抗肿瘤研究进展, 为改善癌症患者的治疗提供了一种可能的方法. 上述研究表明, Wnt/β-连环蛋白信号通路活性与免疫检查点的表达呈正相关, 与T 细胞的浸润呈负相关, 从而造成对ICIs 的抵抗, 为以重塑免疫细胞浸润和增强免疫治疗效果为目标的针对Wnt/β-连环蛋白信号通路开发靶向药物提供了坚实的论据. 但也有研究表明[2], 阻断Wnt/β-连环蛋白信号通路不仅抑制了胶质母细胞瘤细胞的增殖和迁移, 而且促进了肿瘤组织中T 细胞的浸润和效应细胞因子IFN-γ 等的释放, 从而提高PD-1 抑制剂的治疗效果. 然而, 这一发现与其他研究结果不同的原因是, 在PD-L1 的表达提高后, 通过与T 细胞PD-1 的相互作用, T 细胞的浸润提高, 但是浸润的T 细胞并不被有效激活, Treg 细胞也同时被招募, T 细胞耗竭同时发生, 故即使是PD-L1 上调T 细胞浸润, 也不能逆转免疫抑制的TME. 因此, Zhang 等[2]关于PD-L1 表达与T 细胞浸润的相关性研究需要进一步探讨.由于β-连环蛋白在免疫细胞的增殖、分化和迁移等生物学过程中发挥了重要作用, 因此在通过抑制Wnt/β-连环蛋白信号通路来增强肿瘤免疫的过程中, 如何衡量Wnt/β-连环蛋白信号通路的抑制程度是未来Wnt/β-连环蛋白抑制剂与ICIs 联合用药过程中需要重点考虑的问题.
