鹅源酵母菌的分离鉴定及对污水COD的降解性能
2023-06-11杨伟平龙宜张海艳易力张耀武陈万光
杨伟平 龙宜 张海艳 易力 张耀武 陈万光

摘要 [目的]从鹅粪便中分离筛选具有生产潜能的酵母菌,为水质净化、畜禽粪便的资源化利用、动物养殖等提供菌种资源。[方法]使用麦芽汁培养基,采用涂布法和平板划线方法从鹅粪便中分离酵母菌,然后对纯化的菌种进行形态学、生理生化鉴定和26S rDNA序列的同源性分析进行鉴定。同时测定酵母菌对模拟污水COD的降解性能。[结果]分离到4株酵母菌,通过鉴定和系统发育分析,最终将分离到的菌株Y-1、Y-2、Y-3、Y-5分别鉴定并命名为阿氏丝孢酵母菌Y-1(Trichosporon asahii Y-1)、红酵母菌Y-2(Rhodotorula sp.Y-2)、胶红酵母菌Y-3(Rhodotorula mucilaginosa Y-3)、隐球酵母菌Y-5(Cryptococcus albidus Y-5)。4株酵母菌中,Y-3对模拟污水COD的去除效果最好,在菌浓度为1.5×109 CFU/mL、1%接种量、培养96 h时,对污水中COD的去除效果达到56.8%。[结论]筛选到4株酵母菌,其中胶红酵母菌Y-3对模拟污水COD的去除效果最好,可进一步用于后续研究。
关键词 酵母菌;分离鉴定;系统发育分析;COD降解
中图分类号 X703 文献标识码 A
文章编号 0517-6611(2023)10-0005-05
Abstract [Objective]To isolate and screen yeast with production potential from goose feces,and provide bacterial resources for water purification,resource utilization of livestock and poultry feces and animal breeding.[Method]Yeasts were isolated from goose feces using the wort medium by the plate coating method and the streak plate method,and according to morphological,physiological and biochemical ,26S rDNA sequence analysis.At the same time,it was measured that the degradation performance of the yeast for COD in simulated sewage.[Result]The four isolated yeast strains Y1,Y2,Y3 and Y5 were finally named as Trichosporon asahii Y1,Rhodotorula sp.Y2,Rhodotorula mucilaginosa Y3,Cryptococcus albidus Y5 through identification and phylogenetic analysis.Among the 4 strains of yeast,Rhodotorula mucilaginosa Y3 had the best removal effect on COD in simulated sewage,and the removal rate reached 56.8% when the bacterial concentration was 1.5×109 CFU/mL,1% inoculum and cultured for 96 h.[Conclusion]Four strains of yeasts were screened,among which Rhodotorula mucilaginosa Y3 had the best removal effect on COD in simulated sewage,which could be further used in subsequent studies.
Key words Yeast;Isolation and identification;Phylogenetic analysis;COD degradation
酵母菌是一種结构简单的、兼性厌氧型单细胞微生物,菌体中富含动物和人体所必需的多种氨基酸、糖类、蛋白质、维生素等[1]。酵母菌在动物生产中作为益生菌,不仅能恢复肠道的微生态平衡,而且有助于肠道形态的生长和发育[2-3]。齐琼[4]研究表明海洋红酵母菌的添加不仅对虾的增重率、饵料系数等均有提高,还可改善肠道菌群,增加虾壳的虾青素和抵抗力。唐微微等[5]所分离的2株酵母菌具有一定除臭作用,两菌复合后对猪粪便中的氨气和硫化氢的去除率增加。惠文森等[6]研究发现,酵母菌可提高发酵玉米秸秆粗蛋白、粗脂肪的含量,但对粗纤维作用甚微;而刘晓辉等[7]从土壤中分离出的一株胶红酵母菌则对纤维素有一定的降解能力。此外,酵母菌还对水质有较大的净化作用,较好地应用在有毒废水、高浓度有机废水以及生活废水中,对重金属离子具有一定的清除效果[8-9]。
动物肠道中的真菌在正常菌群中所占比例极小,但在维持肠道微生态平衡和机体健康中发挥重要作用。该试验旨在从鹅的新鲜粪便中分离筛选有益的酵母菌并对其进行鉴定和分析,以便为水质净化、动物饲料添加剂开发、秸秆腐熟以及动物粪便除臭等方面的研究提供菌种资源。
1 材料与方法
1.1 试验材料
1.1.1 样品采集。该试验中所用的鹅的新鲜粪便采集于洛阳师范学院伊滨校区月明湖畔。采集粪便时,除去其表面的杂草和泥土,取中间部分,装封口塑料袋中,排气封口,编号,放入干净的泡沫盒中迅速带回实验室并进行酵母菌的分离。
1.1.2 培养基配制。
(1)麦芽浸粉琼脂培养基。称取成品的麥芽浸粉琼脂33.6 g,加热煮沸溶解于1 000 mL蒸馏水中,分装,121 ℃高压灭菌15 min,用作酵母菌的分离筛选[10]。
(2)YPD培养基。酵母粉10 g/L、蛋白胨 20 g/L、葡萄糖20 g/L,若制固体培养基,加入1.7%琼脂粉,121 ℃高压灭菌15 min,用作酵母菌的培养和纯化[5]。
1.1.3 模拟污水的制备。
模拟污水的配制参照黄秋婷等[11]的方法进行。通过测定,模拟污水化学需氧量(COD)为513.07 mg/L。
1.2 试验方法
1.2.1 鹅粪便的预处理。
称取采集的鹅粪便5.0 g,转移至无菌的锥形瓶中,加入100 mL灭菌的蒸馏水,于30 ℃、150 r/min 条件下在摇床中振荡30 min后,静置20 min后用于酵母菌的分离。
1.2.2 酵母菌的分离纯化。
取“1.2.1”中一定量的粪便稀释液样品进行梯度稀释,分别从 10-2、10-3、10-4稀释度下吸取 0.1 mL 于麦芽浸粉琼脂平板上涂布,30 ℃条件下在恒温培养箱培养2 d。挑取单菌落,进一步用平板划线法在YPD固体培养基上划线纯化培养2~3次,然后进行斜面保存和-20 ℃下甘油保存。
1.2.3 酵母菌的鉴定方法。
1.2.3.1 形态学特征和生理生化鉴定。参照《酵母菌的特征与鉴定手册》[12],采用糖发酵试验、氮源同化试验、碳源同化试验等进行酵母菌种属的鉴定。
1.2.3.2 分子生物学鉴定。按照《分子克隆实验指南》[13]的方法提取酵母菌基因组DNA,根据 26S rDNA的D1/D2 区序列合成的一对保守引物(NL1-F:5′-GCA TAT CAA TAA GCG GAG GAA AAG-3′,NL4-R: 5′-GGT CCG TGT TTC AAG ACG GG-3′)[5,7],然后对酵母菌的26S rDNA 的D1/D2 区序列进行PCR扩增。PCR扩增条件:预变性 95 ℃ 5 min;随后进行30个循环的变性 95 ℃ 30 s,退火30 s,延伸40 s;最后在 72 ℃下延伸5 min。PCR扩增产物用1%的琼脂糖凝胶电泳进行检测后委托上海生工生物工程股份有限公司测序。将测序结果在NCBI中进行Blast,分析并下载与待鉴定菌株26S rDNA相似性高的序列,利用Clustal X软件和Mega 6.0软件进行序列比对和构建系统发育树[7]。
1.2.4 分离菌株对模拟污水降解性能的测定。
将初筛的纯化好的各菌液浓度调至OD600=0.5左右,按1%接种量接种至盛有100 mL模拟污水的三角瓶中,在30 ℃、150 r/min 振荡培养48 h取上清液测定模拟污水的COD含量,计算各菌株对模拟污水中COD的去除效果。对照组接种同量的灭菌发酵液。
1.2.5 试验菌株在不同浓度和培养时间下对模拟污水COD的去除能力。
根据各菌株对模拟污水COD的去除效果,选择去除效果最好的菌株进一步研究。该试验中,除对照组(CG)外,共分为4个试验组,即试验组1(EG1,各菌的原液,浓度为1.5×109 CFU/mL)、试验组2(EG2,浓度为5.0×108 CFU/mL)、试验组3(EG3,浓度为3.0×108 CFU/mL)、试验组4(EG4,浓度为1.5×108 CFU/mL)。按 1%的接种量接种到模拟污水中,于 30 ℃下150 r/min 振荡培养,分别在24、48、72、96 h取样测定模拟污水的COD含量。对照组接种同量的灭菌发酵液。
1.3 数据分析 试验数据在Excel中进行分析整理,然后用SPSS 19.0统计分析软件进行分析,采用 Dancan法进行多重比较。
2 结果与分析
2.1 鹅源酵母菌的分离纯化及形态学特征
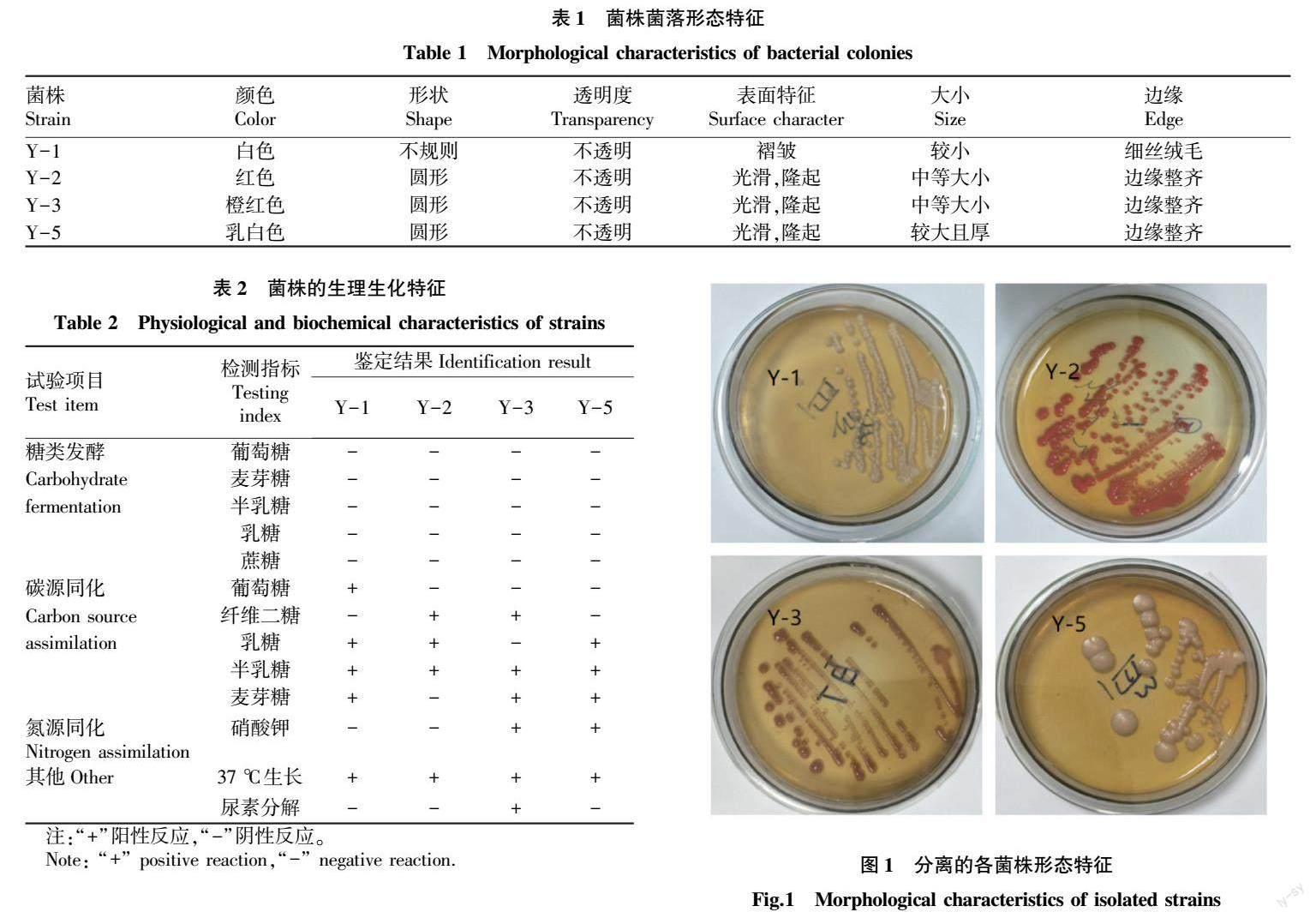
通过使用麦芽汁琼脂培养基对鹅粪便中酵母菌的分离,挑取单一的乳白色、红色菌落在YPD固体培养基上进行划线纯化培养,根据其生长快慢,最终从鹅粪便样品中共分离纯化出4株疑似酵母菌的菌株,分别标号为Y-1、Y-2、Y-3、Y-5(图1),其菌落形态特征描述见表1。
2.2 菌株的生理生化鉴定
试验所分离的酵母菌经生理生化鉴定,发现4株都能在28~37 ℃条件下生长,且对糖类都发酵,其具体结果见表2。
2.3 菌株分子生物学鉴定
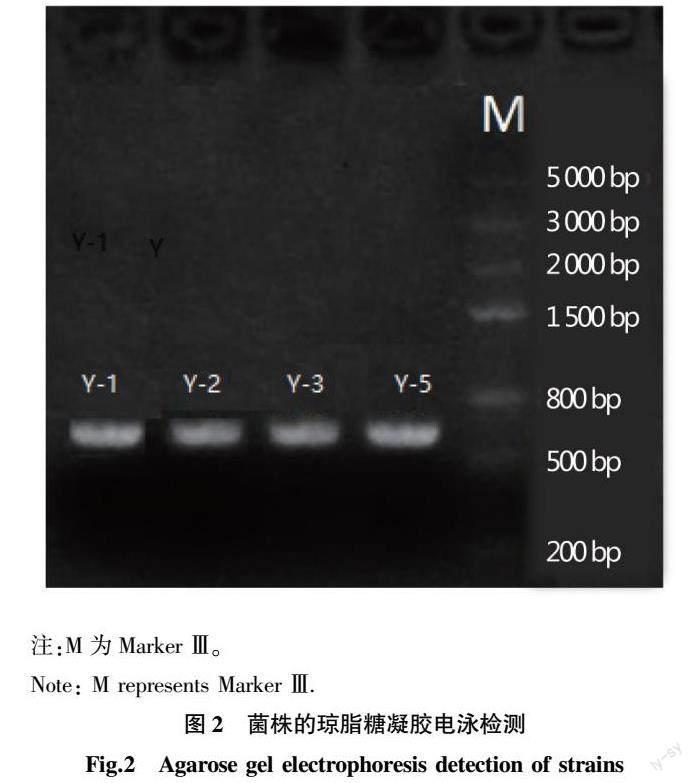
以酵母菌基因组DNA为模板,通过PCR扩增其26S rDNA的D1/D2 区序列,用1%琼脂糖凝胶电泳检测后,均扩增到一清晰的600 bp左右的条带(图2)。测序结果显示,Y-1、Y-2、Y-3、Y-5菌株的26S rDNA D1/D2 区序列长度分别为611、584、575和585 bp,与预期结果基本相符合。
将测序的序列在NCBI中进行Blast分析,结果见表3。各菌株的26S rDNA的D1/D2 区序列与NCBI中相应模式菌株26S rDNA序列的相似性均达到了97%及以上。从构建的系统发育树结果(图3)来看,Y-1的26S rDNA序列与Trichosporon asahii CLIB 3029(LT627403.1)的同源性达到100%,菌株Y-2与Rhodotorula sp.CRUB 1485 (EF585198.1)的序列同源性达到了97%,菌株Y-3与Rhodotorula mucilaginosa lhWW25 (MF448272.1)的同源性达到98%,菌株Y-5与Cryptococcus albidus YM2518 (KT345310.1)的同源性达到了100%。
结合各菌株的菌落形态特征、生理生化试验以及系统发育树分析结果,鉴定菌株Y-1为阿氏絲孢酵母菌(Trichosporon asahii),命名为Trichosporon asahii Y-1;菌株Y-2为红酵母菌(Rhodotorula sp.),命名为Rhodotorula sp. Y-2;菌株 Y-3为胶红酵母菌(Rhodotorula mucilaginosa),命名为Rhodotorula mucilaginosa Y-3;菌株Y-5属于隐球酵母菌(Cryptococcus albidus),命名为Cryptococcus albidus Y-5。
2.4 分离酵母菌株对模拟污水降解性能的测定
从各酵母菌在48 h时对模拟污水COD的去除效果来看(图4),Y-2和Y-3显著优于Y-1和Y-5(P<0.05),且Y-2和Y-3均属于红酵母菌属,但Y-3对模拟污水COD的去除效果最好,对模拟污水中COD的去除率达36.2%。
对Y-3去除模拟污水COD的效果进一步研究发现(图5),随着使用时间的延长,不同浓度的Y-3去除模拟污水COD的效果逐渐增强,但从同一时间不同浓度来看,试验组1(EG1)去除COD的效果显著优于其他试验组(P<0.05);在菌浓度为1.5×109 CFU/mL、1%接种量、培养96 h时,对污水中COD的去除效果达到56.8%。
3 讨论
3.1 酵母菌的分离及鉴定
酵母菌在自然界中如土壤[7]、污水口[5]、动物胃肠道[8,10]和食品[14-15]等中广泛存在,采用特定的培养基从这些环境中分离筛选出具有有益的酵母菌也成了人们常采用的方法。
在酵母菌的鉴定中,细胞的形态会因不同的生长阶段和不同的培养基而有所差异,所以形态学不能提供有效的分类学信息。菌株的生理生化鉴定中,因酵母菌属各菌种间生理生化特性差异有限,对试验条件和培养基也要求严格,菌的生长状态和代谢能力也导致试验结果不稳定。因此,酵母菌rDNA序列分析被广泛用于其分类学研究中[16]。
酵母菌rDNA为编码核糖体rRNA的串联重复序列,包括高度保守的序列和较大变异性的区域。在酵母菌分类和系统学研究中,主要以5.8S-ITS间隔区和26S rDNA D1/D2 区序列分析为依据[14]。如谢凤行等[8]扩增了所分离酵母菌的5.8S rDNA序列,利用Gen Bank数据库及Mega 6.0软件对其测序序列进行分析,并对所分离的酵母菌进行了鉴定。郭冬琴[14]采用5.8S rDNA及其ITS间隔区序列RFLP分析和26S rDNA D1/D2区序列测定相结合的方法鉴定了所分离的酵母菌株。刘晓辉等[7,15,17]用26S rDNA基因序列测序分析对所分离的酵母菌株进行了鉴定。但酵母菌26S rDNA的Dl/D2区序列的数据库比5.8S-ITS序列数据库更完整,进行序列比对时可以搜索到同源性更高的参考菌株序列,因此,宜选择26S rDNA的Dl/D2区序列用于酵母菌的鉴定[14-16]。
通过对分离菌株的序列相似性分析结果看,所分离到的4株酵母菌与模式菌序列的相似性均达到了97%以上,可认为是用一种菌。目前比较公认的观点是具有相同Dl/D2区序列或ITS序列的酵母菌应属于同一个种;在Dl/D2区序列或ITS序列中碱基差异大于1%的菌株应属于不同的种[16]。根据系统发育树分析结果看,该试验中菌株Y-1和Y-5与其相应的模式菌株的同源性均达到100%,所以与模式菌株为同一种菌,即分别命名为Trichosporon asahii Y-1和Cryptococcus albidus Y-5;而Y-2和Y-3与其相应的模式菌株的同源性分别为97%和98%,所以与模式菌株为同一属中的不同亚种或者是其变种,分别命名为Rhodotorula sp.Y-2和Rhodotorula mucilaginosa Y-3。
3.2 对模拟污水COD的降解性能
在集约化水产养殖模式中,由于水产动物粪便、生物残体和残饵大量沉积腐烂,水体养分富集,导致有害藻类和病菌的大量繁殖,水质恶化[8]。目前用于水产养殖水体净化的微生物菌剂中,与光合细菌、芽孢杆菌等相比,酵母菌因具有生长快、胞体营养成分丰富和能够降解水中有机物而受到水产养殖行业的欢迎[18]。该试验所分离的4株酵母菌在对模拟污水COD去除性能的研究中,胶红酵母菌Y-3具有强的去除模拟污水COD的能力,且去除效果优于其他3株菌,但对COD的去除效果低于谢凤行等[8,19]的研究结果。有研究发现,COD初始浓度的高低影响微生物菌剂对COD的去除效果,即COD初始浓度越高,微生物菌剂对COD的去除效果越弱[19-20]。
此外,通过研究不同时间和不同接种量对COD的影响,发现菌种菌液的浓度和使用时间对COD的去除均有一定的影响,但该试验结果均低于其他学者的研究[8,19-20]。由此可见,微生物菌剂对COD的去除效果不仅与模拟污水初始COD浓度有关,还与微生物菌剂的投加量、菌种来源、作用时间等均有一定的关系。
3.3 所分离酵母菌可能存在的用途和问题
根据前人研究发现,分离到的4个酵母菌均有一定的用途。如阿氏丝孢酵母菌能够产生高的β-葡萄糖苷酶,在红酒的酿造中能够保持酒体色泽[21]。在骆驼奶中发现的阿氏丝孢酵母菌能够产生抗菌肽P16,对根状芽孢杆菌有一定的抑制作用[22]。但也有研究表明,丝孢酵母属菌还属于条件致病菌,对皮肤、黏膜、肝、脾、肾、肠道等系统有一定的损害[23]。
Vajpeyi等[24]对白色隐球酵母菌的基因组序列和代谢路径进行研究,指出该菌可以利用各种有机碳源合成脂质。张岳等[25]研究指出白色隐球酵母菌能显著抑制葡萄灰霉病菌和柑橘青霉病菌的生长,为果实采后保鲜提供可能。此外,由于临床上隐球菌病发病频率的增加,Cryptococcus albidus的研究受到重视,目前已经从血液、肺、皮肤和脑脊液中有分离出来[26]。Nascimento等[27]从鹦鹉泄殖腔的样品中分离到了10株隐球酵母属菌,其中9株属于Cryptococcus albidus var.,并且这9株酵母菌均能产生细胞毒力因子磷脂酶和蛋白酶,因此指出不仅是环境,鸟类也可能是该菌携带者。该研究分离到的Cryptococcus albidus Y-5来自健康鹅的粪便,可能属于Cryptococcus albidus 的一个变种,是否与隐球菌病有一定的关联还需进一步的深入研究。
人类和动物不能合成类胡萝卜素,必须通过摄取富含类胡萝卜素的食物,经过消化吸收后才能利用[28]。而红酵母菌属的酵母菌的菌体含有蛋白质、β-胡萝卜素、虾青素、天然类胡萝卜素、多不饱和脂肪酸和维生素等营养成分和生物活性物质,是很有潜力的工业生产菌株,因此在食品工业、食品添加剂开发、水产养殖饵料和饲料等方面被广泛应用[17,19,29-31]。而红酵母菌具有氨氮降解[32]、吸附和抵抗Cu2+对细胞的毒害作用[33],因此在水质净化方面也被广泛关注[8,9,19]。
4 结论
(1)该试验从鹅粪便中分离到了4株酵母菌,根据其形态学、生理生化特征及26S rDNA的Dl/D2区序列分析分别被鉴定为阿氏丝孢酵母菌Y-1(Trichosporon asahii Y-1)、红酵母菌Y-2(Rhodotorula sp. Y-2)、胶红酵母菌Y-3(Rhodotorula mucilaginosa Y-3)、隐球酵母菌Y-5 (Cryptococcus albidus Y-5)。
(2)4株酵母菌中,胶红酵母菌Y-3对模拟污水COD的去除效果最好,在菌浓度为1.5×109 CFU/mL、1%接种量、培养96 h时,对污水中COD的去除效果达到56.8%。
参考文献
[1]石陆娥,应国清,唐振兴,等.酵母的开发利用研究进展[J].中国食品添加剂,2006(5):62-65,104.
[2] HU P,MAO J X,ZENG Y,et al.Isolation,identification,and function of Rhodotorula mucilaginosa TZR2014 and its effects on the growth and health of weaned piglets[J].Frontiers in microbiology,2022,13:1-14.
[3] 张彩凤,王晓翠,张海军,等.乳酸菌和酵母菌复合制剂对肉仔鸡生长性能、屠宰性能和肠道健康的影响[J].动物营养学报,2017,29(4):1248-1256.
[4] 齐琼.海洋红酵母的筛选及其在凡納滨对虾养殖中应用效果初步研究[D].舟山:浙江海洋大学,2019.
[5] 唐微微,张姝,李树伟,等.两株酵母菌的筛选及其除臭性能[J].安全与环境学报,2013,13(2):26-30.
[6] 惠文森,王康英,申晓蓉,等.酵母菌发酵玉米秸秆试验研究[J].草业学报,2011,20(6):180-185.
[7] 刘晓辉,高晓梅,李杨,等.秸秆腐熟剂菌种筛选及鉴定[J].干旱区资源与环境,2021,35(1):141-145.
[8] 谢凤行,张峰峰,周可,等.水质净化酵母菌的分离筛选及鉴定[J].微生物学报,2015,55(5):635-642.
[9] RUAS F A D,AMORIM S S,LEO V A,et al.Rhodotorula mucilaginosa isolated from the Manganese mine water in Minas Gerais,Brazil:Potential employment for bioremediation of contaminated water[J].Water,air,& soil pollution,2020,231(10):527.
[10] 高晓莎,段晋伟,张艳冰,等.瘤胃源酵母的分离筛选及其在不同精粗比饲粮中对瘤胃体外发酵的影响[J].中国畜牧杂志,2020,56(6):95-101.
[11] 黄秋婷,薛天福,杨梅,等.几种低温微生物菌株及其组合对北方农村生活污水处理效果[J].北京化工大学学报(自然科学版),2020,47(3):50-57.
[12] 巴尼特 J A,佩恩 R W,亚罗 D.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版社,1991.
[13] 萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南[M].黄培堂,译.3版.北京:科学出版社,2002.
[14] 郭冬琴.橙汁中酵母菌的分离鉴定及其快速分子检测技术研究[D].重庆:西南大学,2012.
[15] 温雅骄.干红葡萄酒酿酒酵母的优选与鉴定及其酿酒品质评价[D].呼和浩特:内蒙古农业大学,2019.
[16] 李金霞,刘光全,程池.酿酒酵母26S rDNA D1/D2区域序列分析及其系统发育研究[J].酿酒,2007,34(1):37-39.
[17] KUNTHIPHUN S,CHOKREANSUKCHAI P,HONDEE P,et al.Diversity and characterization of cultivable oleaginous yeasts isolated from mangrove forests[J].World journal of microbiology and biotechnology,2018,34:125.
[18] 陈文,邱磊,曹树威,等.微生态制剂在水产养殖中的应用[J].水产养殖,2022,43(7):13-16.
[19] JARBOUI R,MAGDICH S,AYADI R J,et al.Aspergillus niger P6 and Rhodotorula mucilaginosa CH4 used for olive mill wastewater (OMW) biological treatment in single pure and successive cultures[J].Environmental technology,2013,34(5):629-636.
[20] 王冰,白萱,王嘉丽,等.光合细菌对模拟海水养殖废水COD的去除能力研究[J].大连民族大学学报,2018,20(3):198-200,209.
[21] 王玉霞.阿氏丝孢酵母(Trichosporon asahii)β-葡萄糖苷酶及葡萄糖苷类风味物质水解机制的研究[D].无锡:江南大学,2012.
[22] IDER S,BELGUESMIA Y,CAZALS G,et al.The antimicrobial peptide oranicin P16 isolated from Trichosporon asahii ICVY021,found in camel milks,inhibits Kocuria rhizophila[J].Food bioscience,2020,36:1-11.
[23] FRANCISCO E C,DE ALMEIDA JUNIOR J N,QUEIROZTELLES F,et al.Correlation of Trichosporon asahii genotypes with anatomical sites and antifungal susceptibility profiles:Data analyses from 284 isolates collected in the last 22 years across 24 medical centers[J].Antimicrobial agents and chemotherapy,2021,65(3):1-8.
[24] VAJPEYI S,CHANDRAN K.Draft genome sequence of the oleaginous yeast Cryptococcus albidus var.albidus[J].Genome announcements,2016,4(3):1-10.
[25] 張岳,杨俊颖,王旭东,等.2株浅白隐球酵母对葡萄灰霉病和柑橘青霉病采后防治效果的研究[J].江苏农业科学,2017,45(2):96-100.
[26] BOULWARE D R.Cryptococcus:From human pathogen to model yeast[J].The lancet infectious diseases,2011,11(6):434.
[27] NASCIMENTO D C,PAULA C R,DA SILVA RUIZ L,et al.Cryptococcus albidus var.albidus isolated from turquoisefronted parrots (Amazona aestiva:Psittacidae) kept in captivity:A probable reservoir ecological of fungal specimen[J].Journal of veterinary science & technology,2017,8(6):1-5.
[28] MANNAZZU I,LANDOLFO S,DA SILVA T L,et al.Red yeasts and carotenoid production:Outlining a future for nonconventional yeasts of biotechnological interest[J].World journal of microbiology & biotechnology,2015,31(11):1665-1673.
[29] 马娜,王星晨,孔彩琳,等.胶红酵母与酿酒酵母共发酵对干红葡萄酒香气与色泽的影响[J].食品科学,2021,42(2):97-104.
[30] 庄荣玉,王如晨,邱晓挺,等.胶红酵母生产生物活性物质研究进展[J].食品科学,2020,41(1):318-329.
[31] 王金才,于鸽,刘唤明,等.对虾养殖环境中红酵母的筛选及其发酵工艺研究[J].安徽农业科学,2020,48(11):104-106,109.
[32] 凌晓,郭刚,陈雷,等.高氨氮利用酵母菌的筛选及相关酶活性[J].微生物学通报,2020,47(12):4042-4049.
[33] WANG M X,MA J X,WANG X W,et al.Detoxification of Cu(II) by the red yeast Rhodotorula mucilaginosa:From extracellular to intracellular[J].Applied microbiology and biotechnology,2020,104(23):10181-10190.
