茄子叶际固氮菌的分离鉴定·培养特性及抑菌活性
2023-06-11幸翀郭青云
幸翀 郭青云
摘要 采用Ashby无氮培养基从茄子叶际分离得到1株具有高效固氮性能的自生固氮菌QZ-1,经16S rDNA序列鉴定,该菌株与克雷伯氏菌属各菌株同源性高达99%以上,初步鉴定为克雷伯氏菌(Klebsiella sp.),其在酵母粉为碳源、pH为5.0时生长最好。菌株QZ-1具有广谱抗真菌活性,对油菜菌核病、葡萄炭疽病、番茄灰霉病抑制效果可达40%以上。自生固氮菌QZ-1具有固氮和生防作用,可为进一步研发优良的叶际固氮菌肥提供微生物资源。
关键词 茄子;叶际固氮菌;克雷伯氏菌;分离鉴定;培养特性;抑菌活性
中图分类号 S182 文献标识码 A
文章编号 0517-6611(2023)10-0001-04
Abstract A nitrogenfixing bacteria strain QZ1 in the phyllosphere of Solanum melongena L.was screened using Ashby nitrogenfree medium.By 16S rDNA sequence analysis,the homology between strain QZ1 and Klebsiella isolated was up to 99%,thus,the isolated strain was identified as Klebsiella sp..The growth of strain QZ1 was better with yeast powder as carbon source at pH 5.0.Strain QZ1 had broadspectrum antifungal activity,with an inhibitory effect of over 40% on Sclerotinia sclerotiorum,grape anthracnose and Botrytis cinerea.The autotrophic nitrogen fixing bacterium QZ1 had nitrogen fixation and biocontrol effects,which could provide microbial resources for the further development of nitrogenfixing bacteria fertilizer.
Key words Solanum melongena L.;Nitrogenfixing bacteria from phyllosphere;Klebsiella sp.;Isolation and identification;Cultural characteristic;Antifungal activity
植物葉际存在许多有益的微生物种群,在一定程度上促进植物生长、拮抗植物病原菌。固氮菌可以定殖在植物叶际,通过固定空气中的氮气为植物生长提供必需营养物质,促进植物生长繁殖,在自然生态系统氮循环中发挥着重要的作用[1-2]。固氮菌是植物叶际的主要微生物类群,大多为细菌,目前已分离出的叶际固氮菌主要包括固氮菌属(Azotobacter)、气杆菌属(Aerobaeter)、拜氏固氮菌属(Beijerinekia)、黄杆菌属(Flavobaeterium)、假单胞杆菌属(Pseudomonas)、分枝杆菌属(Myeobaeterium)、克氏杆菌属(Klebsiella)、螺菌属(Spirillum)等[2-4]。研究发现叶际固氮菌不仅具有较高的固氮能力,还能促进作物生长,提高作物产量。如将森林植物叶际分离出Flavobacterium sp.TK2,接种于玉米叶际,可使产量提高约1/3[5]。水稻叶际固氮菌具有溶磷作用并能产生吲哚乙酸,可促进水稻生长[6]。叶际固氮菌还能产生抗菌物质,降低玉米大、小斑病的发病率,提高植物抗病能力,间接促进作物生长发育[3-4]。因此,固氮菌被广泛用于生物菌肥中,在取代氮肥的施用上具有广阔前景。
茄子(Solanum melongena L.)是我国广泛种植的蔬菜作物,营养丰富,食用方法多样,深受人民喜爱。茄子生长周期长,需要大量的营养物质,氮素是限制茄子生长的主要营养元素[7]。合理施用氮肥可以使茄子增产增收,但多年连续施用氮肥,不仅会增加农业种植成本,还会污染环境,造成土壤板结、肥力下降,甚至威胁人体健康。生物固氮具有成本低、高效、无污染等优点被广泛用于生物菌肥中,大多数农作物施用叶际固氮菌剂后,可以促进养分的吸收,减少氮肥和农药的用量,提高作物的产量和品质[7-8]。茄子叶际存在大量固氮微生物,与茄子生长发育密切相关,该研究利用传统微生物学方法分离筛选茄子叶际固氮菌,并对其培养特性和抗菌活性进行研究,可为生物菌肥生产提供固氮菌种资源,对农业的生产发展具有重要意义。
1 材料与方法
1.1 材料
供试茄子样品于2021年9月采自农民自种蔬菜园,取样时每个样品随机选取5株植物,戴上无菌手套进行采集,选取地上叶片,所取叶片位于新叶与老叶之间,避免沾染泥土引起试验误差,将采集到的叶片混合放入无菌培养皿中,24 h内对叶片进行处理。
1.2 供试病原菌
棉花立枯病菌(Rhizoctonia solani)、棉花枯萎病菌(Fusarium oxysporum)、番茄灰霉病菌(Botrytis cinerea)、黄瓜灰霉病菌(Botrytis cinerea Pers.)、油菜菌核病菌(Sclerotinia sclerotiorum Lib.)、苹果轮纹病菌(Botryosphaeria dothidea)、葡萄炭疽病菌(Colletot-richum gloeosporioides)、稻瘟病菌(Magnaporthe oryzae)均由赣南师范大学生命科学学院袁小勇教授提供。
1.3 茄子叶际固氮菌分离筛选
将取回的新鲜叶片置于装有100 mL无菌磷酸缓冲液(pH 7.0,含0.1% Tween)的锥形瓶中,保证溶液完全浸没叶片,25 ℃ 200 r/min摇床振荡30 min,超声波40 kHz 超声5 min,用镊子取出叶片,将其余的溶液转移至50 mL离心管中,然后以10 000 r/min离心10 min,倒掉上清,收集得到沉淀菌體。吸取 100 μL稀释液平板涂布法均匀接种到固体Ashby无氮培养基上,28 ℃培养5 d。根据菌落形态选择长势较好、生长速度较快的不同菌落进行划线纯化,直至出现有规则的单菌落。
1.4 菌株16S rDNA和nifH基因的PCR扩增
将筛选获得的固氮菌接种于LB液体培养基中,于28 ℃、200 r/min的摇床中过夜培养,收集菌体,用天根细菌基因组DNA提取试剂盒进行基因组DNA提取,以细菌16S rDNA全序列通用引物27F/1492R[9]和固氮基因nifH特定的引物PolF/PolR[10]分别进行PCR扩增,用1%琼脂糖凝胶电泳进行验证。扩增的PCR产物送至北京擎科生物有限公司测序,使用NCBI数据库进行序列比对,利用MEGA 7.0软件采用最大似然(ML)算法构建系统发育树。
1.5 固氮酶活性测定
按照微生物固氮酶(NITS)ELISA试剂盒说明书操作测定。取96孔酶标板,分别依次加入待测样本10 μL,样本稀释液40 μL,加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,37 ℃温育60 min,弃去液体,然后加入200 μL洗涤缓冲液洗板5次,加入显色液37 ℃避光孵育15 min,加入终止液50 μL终止反应于15 min内在450 nm波长处测定OD值。同时以不同标准活性的标准品为对照绘制标准曲线,依据标准曲线计算样本固氮酶活性。每个样本至少重复3次。
1.6 菌株培养特性研究
1.6.1 pH对菌株生长的影响。
取等量的细菌培养液接种于pH为5.0、6.0、7.0、8.0和9.0的LB液体培养基中,每个pH至少做3个平行试验,置于28 ℃下180 r/min恒温振荡培养箱中培养48 h,测定菌液OD600的平均值,确定菌株的最适生长pH。
1.6.2 NaCl浓度对菌株生长的影响。
取等量细菌培养液接种到含NaCl质量分数为0、1%、2%、3%和4%的LB液体培养基中,至少做3个平行试验,置于28 ℃下180 r/min恒温振荡培养箱中培养48 h,测定其OD600的平均值,确定菌株的耐盐性。
1.6.3 碳源对菌株生长的影响。
配制分别由麦芽糖、葡萄糖、淀粉和蔗糖代替LB培养基中的碳源(酵母粉)的液体培养基,取等量细菌培养液接种于上述培养基中,至少做3个平行试验,置于28 ℃下180 r/min恒温振荡培养箱中培养48 h,分别测定不同碳源下菌液OD600。
1.7 固氮菌对植物病原真菌的抑制活性
采用平板对峙法[11-12]研究固氮菌对植物病原真菌的抑制活性。将病原菌菌饼接种于PDA琼脂平板(d=8.5 cm)中央,在距离菌饼两侧3 cm处划线接种菌株,将接种后的培养皿在28 ℃恒温培养箱中倒置培养5 d,同时接种只含有病原真菌的PDA琼脂平板作为对照。用十字交叉法测量菌落直径,根据以下公式计算菌丝生长抑制率:菌丝生长抑制率=(对照菌落直径-对峙板菌落直径) /对照菌落直径 × 100%。
2 结果与分析
2.1 固氮菌的分离及鉴定
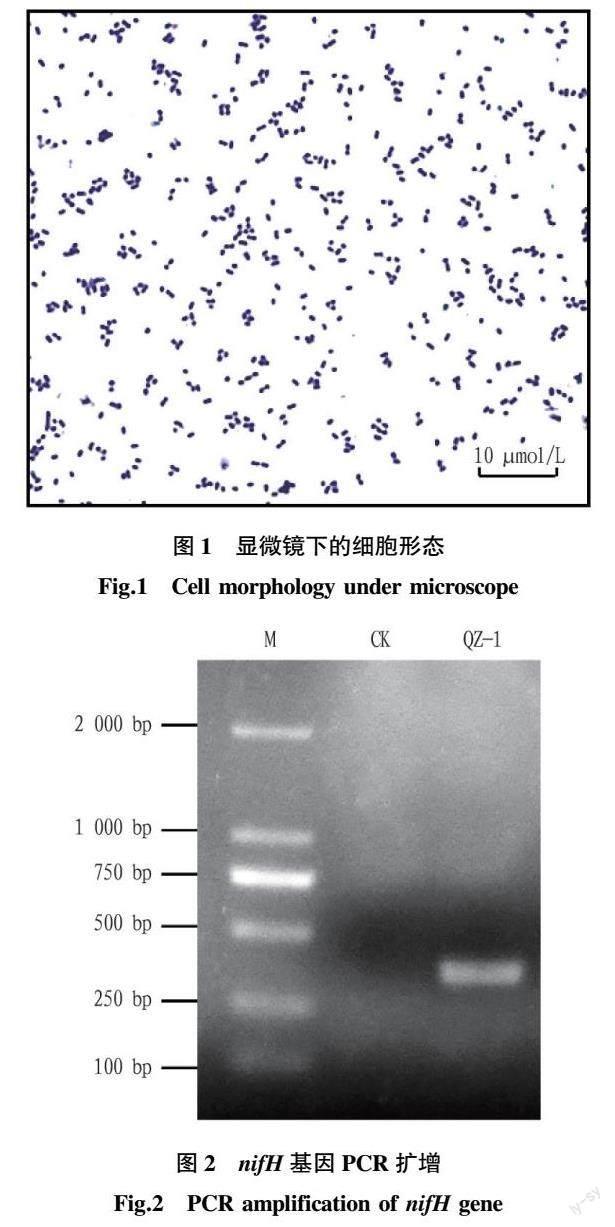
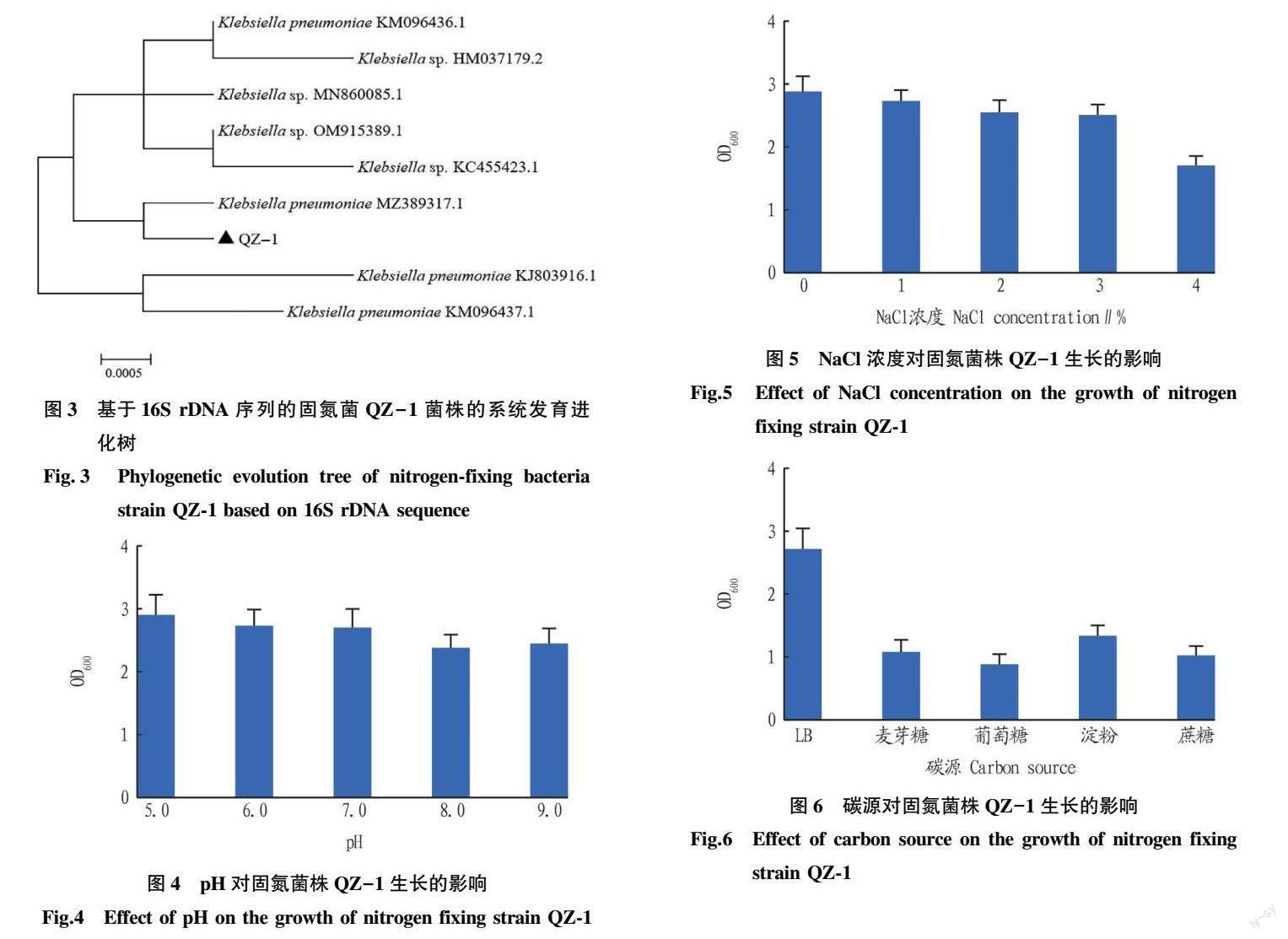
从茄子叶际分离到1株能在Ashby无氮培养基上生长较快的菌株。经过5代的分离纯化后,其菌落为圆形半透明,边缘整齐,表面湿润,不易挑起,能够产生黏液。在显微镜下观察为棒杆状(图1)。通过扩增固氮酶基因nifH进行复筛,扩增得到大小约为360 bp的基因片段(图2),与预期结果一致,将其编号为QZ-1。运用ELISA法测定其固氮酶活性,菌株QZ-1的固氮酶活性为78.79 IU/L,结合nifH基因扩增和固氮酶活性测定确定菌株QZ-1具有固氮能力。菌株QZ-1的16S rDNA序列1 437 bp,序列提交至GenBank数据库,登记号为ON778565。在数据库中进行BLAST比对发现,菌株QZ-1和克雷伯氏菌Klebsiella pneumoniae亲缘关系最近,聚为一支,序列相似度大于99%,因此将QZ-1命名为Klebsiella sp.QZ-1(图3)。
2.2 固氮菌的培养特性
2.2.1 pH对菌株生长的影响。
从图4可以看出,菌株QZ-1在pH为5.0~9.0时生长较好,生长速率随pH的增大呈减小趋势,在pH为5.0时OD600达到最大,说明克雷伯氏菌对pH有较强的酸碱适应性。在pH为6.0时比pH为8.0时生长状况好,说明菌株QZ-1为中性偏酸菌。
2.2.2 NaCl浓度对菌株生长的影响。
菌株QZ-1在0~4% NaCl浓度下均能生长,说明菌株有较广的盐度适应性。菌株的生长速率随NaCl浓度的增大而减小,在NaCl浓度为0时,OD600达到最大,NaCl浓度为4%时,OD600最小(图5)。由此可见,该菌株的最佳NaCl浓度为0,较为适宜的NaCl浓度为0~3%。
2.2.3 碳源对菌株生长的影响。
当LB培养基中的酵母粉被淀粉、麦芽糖、蔗糖和葡萄糖替代后,菌株QZ-1对各碳源均能利用,但是酵母粉被替代后生长状况不好,在培养48 h后,以淀粉为碳源的菌液OD600最高(1.32),远低于在LB培养基中OD600(2.73),说明酵母粉为菌株的最佳碳源(图6)。
2.3 固氮菌对植物病原真菌的抑制活性
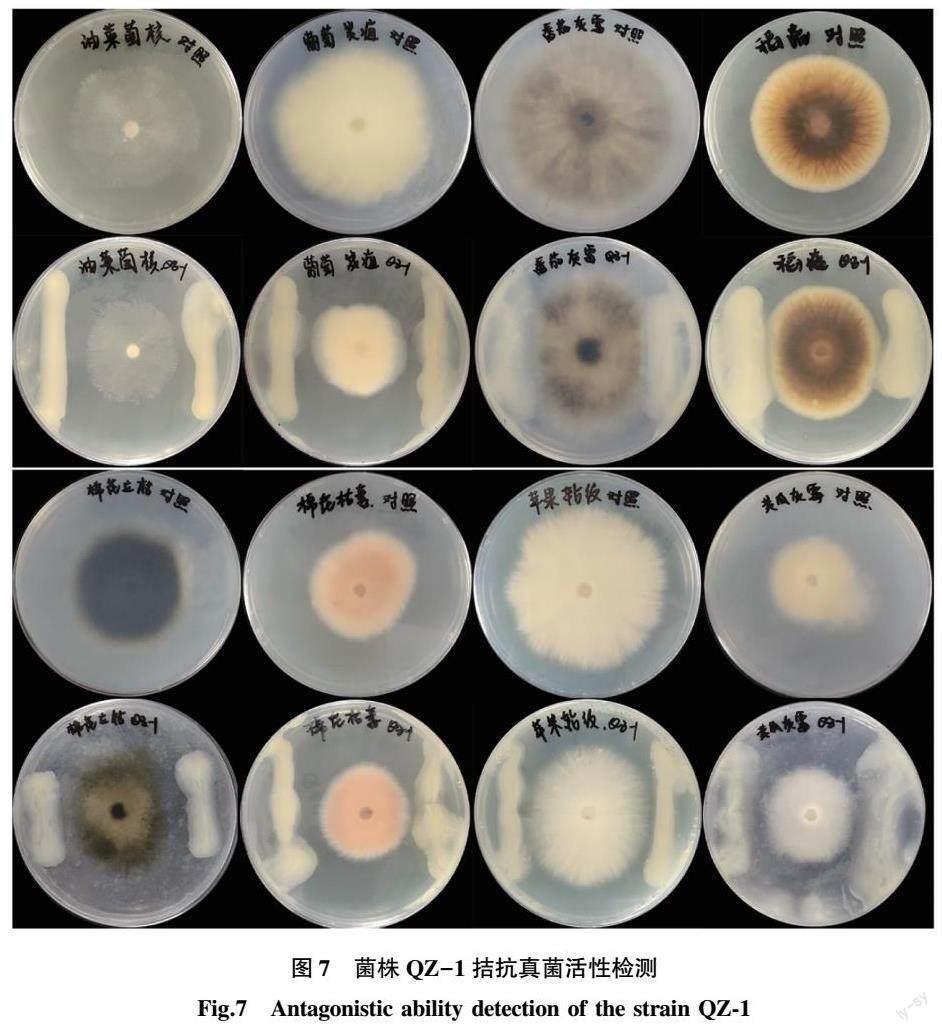
菌株QZ-1具有广谱抗真菌活性,对多种植物病原菌的抑制率从大到小依次为油菜菌核病菌(63.53%)、葡萄炭疽病菌(57.14%)、番茄灰霉病菌(48.75%)、稻瘟病菌(33.33%)、棉花立枯病菌(31.91%)、苹果轮纹病菌(21.88%)、棉花枯萎病菌(22.22%)、黄瓜灰霉病菌(8.57%),可见,其对油菜菌核病菌、葡萄炭疽病菌、番茄灰霉病菌活性的抑制效果较好,对黄瓜灰霉病菌活性的抑制效果最弱。与对照组相比,各试验组的抑菌圈边界清晰,抑菌圈周围菌丝生长缓慢(图7)。
3 讨论与结论
自生固氮菌可以独立进行固定空气中分子态氮,促进植物生长,增加农作物产量,在农业生产中发挥重要作用。植物叶际存在高水平的碳水化合物和碳氮比,营养物质丰富,存在广泛的固氮作用,在自然条件下已经发现菊科、禾本科、十字花科、蔷薇科、杜鹃科、榆科等科的植物叶际具有较高的固氮酶活性[2-3]。人工接种叶面固氮菌可以达到增产增收的效果,大豆喷施叶面固氮菌的增产率可达13%以上,玉米在苗期和孕穗期喷施叶际固氮菌可增产10%以上[4]。自生固氮菌因其不与植物形成宿主关系且适应能力强,具有增加农作物产量以及绿色环保等优点,已成为21世纪新型肥料发展的重要方向之一。
该研究从茄子叶际分离到一株自生固氮菌QZ-1,经16S rDNA序列比对分析鉴定为Klebsiella属,将其命名为Klebsiella sp.QZ-1。据研究报道,克雷伯氏菌属的一些种类是重要的条件致病菌和医源性感染菌,大部分克雷伯氏菌基因组可检测出固氮基因nif,说明该属细菌具有固氮的遗传基础,对植物的生长及代谢起着间接的促进作用,在农业生产中可作为一种绿色菌肥[13]。罗霆等[14]从甘蔗根系分离筛选到1株克雷伯氏固氮菌,其固氮百分率可达29.2%。李树品等[15]和黄磊等[16]从小麦根系分离得到3株具有高固氮酶活性的克雷伯氏菌。韩梅等[17]从玉米中分离的内生固氮菌克雷伯氏菌(K.trevisan),具有促进玉米生长的作用。该研究分离的自生固氮菌QZ-1在碳源氮源的利用方面基本与同属的固氮菌利用情况相似,在淀粉为碳源或者无氮条件下都能生长良好,能耐受低浓度的盐类,在偏酸(pH 5.0)的环境下生长良好,而现阶段报道的菌株适应的pH为5.5~7.2,该试验筛选菌株与一般的在酸性环境下难以生存的菌株形成差异,在菌肥应用中能更好地用于不同酸碱度的土壤,因此可以更广泛地应用在农业生产中。
克雷伯氏菌作为生防菌,对多种植物病原真菌均有抑菌活性。如Park等[18]研究发现产酸克雷伯氏菌(K.oxytoca)可防治胡萝卜软腐病。从石斛上分离到一株内生细菌(K.variicola)可防治由链格孢引起的烟草赤星病、甘蓝黑斑病和番茄早疫病等[19]。该研究中分离的菌株Klebsiella sp. QZ-1具有广谱抗真菌活性,对油菜菌核病菌、葡萄炭疽病菌、番茄灰霉病菌抑制效果可达40%以上。因此,自生固氮菌QZ-1的筛选为叶际固氮菌的研究提供了微生物资源,由于克雷伯氏菌繁殖速度快,对环境的适应能力强,具有固氮和生防作用,繁殖过程中能够产生黏液,易于在植物叶际定殖等优点,可望高效地应用于固氮菌剂中进行资源化利用。
参考文献
[1]VORHOLT J A.Microbial life in the phyllosphere [J].Nat Rev Microbiol,2012,10(12):828-840.
[2] 潘建刚,呼庆,齐鸿雁,等.叶际微生物研究进展[J].生态学报,2011,31(2):583-592.
[3] 沙小玲,梁胜贤,庄绪亮,等.植物叶际固氮菌研究进展[J].微生物学通报,2017,44(10):2443-2451.
[4] 王楠,李刚强,李云龙,等.固氮类芽孢杆菌的分离鉴定及其促生、抑菌活性的测定[J].中国农业科技导报,2019,21(5):95-103.
[5] GIRI S,PATI B R.A comparative study on phyllosphere nitrogen fixation by newly isolated Corynebacterium sp.& Flavobacterium sp.and their potentialities as biofertilizer[J].Acta Microbiol Immunol Hung,2004,51(1/2):47-56.
[6] MWAJITA M R,MURAGE H,TANI A,et al.Evaluation of rhizosphere,rhizoplane and phyllosphere bacteria and fungi isolated from rice in Kenya for plant growth promoters[J].SpringerPlus,2013,2:1-9.
[7]奚辉,陈喜靖,景金富,等.滴灌施肥对秋茄子生长、产量及品质的影响[J].浙江农业科学,2015,56(7):1000-1001,1003.
[8] 焦永刚,郭敬华,董灵迪,等.生物菌肥对土壤生态环境改良效果[J].北方园艺,2017(13):135-139.
[9] 李瑞芳,赵玉峰,薛雯雯,等.一株芽孢杆菌16S rRNA 的基因序列测定和系统进化分析[J].广东农业科学,2011,38(3):121-122,125.
[10] RSCH C,MERGEL A,BOTHE H.Biodiversity of denitrifying and dinitrogenfixing bacteria in an acid forest soil [J].Appl Environ Microbiol,2002,68(8):3818-3829.
[11] 王家和.烟草根病拮抗真菌的分离与筛选[J].中国生物防治,1998,14(1):28-31.
[12] 冯蓉,刘丽,陈海念,等.解淀粉芽孢杆菌F11抗真菌活性研究[J].农业资源与环境学报,2021,38(5):849-857.
[13] 李梦娇,彭晟,徐绍忠,等.克雷伯氏菌在农业与环境治理上的应用[J].生物技术进展,2014,4(6):415-420.
[14] 罗霆,歐阳雪庆,杨丽涛,等.1株有固氮能力的甘蔗克雷伯氏菌的分离鉴定及固氮特性[J].热带作物学报,2010,31(6):972-978.
[15] 李树品,蒋千里,楚杰,等.产酸克雷伯氏杆菌(klebsiella oxytoca)的分离及其特性研究[J].山东科学,1991,4(3):19-25.
[16] 黄磊,石万瑜,董绍佩,等.小麦根系克雷伯氏杆菌的分离与鉴定[J].新疆农业科学,1990,27(1):27-28.
[17] 韩梅,罗培宇,肖亦农,等.玉米内生固氮菌的分离鉴定及其促生长作用研究[J].沈阳农业大学学报,2010,41(1):94-97.
[18] PARK M R,KIM Y C,LEE S,et al.Identification of an ISRrelated metabolite produced by rhizobacterium Klebsiella oxytoca C1036 active against softrot disease pathogen in tobacco[J].Pest Manag Sci,2009,65(10):1114-1117.
[19] 李祖红,曾嵘,文国松,等.一株植物内生细菌SH-1及其应用:CN201310383464.0[P].2014-01-01.
