帕金森病患者血清代谢组学初步研究
2023-06-10兰甜甜侯莉微王珍珍李东初陈桂生
兰甜甜,常 乐,侯莉微,王珍珍,李东初,陈桂生
帕金森病(PD)是一种常见的神经退行性疾病,其发病率及死亡率正在逐年增加。如果能找到与帕金森病发生发展过程相关的潜在生物标志物,尽早明确诊断并采取干预措施,将在很大程度上改善帕金森病患者的预后[1]。以液相色谱-质谱联用(LC-MS)技术为核心的代谢组学分析技术是研究代谢物变化规律的有力手段[2]。本研究使用基于LC-MS的非靶向代谢组学研究方法,通过分析帕金森病患者的血清代谢物水平,试图找出与帕金森病相关的差异代谢物变化并进行代谢通路分析,从而初步筛选出可能用于帕金森病临床诊断的潜在生物标志物,为探索帕金森病可能的致病机制提供参考依据。
1 资料与方法
1.1 一般资料:选取2020年3月至2021年12月就诊于宁夏医科大学总医院神经内科门诊的30例原发性帕金森病患者为实验组(PD组)。
1.1.1 纳入标准:①患者年龄在18~80岁;②按照《中国帕金森病的诊断指南(2016版)》实施帕金森病诊断标准。
1.1.2 排除标准:①帕金森叠加综合征、多种因素引起的帕金森综合征及遗传性帕金森病综合征;②严重的全身性疾病。选取同时期就诊于宁夏医科大学总医院体检中心的15名受试者为健康对照组(HC组)。本研究已获得宁夏医科大学总医院伦理委员会批准,符合《赫尔辛基宣言》要求,所有参与者在参与研究前均已签署知情同意书。
1.2 血清样本的处理:使用一次性真空负压采血管抽取空腹状态下45名受试者静脉血液5 mL,将100 μL试样放入试管,加入300 mL抽提液,搅拌30 s,超声波10 min,-40 ℃放置1 h,离心15 min,取上清液并立即保存在-80 ℃低温冰箱中等待后续的上机检测[2]。
1.3 数据处理:采用 ProteoWizard软件把原始数据转化为 mzXML,再用 XCMS实现峰识别、峰提取、峰对齐、整合等处理,再将该物质与BiotreeDB(V2.1)自行建立的第二级质谱数据库相匹配[2]。
2 结果
2.1 一般情况:本研究共收集了45份血清样本,其中15份来自HC组,30份来自PD组。2组受试者年龄、性别、吸烟、饮酒、高血压、糖尿病、高脂血症、心血管疾病等一般情况比较差异无统计学意义,具有可比性。
2.2 代谢组学分析结果
2.2.1 质量控制:用质控(QC)样本间的反应峰高差来判定样本检测过程的稳定性[3],QC样本反应强度的稳定性良好。QC样本具有良好的聚合性能。
2.2.2 正交偏最小二乘法-判别分析(OPLS-DA):我们应用OPLS-DA对结果进行分析[2],2组样本区分非常显著,样本基本处于95%置信区间内。
2.2.3 差异代谢物的筛选:使用P值以及OPLS-DA模型第一主成分的变量投影重要度(VIP值)来筛选差异代谢物[4],筛选出的差异代谢物必须同时满足VIP值大于1和P值小于0.05。差异代谢物的筛选结果如表1所示,在PD组与HC组的对比中,一共筛选出30个差异代谢物。
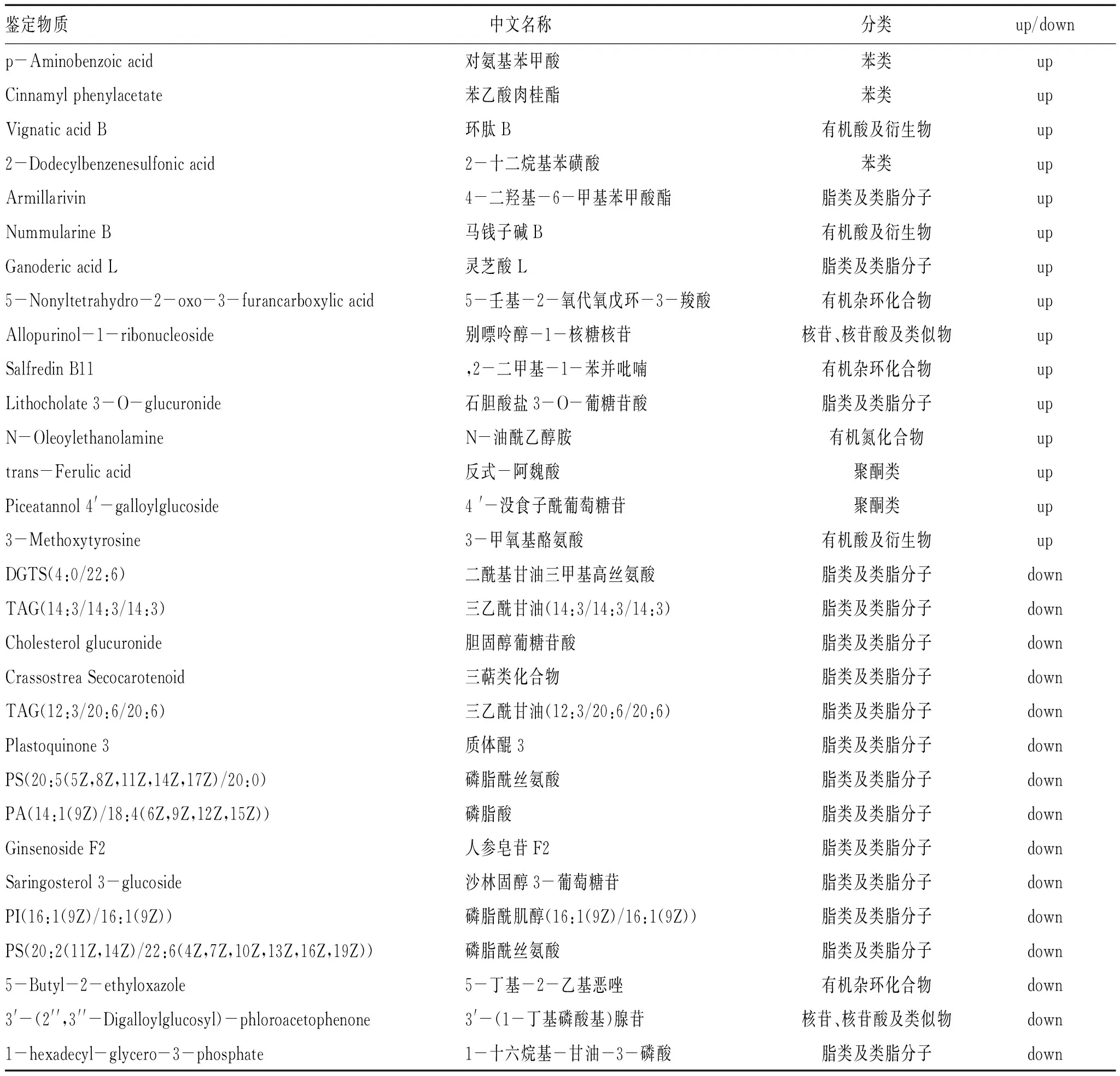
表1 差异代谢物基本信息
2.2.4 差异代谢物分类统计:本研究筛选出的差异代谢物包括脂类及类脂分子、苯类、有机酸及衍生物、有机氮化合物、有机氧化合物、有机杂环化合物及聚酮类等,其中脂类及类脂分子(甘油磷脂类为主)占比最高。
2.2.5 差异代谢物KEGG富集分析:本研究利用 KEGG数据库将30个差异代谢物所对应的代谢通路进行分类[5]。差异代谢物主要富集在13条代谢通路上。
2.2.6 差异代谢物代谢通路分析:对差异代谢物所在代谢通路进行综合分析[4]。图中富集程度高、影响因子大的深色大气泡代表了8条与差异代谢物相关性高的关键通路,它们分别是甘氨酸、丝氨酸和苏氨酸代谢,鞘脂代谢,嘌呤代谢,嘧啶代谢,精氨酸和脯氨酸代谢,原发性胆汁酸生物合成,叶酸生物合成和甘油磷脂代谢。
3 讨论
本次研究中共发现了30个差异代谢物,其中甘油磷脂类(GP)占比最大。GP主要用于构成生物膜及作为信号分子调控脂质代谢相关基因的表达[6],其可分为磷脂酸(PA)、磷脂酰乙醇胺(PE)、磷脂酰甘油(PG)、心磷脂(CL)、磷脂酰丝氨酸(PS)、磷脂酰胆碱 (PC)和磷脂酰肌醇(PI)[7]。
PE参与组成哺乳动物细胞膜,有研究资料指出帕金森病患者出现了PE含量显著下降的情况[8],PE是α-突触核蛋白和生物膜相互作用的关键桥梁,PE的缺乏可导致α-突触核蛋白稳定状态受损,这提示我们 PE的缺乏可能会加快 PD的病情进展[7]。PS在多种信号通路中发挥作用,有研究发现利用抗PS抗体阻断小胶质细胞介导的吞噬作用可以发挥对神经元的保护作用[9]。CL主要存在于线粒体内膜,有资料指出导致帕金森病发展的主要风险因子是线粒体功能障碍和异常蛋白质形成,PTEN诱导的激酶1(PINK1)基因表达突变会引起线粒体功能障碍,补充CL可修复线粒体功能[10]。
本研究还发现包括鞘脂代谢在内的8条关键代谢通路的紊乱可能参与了帕金森病的发生和发展。有研究表明,鞘脂代谢稳态的破坏与神经退行性病变中进行性神经元毒性变化有着很大关联[7]。鞘脂代谢通路的紊乱影响了细胞增殖、分化和运动等多种细胞过程。鞘脂在中枢神经系统中含量丰富,其代谢产物(神经酰胺、鞘氨醇、鞘氨醇1-磷酸酯)也起着调节信号分子的作用。有研究发现神经酰胺可能通过调节线粒体自噬来促进帕金森病的发生[11]。鞘氨醇激酶(Sphk1/2)主要负责合成鞘氨醇-1-磷酸,有研究发现在帕金森病小鼠模型中,Sphk2在小鼠中脑黑质区的含量显著下降[12]。有研究表明,葡糖基神经酰胺、鞘氨醇等与代谢病相关的鞘脂可在体外促进α-突触核蛋白聚集,这表明鞘氨醇是人类神经元内源性α-突触核蛋白聚集体形成的诱因[13]。
综上所述,帕金森病患者与健康对照组的代谢谱存在显著差异。初步确定可能与帕金森病发生发展相关的潜在生物标志物有30个,其中甘油磷脂类占比最大,这为进一步研究将甘油磷脂类代谢物作为帕金森病生物标志物和治疗靶点的潜力提供了一定的依据。此外,本研究还进一步观察到有8条代谢通路的紊乱可能是PD的潜在发病机理,其中鞘脂代谢障碍可能是帕金森病的关键代谢事件,上述发现在一定程度上提高了我们对帕金森病发病机理的认识,并有助于治疗干预的靶向筛选。本研究的局限性在于样本量少,未来还需要多中心多样本的临床研究来进一步验证并与其他神经退行性疾病的血清或血浆进行比较,以便筛选出帕金森病患者特异性的生物标志物。
