槲皮素抑制LPS诱导的大鼠急性肺损伤和巨噬细胞的促炎表型
2023-06-10李桂荣沈忱悠陈静瑜
李桂荣,沈忱悠,卫 栋,陈静瑜
急性肺损伤(ALI)是指心源性以外的因素导致急性的、进行性的、缺氧性的急性呼吸衰竭,典型特征是出现弥漫性肺泡损伤,肺组织发生过度炎症、水肿、肺透明膜,严重时导致急性呼吸窘迫综合症,致死率在29%~42%[1-3]。LPS作为TLR4激动剂可诱导急性肺损伤,激活TLR4信号途径,接着导致NF-κB信号途径的激活,促进炎症因子的表达[4]。急性肺损伤中,多种免疫细胞如巨噬细胞和中性粒细胞被激活和招募,尤其是肺泡巨噬细胞,占肺组织常驻细胞的80%,不同的微环境下呈现促炎和抗炎的表型,参与肺组织的炎症反应及组织修复[5-6]。
槲皮素是广泛存在于自然界的黄酮醇化合物,具有抗炎和抗氧化应激的作用[7]。越来越多的研究表明,槲皮素对不同因素导致的急性肺损伤有保护作用。在脂多糖(LPS)诱导的小鼠急性肺损伤中,槲皮素可以抑制肺组织炎症细胞的流入和cAMP-Epac信号途径,减轻了肺组织炎症损伤[8-9]。吸烟诱导的急性肺损伤,槲皮素可抑制肺组织的氧化应激压力和白细胞水平,减轻肺组织损伤[10]。在脓毒症诱导的小鼠急性肺损伤中,槲皮素可以通过SIRT1/AMPK信号途径降低氧化应激的压力,减轻肺组织损伤[11]。而槲皮素在脂多糖诱导的大鼠急性肺损伤中的作用和机制仍不清楚。本研究利用LPS诱导的大鼠急性肺损伤模型,研究槲皮素对急性肺损伤大鼠的保护作用及对巨噬细胞促炎表型的调节作用机制。
1 资料与方法
1.1 一般资料:SPF级SD大鼠,购于常州卡文斯实验动物有限公司[SCXK(苏)2021-0013],本研究符合一般动物实验伦理学原则;槲皮素购于Sigma公司;一抗抗体CD68、IRF5、Arg1、Notch1购于Abcam公司;内参β-actin、辣根过氧化氢酶标记的羊抗兔及羊抗鼠二抗、配制SDS-PAGE蛋白胶的相关试剂、动物RNA抽提试剂盒购于上海碧云天生物技术有限公司;生物素标记的羊抗兔二抗、链霉亲和素全长蛋白、DAB显色试剂盒购于Abcam公司;反转录试剂盒、实时荧光定量PCR试剂盒购于Takara公司;ECL底物发光液购于Thermo公司。
1.2 急性肺损伤动物模型的建立:30只SPF级SD大鼠,重量(200±30)g,随机分成3组,即对照组、脂多糖组、脂多糖+槲皮素组。在脂多糖组,用2%的戊巴比妥钠腹腔注射,给药40 mg/kg麻醉大鼠,剪开颈部皮肤,暴露气管,用1 mL注射器吸取LPS 100 μL,给药量5 mg/kg,经气管进行滴注,为了让LPS均匀分布到肺组织,滴注完LPS后,大鼠保持直立并旋转1~2 min,缝合皮肤,正常喂养,LPS刺激24 h 后取肺,部分肺组织-80 ℃冻存,部分肺组织置于10%中性福尔马林中固定,用于后续的病理实验。对照组的大鼠暴露气管后给予同等体积的PBS,取肺后部分组织-80 ℃冻存,部分组织置于10%中性福尔马林中固定。脂多糖+槲皮素组,腹腔注射给予槲皮素,一次给药量为50 mg/kg,同时气管滴注给予LPS (5 mg/kg),24 h后取肺,部分肺组织于-80 ℃冻存,部分肺组织置于10%中性福尔马林中固定,用于后续病理实验。
1.3 肺组织苏木精-伊红染色:苏木精-伊红染色(HE染色)的方法观察肺组织的病理变化,灌流后的左肺组织在10%中性福尔马林中固定24 h,进行梯度酒精脱水、二甲苯透明、浸蜡,然后包埋,切片,厚度为4 μm,对切片进行HE染色,中性树胶封片,光镜下拍照,观察肺组织病理变化。
1.4 肺组织湿干重比检测:用肺组织湿干重比检测肺组织的水肿变化程度。取新鲜的左肺组织,纱布吸取表面的液体,称取肺组织的质量为湿重,然后置于60 ℃烘箱中72 h,至肺组织质量不再发生变化时称取的质量为干重。湿重与干重的比值反应肺组织的水肿程度。
1.5 肺组织炎症因子的检测:qRT-PCR方法检测肺组织中炎症因子TNF-α、IL-1β的mRNA表达变化。设计合成引物1OD,TNF-α(上游序列5′-CTGGCGTGTTCATCCGTTCT-3′,下游序列5 ′-GCCACTACTTCAGCGTCTCG-3′),IL-1β(上游序列5 ′-AGGCTGACAGACCCCAAAAG-3′,下游序列5 ′-GCTCCACGGGCAAGACATA-3′),内参GAPDH(上游序列5 ′-CGCTAACATCAAATGGGGTG-3′,下游序列5 ′-TTGCTGACAATCTTGAGGGAG-3′),用RNA抽提试剂盒抽提右上肺组织RNA,用反转录试剂盒合成cDNA,实时荧光定量PCR进行扩增。GAPDH作为内参,用2-ΔΔCt方法计算目标基因TNF-α和IL-1β的相对表达量。
1.6 肺组织免疫组织化学实验检测:经多聚甲醛灌流后的肺组织置于10%中性福尔马林溶液中固定24 h,进行梯度酒精脱水、二甲苯透明、浸蜡、包埋。取左肺切片厚度4 μm,进行脱蜡复水,然后置于0.3%甲醇-H2O2溶液中浸泡20 min,灭活内源性过氧化物酶,切片置于枸橼酸缓冲液中用高压锅煮沸10 min,进行抗原修复。用5%的BSA室温封闭40 min后,一抗CD68,4 ℃孵育过夜。切片洗涤后,滴加生物素标记的二抗,室温孵育1.5 h,洗涤,用链霉亲和素-过氧化物酶封闭后,用DAB显色液显色,苏木精衬染、脱水、透明、封片,拍照观察。Image J软件计算各组图片的阳性细胞占总细胞的百分比,在分析过程中,各组取五张片子,每张片子取五个视野,统计分析CD68的表达差异。
1.7 Western blot 实验:取各组大鼠的右下肺组织,液氮下研磨成粉,RIPA裂解液提取蛋白,加入5×上样缓冲液混匀,100 ℃煮沸5 min,上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后电转移至PVDF膜上,转膜2 h,5%牛奶封闭1 h,加入一抗IRF5、Arg1、Notch1及β-actin抗体,4 ℃孵育过夜。TBST洗膜3次,辣根过氧化氢酶标记的羊抗兔和羊抗鼠二抗室温孵育1.5 h,TBST洗膜3次,ECL发光液显色,G:Box凝胶成像系统拍照。
2 结果
2.1 槲皮素抑制LPS诱导的大鼠肺组织炎症损伤:HE染色结果显示,在SD大鼠中,LPS刺激肺组织24 h后,造成肺组织急性的炎症损伤,肺泡壁增厚,肺泡腔发生炎症浸润,给予槲皮素后,肺泡腔的炎症浸润降低,肺泡壁厚度降低,见图1(目录后)。LPS刺激大鼠肺组织24 h后,肺组织湿干比值、炎症因子肿瘤坏死因子(TNF-α)、白细胞介素1β(IL-1β)的mRNA表达增加,与对照组相比差异有统计学意义(P<0.05),给予槲皮素后,肺组织湿干比值及炎症因子TNF-α、IL-1β的mRNA表达降低,与脂多糖组相比差异有统计学意义(P<0.05),见表1。
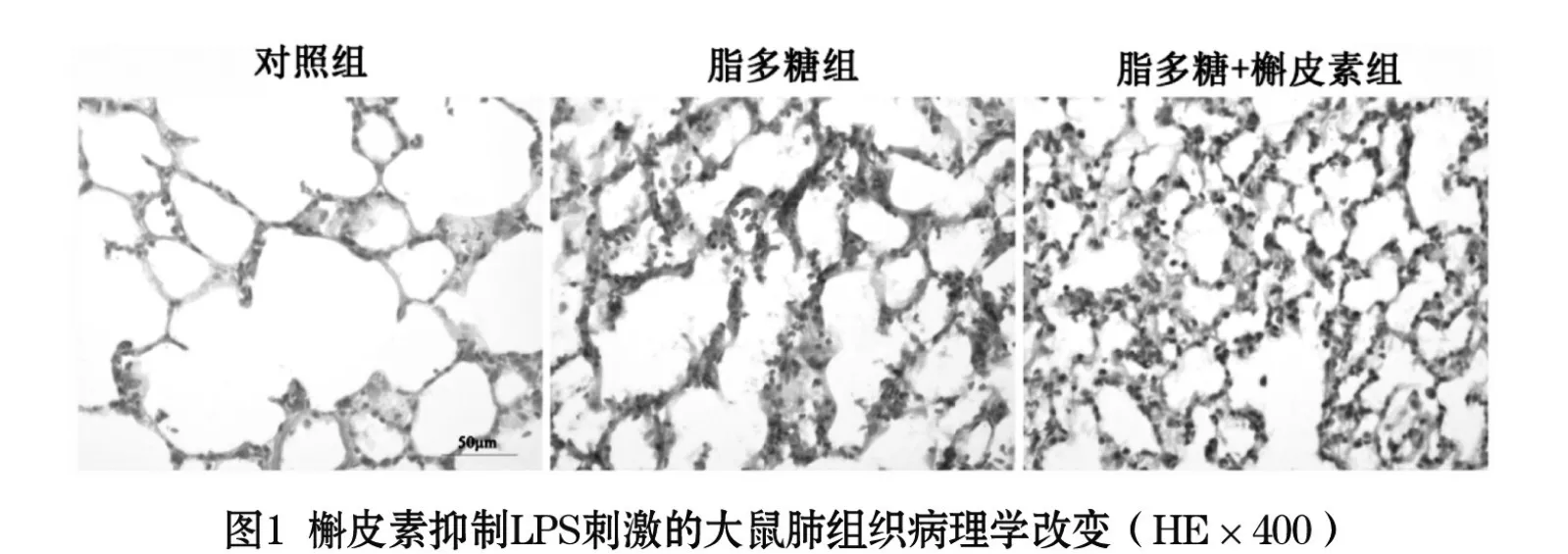
表1 槲皮素对LPS刺激大鼠肺组织湿干比和TNF-α、IL-1β的mRNA水平的影响
2.2 免疫组化染色观察槲皮素对LPS刺激大鼠肺组织中CD68的表达影响:免疫组织化学方法染色肺泡巨噬细胞的标志蛋白CD68,结果显示,LPS刺激大鼠肺组织24 h后,肺组织中肺泡巨噬细胞浸润,与对照组相比差异有统计学意义(P<0.05);给予槲皮素后,肺组织的巨噬细胞浸润程度显著降低,与脂多糖组比较差异有统计学意义(P<0.05),见图2(目录后)与表2。
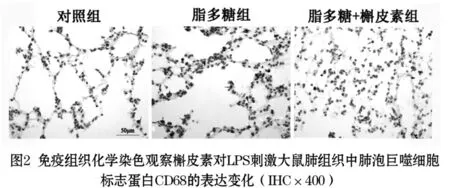
表2 免疫组化染色中各组大鼠肺组织CD68阳性细胞的百分比分析
2.3 Western blot分析槲皮素对LPS刺激大鼠肺组织中IRF5、Arg1和Notch1蛋白表达的影响:IRF5对肺泡巨噬细胞的促炎表型有关键的调节作用,Western blot结果显示,LPS刺激大鼠肺组织24 h后,IRF5的表达增加,给予槲皮素后,IRF5的表达降低。巨噬细胞抗炎表型的标志蛋白Arg1在LPS刺激24 h后表达降低,给予槲皮素后,Arg1蛋白表达上调。说明槲皮素可抑制肺组织巨噬细胞的促炎表型。此外,LPS刺激肺组织后,Notch1蛋白表达增加,腹腔注射给予槲皮素后,Notch1蛋白表达下降,结果表明槲皮素抑制了Notch1蛋白的表达,见图3(目录后)和表3。
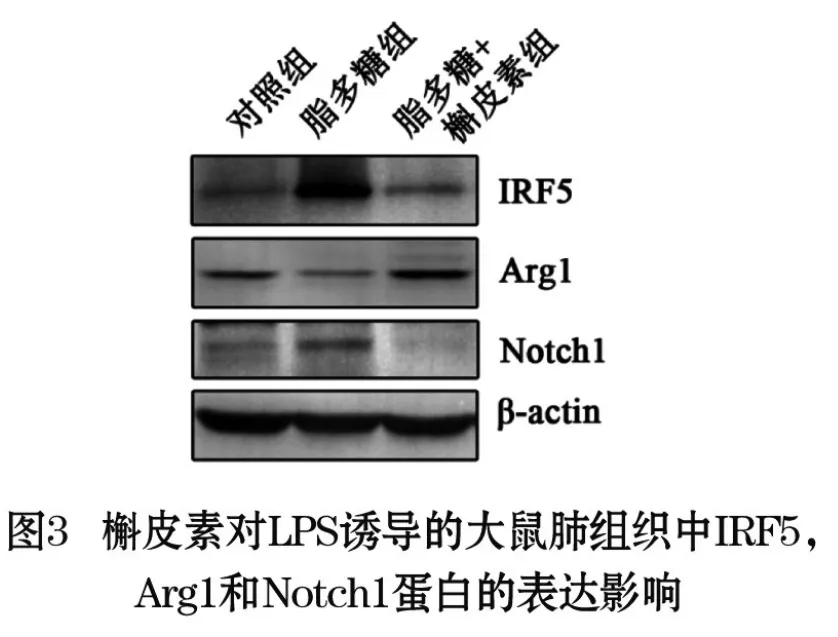
表3 槲皮素对LPS刺激的大鼠肺组织IRF5、Arg1、Notch1蛋白表达的影响
3 讨论
槲皮素是自然界广泛存在的黄酮类化合物,具有抗炎、抗氧化应激及抗纤维化的作用,很多研究表明针对不同的疾病动物模型,槲皮素的保护作用机制不同。在四氯化碳诱导的小鼠肝纤维化中,槲皮素可以抑制肝组织的炎症和纤维化,其机制与抑制肝组织M1型巨噬细胞的激活有关[12]。在盲肠结扎穿孔引起的休克中,槲皮素可降低氧化应激和炎症对肺组织的损伤[13]。在小鼠肾损伤中,槲皮素可通过调节巨噬细胞M1/M2极化衰减肾损伤和纤维化[14]。本研究的实验结果表明,槲皮素可抑制肺组织炎症浸润、肺水肿及肺组织炎症因子的表达,抑制肺组织中肺泡巨噬细胞的浸润和促炎表型可能与Notch1蛋白有关。
急性肺损伤是一个复杂的病理过程,肺泡巨噬细胞在急性肺损伤的病理生理过程中发挥关键的免疫调节作用[15]。在急性肺损伤的炎症反应阶段,肺泡巨噬细胞启动促炎的级联反应清理气道和肺泡的病原菌,传导固有免疫应答,早期分泌的促炎因子如TNF-α、IL-1β可招募中性粒细胞、巨噬细胞等。炎症阶段的肺泡巨噬细胞呈M1型,过度释放NO和MMP会直接导致组织的损害,也可以通过过度招募中性粒细胞和TH17细胞间接扩大组织损伤。在急性肺损伤的后期,肺损伤的修复机制被激活,伴随着病原菌的清除,促炎信号的降低及促炎中性粒和巨噬细胞的清除,巨噬细胞由促炎的M1表型转变为抗炎的M2表型,释放TGF-β、IL-10等产物,促进组织的修复[3,16]。本研究中,在LPS刺激大鼠肺组织后,CD68蛋白和IRF5蛋白表达上调,Arg1蛋白表达下调,肺组织的巨噬细胞发生浸润及呈现促炎的表型,应答肺组织的炎症反应。槲皮素抑制了CD68蛋白和IRF5蛋白表达,促进Arg1蛋白表达,抑制了肺泡巨噬细胞的浸润和促炎表型,进一步抑制肺组织的炎症损伤。
Notch信号通路广泛存在于脊椎动物和无脊椎动物体内,研究表明,Notch信号途径在免疫性疾病及炎症性疾病中,对巨噬细胞的活化能够发挥调节作用[17]。在风湿性关节炎疾病中,抑制Notch通路的激活,可降低关节炎的M1型巨噬细胞,增加M2型巨噬细胞,减轻关节组织的损伤[18]。Notch信号在糖尿病的损伤修复的早期有关键作用,可调节巨噬细胞依赖的炎症介质产物[19]。在骨髓源的巨噬细胞(BMDM)中,Notch通路直接抑制信号调节蛋白α(SIRPα)的表达,调控巨噬细胞的极化和吞噬作用[20]。本研究中,LPS刺激大鼠肺组织后,Notch1蛋白表达上调,加剧了肺组织炎症损伤,槲皮素抑制了Notch1蛋白的表达,因此,槲皮素对大鼠急性肺损伤的保护作用可能与Notch1蛋白相关,但具体机制需要进一步研究。
综上所述,LPS可诱导大鼠肺组织的急性肺损伤,肺组织发生水肿时炎症因子TNF-α和IL-1β表达上调,CD68蛋白上调,肺组织巨噬细胞发生浸润,促炎巨噬细胞标志蛋白IRF5表达上调,抑炎标志蛋白Arg1表达下调,肺部巨噬细胞呈现M1表型。给予槲皮素后,抑制了肺组织巨噬细胞的浸润,促炎表型和肺组织炎症损伤,因此槲皮素对大鼠急性肺损伤有保护作用。
