蚕豆叶保卫细胞和根边缘细胞对2种桉叶挥发物的响应及信号调节
2023-06-10孟巧巧何胜利马丹炜王亚男
王 强,孟巧巧,何胜利,马丹炜,王 煜,张 红,王亚男
(四川师范大学生命科学学院,成都 610101)
【研究意义】桉树(Eucalyptusspp.)为桃金娘科(Myrtaceae)桉属(Eucalyptus)植物的总称,原产于澳大利亚、印度尼西亚岛屿和马布亚新几里亚[1],被100多个国家广泛引种,是世界上最常见的人工造林树种[2-3]。根据Wu和Chen[4]的报道,中国桉树种植面积已经达到5.40×106hm2,其中蓝桉(Eucalyptusglobulus)和巨桉(E.grandis)为主要引种树种[4-6]。桉叶富含挥发油,当挥发性化感物质释放到环境中,大部分挥发进入大气作用于植物的地上器官,小部分进入土壤[7],因此,揭示桉树挥发性化感物质的化感效应,对桉树引种健康发展具有重要意义。【前人研究进展】近年来,桉树种植导致物种多样性和功能多样性下降等生态问题引起了高度关注[8-9]。桉叶富含挥发油,目前已从桉叶挥发油中鉴定出近80种化合物,主要包括桉油精、α-蒎烯、桉叶醇、柠檬烯、ρ-对伞花素、香茅醛、蓝桉醇等[10-11]。气孔保卫细胞能够感知胞间CO2浓度和可利用水分的变化,调节气孔开度以维持光合作用的最佳细胞状态[12],根尖是植物吸收水分和矿质营养最活跃的部位[13-14]。根边缘细胞(Root border cells, RBCs)与其分泌的粘液共同形成根尖保护鞘,在植物根系-外部环境之间构筑了一道生物、化学和物理屏障[15]。桉树挥发油具有植物毒性[16],释放到环境后对周围植物形成较强的化感胁迫[9,17]。化感作用是外来植物引起生物多样性下降的因素之一[18],受体对化感作用的耐受性和敏感性涉及复杂的生命活动过程。高等植物机体由多细胞构成,每一种细胞的生命活动均会受机体其他细胞制约。以单细胞模式系统作为研究化感作用的靶标,可排除干扰从而直观地洞察化感作用的本质。【本研究切入点】近年来,气孔保卫细胞和根边缘细胞逐渐成为评估胁迫的单细胞模式系统,具有反应灵敏、取材方便、易于控制试验条件、耗费少、周期短等优势[19-20],但桉树挥发物化感作用对保卫细胞和根边缘细胞影响的报道较少。【拟解决的关键问题】以中国桉树种植区主要农作物蚕豆(ViciafabaL.)为受体,研究叶气孔保卫细胞和根边缘细胞对蓝桉和巨桉的叶挥发油及其共有成分α-蒎烯和桉油精的响应和信号调节,旨在探讨桉树化感作用的分子生态过程,为桉树种植和资源管理提供理论依据。
1 材料与方法
1.1 挥发油及其处理母液的制备
蓝桉、巨桉叶采集于四川师范大学成龙校区及其附近街道,阴干后剪成小段,采用水蒸气蒸馏法[21]提取桉叶挥发油,无水Na2SO4除去水分,称重,4 ℃保存备用。经过GC-MS检测,确定桉油精和α-蒎烯为2种桉油的主要成分,蓝桉叶的桉油精和α-蒎烯分别为543.23 和156.72 mg/mL,巨桉叶的桉油精和α-蒎烯中分别为477.49和169.19 mg/mL。供试标准品α-蒎烯(≥99%)和桉油精(≥99%)购自科赛斯特(成都)科技有限公司。
用25%二甲基亚砜(DMSO)配制桉叶挥发物母液,蓝桉和巨桉的叶挥发油母液浓度为0.1 μL/μL(分别记为VL和VR),根据在桉叶挥发油中的含量配制主要成分的母液,其中,α-蒎烯为0.02 μL/μL,桉油精为0.06 μL/μL。
1.2 材料培养及其制备
供试植物蚕豆种子(成胡14#)购自成都市龙泉驿区大面镇街道种子市场;挑选大小均一、无病、无霉斑和颗粒丰满匀称的蚕豆种子, 0.5% KMnO4溶液消毒15 min,蒸馏水清洗5次, 25 ℃培养箱中浸种24 h后,均匀铺在垫有湿纱布磁盘中,再覆盖1层湿纱布,放入25 ℃培养箱中避光培养至种子露白。
RBCs收集:待露白蚕豆种子生长到根长约2 cm时截取2 cm根尖,取0.5 mL EP管若干,每个管中放入根尖5个,加入100 μL ddH2O,涡旋振荡30 s,取出根尖并用50 μL ddH2O冲洗2次,用移液枪吹打使细胞散开,获得根边缘细胞悬液,每管200 μL。
表皮条的制备:将露白蚕豆种子播种在盛有石英砂的花盆(直径10 cm,高6 cm)中,置于光暗周期14 h/10 h、25 ℃培养箱中培养。培养期间盆内Hoagland营养液保持在0.2%; 4周后取顶端1~2对完全展开的叶片,蒸馏水洗净后,在无叶脉的部位用镊子撕取1.0 cm×0.5 cm的叶下表皮条,浸入装有5 mL MES缓冲液的EP管中备用,每管5个表皮条。
1.3 根边缘细胞试验
挥发物处理后根边缘细胞的活性观察参照杨小环等[22]的方法。分别取处理母液1、2、3、4和5 μL,用25% DMSO补足体积至5 μL作为处理液,加入到200 μL根边缘细胞悬液中,以5 μL ddH2O为对照,每个处理重复3次。置于25 ℃培养箱中避光培养30 min。处理结束后,取细胞悬液10 μL加入4 μL吖啶橙和溴乙锭混合液(体积比为1∶1),混匀,暗处染色1~3 min,LEICA DM 3000荧光显微镜(蓝光,激发波长420~485nm)镜检,活细胞为绿色荧光,死细胞为橘红色荧光。统计死细胞和活细胞的数量,计算根边缘细胞的死亡率:死亡率=(死细胞数/总细胞数)×100%。
1.4 叶表皮条试验
将制备的表皮条随机分为3组。A组:分别取处理母液2、4、6、8和10 μL,用25% DMSO补足体积至10 μL作为处理液处理表皮条,以10 μL MES缓冲液为对照。B组:缓解组先用10 μL拮抗剂处理表皮条5 min,再加入8 μL母液和2 μL 25% DMSO,处理组为8 μL母液+2 μL 25% DMSO+10 μL MES缓冲液,对照组为20 μL MES缓冲液;拮抗剂包括泛Caspase抑制剂Z-VAD-FMK(10和40 μmol/L)、Ca2+通道阻断剂(0.1 mmol/L LaCl3)、活性氧清除剂抗坏血酸(0.1 mmol/L AsA)和硝酸还原酶抑制剂(0.1 mmol/L NaN3)。C组:缓解组分别取微丝聚合抑制剂细胞松弛素B(CB,10和20 μmol/L)、NADPH氧化酶抑制剂二联苯碘(DPI,1和2 μmol/L)和活性氧清除剂抗坏血酸(0.1 mmol/L)10 μL处理表皮条5 min,再加入8 μL 处理母液和2 μL 25% DMSO,混匀;处理组加入8 μL母液、2 μL 25% DMSO和10 μL MES缓冲液;20 μL MES缓冲液作对照。
A组、B组和C组每个处理重复3次,置于25 ℃、4000 lx光照培养箱中处理30 min。处理结束后测定相关指标。
蚕豆叶保卫细胞活性检测:细胞活性检测参照马丹炜等[23]的方法。A组和B组表皮条用MES缓冲液清洗3次后,铺展在载玻片上,吸去多余缓冲液,AO/EB避光染色3 min,LEICA DM 3000荧光显微镜(蓝光,激发波长420~485 nm)观察并拍照。每处理计数1000个蚕豆叶保卫细胞,重复3次。计算细胞存活率:细胞存活率(%)=活细胞数/细胞总数×100%。
蚕豆叶保卫细胞核畸变和细胞核形态检测:细胞核形态检测采用 Feulgen染色法[23]。A组表皮条用MES缓冲液清洗3次,卡诺固定液[v(冰醋酸)∶v(无水乙醇)=1∶3) 4 ℃下固定2 h,1 mol/L HCl 60 ℃解离8 min,清洗3次,Schiff试剂避光染色1 h。LEICA DM 3000光学显微镜观察并拍照。每处理计数1000个蚕豆叶保卫细胞,重复3次。计算细胞核畸变率:细胞核畸变率(%)=核畸变细胞数/细胞总数×100%。
TUNEL检测:参照黄素等[24]的方法。A组表皮条MES缓冲液清洗3次,卡诺固定液4 ℃下固定2 h,酶溶液(4%果胶酶,2%纤维素酶)37 ℃下酶解10 min,然后在2% triton-× 100溶液(PBS配制而成)中孵育5 min,PBS漂洗3次,将吸干水分的表皮条置于TUNEL反应混合物中,37 ℃避光染色60 min。LEICA DM 3000荧光显微镜(蓝光,激发波长420~485 nm)观察并拍照。
气孔开度检测:用MES缓冲液清洗A组和C组表皮条3次,平铺于载玻片上,在LEICA DM 3000光学显微镜下观察并测定,每次观察6个表皮条,每个表皮条随机选取3个视野(40×),每个视野随机选取10个气孔进行测量,每个处理组至少重复3次。
蚕豆叶保卫细胞内ROS、NO和Ca2+水平检测与原位观察:用MES缓冲液清洗A组表皮条3次,采用ROS、NO、Ca2+检测试剂盒(碧云天,上海)测定ROS、NO和Ca2+水平,用Nikon ECLIPSE 55i荧光显微镜观察胞内ROS、NO、Ca2+的分布,酶标仪测定蚕豆叶保卫细胞相对荧光值。
qRT-PCR分析:采用RNA提取试剂盒(福际,成都)提取A组叶表皮条的总RNA;用Primer Premier 5.0引物设计软件,设计蚕豆NADPH氧化酶基因(Rboh)和内参基因(EF-1-alpha)特异性引物。RbohF:5’-GGGTATTTGCTCTGTGGATTGG-3’;RbohR:5’-CCTGAGCCAAGTAATGGTGTTTC-3’;EF-1-alphaF:5’-ACGAGGCTCTCACTGAGGCTCTTCC-3’;EF-1-alphaR:5’-CCTTGGCAGGGTCATCCTTGGAGTTG-3’。
引物由武汉塞维尔生物科技有限公司合成,使用荧光定量PCR仪(Stepone plus,ABI)进行qRT-PCR分析。反应体系(25 μL)包含qPCR Mix 12.5 μL、7.5 μmol/L基因引物2.0 μL、反转录产物2.5 μL和ddH2O 8.0 μL。PCR扩增程序为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,40个循环;每处理重复3次;使用StepOne Software v2.3软件分析PCR过程的CT(Threshold cycle)值。
1.5 数据统计与分析
根据Williamson和Richardson[25]提出的化感作用响应指数(Allelopathy response index, RI)用于衡量化感作用强度。
式中,C为对照值,T为处理值,RI<0表示抑制效应,RI>0表示促进效应,其绝对值表示化感作用强度大小;化感作用综合效应(Synthesis effect,SE)为RI的算术平均值[26]。
采用SPSS 25.0对数据进行单因素方差分析(One-Way ANOVA)、Tukey检验多重比较(LSD)和Pearson相关性分析, Excel 2019作图。
2 结果与分析
2.1 桉叶挥发物对蚕豆根边缘细胞活性的影响
蚕豆RBCs活性随挥发物处理剂量升高而降低(图1)。与对照相比,挥发物处理组死亡率显著增加(P<0.05)。最大处理剂量时,蓝桉挥发油、巨桉挥发油、α-蒎烯和桉油精处理组的RBCs死亡率分别比对照上升5.15、5.30、2.97和2.66倍。表明桉叶挥发物对RBCs具有致死效应。

VL.蓝桉挥发油,VR.巨桉叶挥发油;不同字母表示在0.05水平上的差异显著性,下同。VL and VR were volatile oil from E. globulus and E. grandis, respectively. Different letters indicated significance of difference at 0.05 level. The same as below.图1 桉叶挥发物作用下蚕豆根边缘细胞死亡率的变化Fig.1 Change of mortality rates of V.faba root border cells treated with the volatiles from Eucalyptus leaves
2.2 桉叶挥发物对蚕豆叶保卫细胞的毒性效应
从图2可知,随着桉叶挥发物处理母液体积增加,蚕豆叶保卫细胞活性逐渐下降,达到最大处理剂量(10 μL)时,蓝桉和巨桉的叶挥发油处理组的蚕豆叶保卫细胞存活率分别比对照组下降30.31%和43.22%。

图2 桉叶挥发物作用下蚕豆叶保卫细胞活性的变化Fig.2 Changes of the guard cell activities of V. faba leaves treated with the volatiles from Eucalyptus leaves
AO/EB染色结果表明,蚕豆叶保卫细胞的细胞核在对照组中大多呈均匀的绿色荧光(图3-a,3-b),而处理组则出现了橘红色荧光(图3-d,3-f),且表现为剂量依赖效应,表明挥发物降低了蚕豆叶保卫细胞活性;Schiff试剂染色结果显示,蚕豆叶保卫细胞的细胞核在对照组中位于细胞中央,形态规则(图4-a),而处理组则出现固缩(图4-b)、拉长(图4-c)、畸形(图4-d)、裂解(图4-e)以及核消失(图4-f)等畸变特征,核畸变率呈剂量依赖性升高(P<0.05)(图5),当达到最大处理剂量时,蓝桉挥发油、巨桉挥发油、α-蒎烯、桉油精处理组的细胞核畸变率分别达到69.43%、52.52%、42.50%和40.14%。表明桉树挥发物降低了蚕豆叶保卫细胞活性。
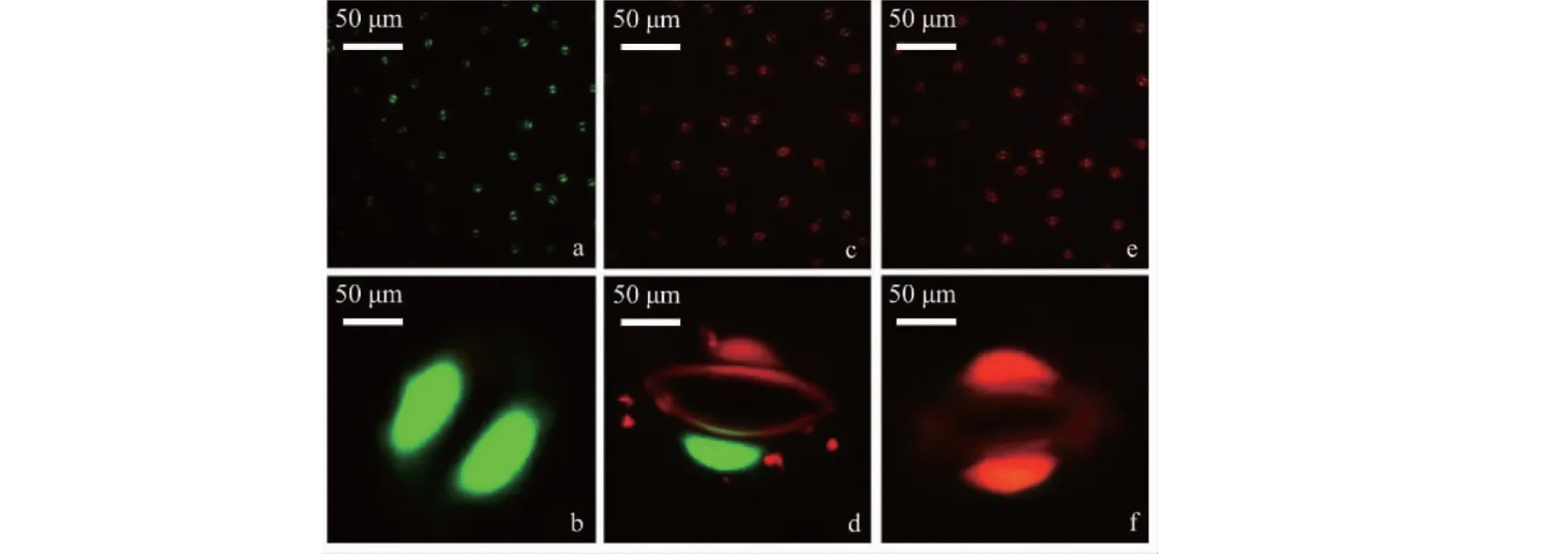
a和b对照组;c. 低剂量处理组;d. 高剂量处理组; e. 气孔单保卫细胞活性丧失;f. 气孔双保卫细胞活性丧失。a and b.Control group; c. Low-dose treatment group; d. High-dose treatment group; e. Loss of single guard cell activity; f. Loss of double guard cell activity.图3 桉叶挥发物作用下蚕豆叶保卫细胞的荧光显微图Fig.3 Fluorescence images of V. faba leaf guard cells treated with volatiles from Eucalyptus leaves

a.对照组;b.核固缩;c.核拉长;d.核畸形;e.核裂解;f.核消失。a.Control group; b.Nuclear pyknosis; c.Nuclear elongation; d.Nuclear deformity; e.Nuclear lysis; f.Nuclear disappearance.图4 桉叶挥发物作用下蚕豆叶保卫细胞核形态的变化Fig.4 Changes of the nucleus morphology of V. faba leaf guard cells treated with volatiles from Eucalyptus leaves

图5 桉叶挥发物作用下蚕豆叶保卫细胞核畸变率的变化Fig.5 Changes of the nuclear aberration rates of V. faba leaf guard cells exposed to Eucalyptus volatiles
TUNEL检测结果(图6)表明,桉叶挥发物处理后,蚕豆叶保卫细胞均呈绿色荧光,表明挥发物诱导蚕豆叶保卫细胞发生凋亡,其中α-蒎烯和桉油精处理组的荧光相对较弱;当泛Caspase抑制剂Z-VAD-FMK与挥发物共处理时,蚕豆叶保卫细胞的绿色荧光强度变弱,表明蚕豆叶保卫细胞活性显著升高; Z-VAD-FMK浓度越高,蚕豆叶保卫细胞活性越大(图7),表明桉叶挥发物诱导的蚕豆叶保卫细胞凋亡为Caspase依赖性细胞凋亡。

图6 桉叶挥发油作用下蚕豆叶保卫细胞TUNEL原位图Fig.6 TUNEL in situ image of leaf guard cells of V. faba exposed to Eucalyptus volatiles

图7 Caspase抑制剂与桉叶挥发物共同处理下对蚕豆叶保卫细胞活性的变化Fig.7 Changes of guard cell activities of V. faba leaves co-treated with Caspase inhibitor and Eucalyptus volatiles
2.3 桉叶挥发物作用下蚕豆叶保卫细胞信号分子的变化
桉叶挥发物处理后蚕豆叶保卫细胞内ROS、NO、Ca2+含量显著增加(图8),其中挥发油处理组变化最明显,用蓝桉和巨桉的叶挥发油处理后,蚕豆叶保卫细胞内ROS含量分别为对照的6.97和4.93倍;NO含量分别为对照的2.76和2.36倍;Ca2+含量分别为对照的4.17和3.75倍。

图8 桉叶挥发物作用下蚕豆叶保卫细胞ROS、NO和Ca2+水平的变化Fig.8 Changes of ROS,NO and Ca2+ levels of leaf guard cells in V. faba exposed to Eucalyptus volatiles
当LaCl3、NaN3和AsA分别与挥发物共处理时,蚕豆叶保卫细胞存活率显著高于挥发物处理组(图9),表明胞内信号分子ROS、NO和Ca2+参与了挥发物诱导的蚕豆叶保卫细胞死亡。荧光定位试验结果(图10)表明,与挥发油处理组相比,AsA共处理组蚕豆叶保卫细胞内NO和Ca2+水平较低, NaN3共处理组蚕豆叶保卫细胞内ROS和Ca2+水平较低, LaCl3共处理组蚕豆叶保卫细胞内ROS和NO水平差异不明显。由此推测桉叶挥发油诱导蚕豆叶保卫细胞ROS和NO升高,从而调节胞内Ca2+水平。
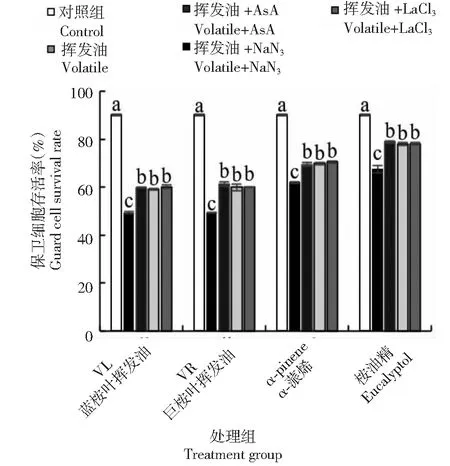
图9 桉叶挥发物与ROS、NO和Ca2+抑制剂共处理下蚕豆叶保卫细胞存活率的变化Fig.9 Changes of guard cell activities of V. faba leaves co-treated with ROS, NO and Ca2+ inhibitors and volatiles of Eucalyptus
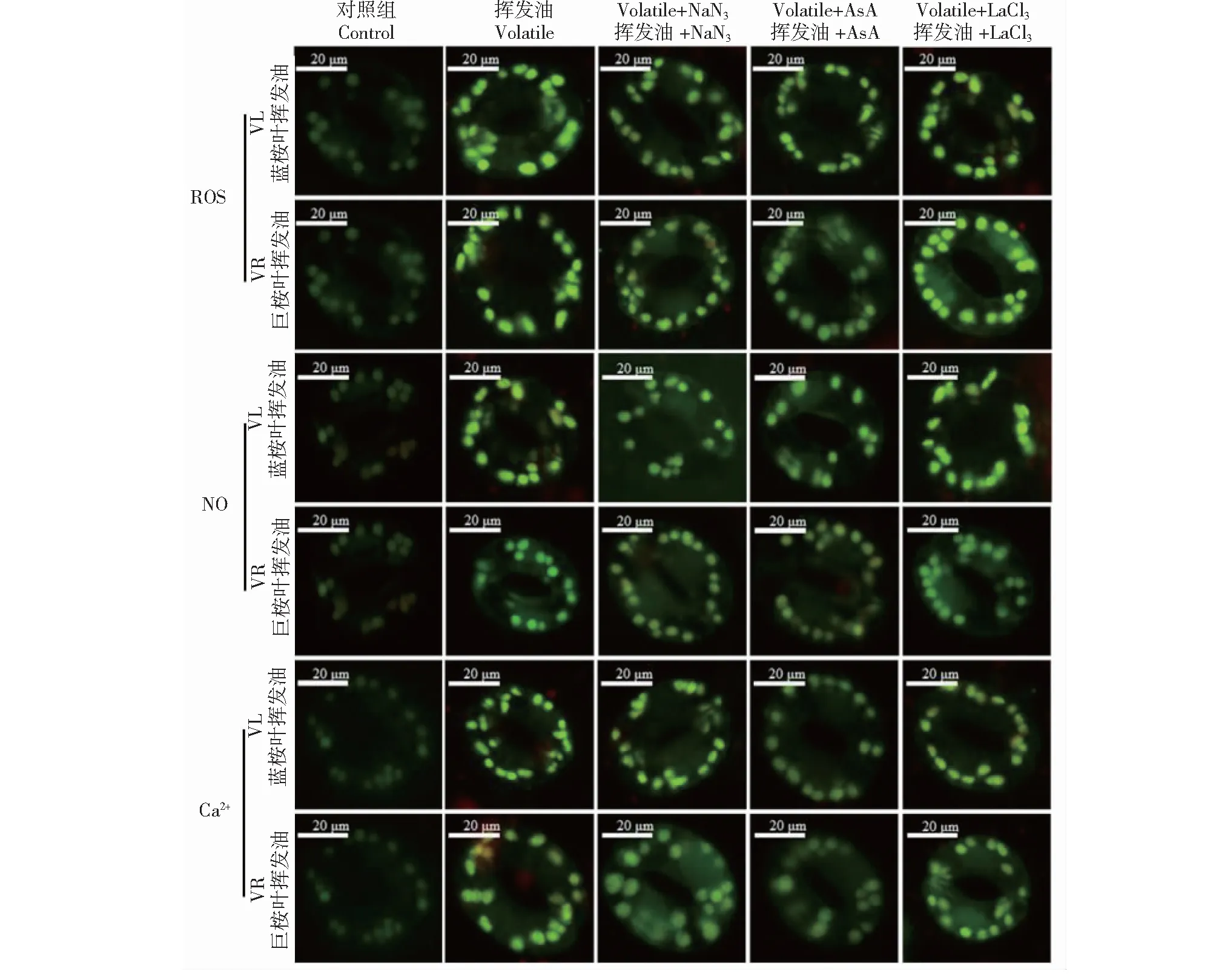
图10 NaN3、AsA和LaCl3与桉叶挥发油共处理后蚕豆叶保卫细胞内ROS、NO和Ca2+荧光定位Fig.10 Fluorescence localization of ROS,NO and Ca2+ in V. faba L. leaf guard cells under the combined action of NaN3, AsA and LaCl3 with three Eucalyptus volatile oils
2.4 桉叶挥发物对蚕豆叶气孔运动的影响
蚕豆叶气孔开度随桉叶挥发物剂量升高逐渐下降(图11)。最大处理剂量组中,蓝桉挥发油、巨桉挥发油、α-蒎烯和桉油精处理组的气孔开度仅为对照组的22.31%、22.45%、30.26%和27.87%。

图11 桉叶挥发物作用下蚕豆叶气孔开度的变化Fig.11 Changes of the stomatal aperture of V. faba leaves exposed to Eucalyptus volatiles
与挥发物处理组相比,CB、DPI和ASA与挥发物共处理组均表现出气孔开度显著增大(图12)。CB和DPI浓度越大,气孔开度越大。表明桉叶挥发物引起蚕豆叶保卫细胞内微丝聚合、ROS和NADPH氧化酶活性升高,导致气孔关闭。
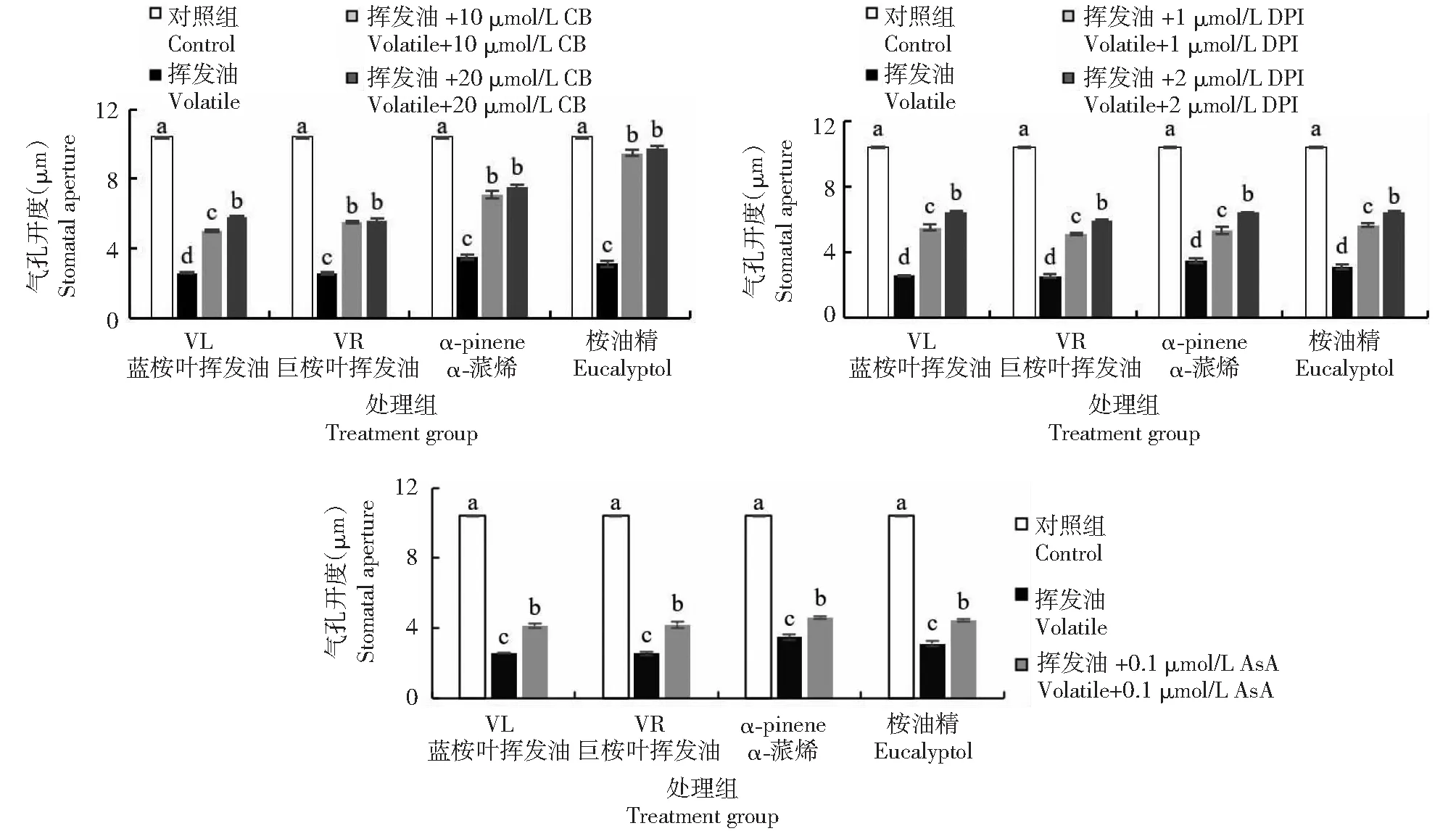
图12 桉叶挥发物与CB、DPI和ASA共处理下蚕豆叶气孔开度的变化Fig.12 Changes of the stomatal aperture of V. faba leaves co-treated with volatiles from Eucalyptus leaves with CB, DPI and ASA
2.5 蚕豆叶片NADPH氧化酶Rboh基因的表达
qRT-PCR结果(图13)显示,在桉树叶挥发物作用下,蚕豆叶片内NADPH氧化酶基因Rboh表达显著上调,其中以巨桉叶挥发油处理组上调幅度最大,为对照组的14.2倍,表明桉叶挥发油改变了叶片基因表达,引起细胞内ROS水平增加。这一结果印证了蚕豆叶保卫细胞活性和气孔开度与ROS变化相关的结果。
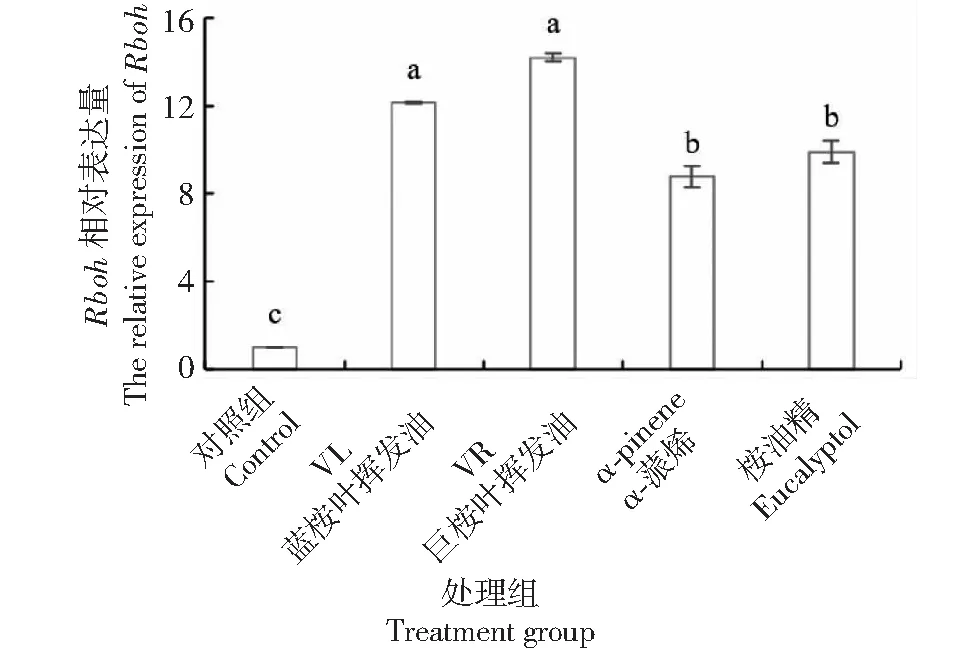
图13 桉树叶挥发油作用下NADPH氧化酶基因Rboh相对表达量的变化Fig.13 Changes in the relative expression of NADPH oxidase Rboh exposed to Eucalyptus volatile oils, α-pinene and eucalyptol
2.6 不同桉叶挥发物对蚕豆细胞的化感效应及分子机制
根据化感综合效应指数可知,4种挥发物化感综合效应由大到小依次为蓝桉挥发油(0.529)>巨桉挥发油(0.525)>α-蒎烯(0.441)>桉油精(0.421),α-蒎烯和桉油精与2种挥发油的化感效应呈极显著正相关(P<0.01),表明二者是桉叶挥发油的主效化感物质。
桉树挥发物对蚕豆细胞化感作用的分子机制如图14所示。

a.桉叶挥发物的作用途径;b.受体叶保卫细胞的信号调节。a.The action pathway of Eucalyptus volatiles;b.Signal regulation of receptor guard cells.图14 蓝桉和巨桉通过挥发途径化感作用的分子机制Fig.14 Molecular mechanism of allelopathy of E. globulus and E. grandis via volatile pathway
3 讨 论
3.1 桉叶挥发物对蚕豆根边缘细胞和蚕豆叶保卫细胞的毒性效应
植物释放的挥发性化感物质进入土壤后会破坏根的微观结构,干扰植物的矿物质元素吸收和光合作用[27]。作为植物根系的第一道防御屏障,根边缘细胞通过加速死亡[28]或分泌一些活性物质螯合有毒物质[29],可在一定程度上阻止有毒物质侵入根系,从而缓解毒害作用[29-30],但这种缓解效应具有一定的阈值。桉树油具有显著的植物毒性[31-32],对其他植物的种子萌发和幼苗生长均具有很强的化感作用[32-33]。本研究表明,在桉树叶挥发物作用下,蚕豆的根边缘细胞和叶保卫细胞活性均降低,保卫细胞出现了固缩、裂解、消失等多种类型的核畸变,并出现Caspase依赖性细胞凋亡,引起保卫细胞内微丝聚集、气孔关闭。这些现象说明桉叶挥发物具有较强的细胞毒性,通过破坏根系的防御功能、干扰光合作用过程而影响植物的生长发育,而且α-蒎烯和桉油精的化感作用明显,推测二者是桉叶挥发油的主要化感物质。
3.2 桉叶化感胁迫下蚕豆叶保卫细胞NO和ROS的串扰
当外界胁迫超出植物自身的耐受范围时,植物体内往往会出现ROS爆发[34]。 在植物发生氧化应激过程中,ROS往往与NO、Ca2+等信号分子相互作用[35],ROS和NO之间的平衡是调控细胞凋亡的决定性因素[36-37]。一方面NO作为一种保护性抗氧化剂直接淬灭ROS[38],形成毒性较小的ONOOH,防止细胞损伤[39]。 另一方面,高浓度的NO和ROS协同作用,二者均可使线粒体释放Cyt c,产生Caspase样信号级联,导致细胞凋亡[40-41]。此外,NO也可独立诱导细胞凋亡,如Cd胁迫下拟南芥大量积累NO,激活MPK6介导的Caspase-3样细胞凋亡[42]。本研究表明,在桉叶挥发物作用下,蚕豆叶保卫细胞内ROS、NO、Ca2+水平呈剂量依赖性大幅上升, ROS、NO、Ca2+清除剂显著缓解了挥发物对叶保卫细胞的致死效应,主要表现为NO合成抑制剂NaN3使ROS和Ca2+水平降低,抗氧化剂AsA降低胞内ROS水平进而降低NO和Ca2+水平。但Ca2+通道特异性抑制剂LaCl3阻止胞外Ca2+内流后,胞内ROS和NO水平无明显变化。说明,在桉叶挥发物诱导蚕豆叶保卫细胞死亡过程中,ROS和NO均能调节胞内Ca2+水平,而Ca2+对ROS和NO水平没有明显影响,推测在2种桉叶挥发油及其主成分作用下,蚕豆叶保卫细胞通过NO直接调节Ca2+信号,或通过ROS调节Ca2+信号系统,改变胞内相关基因表达水平引起细胞凋亡。
3.3 桉叶化感作用对蚕豆叶气孔运动的作用机制
环境变化时气孔能感知植物胞间CO2浓度和水分含量,通过调节气孔开度来维持光合作用最佳条件。气孔运动的信号调控网络十分复杂,其中ROS作为信号分子起着关键作用[13],ROS的产生与NADPH氧化酶密切相关。本研究中,在桉叶挥发物作用下蚕豆叶气孔开度下降,质膜NADPH氧化酶基因Rboh表达上调,而NADPH氧化酶抑制剂和细胞松弛素B可缓解气孔关闭,表明桉叶挥发物导致蚕豆叶保卫细胞内NADPH氧化酶活性增加,ROS爆发,微丝聚合,从而引起气孔关闭,势必会影响光合作用过程,这些结果与Laila等[43]和魏爱丽等[44]研究逆境胁迫的结果较为相似。
4 结 论
蓝桉和巨桉的叶挥发油及其共有成分α-蒎烯和桉油精具有细胞毒性,通过毒害根边缘细胞,破坏根系保护屏障,影响根系对水分和矿质元素的吸收;在桉叶挥发物作用下,蚕豆叶片内NADPH氧化酶基因表达上调,保卫细胞ROS爆发导致核畸变和微丝聚合,ROS和NO相互串扰导致胞内Ca2+浓度升高, 最终诱导蚕豆叶保卫细胞发生Caspase依赖性凋亡,影响气孔运动和光合作用。
