烟草短期连作对根际微生物和代谢物的影响
2023-06-10赖先军张文友段旺军王海燕
赖先军,颜 朗,张文友,段旺军,王海燕
(1. 西昌学院/攀西特色作物研究与利用四川省重点实验室,四川 西昌 615013;2. 四川中烟工业有限责任公司,成都 610066;3. 四川大学生命科学学院/分子生物学及生物技术四川省重点实验室,成都 610065)
【研究意义】烟草是一种忌连作的经济作物,长期连作种植会导致植烟土壤性质恶化,增加病虫害的发生概率,进而影响烟草的正常生长,制约烟草生产的可持续发展[1-2]。然而,随着我国耕地面积不断降低,为提高耕地利用率,连作成为我国西南山区烟叶的主要种植制度。目前,通过套作和合理施肥能够在一定程度上提高土壤微生物群落多样性,改善某些微生物对烟苗的生长抑制,减轻连作障碍带来的损失[3-5]。因此,探索植烟土壤连作障碍发生的机理,了解烟草连作障碍与根际微生物及代谢物的关系对于指导合理施肥及连作土壤修复具有一定意义。【前人研究进展】连作障碍产生的原因主要是植烟土壤微生物种群结构失衡、土壤理化性质恶化以及根系分泌物化感自毒作用[6]。目前,对于连作障碍机理的研究大多集中在土壤微生物区系变化对土壤养分和酶活性的影响方面。研究表明,作物中长期连作使植烟土壤微生物种群失调,主要表现在随着烟田连作年限的增加,细菌数量下降,真菌和放线菌数量增加[7-8]。相比中长期连作,短期连作(连作年限≤3年)土壤中仍具有较高的微生物活性,其土壤微生物具有较高的碳源利用率[9]。因此,短期连作并不会造成土壤养分及酶活性的恶化。【本研究切入点】烟草在短期连作中依然表现出一定的连作障碍,比如仅连作1年烟叶中出现总氮含量降低、黑胫病发病率较未连作烟田显著增高等。因此,烟草连作障碍的发生机制究竟是植烟土壤微生物种群失调还是土壤中某些元素的缺失,亦或是根系分泌物化感自毒作用,值得深入研究。【拟解决的关键问题】本研究利用多组学分析,基于高通量测序技术与超高效液相色谱串联四级杆飞行时间质谱技术,以种植红花大金元和云烟87两个品种的连作和非连作植烟根际土壤为材料,研究烟草短期连作对根际微生物和代谢物多样性的影响,为进一步解析烟草连作障碍机理提供理论基础。
1 材料与方法
1.1 样品收集
本实验采样地点位于四川省凉山州西昌市西昌学院校内实验田。在同一生态区域内,分别选择连续单作2年烟草土壤和休耕2年土壤,划分小区随机种植两个烟草品种红花大金元和云烟87,待烟苗进入团棵期进行根际土壤取样。为保证结果的准确性,每个处理设置6个重复,每个重复取3株烟苗,共收集24个根际土壤样品。根际微生物样品制备采用震荡法,准备含40 mL 无菌PBS缓冲液的无菌离心管2~3个,将收集到的烟苗用力抖落泥土后,将根剪下放入离心管中,用力震荡2~3 min,静置5~10 min,待土粒自然沉降后,取出根系放入另一离心管并重复此步骤1~2次。收集含沉降土粒的洗涤液,静置5~10 min,待土粒自然沉降后,留取10 mL上层液体涡旋30 s,分装至2 mL 或更大体积的EP管或冻存管中,用于根际微生物DNA制备。同时,取团棵期烟苗,3株为1个重复,每个处理设置3个重复,收集12个样品后,按上述方法制备实验样品,进行根际土壤代谢物检测。
1.2 主要试剂与仪器
试剂:建库DNA提取试剂盒购置于美国MOBIO公司的Power Soil DNA Isolation Kit试剂盒,用于代谢组分析所需试剂有LC-MS级甲醇,LC-MS级乙腈,Merck公司;≥98% L-2-氯苯丙氨酸,上海阿拉丁;LC-MS级甲酸,TCI公司。
仪器:用于微生物多样性测序所需仪器有Bio-Rad PCR仪、Eppendorf离心机、超微量分光光度计Nanodrop 2000,高通量测序仪Illumina MiSeq 2500。用于代谢组分析所需仪器有超高效液相色谱Waters UPLC Acquiy I-Class Plus; 高分辨质谱Waters UPLC Xevo G2-XS QTof;色谱柱Acquity UPLC HSS T3 1.8 um 2.1 mm×100 mm, Waters。
1.3 样品16S rRNA和ITS基因组测序
样品基于Illumina MiSeq测序平台进行细菌和真菌高通量测序。使用DNA提取试剂盒对样品中微生物的基因组DNA进行抽提。使用超微量分光光度计(Nanodrop 2000)检测DNA浓度≥20 ng/mL,OD260/280为1.8~2.0,OD260/230为1.8~2.0即为合格。提取的总DNA在1%琼脂糖凝胶电泳下检查完整性,随后稀释至3.5 ng/μL并保存于-20 ℃条件下用于后续PCR扩增。使用引物338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)扩增细菌16S rRNA基因的V3~V4区域,使用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’) 扩增真菌ITS区域,并采用 Illumina MiSeq 2×300 测序平台对 PCR 扩增产物进行双端测序。测序部分委托北京百迈客生物科技有限公司完成。
1.4 样品代谢物检测
采集的样本经提取离心后,每个样本各取10 μL制成混合QC样本,随即将所有样本上机检测。正离子模式扫描下流动相 A为0.1%甲酸水溶液, B为0.1%甲酸乙腈;负离子模式扫描下流动相 A为0.1%甲酸水溶液,B为0.1%甲酸乙腈,进样体积为1 μL,梯度洗脱条件见表1。

表1 流动相梯度洗脱条件Table 1 Gradient elution conditions of mobile phase
1.5 数据处理与统计分析
对测序原始数据进行质控。首先进行质量过滤,即使用 Trimmomatic v0.33软件[10],对测序得到的Raw reads进行过滤;然后使用cutadapt 1.9.1软件进行引物序列的识别与去除[11],得到不包含引物序列的Clean reads。使用 Usearch v10软件进行双端序列拼接,然后根据不同区域的长度范围对拼接后数据进行长度过滤;随即使用 UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(Effective reads)。基于有效数据进行OTUs(Operational taxonomic units)物种分类分析,并通过物种注释,得到每个样品的OTUs分类的基本分析结果。最后,对OTUs进行丰富度、多样性指数分析、Alpha多样性指数统计。
对下机的代谢组数据,使用MassLynx V4.2将采集的原始数据通过Progenesis QI软件做峰提取[12]、峰对齐等数据处理操作,基于Progenesis QI软件在线METLIN数据库进行鉴定,同时进行理论碎片识别,质量数偏差均在100 ppm以内。最后以两组间的差异倍数(Fold change,FC≥2)筛选获得差异代谢物。
2 结果与分析
2.1 短期连作与未连作植烟根际微生物差异分析
2.1.1 菌群结构分析 基于细菌 16S rRNA 基因 V3~V4 区和真菌 ITS1 区高通量测序,对两个烟草品种连作与未连作植烟土壤根际微生物群落结构进行分析。24个根际土壤样本测序序列经质控后依据97%序列相似性聚类获得细菌1760个OTUs。使用 M 值方法对每个样本中OTU数量进行标准化,所有样本中 OTU 的覆盖率均>99.3%,说明该测序量能够反映样本中微生物群落的真实情况。使用相同方法,聚类共获得1198个真菌OTUs,覆盖率均大于99.9%。经统计不同样本间OTUs数量后发现,两个品种间、连作与未连作处理间OTUs数均无显著差异。
构建稀释曲线分析组间样品菌群结构差异。如图1-A~D所示,虽然红花大金元品种的根际细菌多样性较云烟87品种更高,短期连作土壤根际细菌菌群多样性较未连作土壤更高,但其物种丰富度差异均不显著(P>0.05)。因此,根际细菌菌群多样性在不同品种间、连作与未连作组间均无显著差异。在真菌群落中,红花大金元品种根际真菌群落多样性高于云烟87品种,但差异不显著(P>0.05)。未连作土壤根际真菌多样性显著高于短期连作土壤根际真菌多样性,短期连作土壤中根际真菌丰度和均匀度显著降低。真菌菌群α多样性指数结果也表明,短期连作土壤与未连作土壤相比,Chao1指数、ACE指数和Shannon指数均显著降低。同时,连作与未连作根际土壤间根际细菌菌群OTUs均为共有OTUs,未见特异性细菌类型,而真菌菌群间有51个OTUs为未连作土壤中特异性类群,21个为连作土壤中特异性类群(图1-E~F)。

A~B. 不同品种间以及不同连作处理间细菌菌群稀释曲线;C~D. 真菌菌群稀释曲线;E~F分别为短期连作与未连作植烟土壤根际细菌和真菌样品间共有和特有OTU数量。A-B. Rarefaction curve for alpha diversity measures of bacteria; C-D. Fungal communities between different varieties and different continuous cropping treatments; E-F showed the number of common and unique OTUs in bacteria and fungi samples between short-term and non-continuous tobacco cropping soils.图1 短期连作与未连作植烟土壤根际细菌和真菌菌群结构差异Fig.1 The structure difference of bacteria and fungi in the tobacco rhizosphere of short-term and non-continuous cropping soil
2.1.2 物种丰富度分析 选取门(Phylum)分类水平上的微生物菌群分析最大丰度TOP10的物种发现(图2),植烟土壤根际细菌中变形菌门(Proteobacteria)丰富度最高,其次为酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria),其主要优势菌门还有蓝藻细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)及芽单胞菌门(Gemmatimonadetes)。短期连作土壤中变形菌门、拟杆菌门和绿弯菌门丰度较未连作土壤显著增加,蓝藻细菌门丰度较未连作土壤显著降低。

图2 门分类水平上短期连作与未连作植烟土壤细菌和真菌物种相对丰富度Fig.2 Relative abundance of soil bacterial and fungal community at the level of phylum
短期连作与未连作植烟土壤根际真菌以子囊菌门(Ascomycota)、担子菌门(Badidiomycota)、油壶菌门(Olpidiomycota)和被孢霉门(Mortierellomycota)为主。子囊菌门和油壶菌门在短期连作根际土壤中的丰度高于未连作根际土壤,而担子菌门和被孢霉门则在未连作根际土壤中的丰度高于连作根际土壤。进一步比较短期连作与未连作根际真菌菌种(Species)分类水平差异发现,甘蓝油壶菌(Olpidiumbrassicae)、木贼镰刀菌(Fusariumequiseti)丰度在短期连作根际中显著增高,细长被孢霉菌(Mortierellaelongata)丰度在未连作根际中显著增高。
2.1.3 组间差异显著性分析 通过LEfSe[13](Line discriminant analysis effect size)分析在不同组间寻找具有统计学差异的标志物。比较连作与未连作土壤根际微生物优势群落后得到在丰度上有显著差异的物种。如图3所示,与未连作土壤相比,短期连作土壤中有6个优势细菌菌群,即拟杆菌门(Bacteroidtes)、拟杆菌纲(Bacteroidia)、黄杆菌目(Flavobacteriales)、Patescribacteria、Saccharimonadia和Saccharimonadales,而未连作土壤中并未发现具有显著丰度差异的细菌菌群。采用同样方法发现,镰刀菌属(Fusarium)真菌为短期连作土壤中的优势真菌,而伞菌目(Agaricales)、粪伞科(Bolbitiaceae)、田头菇属(Agrocybe)和平田头菇(Agrocybe-pediades)为未连作根际土壤中的优势真菌。
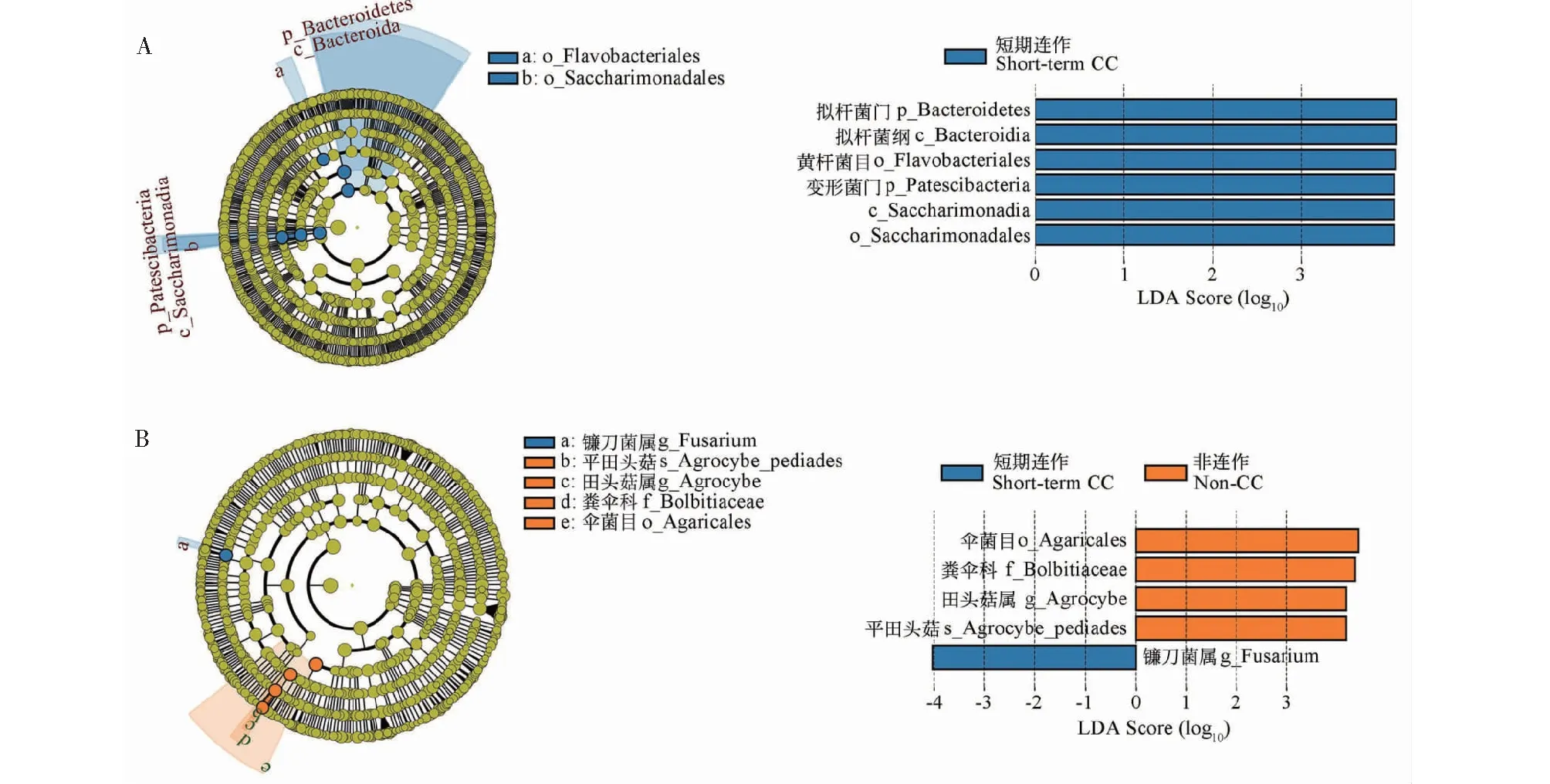
图3 LEfSe分析烟草连作与未连作根际土壤中优势微生物类群Fig.3 Key microbial groups in continuous cropping tobacco-growing soils and non-continuous cropping tobacco-growing soils by LEfSe analysis
2.2 短期连作与未连作植烟根际土壤代谢物差异分析
2.2.1 代谢组数据质控 通过代谢组学方法对连作和未连作条件下2个烟草品种根际土壤的代谢物质进行测定。为获得高质量的代谢组信息,对色谱质谱联用仪下机数据进行一系列质控分析。图4-A~B揭示了正负离子扫描模式下所有质控样本的变化趋势,可知QC样本分布于2STD之内。由图4-C~D可知所有样本QC相对集中,组内差异不明显,组间差异明显。表明,代谢组数据质量较理想,可以进行后续分析。

A~B. PCA-X一维分布;C~D. 正负样本的PCA分布。A-B. PCA-X one-dimensional distribution; C-D. PCA distribution of positive and negative samples.图4 代谢组数据质控样本评估Fig.4 Assessment of quality control sample of metabolome
2.2.2 多元统计分析 对经Progenesis QI处理后的数据进行PCA和OPLS-DA分析。通过主成分分析(PCA)方法,将多维代谢组数据转换成几个主成分来评估样品差异。通过OPLS-DA方法,可进一步明确潜在差异代谢物。图5-A展示了2个品种在短期连作和未连作条件下根际土壤代谢物的差异,结果发现不同品种间根际土壤代谢物差异较大,在第一主成分坐标中被明显区分,说明烟草品种不同可能造成根际分泌物差异,对于根际土壤代谢物组成影响较大。将不同品种短期连作和未连作根际土壤代谢物分别进行PCA分析发现,短期连作和未连作根际土壤样品在组内聚集,而在组间区分明显。同时,OPLS-DA分析表明每个分组中样品分离效果良好(图5-B~E)。该结果表明测定结果重复性较好,同时短期连作和未连作根际土壤样品具有明显差异,短期连作造成根际土壤代谢物明显变化。

图5 短期连作与未连作植烟根际土壤代谢物PCA(A~C)和OPLS-DA(D~E)分析Fig.5 PCA(A-C) and OPLS-DA(D-E) plots of continuous cropping tobacco-growing soils and non-continuous cropping tobacco-growing soils
2.2.3 差异代谢物的挖掘与功能富集 将差异倍数、t检验P值和OPLS-DA模型的VIP值相结合,筛选短期连作和未连作条件下烟草根际土壤的差异代谢物,筛选标准为FC>2,P<0.05和VIP>1。在红花大金元品种连作与未连作土壤样品的比较组中,共发现21个显著差异代谢物,其中14个代谢物在短期连作土壤样品中丰度上调,7个代谢物丰度下调(图6-A)。通过差异代谢物KEGG功能注释及富集分析发现,这些差异代谢物主要参与孕烯醇酮脂(meta_196,meta_431)、有机氮化合物(meta_554)和鞘脂类(meta_391)等生物合成。在云烟87品种连作与未连作土壤样品的比较组中,共发现6个差异代谢物,均在短期连作土壤样品中丰度上调(图6-B)。KEGG功能注释及富集分析发现这些差异代谢物主要包含生物碱(meta_78)及其衍生物和类固醇及类固醇衍生物(meta_366)。

图6 不同种植样品连作植烟土壤与非连作植烟土壤的差异积累代谢物热图Fig.6 The heatmap of differentially accumulated metabolites between continuous cropping tobacco-growing soils and non-continuous cropping tobacco-growing soils
为了进一步分析短期连作土壤与未连作土壤根际差异代谢物的组成,根据显著性差异P值结果挑选出两个品种中分别TOP5的显著差异代谢物(表2)。在红花大金元品种短期连作土壤与未连作土壤的比较组中,前5个显著差异代谢物分别为Capsidiol、法尼醇、N-乙酰基-D-苯基丙氨酸、酒渣碱、色氨酸-P-1,其中,Capsidiol和法尼醇在未连作土壤中的丰度显著高于短期连作土壤。在云烟87短期连作土壤与未连作土壤比较组中,前5个显著差异代谢物分别为小檗碱、2,5-二羟基丙酮-4-甲氧基二苯甲酮、岩白菜素、4′,5-二羟基-7-甲氧基-6,8-二甲基黄酮、脂肪酸酯脂,这些代谢物在短期连作土壤中的丰度显著高于未连作土壤。
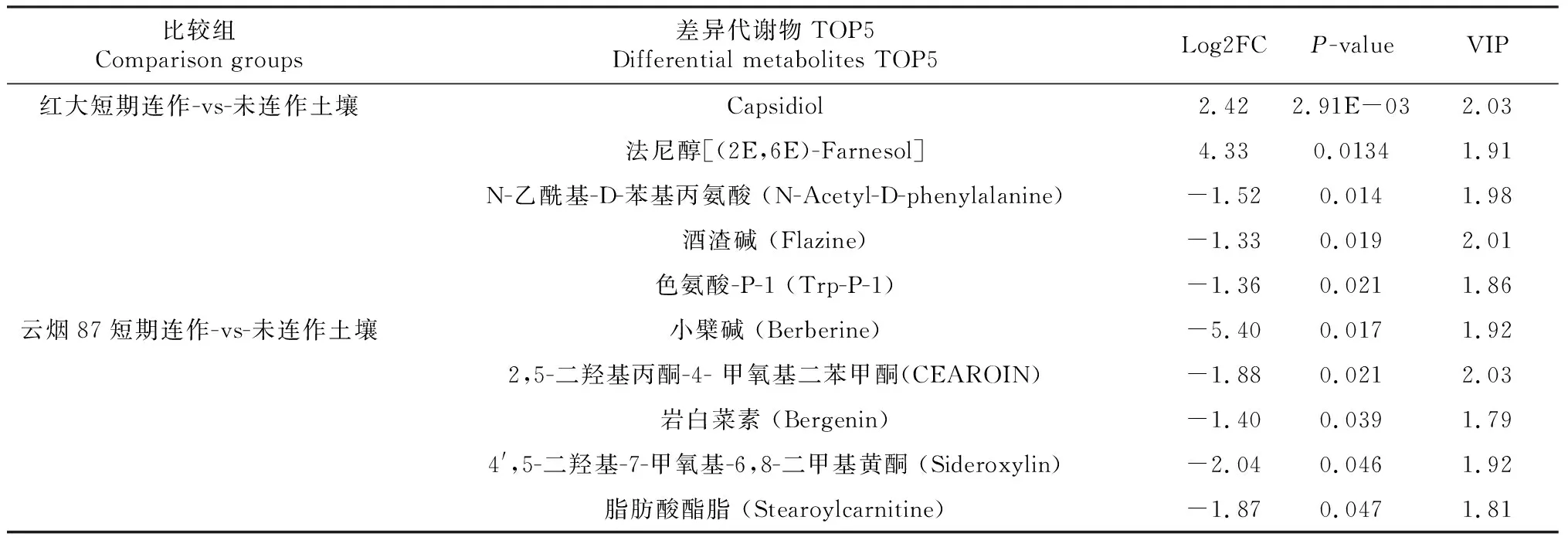
表2 2个烟草品种连作土壤与未连作土壤根际差异代谢物TOP5Table 2 TOP5 differential metabolites in the rhizosphere between continuous cropping and non-continuous cropping soils of two tobacco varieties
3 讨 论
研究表明,连作障碍的发生与土壤理化性状、根系分泌物、土壤微生物变化有着紧密联系[14-15]。通过测定不同连作年限的烟草根际与非根际土壤养分发现,在烟草生长期内根际、非根际土壤pH及非根际土壤有机质均呈先降低后增加趋势,而根际土壤有机质含量则出现递增趋势[16]。此外,随着烟草种植年限增加,土壤中的硝态氮、铵态氮和有效磷含量逐渐增加,出现不同程度的积累[17]。除了土壤理化性质的影响,根系分泌物质包括组织脱落物及分泌的有机酸等物质也能够影响土壤养分,且能够降低重金属对作物本身的毒害。当然,根系分泌物积累到一定量时则会对作物的生长产生抑制作用[18]。研究发现,连作土壤较易积累具有明显生物毒性的阿魏酸是烟草连作的主要生物毒素[19]。不仅如此,土壤微生物的不同也会影响连作效应。土壤微生物通过矿化、硝化、氨化等一系列理化反应,能够影响土壤养分。尽管已有相关研究探讨了烟草连作障碍的产生原因,然而,当前烟草连作障碍的热点研究还是集中在土壤养分与病虫害方面,烟草连作障碍的机理还需更深入的研究。
本研究基于微生物组学和代谢组学,分别对两个烟草品种短期连作和未连作的根际土壤进行微生物多样性和差异代谢物分析。根据测序结果,短期连作与未连作根际间根际细菌菌群结构并无显著差异,表明短期连作对根际细菌的影响不大。有研究表明,短期连作(连作年限≤3 年)土壤仍保持较高的细菌菌群多样性和较高的碳源利用率,而连作4~5年后的土壤细菌多样性则急剧降低[19-20]。然而,短期连作根际真菌群落结构相较于未连作来说出现显著差异,主要表现在子囊菌门和油壶菌门在短期连作根际土壤中的丰度高于未连作根际土壤。马红梅等[21-22]曾通过灵芝连作土壤中优势真菌菌群对灵芝菌丝体的化感效应分析表明,曲霉菌属、木霉属、青霉属和链孢霉属等子囊菌门真菌是灵芝连作土壤中的主要病原菌。本研究发现镰刀菌属(Fusarium)的木贼镰刀菌(Fusariumequiseti)为短期连作土壤中的特异性优势真菌。木贼镰刀菌是一种重要的植物病原菌,易侵染多种粮食和经济作物,引起根腐、茎腐和穗(粒)腐等多种病害,造成作物减产,给世界范围内农作物生产带来严重破坏。同时,本研究发现甘蓝油壶菌(Olpidiumbrassicae)丰度在烟草短期连作根际中显著增高。有研究表明,甘蓝油壶菌在许多高等植物根部专性寄生,其游动孢子是传播一些土壤中病毒的介体,至今已发现其传播烟草坏死病毒、烟草坏死卫星病毒、烟草矮化病毒等。因此,这类真菌在短期连作根际土壤中的丰度增加也表明其可能与烟草短期连作障碍有关。另外,本研究发现未连作根际土壤中以细长被孢霉(Mortierellaelongata)为主的被孢霉门真菌丰度显著高于短期连作根际土壤。由于细长被孢霉对于有机物输入具有强烈的响应作用,具有降解一系列有毒有机物的功能,从而改善土壤健康。因此孢霉门真菌可进一步培养和应用,以应对烟草在连作过程中根际真菌的抑制性富集,以期达到改良土壤、改善烟株健康的目的。
本研究通过对短期连作与未连作植烟土壤根系代谢物差异分析发现,短期连作根际土壤中显著富集游离氨基酸和小檗碱、茄定碱、酒糟碱等生物碱,表明短期连作中已经产生真菌感染和自毒效应。例如,鞘脂是细胞生物膜结构重要的组成部分,在植物—细菌和植物—真菌的相互作用中,植物鞘脂能够诱导植物产生抗性反应[23],一些真菌鞘脂中的GlcCers是一些植物防御素的结合位点,能够诱导植物产生防卫反应,有利于植物与真菌建立起互利共生关系[24-25]。此外,大量研究表明,小檗碱、茄定碱、酒糟碱等生物碱类次生代谢物质通过植株根部分泌途径释放到根际环境,直接或间接抑制植株生长或产生毒害作用[26]。本研究表明,在烟草短期连作中,根际次生代谢物产生的化感作用能够快速且显著改变根际真菌菌群结构,导致治病真菌的快速繁殖,而短期连作对根际细菌群落的影响较小。本研究为今后深入开展微生物群落结构、根际分泌物与连作植烟土壤之间的关系研究,进一步开发微生物制剂调整连作植烟土壤根际环境,有效解决或缓解烟草连作障碍,提高烟草产量奠定理论基础。
4 结 论
本研究发现烟草短期连作对其根际细菌菌群影响不显著,但显著改变了真菌菌群的结构和多样性。其中,以木贼镰刀菌(F.equiseti)为代表的病原真菌在短期连作根际土壤中特异性富集表明其可能对烟草短期连作产生负面影响。另外,在短期连作根际土壤中显著差异性富集了以游离氨基酸和小檗碱、茄定碱、酒糟碱等生物碱为代表的有机氮化合物、鞘脂类、萜类、类固醇及类固醇衍生物,表明烟草短期连作中已经产生明确的真菌感染和自毒效应。本研究通过根际微生物组与代谢组联合分析,探讨了烟草短期连作对根际微生物多样性和根际代谢物差异的影响,为进一步解析烟草连作障碍机理提供理论基础。
