植物乳杆菌对脂环酸芽孢杆菌的抑菌机理研究
2023-06-09李国旻谢英曼董华煜仇梦真王然然樊明涛魏新元
李国旻 谢英曼 董华煜 仇梦真 王然然 樊明涛 魏新元

摘要:脂环酸芽孢杆菌是当前许多水果饮品中的致腐菌,其中酸土脂环酸芽孢杆菌最为常见。许多被公认安全的乳酸菌对脂环酸芽孢杆菌具有抑菌活性。为了研究乳酸菌抑制脂环酸芽孢杆菌的机理,该研究从分离自中国传统泡菜的乳酸菌中,筛选出对酸土脂环酸芽孢杆菌DSM 3922T具有较强抑菌活性的植物乳杆菌509,采用非靶向代谢组学分析了酸土脂环酸芽孢杆菌DSM 3922T受植物乳杆菌509抑制时的代谢产物变化,受抑制后的酸土脂环酸芽孢杆菌DSM 3922T中上调的代谢物有308个,下调的代谢物有666个,它们主要位于氨基酸代谢、核酸代谢、糖代谢、TCA循环、细胞壁合成和跨膜运输等通路中,其中大部分氨基酸及其氨基酰类、核苷及其磷酸盐类等物质均受到下调。研究结果表明,酸土脂环酸芽孢杆菌DSM 3922T中许多参与重要生物途径的中间代谢物受到植物乳杆菌509的抑制,而这些代谢物的下调反过来又促使酸土脂环酸芽孢杆菌自身凋亡,从而达到抑菌效果。
关键词:酸土脂环酸芽孢杆菌;植物乳杆菌;代谢产物;非靶向代谢组学
中图分类号:TS201.3文献标志码:A 文章编号:1000-9973(2023)06-0028-08
Abstract: Alicyclobacillus is the spoilage bacterium in many fruit drinks at present, in which, A. acidoterrestris is the most common. Many lactic acid bacteria that are generally regarded as safe have bacteriostatic activity against A. acidoterrestris. In this study, in order to study the bacteriostatic mechanism of lactic acid bacteria against Alicyclobacillus, Lactobacillus plantarum 509 with strong bacteriostatic activity against A. acidoterrestris DSM 3922T is screened from the lactic acid bacteria isolated from Chinese traditional pickles. Non-targeted metabolomics is used to analyze the changes of metabolites of A. acidoterrestris DSM 3922T when it is inhibited by Lactobacillus plantarum 509. There are 308 up-regulated metabolites and 666 down-regulated metabolites in the inhibited A. acidoterrestris DSM 3922T, which are mainly located in the pathways of amino acid metabolism, nucleic acid metabolism, sugar metabolism, TCA cycle, cell wall synthesis and transmembrane transport, most amino acids and their aminoacyls, nucleosides and their phosphates are down-regulated.The research results show that many intermediate metabolites involved in important biological pathways in A. acidoterrestris DSM 3922T are inhibited by L. plantarum 509, and the down-regulation of these metabolites in turn promotes the self-apoptosis of A. acidoterrestris, thus achieving the bacteriostatic effect.
Key words: Alicyclobacillus acidoterrestris; Lactobacillus plantarum; metabolites; non-targeted metabolomics
作者簡介:李国旻(1998-),男,硕士,研究方向:食品微生物及分子生物学。
*通信作者:魏新元(1971-),男,副教授,博士,研究方向:食品微生物及分子生物学。
脂环酸芽孢杆菌(Alicyclobacillus)是一类需氧、无致病性、产芽孢的革兰氏阳性的嗜酸耐热菌,可在pH 2.5~6.0、25~70 ℃的环境下生长[1]。脂环酸芽孢杆菌已从多种浓缩果汁,包括苹果汁、樱桃汁、葡萄柚、芒果、橙汁、梨汁、番茄汁和葡萄汁等中分离[2-3]。由于脂环酸芽孢杆菌不易在巴氏灭菌条件下彻底杀灭,导致幸存的细胞在果汁降温后能重新生长繁殖,其代谢活动常常产生愈创木酚、卤酚等有不愉快的烟熏味的物质[4],不被消费者接受,给果汁行业造成重大的经济损失[5-6]。
目前对果汁的抑制或杀灭有物理法、化学法和天然产物杀菌法。物理杀灭法主要包括传统热法、超声波处理、紫外处理、高压处理[7]、欧姆加热[8]、超临界二氧化碳和超高压等新型杀菌技术等。传统热法往往容易影响果汁的营养和风味,而高压处理、超声波处理、紫外处理、欧姆加热、超临界二氧化碳和超高压等新型杀菌技术往往要求高端的灭菌设备,从而限制了这些技术在果汁中的应用。化学杀灭技术主要包括中性电解水、苯甲酸及苯甲酸盐、亚氯酸[9]、臭氧[10]等灭菌技术,但由于化学类防腐技术容易对人体造成伤害,逐渐不符合当前食品安全的要求。所以,人们开展对生物杀灭技术的探索,如:乳酸链球菌素[11](Nisin)、迷迭香提取物[12]、石榴提取物[13]等中的抑菌物质,因其安全性、功能性和适口性等特点,成为新的抑菌物质挖掘和应用的热点。乳酸菌则具备以上特点[14]。
乳酸菌是一群公认安全的、可发酵部分碳水化合物产生大量乳酸、革兰氏阳性、不产芽孢的细菌。乳酸菌对食品中的腐败菌、食源性致病菌及霉菌均具有抑杀作用,而且能阻止霉菌毒素的形成[15]。乳酸菌已经被广泛应用于食品、医药和饲料等行业中,陈全毅等[16]在冷鲜鸡肉上涂抹乳酸菌发酵上清液,可显著抑制单增李斯特菌的生长,使鸡肉的保质期至少延长3 d。马国涵[17]在鲜切酸菜产品中添加乳酸菌剂显著抑制芽孢杆菌的生长,使货架期延长。胡昌辉[18]研究发现植物乳杆菌S11发酵液可显著抑制金黄色葡萄球菌、沙门氏菌和大肠杆菌的生长。乳酸菌所展示的抑菌活性为控制脂环酸芽孢杆菌提供了一种有前景的新选择。尽管当前也有研究发现乳酸菌对脂环酸芽孢杆菌具有抑制作用[19],但是对脂环酸芽孢杆菌被抑制的机制尚不清楚。
本研究拟以酸土脂环酸芽孢杆菌(Alicyclobacillus acidoterrestris DSM 3922T)为研究对象,从实验室保藏的乳酸菌中筛选出对脂环酸芽孢杆菌具有明显抑制作用的菌株,通过非靶向代谢组学研究方法鉴定出响应乳酸菌抑菌作用的酸土脂环酸芽孢杆菌的差异代谢物[20],通过对差异代谢物进行通路富集,找出其受乳酸菌抑制作用影响的相关代谢通路,对乳酸菌的抑菌机制进行初步分析,以评估乳酸菌作为果汁工业中抑菌剂的可行性,为进一步研究开发生物防腐、进行菌种资源挖掘提供了思路。
1 材料与方法
1.1 试验材料
酸土脂环酸芽孢杆菌(Alicyclobacillus acidoterrestris DSM 3922T,以下简写为Aa DSM 3922,使用AAM培养)购于德國微生物菌种保藏中心。
乳酸菌菌株:Lactobacillus plantarum 204,323,509,510,512,517,541,546,702,704,812,821;Staphylococcus carnosus 103,104,106,301,305,309,316,320,322,837,846,848,849;Lactobacillus sakei subsp. sakei 101;Weissella confusa 105,114;Weissella cibaria 224,535,保藏于西北农林科技大学食品科学与工程学院食品微生物与生物技术实验室,使用MRS培养基(液体和固体,用于培养)或改良MRS固体培养基(含0.75%碳酸钙,用于活化后分离筛选)。
1.2 其他试剂
甲醇(色谱级)、乙腈(色谱级)、甲酸(色谱纯)、葡萄糖、酵母浸粉、七水硫酸镁、蛋白胨、牛肉膏、无水醋酸钠、吐温-80、磷酸氢二钾、一水硫酸锰、柠檬酸氢二铵、二水氯化钙、磷酸二氢钾、四水硫酸锰、硫酸铵、氯化钠、无水乙醇、盐酸(均为分析纯):北京索莱宝科技有限公司。
1.3 仪器与设备
HH-M6恒温水浴锅 江苏新春兰科学仪器有限公司;QYC-200恒温培养箱 上海圣科仪器设备有限公司;NRY-2102型摇床培养箱 上海南荣实验室设备有限公司;LMQ.CE型立式灭菌锅 山东新华医疗器械有限公司;Thermo Scientific UltiMate 3000超高效液相色谱仪 赛默飞世尔科技公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;PTX-FA110电子天平 福州华志科学仪器有限公司。
1.4 方法
1.4.1 脂环酸芽孢杆菌Aa DSM 3922的活化与筛选
Aa DSM 3922的活化与菌落挑选:将冻存的Aa DSM 3922室温下解冻后按2%接种于5 mL AAM液体培养基中,45 ℃、150 r/min下振荡培养24 h,进行革兰氏染色初步验证后,于AAM平板上进行划线分离,45 ℃培养24 h,选取较大单菌落保存。
1.4.2 乳酸菌菌株的活化
乳酸菌菌株的活化与菌落挑选:将冷冻保藏的各乳酸菌菌株于室温下解冻后按2%接种于5 mL MRS液体培养基中,37 ℃恒温培养箱中培养24 h,然后用接种环取种划线于改良MRS平板,37 ℃恒温培养箱中培养24~48 h,选取溶钙圈明显的较大菌落进行保存。
1.4.3 对Aa DSM 3922具有抑菌活性的乳酸菌的分析与筛选
采用双层平板法分析和筛选抑制Aa DSM 3922的乳酸菌菌株[21]。首先在培养皿底部倒置一层MRS琼脂,凝固后,在平板上点种生长到对数期末期的不同乳酸菌培养液各1 μL,置于37 ℃下培养24 h。然后倒入50 ℃的AAM固体培养基20 mL(厚约0.3 cm),凝固后将对数末期的Aa DSM 3922菌液涂布在AAM培养基上。在37 ℃(Aa DSM 3922生长良好,数据在此未提供)下培养24 h,观察各乳酸菌对Aa DSM 3922的抑菌圈大小,测量乳酸菌的抑菌圈直径,从而进行比较分析,选择抑菌效果好的菌株进行后续试验。
1.4.4 Aa DSM 3922非靶向代谢组学分析样品的制备
为了分析上述选定的乳酸菌抑制Aa DSM 3922的机理,本试验采用非靶向代谢组学(GC-TOF-MS)对Aa DSM 3922受到该乳酸菌抑制后的代谢物变化进行分析。
1.4.4.1 受抑制Aa DSM 3922及对照平板的制备
在平板中先倒一层MRS固体培养基,凝固后,处理组:在培养基上取培养至对数末期且抑菌效果良好的乳酸菌菌液,均匀地用接种环划直线,待菌液被吸收后(对照组:不接种乳酸菌),37 ℃下培养24 h,在其上层倒入约20 mL(厚约0.3 cm)的AAM培养基,然后涂布培养至对数末期的Aa DSM 3922菌液100 μL于AAM培养基上。在37 ℃下继续培养24 h,观察抑菌带范围。
1.4.4.2 受抑制Aa DSM 3922及对照菌体的收集
按照合作方杭州联川生物技术股份有限公司对代谢组学检测样品的要求进行菌体处理,收集足量的菌体样本。用无菌载玻片刮取抑菌带范围及抑菌带边沿的菌苔(对照组直接收集AAM培养基表面生长良好的Aa DSM 3922),用提前冰浴的无菌生理盐水将菌苔冲洗至50 mL无菌离心管中,4 ℃、4 000 r/min离心10 min,倒掉上清液,无菌生理盐水重悬,将其转移至无菌的小离心管中,离心去上清,然后液氮速冻,充分冷却后,放入-80 ℃冰箱中暂时保存。最后送至杭州联川生物技术股份有限公司测定不同样本中的代谢产物。
1.4.5 代谢组学分析
首先使用有机试剂沉淀蛋白法对Aa DSM 3922样本进行代谢物提取,并同时制备质控(quality control,QC)样本(取等量制备好的实验样本混合而成)。然后对所提取的样本进行上机排序(样品采用随机排序),在样品前、中、后分别插入 QC 样品以作实验技术重复评估。样品分别进行质谱正负离子扫描。
对质谱下机原始数据利用ProteoWizard的MSConvert软件转换成可读数据mzXML。利用 XCMS软件进行峰提取,并做峰提取质控。对提取到的物质利用CAMERA进行加和离子注释,然后利用MetaX软件进行一级鉴定[22]。分别使用质谱一级信息进行鉴定和质谱二级信息与in-house标准品数据库进行匹配。候选鉴定物质分别利用HMDB、KEGG等数据库进行代谢物注释,解释代谢物的物理化学性质、生物功能。利用MetaX软件对差异代谢物进行定量、差异代谢物筛选[23]。
1.4.6 数据采集与分析
采用MassLynx、Progenesis QI 软件对UPLC-Q TOFMS获得的原始数据进行峰提取、峰对齐、保留时间校正等处理。采集整理的数据导入Simca 14.1软件,进行主成分分析(PCA)、偏最小二乘判别(PLS-DA)分析。使用MetaboAnalyst 5.0(http://www.metaboanalyst.ca)进行统计分析与通路分析。结合PLS-DA的VIP(变量投影重要性,variable importance in the projection)值≥1、两组间差异倍数≥2和P值≤0.05相结合的方法找出两组Aa DSM 3922样品中显著差异性代谢物[24]。
2 结果与分析
2.1 对Aa DSM 3922具有抑菌活性的乳酸菌的筛选
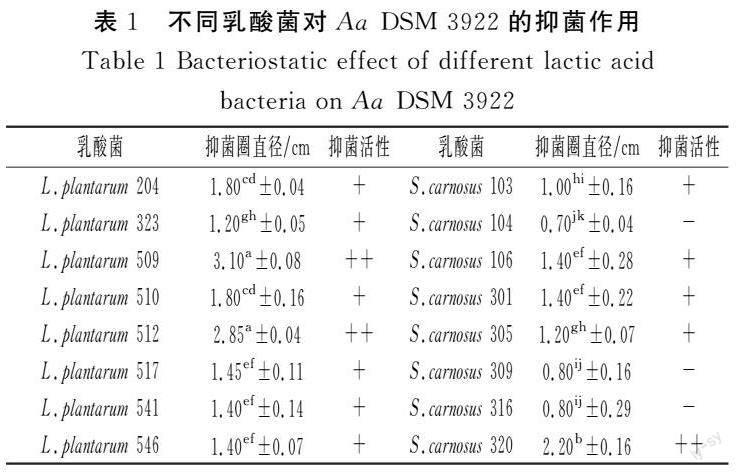
通过比较不同乳酸菌对Aa DSM 3922抑菌圈的大小(见表1),结果显示,不同的乳酸菌菌株对Aa DSM 3922的抑制效果不同,即使同种的不同菌株也表现出差异。其中,L. plantarum 509的抑菌效果最好,抑菌圈直径为3.10 cm,L. plantarum 512的抑菌效果次之,抑菌直径为2.85 cm,其他菌株的抑菌圈更小,因此,选出抑菌作用最强的L. plantarum 509进行后续研究。
2.2 Aa DSM 3922菌体样品的质控分析
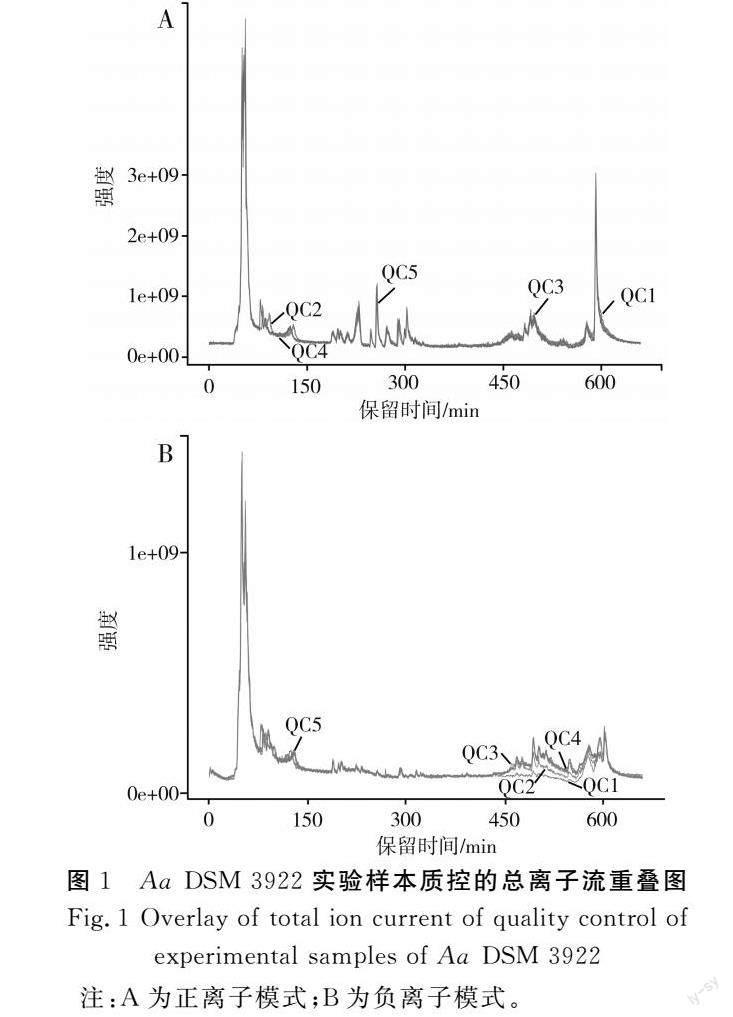
将足量的待测样本提供给杭州联川生物技术股份有限公司后,经公司进一步处理,样品上机并同时加入质控样本进行监测,以时间为横坐标、离子强度为纵坐标绘制提取后的总离子流图谱,通过与不同质控样本的基峰离子流图(BPC图)进行重叠展示分析,从而判断代谢物提取和检测的重复性和仪器稳定性(见图1),其中,图1中A和B分别表示质控样本总离子流图在0~10 min的正离子流图和负离子流图。
由图1可知,样品总离子流图中色谱峰保留时间和峰面积均能较好重叠,表明仪器稳定性很好,且本次提供的待测实验样本质量佳,可用于后期数据测定和分析[25]。
2.3 Aa DSM 3922不同处理的代谢产物的PLS-DA分析
未经L.plantarum 509抑菌处理和经过L.plantarum 509抑菌处理的Aa DSM 3922的代谢物测试数据通过PLS-DA(partial least squares discriminant analysis)法进行分析[26],见图2。
处理组和对照组样本均处于95%置信区间内,且分别位于第一主成分的负半轴和正半轴聚集,说明经L. plantarum 509处理后Aa DSM 3922细胞的代谢水平发生了变化。
为了进一步验证PLS-DA模型的稳健性和预测能力,对PLS-DA模型进行置换检验,结果见图3。发现此模型的R2Y为0.759 7,接近于1,且Q2均在R2Y之下,说明此模型符合样本数据的真实情况;Q2的回归直线与纵轴的截距为-2.078 8<0,说明此模型具有良好的稳健性,未出现过度拟合情况,表明此模型具有很高的预测性和可靠性。
2.4 抑菌处理的Aa DSM 3922代谢物的HMDB Super class分类及主要差异代谢物聚类分析
通过非靶向代谢组学分析,对经L. plantarum 509抑菌处理的Aa DSM 3922代谢物检测数据进行HMDB(human metabolome database) Super class分类,鉴定到的代谢物主要可分为16类,其中检测到的前三位代谢物为有机酸及其衍生物、有机杂环化合物、脂类和类脂分子。
相对于未经抑菌处理的对照组,经L. plantarum 509抑菌处理的Aa DSM 3922的差异代谢物中,共筛选出显著变化的离子974种,正离子和负离子分别为663,311种,其中正离子中上调的有193种,下调的有470种;负离子中上调的有115种,下调的有196种。对主要的差异代谢物进行聚类分析并以热图形式展示,见图3。
图3的热图中每一列代表一个样本,每一行代表一种差异代谢物,每组样本3个平行,颜色深浅表示强度不同,颜色由浅及深表示强度由低到高。聚类分析结果显示,聚类强度差异较大的物质有胆酸、香兰素、L-(+)-乳酸、肉桂酸、3-苯乳酸等酸类物质;1,3-二丙基黄嘌呤、6-二甲氨基嘌呤、黄嘌呤等嘌呤类物质;亮氨酰脯氨酸、脯氨酸、天冬氨酰羟脯氨酸、γ-谷氨酰鸟氨酸等氨基酸类物质。5′-甲基硫腺苷、脱氧肌苷、L-乙酰肉碱、鸟苷、2′-脱氧腺苷、3′-去磷酸辅酶a等核苷酸类物质,说明这些代谢物在处理和对照之间差异很大。以上这些代谢物是菌体维持正常生長状态必不可少的成分[27],它们主要参与菌体的能量代谢、核酸代谢、氨基酸及相应蛋白的物质合成。这些差异代谢物主要参与的通路包括氨基酸和核苷酸糖的代谢、ABC(ATP binding cassette)转运、氨基酸的生物合成、嘌呤代谢、氨基酰-tRNA生物合成、次级代谢产物合成、碳水化合物代谢(carbohydrate metabolism)、不同环境中的微生物代谢、肽聚糖生物合成、磷酸转移酶系统、双组分系统等。
2.5 L. plantarum 509對Aa DSM 3922氨基酸合成的影响
L. plantarum 509的抑制处理使Aa DSM 3922细胞中部分氨基酸及其相关物质的含量发生了明显改变,见表2。赖氨酸(lysine)、丙氨酸(alanine)、鸟氨酸(ornithine)、苏氨酸(threonine)、脯氨酸(proline)、缬氨酸(valine)、甘氨酸(glycine)、丝氨酸(serine)、精氨酸(arginine)、谷氨酸(glutamate)及相关的酰基氨基酸等的含量均下降。氨基酸在菌体的生长代谢过程中起着重要作用。据报道[28],鸟氨酸和天冬氨酸含量降低直接影响菌体的能量代谢和生长状态,也影响其他含氮化合物的合成;丙氨酸、谷氨酸等在肽聚糖的合成中起重要作用,其含量降低影响细菌细胞壁的合成;脯氨酸是20多种氨基酸中唯一的环状亚氨基酸,不仅能参与生物体的应激反应,而且可以参与蛋白质的集聚,而蛋白质的集聚会诱导细胞死亡。氨基酸的变化还会影响酶类和蛋白的合成,进而影响物质的转运和跨膜运输,从而影响菌体的正常生长,最终产生抑菌效果[29]。因此,Aa DSM 3922细胞中氨基酸水平降低与L. plantarum 509抑菌作用相关,并导致自身细胞的生长受到抑制。
2.6 L. plantarum 509对Aa DSM 3922核酸合成相关代谢物的影响
通过非靶向代谢组学分析发现,经过L. plantarum 509抑菌处理的Aa DSM 3922细胞中许多与核酸代谢相关的核苷及核苷磷酸盐类物质的含量下降明显,见表3。Aa DSM 3922经L. plantarum 509作用后,核苷及核苷单磷酸盐在受抑制的Aa DSM 3922细胞中的含量均下降,这可能是细胞受到抑制的结果,反过来,这类物质的降低又会影响细胞的生长。曾经报道3′-去磷酸酶的表达量减少会影响Aa DSM 3922核酸的形成,黄嘌呤代谢水平下降意味着Aa DSM 3922的拮抗能力下降[30]。因此,本试验中检测到黄嘌呤水平降低,也意味着其生长受到抑制。
脱氧腺苷和2′-脱氧腺苷-5′-单磷酸(dAMP)是参与4种脱氧核苷酸补救合成途径的关键原料,经过一系列酶作用生成脱氧核苷三磷酸(dNTP)-DNA合成和修复的底物。经乳酸菌处理后,脱氧腺苷和 dAMP水平显著下降(P≤0.01),推测乳酸菌可能阻断脂环酸芽孢杆菌胞内脱氧核苷酸的合成,进而抑制DNA合成和修复,最终导致细胞损坏或死亡。在本研究中,经抑菌处理的Aa DSM 3922细胞中所测得的5′-腺苷-磷酸(AMP)和鸟苷的含量下降,这与康世墨[31]测定受抑制细胞中AMP和鸟苷含量上升的结果相反。一般认为,当细胞受到胁迫时,会启动应急机制对细胞生长进行补救,导致5′-腺苷-磷酸(AMP)和鸟苷在短期内含量上升。出现不一致的原因可能与取样时间有关,因为本试验中要等到抑菌圈出现了才进行取样,这时细胞中的各物质含量可能已经趋于稳定。以上结果表明,由于乳酸菌的抑制作用,导致Aa DSM 3922细胞中许多与核酸代谢相关的中间产物含量降低,这些产物含量的下降又反过来影响了酸土脂环酸芽孢杆菌的生长。
3 结论
本研究中筛选得到对Aa DSM 3922具有良好抑制效果的L.plantarum 509,通过代谢组学分析结果显示,受L.plantarum 509抑制处理的Aa DSM 3922细胞中许多重要的代谢产物包括氨基酸类、核苷类等物质的含量都受到下调,这种下调反过来抑制了细胞中蛋白质和核酸的代谢活动,从而导致细胞的生长受到影响,引起螺旋式的抑菌作用,产生一种“恶性循环”,导致Aa DSM 3922细胞凋亡。当Aa DSM 3922受到L.plantarum 509抑制时,也检测到许多含量上调的中间代谢物,如香兰素、乳酸、肉桂酸,它们分别相当于对照的29.1,8.9,5.7倍(数据未提供),这几种物质在植物乳杆菌中均能产生,因此这些代谢物含量升高可能来自乳酸菌代谢物的渗透作用。本研究结果表明,L.plantarum 509对Aa DSM 3922具有良好的抑菌活性,而植物乳杆菌又是被普遍认为安全的益生菌,已经广泛应用于食品、医药等行业中,因此,可以将其作为发酵剂用于新型发酵型水果饮料的开发,一方面可以提高水果饮料的风味和功能,另一方面可以抑制水果饮品中的脂环酸芽孢杆菌,达到防止水果饮料腐败、延长其保质期的作用。
参考文献:
[1]黄玉鑫,冯鑫,史文鑫,等.酸土脂环酸芽孢杆菌危害及其控制研究进展[J].食品工业科技,2019,40(12):347-353.
[2]白淼,王玥,江海溶,等.香草酸对脂环酸芽孢杆菌生长代谢影响及紫外线控制研究[J].食品安全质量检测学报,2022,13(4):1294-1300.
[3]王周利,蔡瑞,岳田利,等.果汁中脂环酸芽孢杆菌识别与控制研究进展[J].农业机械学报,2016,47(10):221-243.
[4]PORNPUKDEEWATTANA S, JINDAPRASERT A, MASSA S.Alicyclobacillus spoilage and control-a review[J].Critical Reviews in Food Science and Nutrition,2020,60(1):108-122.
[5]MERLE J, MONTVILLE T J. Alicyclobacillus acidoterrestris: the organism, the challenge, potential interventions[J].Journal of Food Processing and Preservation,2014,38(1):153-158.
[6]丁金英,葛含静,吴永娟,等.脂环酸芽胞杆菌对果汁危害的研究[J].微生物学杂志,2017,37(3):128-133.
[7]闫慧明,李苇舟,李富华,等.高静水压加工对果蔬酚类化合物的影响研究进展[J].食品科学,2020,41(15):323-328.
[8]KIM N H, RYANG J H, LEE B S, et al.Continuous ohmic heating of commercially processed apple juice using five sequential electric fields results in rapid inactivation of Alicyclobacillus acidoterrestris spores[J].International Journal of Food Microbiology,2017,246:80-84.
[9]CAI R, MIAO M, YUE T L, et al. Antibacterial activity and mechanism of cinnamic acid and chlorogenic acid against Alicyclobacillus acidoterrestris vegetative cells in apple juice[J].International Journal of Food Science & Technology,2018,54(5):1697-1705.
[10]FUNDO J F, MILLER F A, TREMARIN A, et al. Quality assessment of Cantaloupe melon juice under ozone processing[J].Innovative Food Science & Emerging Technologies,2018,47:461-466.
[11]ZHANG J Y, LI S H, WANG W J, et al. Bacteriocin assisted food functional membrane for simultaneous exclusion and inactivation of Alicyclobacillus acidoterrestris in apple juice[J].Journal of Membrane Science,2021,618:118741.
[12]MOREIRA S A M, MEG F S, HARUE E E, et al. Control of the growth of Alicyclobacillus acidoterrestris in industrialized orange juice using rosemary essential oil and nisin[J].Letters in Applied Microbiology,2021,72(1):41-52.
[13]MIZUTA A G, MENEZES J L, DUTRA T V, et al. Evaluation of antimicrobial activity of green tea kombucha at two fermentation time points against Alicyclobacillus spp.[J].LWT-Food Science and Technology,2020,130:109641.
[14]胡美麗,王俊钢,李宇辉.产细菌素乳酸菌在食品中的应用[J].食品安全质量检测学报,2022,13(14):4657-4664.
[15]王庆宇,李啸,宋宜兵,等.抑制馒头中腐败霉菌活性乳酸菌的筛选及其应用[J].中国酿造,2021,40(10):139-143.
[16]陈全毅,唐慧芳,刘颖,等.海洋源抗菌活性乳酸菌的筛选及对冷鲜鸡肉货架期评价[J].食品与发酵工业,2020,46(20):164-170.
[17]马国涵.应用乳酸菌制剂控制传统东北酸菜腐败的研究[D].锦州:渤海大学,2019.
[18]胡昌辉.Lactobacillus plantarum P1对食源性致病菌抑菌效果及邻苯二甲酸酯吸附功能的研究[D].上海:华东理工大学,2019.
[19]徐志娇,韩晓江,宋子涵,等.一株植物乳杆菌对脂环酸芽孢杆菌的抑菌活性[J].西北农林科技大学学报(自然科学版),2019,47(6):124-131.
[20]李艳波,史怀.利用代谢组学方法分析生防菌抑菌机理模式的初步建立[J].热带作物学报,2017,38(1):155-159.
[21]宋云博,李院,杨靖鹏,等.植物乳杆菌JCM1149的抑霉活性及其在酱菜保藏中的应用[J].中国食品学报,2018,18(7):180-188.
[22]李思源,李培瑜,刘弈彤,等.代谢组学在食品科学中的应用进展[J].食品与发酵工业,2021,47(5):252-258.
[23]LIU X J, JIAN C, LI M Y, et al. Microbiome-metabolomics deciphers the effects of Cistanche deserticola polysaccharides on agedconstipated rats[J].Food & Function,2022,13(7):3993-4008.
[24]LIU X H, LIANG S, WEI Y Y, et al.Metabolomics analysis identifies sphingolipids as key signaling moieties in appressorium morphogenesis and function in Magnaporthe oryzae[J].mBio,2019,10(4):11-13.
[25]黄慧敏.基于代谢组学技术分析枯草芽孢杆菌对致龋菌的生长抑制作用[D].兰州:兰州大学,2018.
[26]罗帅,张巧玲,杨帆,等.基于非靶向代谢组学分析酱香型大曲中抑菌黑曲的功能成分[J].食品与发酵工业,2022,48(14):16-23.
[27]励建荣,檀茜倩,王丹,等.基于益生菌及其代谢物的食源性致病微生物控制技术研究进展[J].食品科学技术学报,2022,40(3):1-12.
[28]杨柯.氨基酸和有机酸对侧孢短芽孢杆菌抗菌肽的发酵调控研究[D].石家庄:河北科技大学,2017.
[29]黄小流,许东风,罗辉,等.马齿苋多糖对断奶大鼠血清氨基酸代谢谱及肠道菌群影响[J].营养学报,2022,44(3):276-283.
[30]刘欢欢.木质纤维素水解液中抑制剂对丙酮丁醇梭菌发酵产正丁醇的胁迫机制研究[D].天津:天津大学,2017.
[31]康世墨.乳糖酸对耐甲氧西林金黄色葡萄球菌抑菌机理的研究[D].沈阳:沈阳农业大学,2020.
