一个新的玉米Miniature1基因等位突变体的鉴定与遗传分析
2023-06-09徐相波张茂林刘铁山刘春晓关海英汪黎明何春梅
王 娟 徐相波 张茂林 刘铁山 徐 倩 董 瑞 刘春晓 关海英 刘 强 汪黎明 何春梅
一个新的玉米基因等位突变体的鉴定与遗传分析
王 娟 徐相波 张茂林 刘铁山 徐 倩 董 瑞 刘春晓 关海英 刘 强 汪黎明*何春梅*
山东省农业科学院玉米研究所 / 小麦玉米国家工程研究中心 / 农业农村部黄淮海北部玉米生物学与遗传育种重点实验室, 山东济南 250100
籽粒发育是决定玉米产量和品质的关键因素, 但目前对其遗传调控机制的研究还相当不完善。我们在田间筛选到一个玉米籽粒发育突变体, 表现为籽粒灌浆不充分, 胚和胚乳变小, 成熟籽粒干瘪或“空果皮”。该突变表型受单个隐性核基因控制。通过图位克隆的方式将候选突变基因定位到2号染色体1.1 Mb的区间内, 进一步研究发现, 该区间内()基因在第1个外显子处发生转座子插入, 导致基因表达下调和无义突变。此插入突变与突变体籽粒灌浆缺陷表型完全连锁, 该突变体被命名为-。通过与突变体进行等位测验, 确认-即为基因的等位突变体。因此, 本研究鉴定了一个新的等位突变体, 其突变位点及方式与已知突变体均不相同, 完善了玉米籽粒突变体的种质资源信息, 也为Mn1调控籽粒发育机制的解析提供新的遗传材料。
玉米; 籽粒灌浆;; 突变体
玉米是主要的粮食作物和饲料来源。随着人口日益增长和人们生活水平的提高, 培育优质高产玉米新品种已成为一项重要任务。籽粒是粮食作物的重要性状, 其发育状况与玉米产量和品质密切相关。玉米籽粒的形成为双受精过程, 雄配子经分裂产生2个精子, 其中一个与卵细胞融合形成二倍体的合子, 另一个与中央细胞的2个极核融合形成初生胚乳核。双受精后, 合子发育成种子的二倍体的胚, 初生胚乳核发育成三倍体的胚乳。玉米胚乳发育从雄核与2个极核融合后2~4 h就开始分裂, 首先只进行核分裂而不进行胞质分裂, 在授粉的2 d里形成100多个游离核, 称为多核体; 授粉后4 d, 胚乳细胞化, 细胞壁形成; 授粉后10 d, 细胞化结束, 进入胚乳细胞分化增殖阶段并不断贮存营养物质。分化的胚乳包含4个主要的细胞类型: 淀粉胚乳、糊粉层、传递细胞和胚周围区域的细胞[1]。玉米胚的发育从合子的不对称分裂开始, 形成顶端-基部轴, 基部细胞发育成胚轴, 后成为根分生组织; 顶端细胞首先形成球状胚, 进入转变期后, 分化出盾片、胚芽鞘和叶原基[2]。Clark[3]和Sheridan等[4]又把上述各时期分为3个阶段。第1阶段, 胚的顶底不对称形成并可以通过胚柄和胚基识别胚; 第2阶段,辐射不对称出现并且胚轴和茎尖分生组织形成; 第3阶段, 胚芽和胚根的结构越来越精细, 并且休眠不断加强。
种子的大小涉及种子的长度、宽度及灌浆度。目前, 对于一些玉米籽粒发育突变体的研究或借助关联分析方法已经发现了一些调控种子大小和重量的基因或性状位点[5]。在玉米突变体-和-中, 谷氨酰胺合成酶(GS)的基因表达量和蛋白活性均受损伤。突变体分别表现为籽粒数量降低和体积变小, 双突变体--表现为籽粒大小和数量同时降低。当-在叶子中超表达时, 籽粒数量增加了30%, 进一步证明GS1-3在提高籽粒产量方面发挥重要作用[6]。通过连锁分析、关联分析和表达谱分析发现和-/-与种子的发育和重量密切相关[7-8]。此外, 编码PPR蛋白的基因和等也影响了玉米种子的发育, 基因突变后, 植株籽粒变小[9-10]。编码一个糖转运蛋白, 该基因在基底胚乳转移层上高表达, 特异地促进糖分由母体韧皮部向籽粒的运输, 突变体表现为籽粒灌浆缺陷、成熟籽粒“空果皮”、胚和胚乳变小[11]。
玉米籽粒发育是决定产量和品质的关键因素, 目前对其遗传调控机制的解析还不完善。本研究以田间筛选到的玉米种子胚乳发育突变体为材料, 通过图位克隆的方式分离到发生突变的基因为编码细胞壁蔗糖转化酶的()基因, 此突变体被命名为-, 对突变体及该基因调控籽粒发育机制的研究有助于我们更加深入地认识籽粒发育的分子机制, 并有可能应用到分子育种的实践中。
1 材料与方法
1.1 试验材料
所用的玉米籽粒突变体-为田间发现的来源于Lx9801和PH4CV自交后代的自然突变体, 该突变体表现为籽粒灌浆不充分, 成熟籽粒干瘪或“空果皮”。大部分突变体-能够正常萌发和成苗。基因定位群体为突变体-与自交系B73杂交并自交获得的F2群体。突变体-, 其背景为W22, 为鲁东大学农学院李蓓老师馈赠。
1.2 突变体表型鉴定和遗传分析
观察-与野生型在不同发育时期形态及籽粒的变化, 并分别选取野生型和突变体-成熟期籽粒, 用电子天平对其进行称重并统计成熟期种子的百粒重。取授粉后20 d的籽粒并投入FAA固定液(福尔马林5 mL、50%或70%的洒精90 mL、冰醋酸5 mL)中进行固定, 然后经过系列乙醇脱水、浸蜡、石蜡包埋、切片、染色和封片, 通过显微镜观察并照相, 记录野生型和突变体-籽粒在胚乳细胞及淀粉颗粒大小和形态上的差异。对-与B73杂交得到F1代进行自交, 获得F2分离群体。计算F2分离群体中野生型籽粒和突变型籽粒的数目, 利用卡方测验进行分离比检验。
1.3 目的基因的定位
以突变体-与B73杂交构建的F2代群体为材料, 提取F2群体突变型籽粒萌发后幼苗的DNA用于基因定位试验。利用MaizeGDB (https:// maizegdb.org/)和Gramene (https://www.gramene.org/)数据库, 筛选到-与B73之间覆盖玉米10条染色体的多态SSR (Simple Sequence Repeats)标记, 采用BSA (Bulked Segregant Analysis)分池的方法进行基因的粗定位。利用开发的两亲本之间的多态InDel (Insertion-Deletion)标记进行基因的精细定位(表1)。PCR产物经4%聚丙烯酰胺凝胶或3%的琼脂糖凝胶电泳, 进行基因型分析及交换率的计算。
1.4 基因组DNA提取、PCR扩增和序列分析
利用CTAB法提取玉米基因组DNA。根据玉米参考基因组B73中候选区间内基因序列和注释, 设计基因特异引物, 以野生型和突变体-基因组DNA为模板, 利用Phusion高保真DNA聚合酶进行PCR扩增, 对扩增产物进行测序并利用Sequencher 5.0软件进行序列比对。PCR扩增体系为: 5×Phusion buffer 10 µL、dNTPs (10 mmol L–1) 1 µL、引物(10 µmol L–1) 2.5 µL、模板DNA 2 µL、Phusion DNA聚合酶0.5 µL, 补超纯水至50 µL。PCR扩增条件为: 98℃预变性30 s; 98℃变性10 s, 60℃退火20 s, 72℃延伸1 min, 35个循环; 72℃延伸7 min。用1%琼脂糖凝胶电泳检测目的条带。
1.5 RNA提取及基因表达模式分析
为了检测突变体中基因表达水平变化, 利用Trizol试剂盒提取野生型和授粉后15 d籽粒的RNA; 为了检测基因在不同时期或不同组织的表达模式, 收集野生型玉米的幼嫩果穗(长约4~5 cm)、苞叶、花丝、雄穗、旗叶及授粉后第13、15、19、23、25和29 d籽粒的胚和胚乳组织, 提取各组织RNA。电泳检测RNA完整性并用Nanodrop 2000进行定量。利用TaKaRa的反转录试剂盒得到cDNA, 以cDNA为模板, 设计基因特异引物(表2), 进行半定量RT-PCR (Reverse Transcription-Polymerase Chain Reaction)分析。玉米(Folylpolyglutamate synthase)基因具有较好的表达稳定性, 因此被作为本研究的内参基因[12]。RT-PCR 反应程序为: 95℃预变性5 min; 95℃变性30 s, 56℃退火30 s, 72℃延伸15 s, 循环25 (内参基因)或28 (基因)次; 72℃过度延伸7 min。
1.6 等位测验
为了检测是否为基因等位突变体, 将与进行杂交, 通过观察杂交F1代及其后代籽粒表型, 确认两者是否为等位突变。若籽粒表现为突变型, 则说明两者为等位突变; 反之, 若表现为野生型, 则不是等位突变。
2 结果与分析
2.1 突变体mn1-m2的表型和遗传分析
突变体是从玉米自交系Lx9801与PH4CV的杂交又自交多代的后代中自然突变而来。与野生型相比, 突变体苗期表现为植株矮小(图1-B), 成熟期植株整体株型与野生型差别不大,但籽粒表现为干瘪或“空果皮”, 灌浆受损(图1-A, C)。观察授粉后25 d的籽粒, 与野生型相比, 突变体胚和胚乳变小(图1-D)。百粒重比较结果表明,突变籽粒的百粒重仅为野生型的21% (图1-E), 重量显著降低。进一步对野生型和突变体授粉后20 d籽粒进行石蜡切片观察发现, 与野生型相比,胚乳细胞和淀粉颗粒均变小, 细胞排列不规则(图2)。以上结果表明基因功能丧失后, 严重影响了玉米籽粒胚乳的正常生长发育以及灌浆过程。
将与B73进行杂交, 得到的F1代籽粒表现为野生型, 自交后得到的F2代表现出籽粒表型分离, 在284粒的F2群体中, 野生型籽粒为225粒, 突变体籽粒为59粒, 卡方检测结果为χ2= 2.704, 经查表,> 0.05, 野生型籽粒与籽粒分离比符合3∶1, 即突变体表型由单个隐性核基因突变造成。

表1 基因定位所用的分子标记
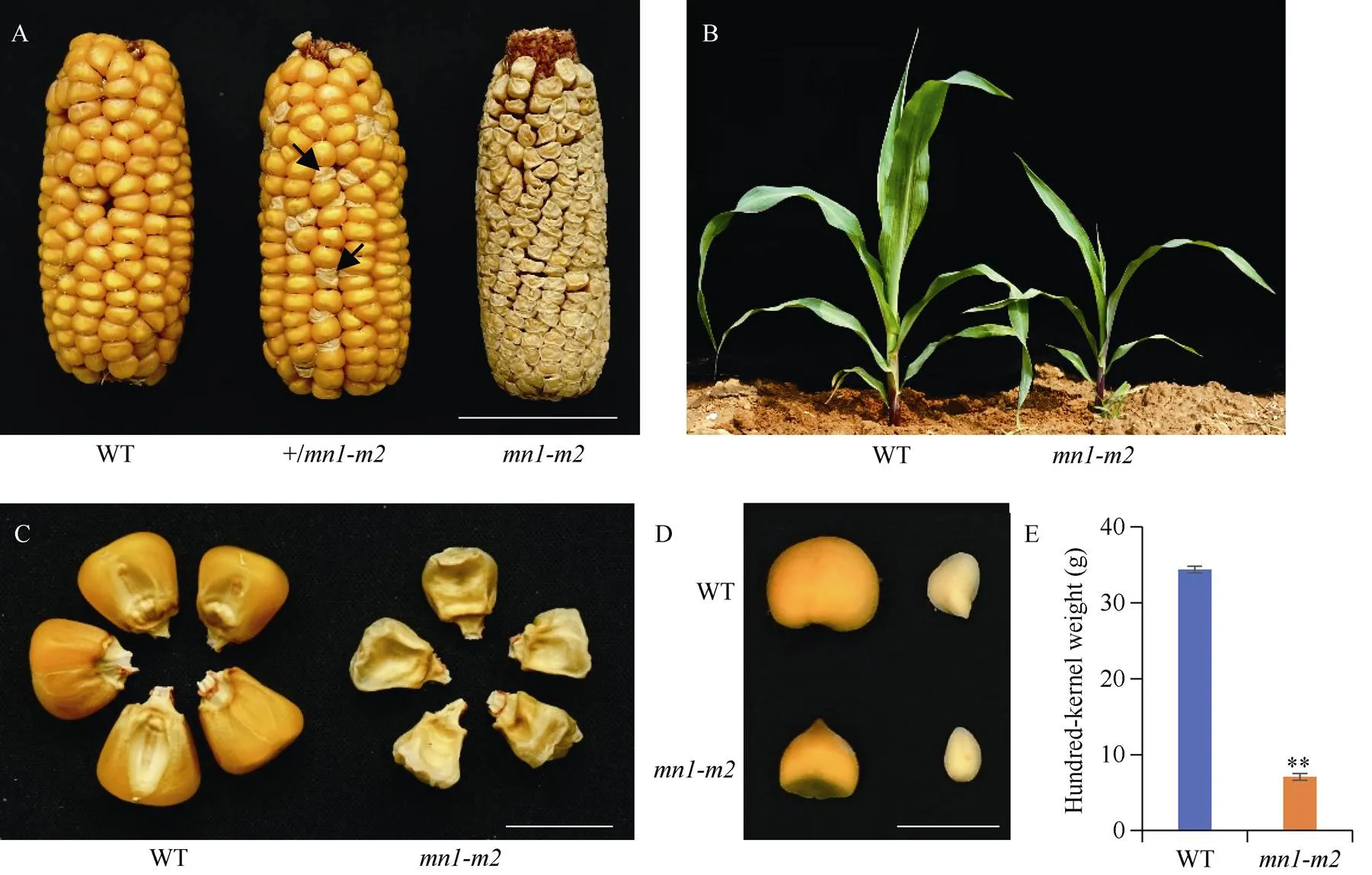
图1 野生型及突变体mn1-m2表型分析
A: 野生型、杂合(+/)及纯合突变体的成熟果穗, 图中箭头为杂合型植株自交后分离出的突变型籽粒; B: 生长3周幼苗; C: 成熟期籽粒; D: 授粉后25 d籽粒的胚乳(左)和幼胚(右)的表型; E: 百粒重统计。A图标尺为5 cm, C~D图标尺为1 cm。
A: mature ears of wild type (WT), heterozygous (+/), and homozygous, and arrows indicate the mutant kernels segregated from ears of the heterozygous plants; B: three-week old seedlings; C: mature kernels; D: kernel endosperm and embryo of 25 days after pollination (DAP); E: statistical analysis of hundred-kernel weight. Bar: 5 cm (A) and 1 cm (C–D).

图2 野生型及mn1-m2授粉后20 d籽粒的石蜡切片观察
A: 授粉后20 d野生型籽粒顶部胚乳观察; B: 授粉后20 d籽粒顶部胚乳观察; C: 为(A)图中红色方框区域的放大图; D: 为(B)图中红色方框区域的放大图。A~B图标尺为500 μm; C~D图标尺为100 μm。
A: the endosperm observation of WT kernels at 20 DAP; B: the endosperm observation ofkernels at 20 DAP; C: the magnification of the area marked as red rectangle in (A); D: the magnification of the area marked as red rectangle in (B). Bar: 500 μm (A–B) and 100 μm (C–D).
2.2 mn1-m2基因定位
将突变体-与B73进行杂交, 得到的F1代自交获得F2代定位群体。采用BSA分池的方法寻找与-突变位点连锁的分子标记。利用筛选到的224对均匀覆盖玉米10条染色体的多态SSR标记, 对-、B73、野生型基因池和突变体基因池进行基因型分析。粗定位选用252株具有突变表型的F2单株, 发现第2染色体上的SSR标记umc2249、umc2030、umc2079和umc2125与突变位点连锁, 交换单株数如图3所示, 因此初步将-定位于SSR标记umc2030和umc2125之间。为了进一步精细定位-基因, 在扩大了定位F2群体的同时, 开发了新的具有多态的In-Del标记(表1)。最终, 我们将候选基因定位于约1.1 Mb的2个InDel标记IDP3和IDP4之间。根据MaizeGDB的注释, 该区间含有10个候选蛋白编码基因, 且含有典型的胚乳发育相关基因(), 又称(), 该基因编码胚乳特异的细胞壁蔗糖转化酶, 在籽粒灌浆和发育过程中发挥重要作用, 该基因突变可致使玉米籽粒发育缺陷[13-14]。以野生型和-植株cDNA为模板, 扩增区间内候选基因的编码区并进行测序。经序列比对发现, 突变体中基因上第1个外显子的第18个核苷酸后发生转座子的插入, 该转座子序列共166 bp, 其中包括8 bp的插入位点序列重复(target site duplication, TSD), 为CTCGTAGT。该转座子内部含有2个TAA终止密码子, 因此导致Mn1蛋白翻译提前终止。
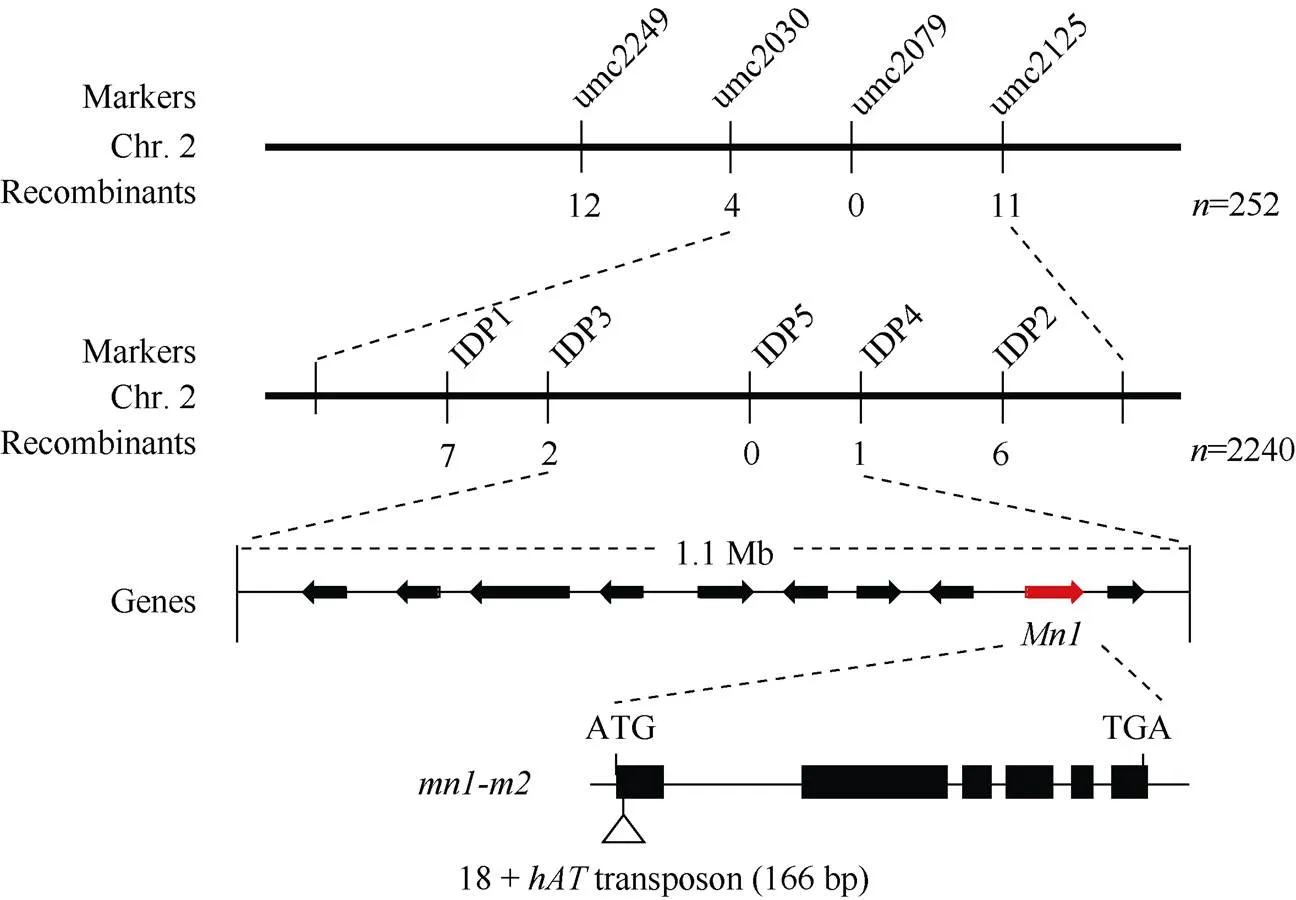
图3 mn1-m2基因的图位克隆
利用与B73之间的多态SSR和In-Del (IDP)标记, 通过放大定位F2群体, 结合对目标区间内基因测序, 最终定位到突变基因为, 编码细胞壁蔗糖转化酶。该基因在第1个外显子的第18个核苷酸后发生转座子(166 bp)的插入。图中标红基因为。黑框代表外显子, 黑线代表内含子。: 群体大小; Recombinants: 重组单株数。
The polymorphic SSR and In-Del (IDP) markers were developed betweenand, using the amplified F2mapping population and, sequencing of putative genes in the target region, thelocus was finally mapped to, which encodes a cell wall invertase. Antransposon (166 bp) was inserted into the first exon at 18 bp from ATG. The gene marked in red was. Black boxes represent exons and lines represent introns.: the number of individuals; Recombinants: the number of recombinants.
2.3 突变位点鉴定与分子标记开发
为了检测转座子插入对基因表达水平的影响, 我们对野生型和突变体授粉后15 d的籽粒做了RT-PCR分析, 结果显示, 与野生型相比, 突变体中基因表达水平显著下调(图4-A)。
根据突变体中转座子引起的插入突变, 我们开发了基因特异的跨转座子的In-Del标记, 标记引物位置如图4-B所示。利用此In-Del标记对野生型亲本、突变体杂合植株(+/)果穗上分离出的野生型表型和突变体表型籽粒萌发后的幼苗进行基因型鉴定, 部分结果如图4-C所示, 野生型亲本单株扩增产物大小均为495 bp, 突变体纯合单株扩增产物大小均为661 bp, 而杂合植株(+/)自交后果穗上分离出的野生型籽粒表现出基因型的分离(+/+和+/), 因此表现出2种扩增产物带型。在检测的152株杂合体自交后代分离群体中, 野生型带型(+/+)单株39株, 杂合型带型(+/)单株82株, 突变体带型(/)单株31株, 符合1∶2∶1分离比(χ2= 1.789,> 0.05)。以上结果表明, 该转座子引起的基因的插入突变与籽粒缺陷表型完全连锁。
2.4 mn1-m2和mn1-89等位测验
已知-为基因的单碱基突变体, 且籽粒发育受损[15]。突变体与的突变位点如图5-A所示, 以为母本, 与父本花粉进行杂交, 杂交后代均表现为籽粒突变表型(图5-B~G)。同样以为母本, 与父本花粉进行杂交, 杂交后代均表现出类似的籽粒缺陷, 无野生型籽粒表型, 因此与为等位突变体。
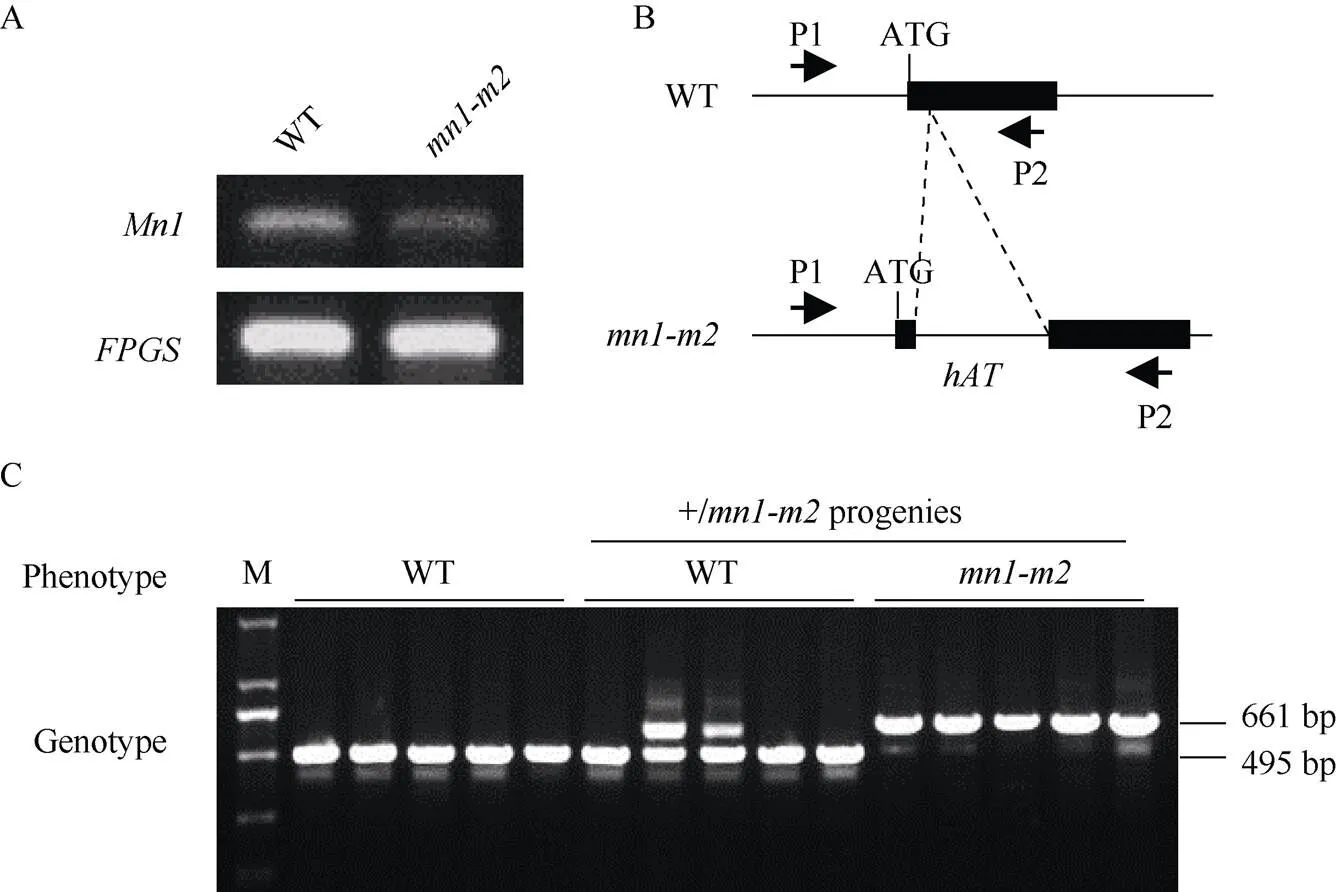
图4 mn1-m2突变体中mn1基因表达水平及hAT转座子插入的鉴定
A: 野生型及授粉后15 d籽粒中基因表达水平,为内参基因; B: In-Del分子标记引物P1和P2位于转座子两侧的示意图; C: In-Del分子标记与突变表型完全连锁。野生型扩增产物大小为495 bp,扩增产物大小为661 bp。
A: the relative expression level ofin 15-DAP kernels of WT and,: reference gene; B: the schematic diagram shows that primers P1 and P2 of the developed In-Del marker flank thetransposon; C: the In-Del marker was completely linked with themutant phenotype. The length of the PCR products was 495 bp for WT, and 661 bp for. M: DNA marker DL2000.

图5 mn1-m2与mn1-89突变体等位测验
A:基因结构及2个突变体的突变位置; B: 突变体,及其杂交后代果穗的表型; C:背景野生型的籽粒; D:籽粒; E:与杂交F1代籽粒; F:籽粒; G:背景野生型W22的籽粒。B图标尺为5 cm, C~G图标尺为1 cm。
A: gene structure ofand mutant sites of the two mutants; B: the ear phenotype of mutant,and×; C: the kernels of WT for; D: the kernels of; E: the kernels of×; F: the kernels of; G: the kernels of W22. Bar: 5 cm (B) and 1 cm (C–G).
2.5 表达模式分析
分别取玉米不同组织和不同发育时期的胚和胚乳, 利用半定量RT-PCR, 以为内参基因, 检测基因的表达模式(图6)。结果表明,在雌穗的籽粒、苞片和花丝, 雄穗及旗叶中均有表达(图6-A)。在授粉后各个时期的胚乳中均有表达, 而胚中只在发育早期有表达(图6-B)。的这种表达模式说明其在雌穗和雄穗发育中均起重要作用, 且主要在籽粒胚发育早期和胚乳发育各时期发挥重要作用。

图6 RT-PCR分析Mn1基因在玉米不同组织中的表达水平
A: 分别提取野生型玉米幼穗、苞片、花丝、雄穗和旗叶组织RNA, 检测表达水平; B: 分别提取授粉后13、15、19、23、25和29 d籽粒的胚和胚乳RNA, 检测表达水平。为内参基因。
A: RNA was extracted from young ear, bract, silk, tassel, and flag leaf for detectingexpression level; B: RNA was extracted from embryo and endosperm of 13, 15, 19, 23, and 29 DAP for detectingexpression level.: the reference gene.
3 讨论
玉米籽粒胚与胚乳的早期发育是一个复杂的生物学过程, 其遗传发育机制一直是玉米研究的热点。胚作为新生植物的幼体, 其萌发所需的营养物质来自于胚乳; 胚乳占籽粒的绝大部分, 在籽粒发育过程中积累淀粉和蛋白质等营养成分。因此, 挖掘玉米籽粒胚乳发育突变体中的调控基因, 对揭示籽粒发育的分子机制以及玉米产量和品质的遗传改良具有重要意义。
玉米籽粒发育缺陷突变体主要分为胚缺陷(,)、籽粒严重缺陷(,)以及空果皮(,)等类型[16], 本研究中突变体表现为籽粒灌浆不充分, 胚乳发育严重受阻, 成熟籽粒干瘪或“空果皮”, 重量仅为野生型的1/5, 因此归属为空果皮类型。目前, 玉米中已报道的PPR (pentatricopeptide repeat)蛋白家族突变体[17]、[18]、[19]和[20], 细胞壁蔗糖转化酶突变体[13], 内质网I型信号肽突变体[21], 以及糖转运蛋白突变体[11]等, 均属于此类。
通过图位克隆及分子标记连锁验证发现, 该突变表型是由于转座子插入玉米基因致使发生无义突变所致。玉米基因是植物中第1个被解析的细胞壁蔗糖转化酶基因[13-14,22], 在胚乳基底层特异表达, 负责将蔗糖分解为葡萄糖和果糖, 从而维持胚乳细胞的有丝分裂活性以及养分从母体到子代组织的运输, 马铃薯中LIN5[23]和水稻中GIF1[24]均与Mn1高度同源且功能保守。本研究中约80%的突变体种子可以正常萌发并长成为成熟植株, 推测()基因突变不致死的原因可能是因为玉米体内的另外一个同源基因的存在, 在一定程度上弥补了功能缺失引起的胚乳发育缺陷表型[25-26]。苗期较野生型矮小, 但成熟期植株形态无明显差别, 推测是由于萌发期胚乳供养不足导致。观察授粉后20 d的籽粒切片发现,-的胚乳细胞和淀粉颗粒均变小, 细胞排列不规则, 导致胚乳发育严重受阻, 与2002年报道的胚乳细胞有丝分裂活性和细胞膨大受抑制的结果相呼应[27]。
玉米-为基因的单碱基突变体, 其突变基因编码蛋白的C端发生一个氨基酸的变化, 致使蛋白酶活性大幅降低, 从而导致籽粒发育缺陷表型[15]。通过等位测验, 对-和-双突变体的表型观察的结果, 进一步验证了-即为基因的一个新的等位突变体。基因主要在胚乳基底层特异表达, 本研究中表达模式分析的结果表明,在胚乳发育的各个时期均有表达, 进一步说明了其在胚乳发育过程中发挥了重要调节作用。
4 结论
本研究发现了一个新的玉米籽粒发育突变体, 该突变体表现为灌浆缺陷, 胚和胚乳变小, 成熟籽粒“空果皮”。该突变体受单个隐性核基因控制。通过基因定位和基因克隆发现,中基因在第1外显子的第18个核苷酸后发生转座子的插入, 导致蛋白翻译提前终止。据此开发的In-Del标记与突变体表型完全连锁, 且与为等位突变体, 由此确定是一个新的基因等位突变体。该研究完善了玉米籽粒突变体的种质资源信息, 也为调控籽粒发育机制的解析提供新的遗传材料。
[1] Olsen O A. ENDOSPERM DEVELOPMENT: cellularization and cell fate specification., 2001, 52: 233–267.
[2] Bommert P, Werr W. Gene expression patterns in the maize caryopsis: clues to decisions in embryo and endosperm development., 2001, 271: 131–142.
[3] Clark J K, Sheridan F. Mutations of maize., 1991, 3: 935–951.
[4] Sheridan W F, Clark J K. Mutational analysis of morphogenesis of the maize embryo., 1993, 3: 347–358.
[5] Kesavan M, Song J T, Seo H S. Seed size: a priority trait in cereal crops., 2013, 147: 113–120.
[6] Martin A, Lee J, Kichey T, Gerentes D, Zivy M, Tatout C, Dubois F, Balliau T, Valot B, Davanture M, Tercé-Laforgue T, Quilleré I, Coque M, Gallais A, Gonzalez-Moro M, Bethencourt L, Habash D Z, Lea P J, Charcosset A, Perez P, Murigneux A, Sakakibara H, Edwards K J, Hirel B. Two cytosolic glutamine synthetase isoforms of maize are specifically involved in the control of grain production., 2006, 18: 3252–3274.
[7] Li Q, Li L, Yang X H, Warburton M L, Bai G H, Dai J R, Li J S, Yan J B. Relationship, evolutionary fate and function of two maize co-orthologs of riceassociated with kernel size and weight., 2010, 10: 143.
[8] Li Q, Yang X, Bai G H, Warburton M L, Mahuku G, Gore M, Dai J R, Li J S, Yan J B. Cloning and characterization of a putativeortholog involved in maize kernel development., 2010, 120: 753–763.
[9] Manavski N, Guyon V, Meurer J, Wienand U, Brettschneider R. An essential pentatricopeptide repeat protein facilitates 5’ maturation and translation initiation ofmRNA in maize mitochondria., 2012, 24: 3087–3105.
[10] Li X J, Zhang Y F, Hou M, Sun F, Shen Y, Xiu Z H, Wang X, Chen Z L, Sun S S, Small I, Tan B C.encodes a pentatricopeptide repeat protein required for mitochondrialtranscript editing and seed development in maize () and rice ()., 2014, 79: 797–809.
[11] Sosso D, Luo D, Li Q B, Sasse J, Yang J, Gendrot G, Suzuki M, Koch K E, McCarty D R, Chourey P S, Rogowsky P M, Ross-Ibarra J, Yang B, Frommer W B. Seed filling in domesticated maize and rice depends on SWEET-mediated hexose transport., 2015, 47: 1489–1493.
[12] Manoli A, Sturaro A, Trevisan S, Quaggiotti S, Nonis A. Evaluation of candidate reference genes for qPCR in maize., 2012, 169: 807–815.
[13] Miller M E, Chourey P S. The maize invertase-deficient-seed mutation is associated with aberrant pedicel and endosperm development., 1992, 4: 297–305.
[14] Cheng W H, Taliercio E W, Chourey P S. Theseed locus of maize encodes a cell walI invertase required for normal development of endosperm and maternal cells in the pedicel., 1996, 8: 971–983.
[15] Carlson S J, Shanker S, Chourey P S. A point mutation at theseed locus reduces levels of the encoded protein, but not its mRNA, in maize., 2000, 263: 367–373.
[16] Dai D W, Ma Z Y, Song R T. Maize kernel development., 2021, 41: 2.
[17] Gutiérrez-Marcos J F, Dal Prà M, Giulini A, Costa L M, Gavazzi G, Cordelier S, Sellam O, Tatout C, Paul W, Perez P, Dickinson H G, Consonni G.encodes a mitochondrion- targeted pentatricopeptide repeat protein necessary for seed development and plant growth in maize., 2007, 19: 196–210.
[18] Yang Y Z, Ding S, Wang H C, Sun F, Huang W L, Song S, Xu C, Tan B C. The pentatricopeptide repeat protein EMP9 is required for mitochondrialandtranscript editing, mitochondrial complex biogenesis and seed development in maize., 2017, 214: 782–795.
[19] Ren X M, Pan Z Y, Zhao H L, Zhao J L, Cai M J, Li J, Zhang Z X, Qiu F Z. Empty pericarp11 serves as a factor for splicing of mitochondrialintron and is required to ensure proper seed development in maize., 2017, 68: 4571–4581.
[20] Xiu Z H, Sun F, Shen Y, Zhang X Y, Jiang R C, Bonnard G, Zhang J H, Tan B C. EMPTY PERICARP16 is required for mitochondrialintron 4-splicing, complex I assembly and seed development in maize., 2016, 85: 507–519.
[21] Yi F, Gu W, Li J F, Chen J, Hu L, Cui Y, Zhao H M, Guo Y, Lai J S, Song W B., encoding an endoplasmic reticulum signal peptidase, is critical in seed development., 2021, 185: 985–1001.
[22] Li B, Liu H, Zhang Y, Kang T, Zhang L, Tong J H, Xiao L T, Zhang H X. Constitutive expression of cell wall invertase genes increases grain yield and starch content in maize., 2013, 11: 1080–1091.
[23] Fridman E, Carrari F, Liu Y S, Fernie A R, Zamir D. Zooming in on a quantitative trait for tomato yield using interspecific introgressions., 2004, 305: 1786–1789.
[24] Wang E T, Wang J J, Zhu X D, Hao W, Wang L Y, Li Q, Zhang L X, He W, Lu B R, Lin H X, Ma H, Zhang G Q, He Z H. Control of rice grain-filling and yield by a gene with a potential signature of domestication., 2008, 40: 1370–1374.
[25] Chourey P S, Jain M, Li Q B, Carlson S J. Genetic control of cell wall invertase in developing endosperm of maize., 2006, 223: 159–167.
[26] Liu J, Huang J, Guo H, Lan L, Wang H Z, Xu Y C, Yang X H, Li W Q, Tong H, Xiao Y J, Pan Q C, Qiao F, Raihan M S, Liu H J, Zhang X H, Yang N, Wang X Q, Deng M, Jin M L, Zhao L J, Luo X, Zhou Y, Li X, Zhan W, Liu N N, Wang H, Chen G S, Li Q, Yan J B. The conserved and unique genetic architecture of kernel size and weight in maize and rice., 2017, 175: 774–785.
[27] Vilhar B, Kladnik A, Blejec A, Chourey P S, Dermastia M. Cytometrical evidence that the loss of seed weight in theseed mutant of maize is associated with reduced mitotic activity in the developing endosperm., 2002, 129: 23–30.
Characterization and genetic analysis of a new allelic mutant ofgene in maize
WANG Juan, XU Xiang-Bo, ZHANG Mao-Lin, LIU Tie-Shan, XU Qian, DONG Rui, LIU Chun-Xiao, GUAN Hai-Ying, LIU Qiang, WANG Li-Ming*, and HE Chun-Mei*
Maize Research Institute, Shandong Academy of Agricultural Sciences / National Engineering Research Center of Wheat and Maize / Key Laboratory of Biology and Genetic Improvement of Maize in Northern Yellow-Huai River Plain, Ministry of Agriculture and Rural Affairs, Jinan 250100, Shandong, China
Grain development is a key determinant for maize grain yield and quality, but the regulatory mechanisms have not been fully revealed. A maize mutant deficient in kernel development was found and selected in our field. The mutant exhibited an incomplete grain filling, reduced embryo and endosperm size, and shriveled mature grains and empty pericarp. Genetic analysis suggested that the mutant phenotype was controlled by a single recessive nuclear gene. The candidate gene was preliminarily mapped to a 1.1 Mb interval on chromosome 2, and further atransposon was inserted into the first exon of() gene, which resulting in a frame-shift mutation and down-regulated expression of. The transposon insertion was fully linked to the defective kernel phenotype of the mutant, which was nominated as-. Allelism test of-and-suggested that-was a noval allelic mutant ofgene. In conclusion, we identified a new allelic mutant ofgene with different mutation site and type, which improved maize germplasm resources and provided new genetic materials for the analysis of the mechanism of Mn1 regulation on kernel development.
maize; grain filling;; mutant
2023-02-10;
2023-02-28.
10.3724/SP.J.1006.2023.23059
通信作者(Corresponding authors):汪黎明, E-mail: 13605401923@126.com; 何春梅, E-mail: chunmeihe11@163.com
E-mail: wqian456@163.com
2022-09-07;
本研究由国家自然科学基金项目(32101761, 31971964)和山东省农业科学院农业科技创新工程项目(CXGC2022A02)资助。
This study was supported by the National Natural Science Foundation of China (32101761, 31971964) and the Agricultural Science and Technology Innovation Project of the Shandong Academy of Agricultural Sciences (CXGC2022A02).
URL: https://kns.cnki.net/kcms/detail//11.1809.S.20230227.1440.010.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
