MDCK-MDR1细胞药物体外吸收模型的建立及验证
2023-06-08韩帅张洁金婷婷闫茹冰褚海辰梁永新
韩帅 张洁 金婷婷 闫茹冰 褚海辰, 梁永新,3
(1 青岛大学医学部,山东 青岛 266071;2 青岛大学附属医院麻醉科;3 青岛大学附属妇女儿童医院麻醉科)
口服给药是临床上最广泛的给药方式之一,药物在消化道吸收的速度和程度是影响药物生物利用度的主要因素[1-2]。MDR1转染犬肾细胞(MDR1-MDCK)是将人的多耐药基因转染MDCK细胞形成的稳定细胞系,能够分化成连接紧密和表达高转运蛋白的单层极性细胞[3-4]。MDCK-MDR1细胞体外吸收模型被广泛用于口服药物肠道上皮吸收转运机制的研究中[5-7]。但由于MDCK-MDR1细胞来源以及各实验室培养条件不同,各实验室对MDCK-MDR1细胞模型的建立方法和检验标准也存在一定的差异。本研究通过对MDCK-MDR1细胞形态特征、生长活力、跨膜电阻(TEER)值和荧光黄表观渗透系数(Papp)等参数进行检测,拟构建可重复性强、稳定性好的MDCK-MDR1细胞体外吸收模型,为药物体外穿膜机制的研究提供可靠的细胞模型。
1 材料与方法
1.1 试剂与仪器
MDCK-MDR1细胞由上海青旗生物技术发展有限公司提供,CCK-8试剂盒由上海翊圣生物科技有限公司生产,荧光黄由北京谨明生物科技有限公司生产,EVOM2跨膜细胞电阻仪购自美国World Precision Instruments公司,NIB620-FL倒置显微镜购自安徽耐可视科技股份有限公司。
1.2 MDCK-MDR1细胞培养及形态观察
将MDCK-MDR1细胞置于DMEM高糖培养基(含有1×105U/L青霉素/链霉素/两性霉素B、2 mmol/L谷氨酰胺和体积分数0.10的FBS)中,于37 ℃、含有体积分数0.05 CO2的培养箱中培养。待MDCK-MDR1细胞(20~35代)处于对数生长期时,分别按浓度1.0×108/L(L组)、2.5×108/L(M组)、5.0×108/L(H组)接种于24孔Transwell培养板(后文简称“培养板”)上,从培养板的滤膜顶端(AP)以及基底侧(BL)分别加入400、600 μL的DMEM高糖培养基,各组细胞均培养7 d,每天更换DMEM高糖培养基,分别于第1、3、5天于NIB620-FL倒置显微镜下观察各组MDCK-MDR1细胞的形态变化情况。
1.3 MDCK-MDR1细胞增殖数量的测定
将培养达到对数生长期的L、M、H组MDCK-MDR1细胞接种于培养板上,按1.2中的方法进行培养,共培养7 d。每天分别从L、M、H组中各取出3孔细胞,以Hank平衡盐溶液(HBSS)洗涤2次后,每孔再分别加入100 μL的DMEM高糖培养基和10 μL的CCK-8试剂,将培养板再次置于37 ℃、含体积分数0.05 CO2培养箱中继续培养2 h后,将各孔中的细胞和培养液转移至96孔板中,采用酶标仪测定450 nm波长处的吸光度(A)值,绘制细胞生长曲线。
1.4 MDCK-MDR1细胞TEER值的测定
将培养达到对数生长期的L、M、H组MDCK-MDR1细胞接种于培养板上,同时将不加MDCK-MDR1细胞的DMEM高糖培养基作为对照,按1.2中的方法进行培养,共培养7 d。每天分别从对照和L、M、H组中各取出3孔细胞,弃去孔中的DMEM高糖培养基,再将400、600 μL的HBSS分别加入培养板的AP侧和BL侧。TEER值测定开始前,将EVOM2跨膜细胞电阻仪电极置于预热至37 ℃ HBSS中平衡15~20 min。每孔重复测量3次,结果取均值。TEER值计算公式:TEER=(TEER测定-TEERR对照)×0.33 cm2,其中TEER测定为L、M、H组培养板孔中的电阻值,TEER对照为对照培养板孔中的电阻值。
1.5 MDCK-MDR1细胞单层膜结构通透性的验证
1.5.1荧光黄标准曲线绘制 用HBSS将荧光黄稀释成0.005、0.010、0.025、0.050和0.100 mg/L的浓度,随后采用酶标仪测量不同浓度荧光黄的荧光强度(激发波长427 nm,发射波长536 nm),以荧光强度为纵坐标,荧光黄浓度为横坐标,绘制荧光黄标准曲线。
1.5.2荧光黄转运实验 根据1.2~1.4中的实验结果,确定MDCK-MDR1细胞形成单层膜结构的最佳接种浓度和培养时间,按照1.2的方法将最佳接种浓度的MDCK-MDR1细胞接种于培养板上,培养至最佳培养时间时,取出3孔细胞吸弃DMEM高糖培养基后,从培养板AP侧加入20 mg/L荧光黄400 μL,BL侧加入600 μL的HBSS,置于37 ℃、含体积分数0.05 CO2的培养箱中再培养1 h。分别于培养0.5、1.0 h时从每孔的BL侧取样100 μL,再补充相同体积的HBSS,以酶标仪测量各孔中BL侧荧光黄的荧光强度(激发波长427 nm以及发射波长536 nm)。参考荧光黄标准曲线,计算各孔BL侧荧光黄Papp值,以Papp值<5.0×10-7cm/s作为细胞单层膜结构的通透性达到通透性试验要求的标准[8]。
2 结 果
2.1 MDCK-MDR1细胞生长形态观察
倒置显微镜下观察显示,MDCK-MDR1细胞在培养板中贴壁生长,呈扁平状,自发性上皮样分化。L、M、H组的MDCK-MDR1细胞分别在第5、3、1天时形成单层膜结构。形成单层膜结构后,MDCK-MDR1细胞间连接紧密,细胞数量达到峰值。H组在第5天时出现细胞成团现象(图1)。
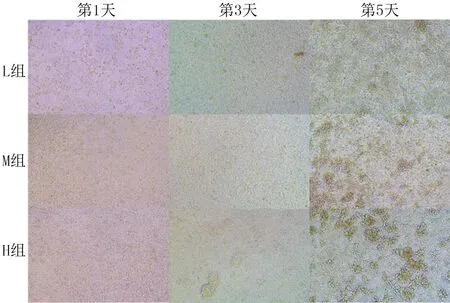
图1 各组MDCK-MDR1细胞培养不同时间时的细胞形态观察(20倍)
2.2 各组MDCK-MDR1细胞增殖数量比较
各组MDCK-MDR1细胞的增殖数量均呈现先上升后下降的趋势,L、M和H组的细胞数量分别在第5、4、3天时达到峰值。重复测量设计方差分析结果显示,时间、组别、时间和组别交互作用对MDCK-MDR1细胞的增殖数量均有显著影响(F时间=41.133,F组别=29.385,F时间*组别=13.211,P<0.05)。在细胞生长早期(1~3 d),H组的MDCK-MDR1细胞增殖数量明显高于L组以及M组(F=26.241~34.645,P<0.05)。在细胞生长的中晚期(5~7 d),H组MDCK-MDR1细胞增殖数量明显低于L组和M组(F=32.256~41.778,P<0.05)。见表1。
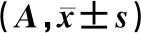
表1 各组MDCK-MDR1细胞第1~7天A值比较
2.3 各组MDCK-MDR1细胞TEER值比较
各组MDCK-MDR1细胞的TEER值在第1~5天时均随培养时间的延长而增加,并于第6天时基本趋于稳定,达到300 Ω·cm2。重复测量设计的方差分析结果显示,时间、组别、时间和组别交互作用对MDCK-MDR1细胞的TEER值均具有显著影响(F时间=26.784,F组别=31.247,F时间*组别=25.773,P<0.05)。与M组和H组相比,L组的TEER值在第5天显著增高(F=13.621,P<0.05),且最快达到300 Ω·cm2左右。在第6~7天时,各组的TEER值进行比较,其差异均无统计学意义(P>0.05)。见表2。
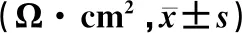
表2 各组MDCK-MDR1细胞第1~7天TEER值比较
2.4 MDCK-MDR1细胞单层通透性的验证
本研究绘制的不同浓度荧光黄标准曲线为Y=674693X+720.86,R2为0.999 7。根据各组MDCK-MDR1细胞不同培养时间细胞的生长形态、生长曲线和TEER值结果可以发现,L组细胞在接种第5天时吸光度值达到峰值,且成团死亡的细胞数较少,TEER值在第5~7天趋于稳定,故认为MDCK-MDR1细胞形成单层膜结构的最佳接种浓度为1.0×108/L,最佳的培养时间为第5天。在此条件下进行的荧光黄转运实验,测得的0.5 h和1.0 h时BL侧荧光强度分别为126±17和382±35,Papp=4.27×10-7cm/s,低于5.0×10-7cm/s,模型验证成功,构建的MDCK-MDR1细胞单层膜结构的通透性符合通透性实验的要求,能够用于模拟口服药物吸收和转运机制的研究。
3 讨 论
口服是临床中首选的给药途径,与其他给药途径相比,具有给药方式简便以及患者依从性好等优点[9-10]。药物在肠道内的吸收速度及吸收程度是影响药物生物利用度的重要因素。药物在胃肠道的吸收途径主要有以下几种:①跨细胞途径:药物借助其脂溶性或细胞膜上的载体穿过细胞被吸收,包括被动转运和主动转运两种机制;②细胞旁路途径:是水溶性小分子吸收的重要途径,属于被动转运;③内吞:药物吸附在细胞膜上,通过膜的凹陷进入细胞形成小泡被吸收;④经派伊尔结(PPs)上的M细胞吸收到淋巴循环:微粒和一些抗原性物质被M细胞摄取以后转运至PPs,被PPs内的巨噬细胞吞噬,经淋巴循环进入血液完成吸收过程。此外,胃肠黏膜的通透性、药物的溶解度、代谢的稳定性、pH值、胃肠道表面积、吸收以及外排转运体的活性等因素,也均会影响到药物的口服生物利用度。人克隆结肠腺癌(Caco-2)细胞和MDCK细胞模型是目前药物吸收渗透性研究应用最多的模型[11-12],但Caco-2细胞缺少黏液层,培养周期较长(21 d),MDCK细胞表达转运蛋白的水平低且来源于动物[13]。与Caco-2细胞和MDCK细胞相比较,MDCK-MDR1细胞能够高效表达P-糖蛋白[14-15],实验成本低,培养周期短(3~5 d),结果重现性好[16-17]。MDCK-MDR1细胞在体外培养时能进行形态和功能的分化,被认为是研究口服药物前期筛选、营养素与毒素吸收最好细胞模型之一。虽然MDCK-MDR1细胞模型具备许多优势,但目前对于构建该模型时MDCK-MDR1细胞接种的浓度和培养时间并未达成一致。
本研究通过在倒置显微镜下面观察MDCK-MDR1细胞生长形态、绘制细胞的生长曲线、测定TEER值评价细胞单层膜结构的完整性来选择最佳的MDCK-MDR1细胞接种浓度和培养时间。后续通过荧光黄转运实验验证MDCK-MDR1细胞单层膜的通透性。本研究选取了MDCK-MDR1细胞的3种接种浓度,各组细胞接种早期生长迅速,吸光度值和TEER值显著升高,随后呈现趋于稳定的趋势,其中H组的吸光度值最早达到峰值,但是由于培养基中维持细胞生长的营养物质减少,代谢产物增加,细胞因为能量耗竭和代谢紊乱出现密度抑制,最终细胞停止分裂,凋亡增加,吸光度值降低。各组MDCK-MDR1细胞TEER值均随培养时间延长而增加,于第6天时基本趋于稳定,达到300 Ω·cm2左右,其中L组细胞的TEER值在1~3 d增加缓慢,4~5 d增长迅速,第5天达到300 Ω·cm2后基本稳定,并保持稳定至第7天,M组和H组细胞的TEER值在1~4 d增长稍平缓,5~6 d快速增长,在第6天达到300 Ω·cm2。一般情况下,跨膜电阻值约为200~1 000 Ω·cm2时,细胞单层膜结构完整性好[18-19],致密度越高,TEER值也就越大[20-22]。结合上述情况,本研究确定的MDCK-MDR1细胞形成单层膜结构的最佳接种浓度为1.0×108/L,最佳培养时间为5 d。
通过荧光黄转运实验对1.0×108/L的MDCK-MDR1细胞接种浓度、培养5 d的单层膜结构进行验证。结果显示,从培养板AP侧至BL侧的荧光黄Papp为4.27×10-7cm/s,低于通透性实验规定的5.0×10-7cm/s,证明该细胞单层膜结构完整,连接紧密性良好,且符合通透性实验的要求。
综上所述,MDCK-MDR1细胞体外吸收模型与细胞接种密度、构建时间密切相关。在本实验室条件下,MDCK-MDR1细胞接种浓度为1.0×108/L,连续培养5 d,显微镜下观察MDCK-MDR1细胞形态良好,生长迅速,TEER值趋于稳定,具有较低的荧光黄渗透率,证明MDCK-MDR1细胞形成单层膜结构且完整性好,可以作为模拟药物的体外肠道吸收转运模型。
作者声明:韩帅、闫茹冰、梁永新参与了研究设计;韩帅、金婷婷、张洁、褚海辰参与了论文的写作和修改。所有作者均阅读并同意发表该论文。所有作者均声明不存在利益冲突。
