逍遥散拆方药队醋酸乙酯部位抗抑郁作用的HPA 轴-神经可塑性关联调控机制研究
2023-06-08曾九僧胡靖文
曾九僧,陈 力,彭 希,栾 飞,胡靖文,刘 蓉,曾 南*
1. 成都中医药大学药学院,四川 成都 611137
2. 成都中医药大学 西南特色中药资源国家重点实验室,四川 成都 611137
3. 成都医学院第一附属医院 药剂科,四川 成都 610500
逍遥散作为经典名方,首载于宋朝《太平惠民和剂局方》,具有疏肝解郁、调和肝脾、养血健脾之功效,实验研究及临床应用中均被证实有确切的抗抑郁效果[1-3]。逍遥散拆方药队(CDB)是实验室前期基于逍遥散功效拆方和均匀设计研究获得的发挥抗抑郁作用的精简组方[4-5]。研究表明,CDB 水煎剂通过上调脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)/磷酸化酪氨酸激酶受体B(phosphorylated tyrosine kinase receptor B,p-TrkB)/磷酸化环磷腺苷效应元件结合蛋白(phosphorylated cAMP-response element binding protein,p-CREB)通路活性,抑制下丘脑-垂体-肾上腺(hypothalamicpituitary-adrenal,HPA)轴-功能亢进,并调节5-羟色胺1A(5-hydroxytryptamine1A,5-HT1A)/5-HT2A受体平衡,显著抑制慢性不可预见性温和应激(chronic unpredictable mild stress,CUMS)动物模型中的抑郁样行为,且抗抑郁效果与全方逍遥散相当[6-7]。然而,CDB 中发挥抗抑郁作用的物质基础和深入的作用机制需要进一步阐明,目前采用中药复方提取物的特定萃取部位作为研究对象开展药理学研究,不仅能遵循中医理论的整体观,而且能在保持复方整体性的前提下富集复方有效成分,对进一步揭示复方物质基础与作用机制具有重要应用价值[8]。
HPA 轴的过度活跃是抑郁症患者中重要的神经内分泌变化,海马区神经可塑性的受损与抑郁症的发病关系同样密切,且2 种发病机制之间存在明显的串扰[9]。研究表明,海马不仅是神经发生的主要区域,也是HPA 轴负反馈的高位调节中枢,参与了压力介导的应激反应[10-11],为抑郁症发生发展中的分子水平改变到结构水平变化提供了理论基础,也为抑郁症临床治疗提供了新的思路。本研究以反复注射糖皮质激素地塞米松诱导的小鼠抑郁模型为载体,从调节HPA 轴-神经可塑性关联角度探究CDB 醋酸乙酯部位的抗抑郁作用机制,有助于丰富CDB 的抗抑郁作用研究内涵,同时可为经方逍遥散的二次开发提供更多的药理学依据。
1 材料
1.1 动物
SPF 级雄性ICR 小鼠,5 周龄,体质量22~24 g,由北京斯贝福生物技术公司提供,合格证号SCXK(京)2019-0010。所有动物均饲养在成都中医药大学药学院动物观察室[合格证号SYXY(川)2019-124)],自由进食饮水,在24 h 明暗周期的环境中饲养,昼夜各12 h(开灯光照时间为8: 30~20: 30),温度(25±1)℃,相对湿度40%~60%。所有动物的饲养和实验操作均符合成都中医药大学实验动物伦理委员会要求,批准号TCM-2019-312。
1.2 药物
CDB 药物配比与实验室前期研究一致[5],成人(60 kg)一日用量合计33 g 原生药,CDB 所需的3种药材均购自太极大药房,柴胡(河北一仁药业有限公司,产地山西,批号200801)为伞形科植物柴胡BupleurumchinenseDC.的干燥根,当归(四川省中药饮片有限责任公司,产地甘肃,批号201022)为伞形科植物当归Angelicasinensis(Oliv.) Diels 的干燥根,薄荷(江苏东莲药业有限公司,批号210227)为唇形科植物薄荷MenthahaplocalyxBriq.的干燥地上部分。经成都中医药大学中药鉴定教研室龙飞副教授鉴定均为正品,符合《中国药典》2020年版要求。
将所需药材适度粉碎,加8 倍量水浸泡1 h,武火加热煮沸后,文火煎煮40 min,趁热滤过;同法加6 倍量的水煎煮30 min 及6 倍量的水煎煮20 min;合并3 次滤液,减压浓缩至1.2 g/mL,临用前稀释至所需浓度。
将所需药材适度粉碎,以8 倍量的95%乙醇浸泡药材12 h,回流提取3 次,每次3 h,合并提取液,减压浓缩至无醇味,得到醇提物。将醇提物分散在40 ℃纯水中,质量浓度为1 g/mL,待恢复至室温后,加入2 倍体积石油醚萃取,萃取8 次至近无色后,收集上层石油醚溶液,下层水溶液加入2倍体积的醋酸乙酯,萃取8 次至近无色,合并醋酸乙酯溶液,减压浓缩并低温烘干,冷冻干燥后获得CDB 醋酸乙酯部位,得率为1.45%(即每100 克生药经提取得到1.45 g CDB 醋酸乙酯部位)。采用UPLC-QE/MS 对CDB 醋酸乙酯部位的化学成分进行分析,结合文献比对确定其主要的化学成分,进一步使用HPLC 法同时测定柴胡皂苷B2、柴胡皂苷A、阿魏酸、迷迭香酸、橙皮苷、绿原酸的平均质量分数为4.20%、3.22%、1.99%、0.79%、0.35%、0.16%。
1.3 药品与试剂
盐酸氟西汀胶囊(20 mg/粒,批号9833A)购自法国Patheon France 公司;无水乙醇(批号2020041001)、石油醚(批号2020041001)、醋酸乙酯(批号2020041001)购自成都市科隆化学品有限公司;地塞米松磷酸钠注射液(批号2107208)购自国药集团容生制药有限公司;5-溴脱氧尿嘧啶核苷(5-bromo-2′-deoxyuridine,Brdu,批号B5002)购自美国Sigma 公司;甲苯胺蓝(批号190410)购自上海如吉生物科技发展有限公司;小鼠皮质酮(corticosterone,CORT)ELISA 试剂盒、小鼠促肾上腺皮质激素(adreno-cortico-tropic-hormone,ACTH)ELISA 试剂盒、小鼠促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)ELISA 试剂盒、小鼠BDNF ELISA 试剂盒购自江苏晶美生物科技公司,批号分别为JM-02344M1、JM-11447M1、JM-02792M1、JM-02487M1;磷酸化磷脂酰肌醇3-激酶(phosphorylated phosphatidylinositol 3-kinase,p-PI3K)兔多克隆抗体、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)兔多克隆抗体、磷酸化哺乳动物雷帕霉素靶蛋白(phosphorylated mammalian target of rapamycin,pmTOR)兔多克隆抗体、mTOR 兔多克隆抗体、p-CREB 兔多克隆抗体、CREB 兔多克隆抗体、磷酸化糖皮质激素受体(phosphorylated glucocorticoid receptor,p-GR)兔多克隆抗体、GR 兔多克隆抗体、热休克蛋白90(heat shock protein 90,HSP90)兔多克隆抗体、BDNF 兔多克隆抗体购自美国CST 公司,批号分别为4228S、4060S、2983S、5536S、9198S、9197S、4161S、12041S、4877S、47808S;PI3K 兔多克隆抗体、Akt 兔多克隆抗体、血清和糖皮质激素调节蛋白激酶 1(serum and glucocorticoidinducible kinase 1,SGK1)、p-TrkB 兔多克隆抗体、TrkB 兔多克隆抗体、突触生长蛋白(Synaptophysin)兔多克隆抗体、β-Tubulin 小鼠多克隆抗体购自上海Abmart 生物医药有限公司,批号分别为T40065、T40067、T55613、T55598、M047714、T55273、M20005;FK506 结合蛋白51(FK506 binding protein 51,FKBP51)兔多克隆抗体(批号DF13305)购自Affinity Biosciences 有限公司;突触后致密蛋白95(postsynaptic density protein 95,PSD95)兔多克隆抗体(批号20665-1-AP)购自武汉Proteach 有限公司;β-actin 兔多克隆抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔多克隆抗体、双皮质素(doublecortin,DCX)小鼠多克隆抗体、Brdu 兔多克隆抗体、CY3 山羊抗兔荧光二抗、山羊抗小鼠二抗、山羊抗兔二抗购自武汉赛维尔生物科技有限公司,批号分别为GB15003、GB11002、GB11317、GB12051、GB21303、G1214、G1213。
1.4 仪器
RE-3000A 型旋转蒸发仪(郑州亚荣仪器有限公司);UPK-10T 型纯水仪(广州优普科技有限公司);BS323S 型电子天平(德国Sartorius 公司);LGJ-18 型冷冻干燥机(北京松源华兴科技发展有限公司);ZZ-6 型小鼠自主活动测试仪(成都泰盟软件有限公司);ST16R 型冷冻离心机、Varioskan Flash全波长多功能酶标仪(美国Thermo Fisher Scientific公司);2016 型转轮式切片机(德国Leica 公司);DS-U3 型切片成像系统(日本Nikon 公司);Pannoramic250 型数字切片扫描仪(济南丹吉尔电子有限公司);DYY-6C 型电泳仪电源(北京六一仪器厂);1658001 型Mini-ProteanTetra 小型垂直电泳槽、ChemiDoc 免染型化学发光凝胶成像系统(美国Bio-Rad 公司)。
2 方法
2.1 反复注射地塞米松诱导的抑郁小鼠模型建立及给药
小鼠适应性喂养3 d,并在3 d 天内进行糖水偏好测试训练。将纯净水和1%糖水放在一个鼠笼上,每隔12 h 将2 个水瓶交换位置,适应性喂养结束后,按照体质量随机分为对照组、模型组、氟西汀(13.2 mg/kg)组、CDB 水煎液(生药量22.0 g/kg)组和CDB 醋酸乙酯部位低、高剂量(0.159、0.319 g/kg,即生药量11.0、22.0 g/kg)组。CDB 醋酸乙酯部位和氟西汀均采用含0.5%羧甲基纤维素钠和0.5%聚山梨酯-80 的溶液进行配制。除对照组外,其余小鼠连续21d(每天9: 30~11: 00 时)ip 地塞米松(10 mg/kg)造模[12],对照组ip 等体积生理盐水。造模后4 h(13: 30~15: 00 时)各给药组ig 相应药物,对照组和模型组ig 等体积生理盐水。在造模并给药的第18~21 天完成行为学测试,行为学测试结束后12 h,麻醉小鼠取血并分离血清,冰台上剖取海马组织,立即置于液氮中,而后转移至-80 ℃保存备用。
2.2 行为学测试
各组小鼠在造模并给药的第17~21 天依次完成以下行为学测试:①飞溅测试:使用喷壶将10%蔗糖水喷洒于小鼠背部,连续喷洒8 次,总体积2 mL。然后将小鼠放回饲养鼠笼中累积记录5 min 内小鼠梳洗背部被喷洒糖水部位的行为时间,即梳洗时间[13]。②悬尾测试:用胶带将小鼠悬挂在悬尾仪中垂直金属棒上,使其呈倒悬状态,头部距离底部台面大于6 cm,适应2 min 后观察并记录随后4 min内小鼠累计保持不动状态的时间。③强迫游泳测试:在高30 cm、直径20 cm 的圆柱型透明器皿中注入20 cm 深的清水,温度(24±1)℃。将小鼠置于器皿内,适应2 min 后记录随后4 min 内小鼠累计不动时间。④糖水偏好测试:将小鼠单只放置于鼠笼中,每个鼠笼上放2 个已称定质量的水瓶(分别为1%的糖水和纯净水),小鼠禁食禁水24 h 后进行测定,以小鼠3 h 内糖水偏好率(糖水偏好率=糖水消耗量/总液体消耗量)作为评价指标[14]。⑤新颖抑制性摄食测试:实验前小鼠禁食不禁水24 h,在自制敞箱底部覆盖一层垫料,在敞箱中心区域放置一颗粒状食物并用垂直光源进行照射凸显。小鼠面向箱壁放置在平台的角落,立即开始计时,记录5 min内小鼠开始进食的时间(摄食潜伏期),超过5 min则按5 min 计[15]。
2.3 ELISA 法检测小鼠血清CORT、ACTH 及CRH 水平
行为学测试结束后12 h,所有小鼠麻醉取血,静置30 min,3500 r/min 离心15 min 分离血清,于-80 ℃低温保存备用。按照试剂盒说明书测定血清CORT、ACTH 及CRH 水平。
2.4 甲苯胺蓝染色法检测海马CA3 区尼氏小体
取小鼠大脑组织固定于4%中性多聚甲醛中,包埋后切片(2~3 μm),切片常规脱蜡至水,放入经预热至50 ℃的1%甲苯胺蓝水溶液中,并在56 ℃温箱中染色25 min;蒸馏水洗后使用70%乙醇浸泡1 min;95%乙醇分化,镜下控制分化程度,直至尼氏小体显示清晰;无水乙醇迅速脱水,使用二甲苯透明,并用中性树胶封固。采用数字切片扫描仪对切片进行图像采集,每张切片先于40 倍镜下观察全部组织,观察大体病变,选择检测区域采集3 张400 倍图片,进行计数。
2.5 免疫荧光法检测海马齿状回区Brdu 和DCX表达
小鼠取材前7 d,每组随机取4 只小鼠ip Brdu(50 mg/kg)以标记分裂增殖的细胞,1 次/d,共注射7 次。剖取小鼠大脑组织固定于4%多聚甲醛中,包埋后切片(3 μm),切片常规脱蜡至水,用柠檬酸(pH 6.0)进行抗原修复,PBS(pH 7.4)洗涤后用组化笔画圈,3%牛血清白蛋白封闭30 min 后,加入Brdu 兔抗(1∶200)、DCX 小鼠抗(1∶500)孵育过夜,PBS 洗涤后加荧光二抗[山羊抗兔(1∶300),山羊抗小鼠(1∶400)]避光室温孵育50 min,PBS洗涤后滴加DAPI 避光室温孵育10 min,PBS 洗涤后加入自发荧光淬灭剂孵育5 min 后洗涤。封片后使用全景切片扫描仪观察并采集图像,使用Indica labs(Halo v3.0.011.314)软件定量观测海马齿状回区的总细胞数,Brdu、DCX 阳性细胞数及Brdu/DCX双阳性细胞数。
2.6 Western blotting 检测海马组织相关蛋白表达
称取海马组织约15 mg,加入10 倍体积的RIPA裂解液匀浆,冰上裂解1 h 后,12 000×g离心15 min,取上清液,BCA 法测定总蛋白浓度,加入蛋白上样缓冲液配制成样品。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,封闭后,孵育p-GR 兔抗(1∶1000)、GR 兔抗(1∶1000)、SGK1 兔抗(1∶1000)、p-PI3K 兔抗(1∶1000)、PI3K 兔抗(1∶1000)、p-Akt 兔抗(1∶1000)、Akt兔抗(1∶1000)、p-mTOR 兔抗(1∶1000)、mTOR兔抗(1∶1000)、p-TrkB 兔抗(1∶1000)、TrkB 兔抗(1∶1000)、p-CREB 兔抗(1∶1000)、CREB 兔抗(1∶1000)、BDNF 兔抗(1∶1000)、Synaptophysin兔抗(1∶1000)、PSD95 兔抗(1∶5000)、GAPDH兔抗(1∶2000)、β-actin 兔抗(1∶2000)、β-Tubulin鼠抗(1∶2000),4 ℃孵育过夜。TBST 溶液洗膜,孵育二抗(1∶3000),洗膜后在凝胶成像系统中成像,使用Image Lab 凝胶图像分析软件分析条带灰度值。
2.7 统计学分析
采用SPSS 21.0 统计软件分析数据,正态分布计量资料以±s表示,两组间比较采用t检验,多组的组间比较采用单因素方差分析,组间两两比较用SNK 法。
3 结果
3.1 CDB 醋酸乙酯部位对抑郁模型小鼠行为学的影响
如表1 所示,与对照组比较,模型组小鼠在悬尾试验、强迫游泳试验中的不动时间显著延长(P<0.001),飞溅试验中的梳洗时间显著缩短(P<0.01),且糖水偏好率显著降低(P<0.001),摄食潜伏期显著延长(P<0.001),上述行为学指标的异常,提示模型小鼠呈现出自我护理能力下降、自我激励行为缺失等抑郁样行为,主观能动性下降,食物获得感减弱,以及焦虑相关的抑郁样行为。其中,糖水偏好率显著降低能反映动物出现了快感缺失和大脑奖赏机制缺乏,是抑郁症的核心症状之一,由此可认为反复注射地塞米松可诱导小鼠抑郁样行为,表明模型构建成功。与模型组比较,CDB 醋酸乙酯部位各剂量组能显著增加小鼠梳洗时间和糖水偏好率(P<0.05、0.01),明显缩短小鼠的悬尾/强迫游泳不动时间和摄食潜伏期(P<0.05、0.01),表明CDB 醋酸乙酯部位对模型小鼠各项抑郁样行为指标均有显著改善作用。
表1 CDB 醋酸乙酯部位对抑郁模型小鼠行为学的影响 (±s, n = 10)Table 1 Effect of CDB ethyl acetate fraction on behavior of depression model mice (±s, n = 10)

表1 CDB 醋酸乙酯部位对抑郁模型小鼠行为学的影响 (±s, n = 10)Table 1 Effect of CDB ethyl acetate fraction on behavior of depression model mice (±s, n = 10)
与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下表同#P < 0.05 ##P < 0.01 ###P < 0.001 vs control group; *P < 0.05 **P < 0.01 ***P < 0.001 vs model group, same as below tables
组别 剂量/(g·kg-1) 梳洗时间/s 悬尾不动时间/s 强迫游泳不动时间/s 糖水偏好率/% 摄食潜伏期/s对照 — 148.3±19.9 58.5±15.2 70.9±18.4 82.7±14.1 75.1±21.6模型 — 73.7±14.8## 114.5±16.0### 159.5±22.4### 54.7±12.5### 187.0±34.9###氟西汀 0.013 2 123.3±11.2** 67.4±18.2** 145.0±33.1 82.4±18.2** 106.1±32.5**CDB 水煎液 22.0 100.6±18.9* 66.4±17.8** 92.1±21.4** 75.3±16.3* 89.4±29.1**CDB 醋酸乙酯部位 11.0 101.7±13.5* 91.8±21.9* 105.4±19.2* 77.3±12.7* 99.4±21.6**22.0 110.8±17.3** 72.5±14.1** 86.1±19.8** 81.2±17.5** 128.3±36.1*
3.2 CDB 醋酸乙酯部位对抑郁模型小鼠血清BDNF 水平及海马CA3 区尼氏小体的影响
BDNF 作为体内含量最丰富的神经营养因子,在突触可塑性及神经元存活等生物过程中发挥重要的功能。如表2、图1 和表3 所示,与对照组比较,模型组小鼠血清中BDNF 水平显著降低(P<0.001),海马CA3 区平均A值显著下降(P<0.001),提示尼氏小体破碎、消失,数量减少,并且位置出现变化,神经元胞间排列松散,分层模糊,表明反复注射地塞米松能使小鼠BDNF 水平下降,并引起神经元功能活性与形态受损。与模型组比较,CDB醋酸乙酯部位各剂量组小鼠血清BDNF 水平显著升高(P<0.05、0.01),海马CA3 区平均A值显著增加(P<0.05、0.01),尼氏小体增加,表明CDB 醋酸乙酯部位能通过上调血清BDNF 水平,发挥神经保护活性从而体现出抗抑郁作用,且作用与CDB 水煎液组比较无明显差异。
表2 CDB 醋酸乙酯部位对抑郁模型小鼠血清BDNF 水平的影响 (±s, n = 10)Table 2 Effect of CDB ethyl acetate fraction on BDNF level in serum of depression model mice (±s, n = 10)
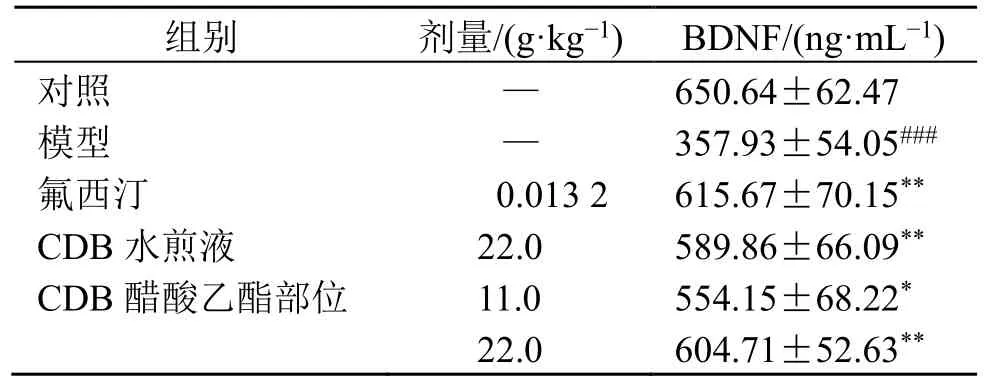
表2 CDB 醋酸乙酯部位对抑郁模型小鼠血清BDNF 水平的影响 (±s, n = 10)Table 2 Effect of CDB ethyl acetate fraction on BDNF level in serum of depression model mice (±s, n = 10)
组别 剂量/(g·kg-1) BDNF/(ng·mL-1)对照 — 650.64±62.47模型 — 357.93±54.05###氟西汀 0.013 2 615.67±70.15**CDB 水煎液 22.0 589.86±66.09**CDB 醋酸乙酯部位 11.0 554.15±68.22*22.0 604.71±52.63**
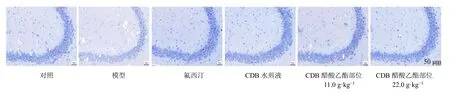
图1 CDB 醋酸乙酯部位对抑郁模型小鼠海马CA3 区尼氏小体的影响 (×250)Fig. 1 Effect of CDB ethyl acetate fraction on hippocampus CA3 Nissl body of depression model mice (× 250)
表3 CDB 醋酸乙酯部位对抑郁模型小鼠海马CA3 区尼氏小体的影响 (±s, n = 4)Table 3 Effect of CDB ethyl acetate fraction on hippocampus CA3 Nissl body of depression model mice(±s, n = 4)
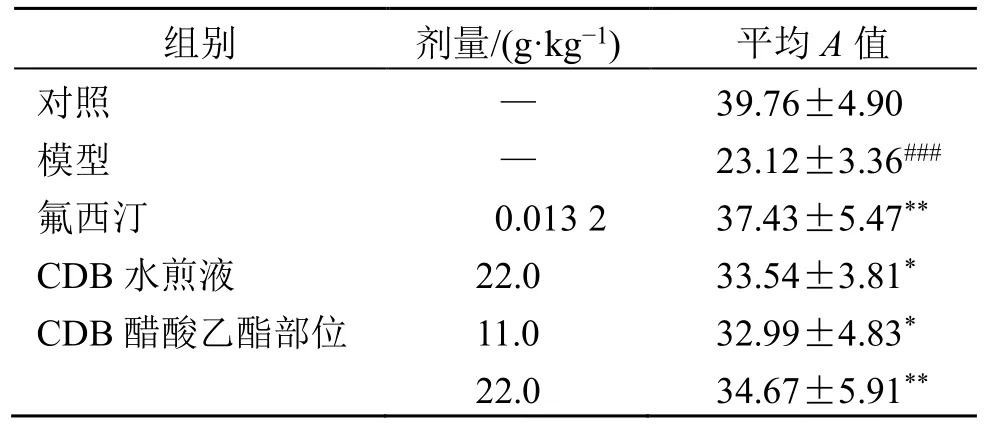
表3 CDB 醋酸乙酯部位对抑郁模型小鼠海马CA3 区尼氏小体的影响 (±s, n = 4)Table 3 Effect of CDB ethyl acetate fraction on hippocampus CA3 Nissl body of depression model mice(±s, n = 4)
组别 剂量/(g·kg-1) 平均A 值对照 — 39.76±4.90模型 — 23.12±3.36###氟西汀 0.013 2 37.43±5.47**CDB 水煎液 22.0 33.54±3.81*CDB 醋酸乙酯部位 11.0 32.99±4.83*22.0 34.67±5.91**
3.3 CDB 醋酸乙酯部位对抑郁模型小鼠血清HPA轴功能指标及海马糖皮质激素受体相关蛋白表达的影响
如表4、图2 和表5 所示,与对照组比较,模型组小鼠血清中CORT、ACTH 及CRH 水平均显著升高(P<0.001),海马部位FKBP51、SGK1 及p-GR/GR 蛋白表达水平均显著上调(P<0.001),提示在慢性地塞米松的刺激下,大量糖皮质激素与GR结合,FKBP51 和SGK1 受到激活,启动了GR 的核转移,致使GR 信号传导主导的负反馈调节受损,进而造成小鼠海马神经细胞的糖皮质激素抵抗,诱导了HPA 轴的过度亢进。与模型组比较,CDB 醋酸乙酯部位能显著降低血清中CORT、ACTH 及CRH 水平(P<0.05、0.01),显著下调p-GR/GR 值及SGK1 的表达,抑制GR 的核转移(P<0.05、0.01),对FKBP51 的表达升高有下调趋势,提示CDB 醋酸乙酯部位能抑制GR 的过度激活,恢复GR 的调节活性,改善GR 的负反馈调节损伤,进而降低HPA 轴的过度活化,发挥其抗抑郁作用。各组HSP90 蛋白表达无显著变化。
表4 CDB 醋酸乙酯部位对抑郁模型小鼠血清中HPA 轴功能指标的影响 (±s, n = 6)Table 4 Effect of CDB ethyl acetate fraction on HPA axis functional indicators in serum of depression model mice (±s, n = 6)

表4 CDB 醋酸乙酯部位对抑郁模型小鼠血清中HPA 轴功能指标的影响 (±s, n = 6)Table 4 Effect of CDB ethyl acetate fraction on HPA axis functional indicators in serum of depression model mice (±s, n = 6)
组别 剂量/(g·kg-1) CORT/(ng·mL-1) ACTH/(pg·mL-1) CRH/(ng·mL-1)对照 — 88.31±14.58 15.54±3.25 15.66±4.08模型 — 151.63±21.77### 22.86±3.17### 25.87±4.67###氟西汀 0.013 2 113.78±29.04** 18.99±4.11* 20.85±3.75**CDB 水煎液 22.0 115.93±26.12** 19.45±3.64* 20.65±4.94*CDB 醋酸乙酯部位 11.0 123.11±22.81* 18.84±4.29* 21.60±4.48*22.0 115.56±28.23** 16.66±3.64** 20.22±3.09**

图2 CDB 醋酸乙酯部位对抑郁模型小鼠海马区糖皮质激素通路相关蛋白表达的影响Fig. 2 Effect of CDB ethyl acetate fraction on glucocorticoid pathway-related protein expressions in hippocampus region of depression model mice
表5 CCDB 醋酸乙酯部位对抑郁模型小鼠海马糖皮质激素通路相关蛋白表达的影响 (±s, n = 4)Table 5 Effect of CDB ethyl acetate fraction on glucocorticoid pathway-related protein expressions in hippocampus region of depression model mice (±s, n = 4)
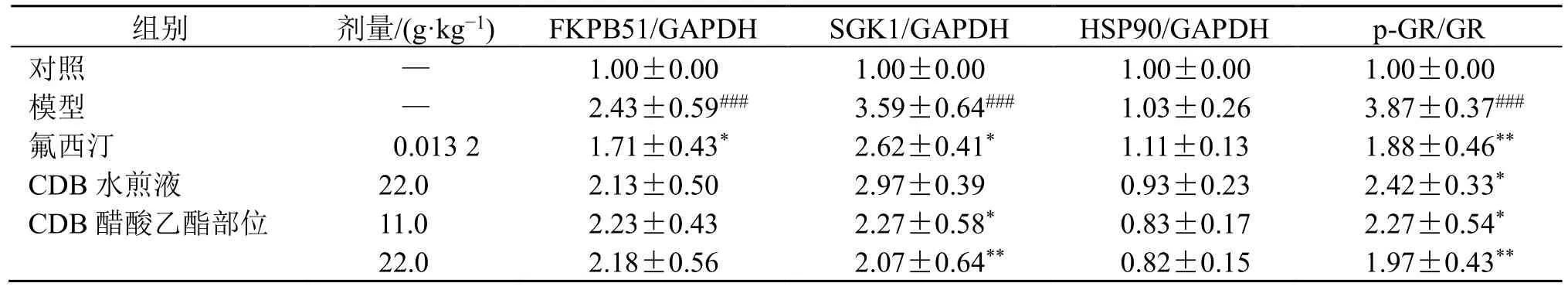
表5 CCDB 醋酸乙酯部位对抑郁模型小鼠海马糖皮质激素通路相关蛋白表达的影响 (±s, n = 4)Table 5 Effect of CDB ethyl acetate fraction on glucocorticoid pathway-related protein expressions in hippocampus region of depression model mice (±s, n = 4)
组别 剂量/(g·kg-1) FKPB51/GAPDH SGK1/GAPDH HSP90/GAPDH p-GR/GR对照 — 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00模型 — 2.43±0.59### 3.59±0.64### 1.03±0.26 3.87±0.37###氟西汀 0.013 2 1.71±0.43* 2.62±0.41* 1.11±0.13 1.88±0.46**CDB 水煎液 22.0 2.13±0.50 2.97±0.39 0.93±0.23 2.42±0.33*CDB 醋酸乙酯部位 11.0 2.23±0.43 2.27±0.58* 0.83±0.17 2.27±0.54*22.0 2.18±0.56 2.07±0.64** 0.82±0.15 1.97±0.43**
3.4 CDB 醋酸乙酯部位对抑郁模型小鼠海马区神经发生及突触相关蛋白表达的影响
神经发生是产生新神经元的过程,在哺乳动物的海马体中持续存在。如图3 和表6 所示,与对照组比较,模型组小鼠海马齿状回区Brdu 及DCX 阳性表达均显著减少(P<0.001),提示反复注射地塞米松会导致小鼠海马齿状回区神经干细胞增殖成新生神经元减少,且抑制新生神经元分化、迁移及成为成熟神经元;与模型组比较,CDB 醋酸乙酯部位显著促进Brdu 阳性表达(P<0.05),高剂量组显著促进DCX 阳性表达(P<0.05)。
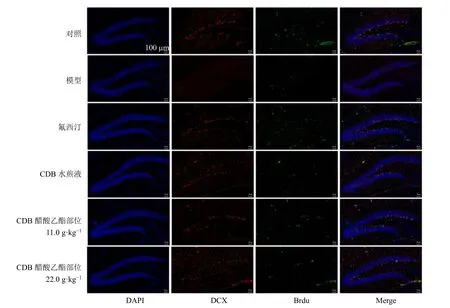
图3 CDB 醋酸乙酯部位对抑郁模型小鼠海马齿状回区神经元Brdu 和DCX 阳性表达的影响 (×400)Fig. 3 Effect of CDB ethyl acetate fraction on Brdu and DCX positive expressions in hippocampus dentate gyrus region of depression model mice (× 400)
表6 CDB 醋酸乙酯部位对抑郁模型小鼠海马齿状回区Brdu 和DCX 阳性表达的影响 (±s, n = 3)Table 6 Effect of CDB ethyl acetate fraction on Brdu and DCX positive expressions in hippocampus dentate gyrus region of depression model mice (±s, n = 3)
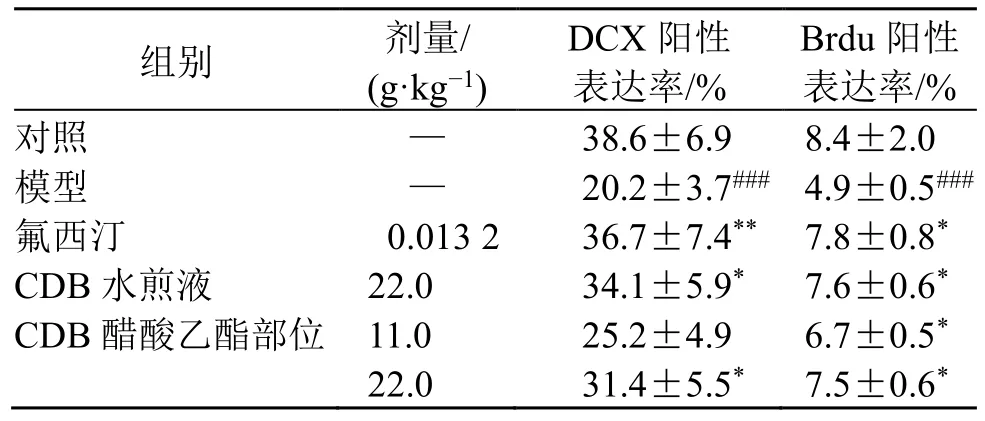
表6 CDB 醋酸乙酯部位对抑郁模型小鼠海马齿状回区Brdu 和DCX 阳性表达的影响 (±s, n = 3)Table 6 Effect of CDB ethyl acetate fraction on Brdu and DCX positive expressions in hippocampus dentate gyrus region of depression model mice (±s, n = 3)
组别 剂量/(g·kg-1)DCX 阳性表达率/%Brdu 阳性表达率/%对照 — 38.6±6.9 8.4±2.0模型 — 20.2±3.7### 4.9±0.5###氟西汀 0.013 2 36.7±7.4** 7.8±0.8*CDB 水煎液 22.0 34.1±5.9* 7.6±0.6*CDB 醋酸乙酯部位 11.0 25.2±4.9 6.7±0.5*22.0 31.4±5.5* 7.5±0.6*
PSD95 和Synaptophysin 作为神经突触形成的主要效应分子,在新生神经元的突触生长和信息传递中具有重要作用,能有效反映神经元中神经发生的情况。如图4 和表7 所示,与对照组比较,模型组小鼠海马区PSD95 及Synaptophysin 蛋白表达均显著减少(P<0.001);与模型组比较,CDB 醋酸乙酯部位能够显著上调小鼠海马区 PSD95、Synaptophysin 蛋白表达(P<0.05、0.01),提示慢性地塞米松应激可抑制小鼠海马齿状回区神经元增殖、分化,减弱神经发生,CDB 醋酸乙酯部位则能通过增加突触相关蛋白的表达,从而促进突触生长,增强神经可塑性,使神经发生功能恢复正常,进而发挥抗抑郁作用。
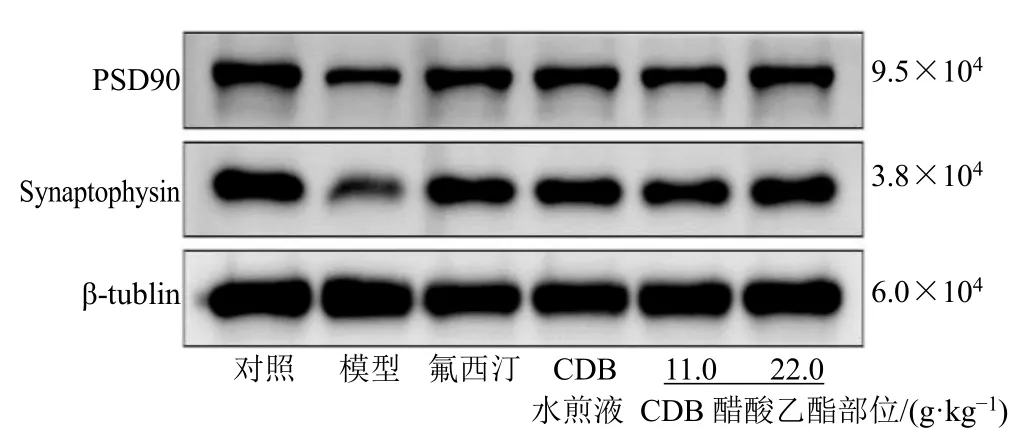
图4 CDB 醋酸乙酯部位对抑郁模型小鼠海马区PSD95 和Synaptophysin 蛋白表达的影响Fig. 4 Effect of CDB ethyl acetate fraction on PSD95 and Synaptophysin protein expressions in hippocampus region of depression model mice
表7 CDB 醋酸乙酯部位对抑郁模型小鼠海马区PSD95 和Synaptophysin 蛋白表达的影响 (±s, n = 4)Table 7 Effect of CDB ethyl acetate fraction on PSD95 and Synaptophysin protein expressions in hippocampus region of depression model mice (±s, n = 4)
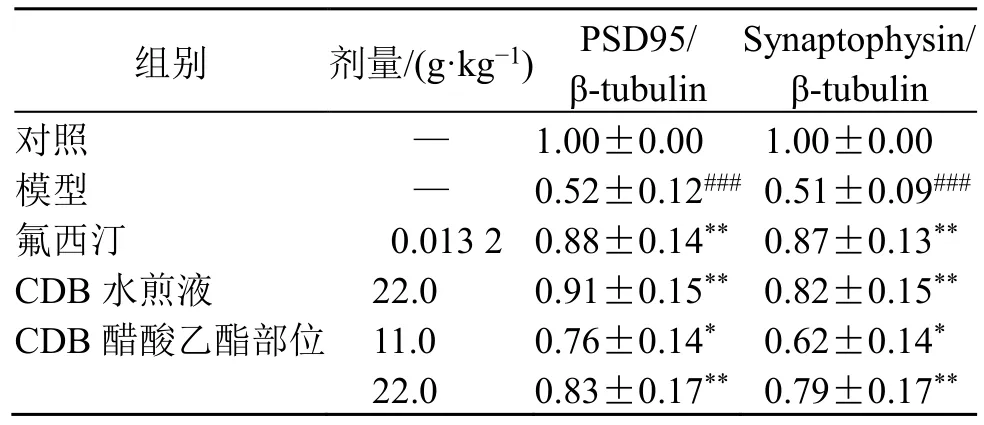
表7 CDB 醋酸乙酯部位对抑郁模型小鼠海马区PSD95 和Synaptophysin 蛋白表达的影响 (±s, n = 4)Table 7 Effect of CDB ethyl acetate fraction on PSD95 and Synaptophysin protein expressions in hippocampus region of depression model mice (±s, n = 4)
组别 剂量/(g·kg-1) PSD95/β-tubulin Synaptophysin/β-tubulin对照 — 1.00±0.00 1.00±0.00模型 — 0.52±0.12### 0.51±0.09###氟西汀 0.013 2 0.88±0.14** 0.87±0.13**CDB 水煎液 22.0 0.91±0.15** 0.82±0.15**CDB 醋酸乙酯部位 11.0 0.76±0.14* 0.62±0.14*22.0 0.83±0.17** 0.79±0.17**
3.5 CDB 醋酸乙酯部位对抑郁模型小鼠海马PI3K/Akt/mTOR 及TrkB/CREB/BDNF 信号通路相关蛋白表达的影响
PI3K/Akt/mTOR 信号通路作为突触相关蛋白的主要上游信号,在抑郁症的发生发展中发挥重要作用,此外TrkB/CREB/BDNF 信号通路亦是抑郁症中影响突触可塑性及海马神经发生的经典信号通路。如图5、表8、图6、表9 所示,与对照组比较,模型组小鼠海马区p-PI3K/PI3K、p-Akt/Akt、pmTOR/mTOR、TrkB/TrkB 和p-CREB/CREB 值和BDNF 蛋白表达水平均显著降低(P<0.001),提示在慢性地塞米松的刺激下可抑制海马区PI3K/Akt/mTOR 通路和TrkB/CREB/BDNF 通路,从而直接影响其下游突触蛋白 PSD95 、Synaptophysin 及BDNF 的表达,进而影响海马神经发生。与模型组比较,CDB 醋酸乙酯部位能够显著增加p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR、p-TrkB/TrkB 和p-CREB/CREB 值以及BDNF 蛋白表达(P<0.05、0.01),呈现出对抗模型小鼠PI3K/Akt/mTOR 和TrkB/CREB/BDNF 通路抑制的作用,从而增加突触相关蛋白的表达,促进突触生长,增强神经可塑性,发挥其抗抑郁作用。
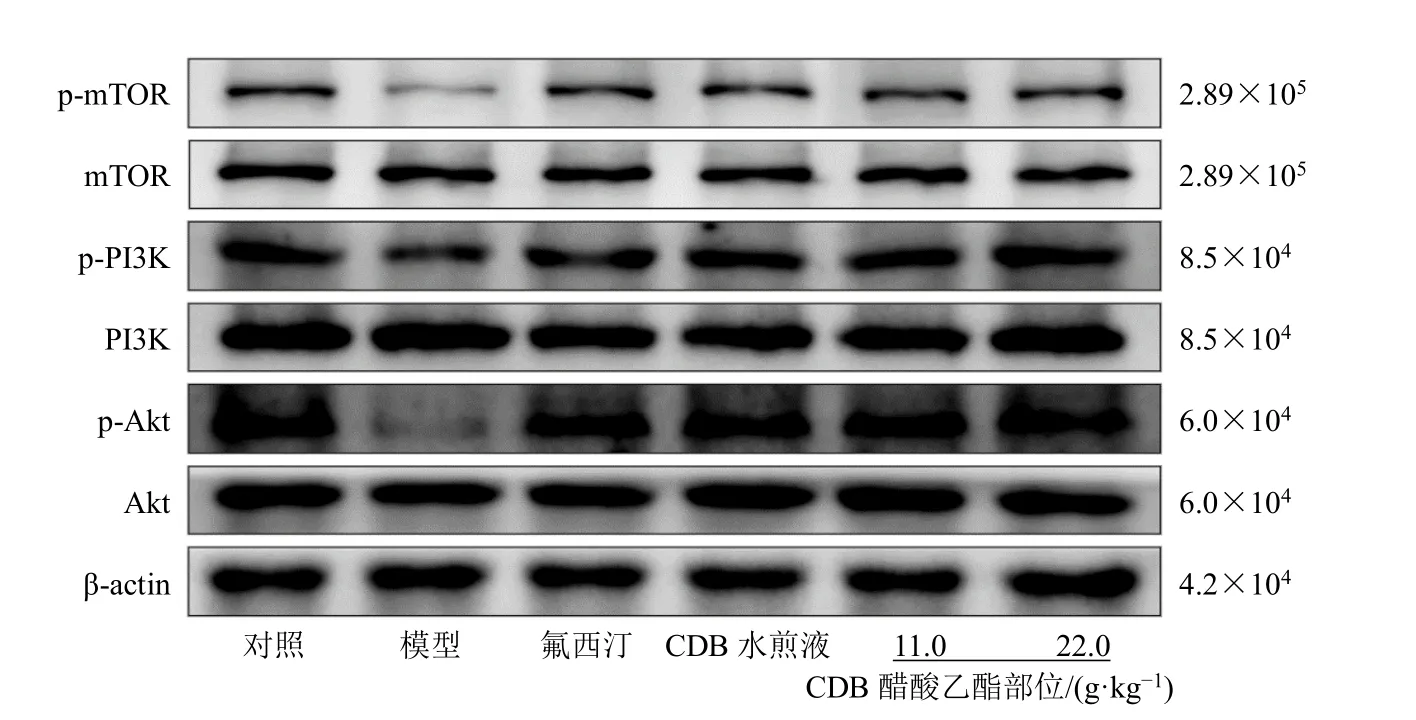
图5 CDB 醋酸乙酯部位对抑郁模型小鼠海马区PI3K/Akt/mTOR 信号通路蛋白表达的影响Fig. 5 Effect of CDB ethyl acetate fraction on PI3K/Akt/mTOR signaling pathway protein expressions in hippocampus region of depression model mice
表8 CDB 醋酸乙酯部位对抑郁模型小鼠海马PI3K/Akt/mTOR 信号通路蛋白表达的影响 (±s, n = 4)Table 8 Effect of CDB ethyl acetate fraction on PI3K/Akt/mTOR signaling pathway protein expressions in hippocampus region of depression model mice (±s, n = 4)

表8 CDB 醋酸乙酯部位对抑郁模型小鼠海马PI3K/Akt/mTOR 信号通路蛋白表达的影响 (±s, n = 4)Table 8 Effect of CDB ethyl acetate fraction on PI3K/Akt/mTOR signaling pathway protein expressions in hippocampus region of depression model mice (±s, n = 4)
组别 剂量/(g·kg-1) p-PI3K/PI3K p-Akt/Akt p-mTOR/mTOR对照 — 1.00±0.00 1.00±0.00 1.00±0.00模型 — 0.51±0.11### 0.45±0.12### 0.49±0.07###氟西汀 0.013 2 0.92±0.14** 0.95±0.11** 0.87±0.15**CDB 水煎液 22.0 0.97±0.12** 1.01±0.19** 0.82±0.12**CDB 醋酸乙酯部位 11.0 0.86±0.15* 0.91±0.16** 0.79±0.12*22.0 0.96±0.14** 0.89±0.18** 0.86±0.14**
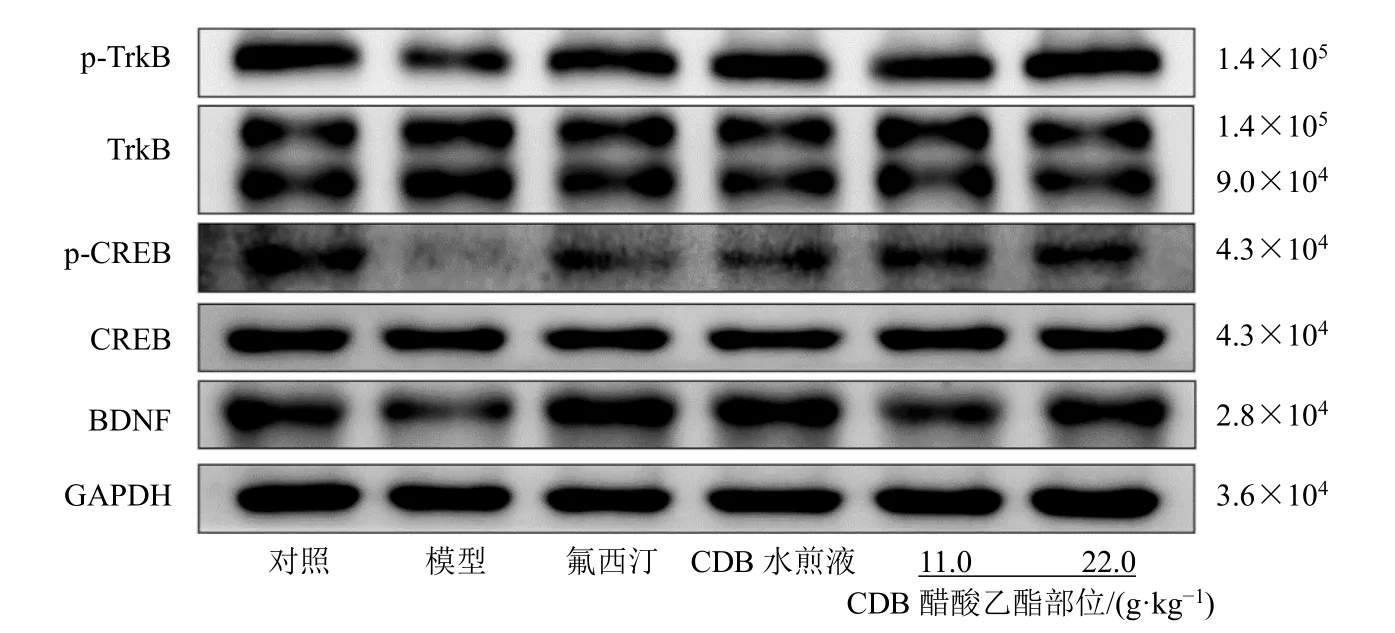
图6 CDB 醋酸乙酯部位对抑郁模型小鼠海马区TrkB/CREB/BDNF 信号通路蛋白表达的影响Fig. 6 Effect of CDB ethyl acetate fraction on TrkB/CREB/BDNF signaling pathway protein expressions in hippocampus region of depression model mice
表9 CDB 醋酸乙酯部位对抑郁模型小鼠海马TrkB/CREB/BDNF 信号通路蛋白表达的影响 (±s, n = 4)Table 9 Effect of CDB ethyl acetate fraction on TrkB/CREB/BDNF signaling pathway protein expressions in hippocampus region of depression model mice (±s, n = 4)

表9 CDB 醋酸乙酯部位对抑郁模型小鼠海马TrkB/CREB/BDNF 信号通路蛋白表达的影响 (±s, n = 4)Table 9 Effect of CDB ethyl acetate fraction on TrkB/CREB/BDNF signaling pathway protein expressions in hippocampus region of depression model mice (±s, n = 4)
组别 剂量/(g·kg-1) p-TrkB/TrkB p-CREB/CREB BDNF/GAPDH对照 — 1.00±0.00 1.00±0.00 1.00±0.00模型 — 0.54±0.12### 0.43±0.15### 0.57±0.10###氟西汀 0.013 2 0.98±0.16** 0.98±0.15** 1.02±0.17**CDB 水煎液 22.0 0.94±0.17** 0.95±0.17** 1.01±0.19**CDB 醋酸乙酯部位 11.0 0.88±0.16* 0.93±0.16** 0.84±0.13*22.0 0.99±0.13** 1.03±0.14** 0.77±0.14**
3.6 CDB 醋酸乙酯部位抗抑郁作用的HPA 轴-神经可塑性关联调控机制相关性分析
鉴于CDB 醋酸乙酯部位对HPA 轴/GR 以及神经可塑性相关指标均具有调节作用,因此对反映上述2 方面功能的代表性指标进行了Pearson 相关性分析,并基于相关性系数构建了HPA 轴-神经可塑性关联调控机制相关性矩阵。如图7 所示,HPA 轴/GR 以及神经可塑性相关指标间均呈负相关,相关性系数均介于0~-1。其中,p-GR/GR 值体现了GR的核转移水平,与血清BDNF、Brdu 阳性数、海马BDNF 及Synaptophysin 表达呈显著的负相关,相关性系数均小于-0.73。此外,CORT 与各项神经可塑性指标均有较强的负相关,相关性系数均小于-0.68,表明高水平CORT 在减弱海马神经可塑性方面发挥显著影响作用,其中CORT 对Brdu 和Synaptophysin 的负相关性最强,提示CORT 在影响海马神经元分裂增殖及突触前膜的信号释放方面作用显著。血清BDNF 和海马Brdu 阳性数与HPA 轴功能指标及p-GR/GR 均具有较强的关联性,也表明在反复注射地塞米松诱导的抑郁模型血清中BDNF水平和神经元新生表现受到抑制,血清BDNF 可作为判断模型成功与否的重要指标。SGK1 与FKBP51在此模型中与神经可塑性关联较小,仅有FKBP51与PSD95 呈现较强的负相关关系。
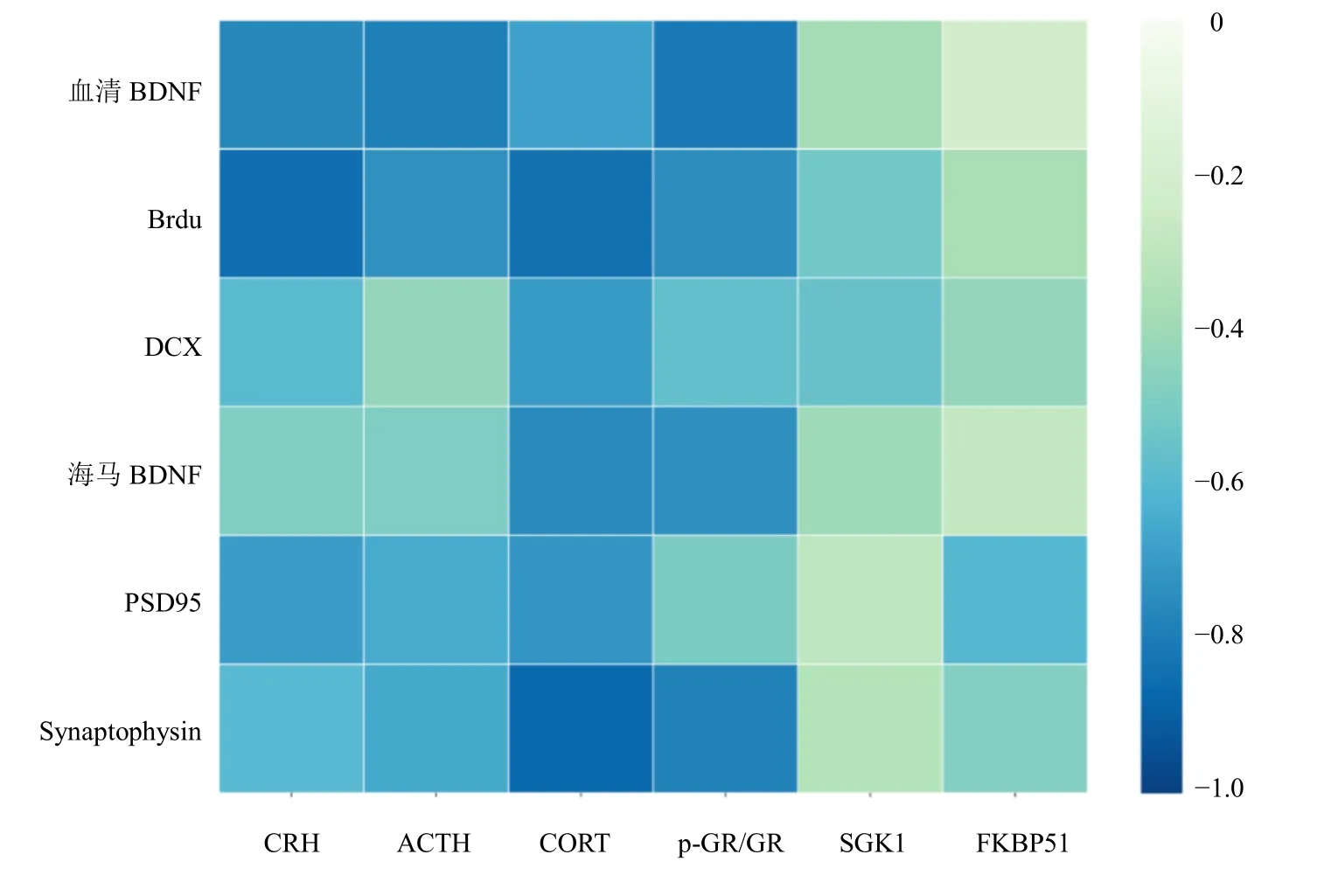
图7 CDB 醋酸乙酯部位的HPA 轴-神经可塑性关联调控机制相关性矩阵热图Fig. 7 Correlation matrix heat map of CDB ethyl acetate fraction exert HPA axis-neuroplasticity associated regulatory mechanisms
4 讨论
逍遥散的抗抑郁作用已得到各项实验研究证实,且在临床应用中也具有显著疗效[16-17]。CDB 作为逍遥散的精简方剂,已有研究表明其在22.0 g/kg(生药量)剂量下能通过调节5-HT1A/5-HT2A受体平衡、激活BDNF/TrkB/CREB 通路及抑制HPA 轴功能亢进等不同路径,显著抑制CUMS 模型小鼠抑郁样行为,表现出与逍遥散全方相当的抗抑郁作用[6-7]。本研究以通过石油醚和醋酸乙酯极性梯度萃取获得的CDB 醋酸乙酯部位为研究对象开展抗抑郁作用研究,旨在进一步挖掘CDB 的抗抑郁物质基础及其深入的作用机制。
慢性CORT 刺激能模拟抑郁症患者体内HPA轴功能持续亢进的病理特征[18],能诱导动物产生抑郁样行为,是目前抗抑郁药的评价及机制研究中常用的动物模型之一[19]。其中人工合成的皮质类固醇地塞米松已被广泛用于抑郁症动物模型的研究中[20-22]。本研究ip 地塞米松(10 mg/kg)21 d 能成功诱导模型小鼠出现糖水偏好降低、悬尾和强迫游泳试验的不动时间延长、飞溅测试中梳洗时间减少及新颖抑制性摄食测试中摄食潜伏期增加等一系列抑郁样行为。此外,亦发现模型小鼠血清BDNF水平显著下降,海马CA3 区神经元尼氏小体溶解、消失,表明慢性地塞米松刺激可使BDNF 功能下调,导致锥体神经元密度降低、树突棘减少、突触可塑性受损。与氟西汀的作用相似,CDB 醋酸乙酯部位则表现出上调模型小鼠血清BDNF 水平,改善海马CA3 区神经元的结构和功能,从而缓解慢性地塞米松刺激引起的抑郁样行为,CDB 水煎剂(22.0 g/kg)表现出同样的抗抑郁作用。
GR 是CORT 的主要细胞质受体,在大脑分布广泛,是完成HPA 轴反馈调节的最关键分子。糖皮质激素与GR 结合后,FKBP51 从HSP90-异源复合体解离,促进GR 核转移。核转移后,GR 同型二聚体与糖皮质激素反应元件结合,以诱导或抑制各种基因的转录表达[23]。正常情况下,GR 入核后会上调FKBP51 的表达,FKBP51 增加后能与HSP90 协同以抑制GR 的活性,基于此负反馈循环保持了外环境中糖皮质激素的相对平衡。若中枢CORT 持续处于高水平的情况下,GR 主导的负反馈调节则失衡,会改变中枢GR 水平和/或功能,致使受体抵抗[24],引发或加剧HPA 轴的过度活化。此外,SGK1作为GR 转移的“下游”机制,也参与调节GR 功能。研究表明,GR 介导的SGK1 表达增加能进一步增强丝氨酸残基S211 处的GR 磷酸化,从而促进和维持了GR 核易位[25-26]。本研究中,模型小鼠海马部位的p-GR/GR 值、FKBP51、SGK1 蛋白表达显著上调,提示在慢性地塞米松的刺激下,启动了GR 的核转移,导致海马糖皮质激素信号传导的负反馈调节紊乱,进而造成HPA 轴功能的过度亢进,致使血清CORT、ACTH 以及CRH 水平异常升高。CDB 醋酸乙酯部位则表现出显著降低模型小鼠海马p-GR/GR 值、SGK1 表达水平的作用,对FKBP51激活有下调趋势,并降低模型小鼠血清CORT、ACTH 和CRH 含量。HSP90 蛋白表达变化不明显,推测与其作为一种多功能分子伴侣,普遍表达于各种细胞中,影响因素较多有关。
海马体作为大脑边缘系统的一部分,是中枢神经系统管理情绪和记忆的重要脑区,含有高水平的GR 和各种神经递质,是HPA 轴的高位调节中枢,因此更容易受到压力和应激的影响[27]。大量证据表明,抑郁症患者和动物模型的海马存在病理性结构与功能异常[28-29]。海马区主要由椎体细胞和神经干细胞构成,负责情绪相关的信息处理、短期记忆的形成[30]以及生命周期中神经元的分裂、增殖与迁移,是新生神经元的主要区域[31]。研究表明,HPA轴激活状态下,神经干/祖细胞增殖和/或分化存在缺陷[10];海马区新生神经元标志物表达减少,神经可塑性被抑制[11]。长时程增强(long-term potentiation,LTP)是神经元胞间交流和相互刺激生长分化的微观现象,也是与突触可塑性/突触传递相关的重要生理过程[32],在抑郁症的神经可塑性假说中具有重要地位。Synaptophysin 和PSD95 分别位于突触前膜和突触后膜,主要影响突触连接和神经元网络,进一步维持和增加LTP 过程[33]。本研究中,模型小鼠海马齿状回区Brdu 和DCX 阳性表达减少,海马Synaptophysin 和PSD95 表达下降,与文献报道结果吻合,证实了慢性地塞米松刺激可导致海马神经元和神经干细胞增殖分化能力下降[34-35]。CDB 醋酸乙酯部位能提高模型小鼠海马Synaptophysin、PSD95 蛋白表达量,一定程度上提示药物能增强神经可塑性,从而对抗小鼠的抑郁样行为,表明药物能通过神经保护作用来发挥抗抑郁作用。
TrkB/CREB/BDNF 通路是介导突触结构和功能变化的经典机制之一[36],BDNF 的转录依赖于CREB 的激活,该蛋白在LTP 和突触可塑性中发挥关键作用[37]。研究表明,在多种慢性应激刺激下TrkB/CREB/BDNF 通路的功能均出现不同程度的下调[38-39],提示神经可塑性受到影响。BDNF与TrkB特异性结合后会激活下游多条细胞信号通路,参与神经元生长、分化及再生等神经可塑性调节活动[40]。其中PI3K/Akt 是信号传递中最活跃的激酶之一,Akt 的磷酸化能在很大程度上反映BDNF/TrkB 信号活性[41]。PI3K/Akt 是细胞内重要的丝氨酸/苏氨酸激酶信号通路之一,在介导多种生长因子促存活和促增殖方面至关重要[42]。研究表明,发育过程中PI3K活性与干细胞、神经祖细胞的功能有关[43];Akt基因缺陷的小鼠大脑体积与重量减小,表明Akt 在中枢神经系统神经发生中有关键作用[44]。mTOR 作为一种保守的丝氨酸/苏氨酸激酶,是PI3K/Akt 下游的重要效应蛋白,整合参与蛋白质合成和突触可塑性的多种细胞外信号[45]。mTOR 的激活能加速神经前体细胞的细胞周期间期,从而增加神经细胞的增殖和分化,且能增加LTP 相关蛋白的表达,在神经可塑性方面有积极作用[42,46]。本研究中,模型小鼠海马部位 PI3K/Akt/mTOR 通路与 TrkB/CREB/BDNF 通路均呈现抑制表现,CDB 醋酸乙酯部位则对此具有对抗作用,能上调通路蛋白表达量,提示可增加突触可塑性,促进神经发生,从而发挥抗抑郁作用。
研究表明,糖皮质激素能影响GR 与TrkB 在细胞内的直接相互作用[47],对BDNF 下游信号传导激活和维持产生负面影响,而PI3K 激活对于BDNF依赖的突触成熟至关重要[36];此外,慢性压力造成的细胞外糖皮质激素水平升高能导致星形胶质细胞中GRs 的减少,并通过PI3K/Akt 信号通路来介导三磷酸腺苷(adenosine triphosphate,ATP)的释放[48];神经祖细胞中的Akt 信号传导被抑制时,成纤维生长因子-2(fibroblast growth factor-2,FGF-2)刺激的细胞中CREB 的激活会受到限制,暗示CREB 可作为PI3K/Akt 下游效应因子[49]。上述研究表明糖皮质激素、GR 和BDNF 之间存在着功能的串扰,本研究基于模型小鼠反映HPA 轴、神经可塑性功能代表性指标的相关性分析所获得的矩阵热图,一定程度上解释了HPA 轴-神经可塑性关联调控机制,CORT 与海马神经可塑性相关指标之间,及p-GR/GR 值与血清/海马BDNF 水平之间呈现显著负向调节关系。
综上,CDB 醋酸乙酯部位能改善慢性注射DEX诱导的抑郁模型小鼠的抑郁样行为,促进海马CA3区尼氏小体合成,抑制海马GR 的过度磷酸化和GR相关蛋白的过度激活从而减轻模型小鼠HPA 轴的过度激活,并增加海马齿状回区增殖、迁移的阳性细胞比例,表现出对神经可塑性的积极作用,作用发挥可能与上调TrkB/CREB/BDNF 通路和PI3K/Akt/mTOR 通路,促进下游突触相关蛋白表达有关,呈现出抑制HPA 轴的亢进和促进神经可塑性的作用路径(图8),为逍遥散拆方药队的研发提供了药理学依据。
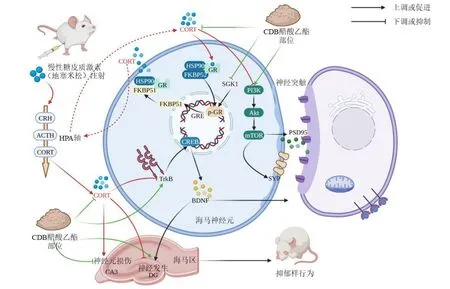
图8 CDB 醋酸乙酯部位对抑郁模型小鼠HPA 轴-神经可塑性关联调控机制Fig. 8 Mechanism of regulation of HPA axis-neuroplasticity association in depression model mice by CDB ethyl acetate fraction
后续研究中可对CDB 醋酸乙酯部位进行成分的进一步富集,利用电镜和膜片钳技术,观察药物是否能直接影响海马的结构可塑性和功能可塑性,进一步证明其对神经可塑性的调控作用,并在体内或体外水平上采用靶标抑制或质粒载体构建沉默技术,深入研究其影响HPA 轴-神经可塑性关联调控的机制及药物相关作用靶点。
利益冲突所有作者均声明不存在利益冲突
