姜黄素治疗溃疡性结肠炎及其微纳米粒传递系统研究进展
2023-06-08廖正根
杨 慧,童 雨,廖正根
江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004
炎症性肠病(inflammatory bowel disease,IBD)已成为世界上第3 大常见疾病[1],溃疡性结肠炎(ulcerative colitis,UC)是IBD 主要形式之一,也是诱发结肠癌的主要因素之一。UC 可使结肠肠道菌群紊乱和肠道屏障功能严重破坏,虽然已有研究对其病理生理机制进行阐述,但确切的发病原因尚不清楚,且无完全治愈的方法[2]。氨基水杨酸盐、皮质类固醇、免疫抑制剂和抗生素等药物已被广泛用于治疗UC,然而,长期摄入这些药物会对患者产生严重的不良反应[3-4],如急性胰腺炎、肠道菌群失衡和骨质疏松症等[5-6]。因此,迫切需要开发有较高疗效且不良反应较小的靶向治疗药物和方法。
姜黄素(curcumin)是一种提取于姜科植物姜黄CurcumalongaL.干燥根茎的多酚类脂溶性化合物,其化学结构如图1 所示。大量研究证明,姜黄素具有抗炎、抗肿瘤、抗纤维化、抗氧化应激等多种生物活性,然而在临床应用中,姜黄素的抗炎作用并不理想,由于其疏水性强,肠道代谢率高,胃肠道不稳定及从体内快速排泄,导致其在UC 治疗中的应用受到严重限制,尚未作为治疗药物上市[7]。
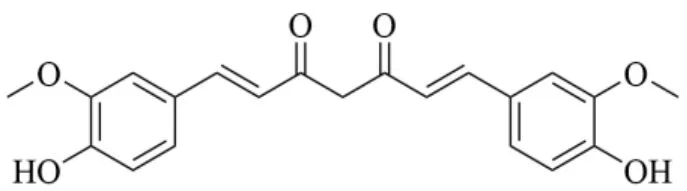
图1 姜黄素的化学结构式Fig. 1 Chemical structural formula of curcumin
近年来,姜黄素及其制剂关于治疗UC 的研究蓬勃发展,大量研究表明,其对UC 治疗具有一定的优势,有望将其开发为抗UC 制剂药物。本文通过对姜黄素治疗UC 的机制、姜黄素微纳米递药系统抗UC 制剂研究进行综述,为姜黄素制剂抗UC研究提供理论依据。
1 姜黄素治疗UC 的机制
1.1 对信号通路的影响
IBD 的治疗重点是控制炎症,从而改善症状,目前抗炎或免疫抑制药物的临床效果并不理想,姜黄素被认为是治疗IBD 的潜在药物之一。UC 特点之一是肠道屏障的破坏,肠屏障的破坏通常归因于核因子-κB(nuclear factor-κB,NF-κB)、激活蛋白-1(activater protein-1,AP-1)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径激活肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和γ-干扰素等促炎因子的过度表达[8]。姜黄素通过抑制NF-κB活化、细胞核形成,起到治疗肠道炎症性疾病的作用[9]。此外,姜黄素可抑制Toll 样受体(Toll-like receptors-4,TLR4),并增强转化生长因子-β(transforming growth factor-β,TGF-β)的生成,尤其是在肠屏障破坏的炎症区域[10-11]。环氧化酶-2(cyclooxygenase-2,COX-2)是一种由NF-κB 和AP-1 信号诱导的炎症酶,在肠道炎症性疾病中其表达上调[12-13]。Kang 等[14]研究表明姜黄素可通过减少AP-1和NF-κB信号传导消除COX-2基因的表达。此外,姜黄素还可通过下调磷酸肌醇 3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)诱导的趋化作用[15]、JNK途径[16]及抑制JAK 途径[17]实现抗UC 作用。
1.2 对炎症因子的影响
UC 具有复发性,如果治疗不充分,可导致肠道的持续损伤,增加患结直肠癌的风险。在UC 中,上皮组织的损伤导致黏膜对腔内病原体的通透性增加,肠道免疫系统的潜在刺激增加,进而导致TNF-α、IL-12 和IL-13 等促炎因子的产生[18]。这些促炎因子通过Janus 激酶(Janus kinase,JAK)转导信息,进一步增强淋巴细胞的活化和增殖[19-20]。在AP-1信号传导中,姜黄素可以直接或间接抑制MAPK,从而限制炎症靶基因的转录[21-22]。姜黄素通过信号通路及炎症因子介导抗炎作用见表1。

表1 姜黄素抗UC 信号通路及炎症因子机制Table 1 Curcumin anti-UC signaling pathway and inflammatory factor mechanism
1.3 对免疫细胞的影响
UC 的发病机制往往与结肠上皮细胞和肠道免疫细胞密切相关。在UC 的发病过程中,T 细胞被炎症因子激活,成熟树突状细胞的活化和敏感性也增加,发生炎症级联反应,表明这些细胞在产生炎症中具有重要作用[22]。
1.3.1 树突状细胞 树突状细胞可表达大量的TLR,通过病原体的识别模式激活多种转录因子,从而引发炎症级联反应[23]。姜黄素通过抑制吲哚胺2,3-双加氧酶,进而抑制树突状细胞分化与成熟,其抗炎作用类似于皮质类固醇[24]。
1.3.2 T 细胞 姜黄素已被证明可抑制T 细胞介导的免疫功能,在治疗慢性肠道炎症疾病中发挥重要作用[25],Chamani 等[26]研究表明姜黄素可降低淋巴细胞的增殖反应,其机制可能是由于姜黄素的抗氧化特性,抑制与活性氧相关的淋巴细胞增殖,及抑制在细胞的合成与分化的周期中至关重要的核糖核苷酸还原酶和DNA 聚合酶的激活。
1.3.3 巨噬细胞 研究表明,姜黄素治疗可增强巨噬细胞的吞噬活性[27]。姜黄素可以通过抑制巨噬细胞产生IL-12 来阻断Th1 细胞亚类的产生,同时也可以增强Th2 细胞亚类的增殖[28]。Zhang 等[27]在三硝基苯磺酸诱导的结肠炎大鼠模型中,姜黄素30 mg/kg 可增强Th2 细胞的合成并抑制Th1 细胞的增殖,从而减少炎症反应。
1.4 抗氧化应激反应
过度氧化应激在肠道炎症性疾病中起着致病作用[29],主要破坏结肠部位细胞组织的紧密连接[30]。肠道炎症性疾病的特征是中性粒细胞募集和激活到达损伤部位,这一过程为黏膜和上皮细胞的损伤提供了活性氧的主要来源[31]。Larmonier 等[32-33]通过炎症小鼠模型和细胞实验研究表明姜黄素通过下调NF-κB 和PI3K/Akt 的作用及减少超氧化物释放,防止中性粒细胞募集。 髓过氧化物酶(myeloperoxidase,MPO)是单核细胞和中性粒细胞的一种成分,可产生高水平的活性氧。MPO 在临床上常被用作中性粒细胞浸润到肠黏膜的标志物[34]。Jiang 等[13]在三硝基苯磺酸诱导的大鼠结肠炎模型中,发现姜黄素可降低与肠道炎症相关的MPO 活性,从而限制氧化组织损伤。生理水平的一氧化氮可保护肠黏膜[35],但在肠道炎症疾病进展过程中,通过一氧化氮合酶(inducible nitric oxide synthase,iNOS)释放的大量一氧化氮可导致组织损伤和坏死[36]。Mouzaoui 等[37]证明了姜黄素能够减少中性粒细胞肠道浸润,从而降低MPO 活性,并通过抑制一氧化氮合酶和减少炎症细胞浸润将一氧化氮水平恢复到基线水平。此外,在大鼠甲氨蝶呤结肠炎模型中,姜黄素可通过降低肠道MPO 活性、清除自由基、增加超氧化物歧化酶(superoxide dismutase,SOD)的水平[38],达到治疗UC 的作用。
1.5 对肠道微生物菌群的影响
人类肠道微生物群构成了体内最大的微生物集合,含有超过35 000 种细菌[39-40]。Frank 等[41]通过16S rRNA 测序发现UC 患者肠道微生物组成与健康人群截然不同。肠道微生物菌群是免疫系统和肠道稳态发育不可或缺的一部分,在防御和耐受机制间存在协同关系[42]。微生物群组成与宿主健康的各个方面存在关联,包括生理发育、新陈代谢和免疫反应,为促进自身的健康,机体需要在致病菌群和共生菌群间取得平衡。然而,UC 患者肠道微生物群发生紊乱,具体表现为:细菌多样性减少,厚壁菌门的比例降低,促炎肠杆菌科的比例升高[43]。厚壁菌是肠道微生物群中主要菌种之一,是具有抗炎特性的短链脂肪酸代谢物的生产者,而短链脂肪酸是结肠细胞的唯一能量来源,表明肠道微生物群在脂质代谢中具有重要作用。De Filippo 等[44]研究表明姜黄素可以调节产生短链脂肪酸的细菌数量,这些细菌可以提供肠黏膜保护并抑制肠道炎症。此外姜黄素通过减少细菌移位和炎症加强肠道屏障,进而对肠道上皮细胞和免疫系统发挥作用[45]。Ungaro等[46]研究表明肠道微生物群可通过TLR 信号通路在UC 的发展中发挥作用,而姜黄素已被证明可抑制TLR 的激活。
UC 的发病机制如图2 所示。

图2 UC 的发病机制Fig. 2 Pathogenesis of UC
2 姜黄素抗UC 微纳米递药系统
姜黄素具有显著的抗炎作用,在治疗UC 方面具有广阔的应用前景,并且美国食品药物管理局将姜黄素视为“公认安全”的化合物[47]。但姜黄素是一种强疏水性化合物,溶解度约为11 ng/mL[48],限制了其在结肠组织的吸收与分布。Chen 等[49]研究表明姜黄素12 g/d 被认为是其最大的安全剂量,由于肝脏的首过效应导致一些姜黄素在肠黏膜和肝脏中代谢,使其在结肠病变部位的吸收减少[50-51]。溶解度低、快速代谢及缺乏靶向传递是姜黄素在结肠病变部位药效作用低的主要原因,基于此,通过结肠靶向药物剂型设计策略改善药物的吸收、分布、代谢和排泄是其开发的重要途径。
2.1 纳米粒
随着纳米技术的进步,纳米粒由于其独特的优点而成为药物递送的潜在载体,包括:增加药物溶解度、延长结肠滞留时间、促进炎症部位的药物积累、药物动力学特性的调节、将药物递送至所需细胞或细胞器的能力[52]。纳米粒因其尺寸小使其渗透性增加,有利于穿过肠上皮细胞膜。因此,口服纳米药物递送系统(oral nanomedicine delivery system,ODS)可最大限度地提高药物的治疗效率,同时减轻其不良反应,已被认为在炎症性肠病治疗中有前途的药物载体[53]。
Luo 等[54]合成了一种以鞣酸包载的京尼平交联人血清白蛋白包衣来封装姜黄素的纳米颗粒(TA/CURNPs)。该纳米颗粒可增强姜黄素的结肠黏附,并提高了其在人结直肠腺癌Caco-2 细胞中的摄取。此外,TA/CURNPs 可阻断与TLR4 相关的NF-κB信号传导,有效改善葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠结肠炎症状。Sharma 等[55]采用固体二元脂质纳米粒(solid binary lipid nanoparticles,SBLN)封装姜黄素,提高制剂的稳定性、负载效率、细胞摄取及姜黄素的治疗特性。对此,以二元脂质为载体,采用溶剂乳化蒸发法合成了负载姜黄素的SBLN。由此产生的姜黄素-SBLNs 显著增强炎症组织中细胞的摄取和定位。结果表明,在DSS 诱导的结肠炎模型中,口服姜黄素-SBLNs 可减少TNF-α 的浸润、氧化应激和分泌。Kesharwani 等[7]使用纳米共沉淀法通过亲水性聚合物Eudragit®S100 开发Ora-姜黄素-S 纳米粒(Ora-curcumin-S,Ora-CUR-S)。然后对制剂进行药动学特性研究。结果表明,Ora-CUR-S 可增加姜黄素的溶解度和稳定性。同时在肠腔结肠组织中显示出精确靶向的潜力。Ora-CUR-S 通过下调TLR-4 的表达,有效阻断了细胞炎症活性的发展,对UC 小鼠模型的体内研究进一步证实Ora-CUR-S 对结肠炎和相关损伤的显著治疗作用。Qiao 等[56]制备并表征了亲水性聚乙二醇和通过二硫键连接的姜黄素纳米粒。所得聚乙二醇-姜黄素(polyethylene glycol-curcumin,PCUR)颗粒在肠道炎症病变部位具有更好的溶解性、聚集性及缓释特性。Mutalik等[57]详细介绍了适用于靶向结肠的药物(负载姜黄素的接枝共聚物纳米颗粒)的开发,合成了一种新型pH 敏感的聚丙烯酰胺接枝黄原胶(PAAm-g-XG)负载姜黄素纳米颗粒(CURNPs),在大鼠乙酸诱导的结肠炎症模型中,CURNPs 的吸收效果比姜黄素单体更好,同时,CURNPs 降低了骨髓过氧化物酶和亚硝酸盐水平,使结肠部位炎症损伤减弱。Beloqui 等[58]采用自发乳化溶剂扩散法,将聚乳酸-羟基乙酸和聚甲基丙烯酸聚合物结合起来开发姜黄素纳米颗粒,结果表明,与姜黄素单体相比,姜黄素纳米颗粒可导致其在细胞膜中的渗透性增加,体内实验表明,姜黄素纳米粒可减少中性粒细胞浸润和TNF-α 分泌。Huang 等[59]采用双乳液溶剂蒸发法将泊洛沙姆 407(pluronic F127,PF127)聚合物和过氧化氢酶(catalase,CAT)封装姜黄素,制备用于治疗UC 的多功能P-CAT/姜黄素纳米颗粒,结果表明在NPs 中引入PF127 和CAT 可以提高其黏液穿透能力,并显著缓解DSS 诱导的小鼠模型中UC的症状。为了提高抗炎药在结肠炎组织中的渗透性、聚集性和靶向性,Chen 等[60]使用改进的双乳液溶剂蒸发技术制备纳米粒,将PF127 和PLGA 对纳米颗粒的表面进行多孔功能化研究,以得到多孔PF127-CURNPs,研究结果表明,经PF127 修饰的多孔姜黄素纳米颗粒在小鼠溃疡性结肠炎组织部位具有更高的渗透性和靶向性。这些研究均揭示姜黄素纳米粒在UC 临床治疗中有较大的运用前景。
2.2 微粒
微粒递药系统1~1000 μm 具有避免药物过早降解、控制释放等优势,研究表明,微粒系统可减少药物在小肠上的吸收,并延长其通过结肠区域的时间,因此,此类系统也可特异性靶向递送药物来增强其在肠道组织的治疗效果,减少全身副作用[61]。
Xiao 等[62]使用乳液溶剂蒸发方法来制备具有pH 敏感的Eudragit S-100(ERS100)和PLGA 的微粒包载姜黄素,制备了一种pH 敏感的Eudragit S100(ERS100)/PLGA 微粒,用于结肠炎特异性药物的输送。体内实验表明,与姜黄素单体相比,口服姜黄素微粒(curcumin-microparticles,CUR-MPs)在缓解UC 小鼠模型结肠炎方面具有更高的治疗效率。Zhang 等[63]通过同轴电喷雾制备具有核壳结构的玉米蛋白微粒, 其中含有虫胶涂层(shellac@CUR/MPs),制备的CUR-MPs 具有较高的包封率和载药量,使用虫胶作为外壳材料不仅可以用作pH 敏感材料,保护药物的胃肠道输送,还可以用作防分解剂,避免姜黄素氧化分解,有利于制剂的保存,且结果表明CUR-MPs 的抗UC 能力显着增强。Sareen 等[64]采用乳液交联法制备了Eudragit S-100 包覆的壳聚糖姜黄素微粒,可防止姜黄素的早期释放,并在Higuchi 模型中表现出长达12 h 的缓释。相比之下,未包被的姜黄素-壳聚糖微粒在4 h 后出现突然释放。此外,在乙酸诱导的小鼠结肠炎模型中进行的体内研究证实,与游离姜黄素相比,载姜黄素微粒的结肠损伤程度和数量显著降低,组织病理学分析进一步证明了这一点。Blanco-García 等[65]通过喷雾干燥法使用玉米蛋白、pH 敏感的聚丙烯酸树脂、GantrezTMAN 聚合物制备载有姜黄素的微粒。结果表明载姜黄素的微粒对脂多糖诱导的巨噬细胞中的细胞因子(即TNF-α 和COX-2)活性产生了抑制作用,有较强的抗炎特性,是肠道输送抗炎剂的有利候选物。Chen 等[66]使用乳液溶剂蒸发法构建载有姜黄素的碗状微粒(bowl-shaped MPs,BMP),口服负载姜黄素的BMP显示出良好的治疗效果,并改善DSS 诱导的小鼠模型中UC 的症状。
2.3 微粒包载纳米粒
将纳米粒子封装于微粒中作为结肠药物口服递送系统备受关注,避免纳米粒子在胃和小肠中的过早降解或吸收,这种新的递送方法相较于纳米粒和微粒递药系统具有更强的结肠靶向特异性与药物聚集性[67-68]。在单个药物递送系统中可同时结合纳米和微粒系统固有的优点,聚合多种功能,更好地控制药物释放速率,减少爆裂效应,增强对药物的保护和稳定性,及增强靶向定位组织细胞的能力。
Xu 等[69]使用己烷-1,6-二丙烯酸酯和4-氨基1-丁醇单体通过迈克尔加成实验聚合合成pH 敏感的线性骨架聚(β-氨基酯) [poly(β-amino esters),PBAE],并通过琥珀酸酐连接剂在PBAE 侧链上接枝活性氧响应PAPE,以获得新型pH/活性氧双敏感/响应纳米载体(PBAE-SA-PAPE),同时,硫酸软骨素(chondroitin sulfate,CS)修饰PBAE-SA-PAPE,再通过纳米沉淀法制备具有pH/ROS 双重敏感能力CS-CUR-NPs-Gel,结果表明CS-CUR-NPs-Gel 可以靶向巨噬细胞并在结肠周围滞留更长时间,是针对UC 的靶向巨噬细胞药物递送的潜在方向。Oshi 等[70]使用超声波辅助抗溶剂结晶和逐层静电自组装(layer by layer electrostatic self-assembly,LBL)涂层技术,以壳聚糖包载的姜黄素纳米晶体(CUNCs)为核,以壳聚糖/海藻酸钠/醋酸纤维素邻苯二甲酸酯的pH 响应聚电解质多层为壳,开发了结肠靶向核壳结构姜黄素纳米粒子(CAP1AG4CH5@CUNCs),成功制备了结肠靶向核壳纳米粒子,可以特异性的将药物递送至结肠炎组织。其原理是通过利用纳米颗粒周围多层膜的表面电荷反转特性来增强姜黄素在炎症结肠组织中的积聚。结果表明该聚电解质能够根据pH 的变化将壳的表面电荷从胃肠道中的负电荷改变为结肠中的正电荷,这种表面电荷反转作用使得粒子能在结肠组织炎症部位发生黏附和聚集,可与黏膜中带负电的蛋白相互作用达到治疗UC 效果。
2.4 胶束
胶束是大量表面活性剂在溶液中“自组装”自由结合形成的胶体溶液。纳米胶束是由一个亲水基团和一个疏水基团在溶液中形成的共聚物自由结合而形成的纳米级核-壳样胶束。Wang 等[71]通过酯化反应成功制备海藻酸盐-姜黄素(Alg-CUR)胶束,其在RAW264.7 细胞中发挥有效的抗炎作用。DSS诱导的结肠炎小鼠模型结果表明,92.32%的Alg-CUR 到达结肠部位,酯键被共生厌氧菌群产生的酯酶迅速剪切,释放出姜黄素小分子被迅速吸收,从而减少促炎因子的表达和释放,有效缓解UC 的症状。
2.5 脂质体
脂质体系指将药物包封于类脂质双分子层内而形成的超微球形载体制剂[72],具有改善药物溶解性、提高药物稳定性、增强体内靶向性等优点。Wang等[73]采用乙醇注射法成功制备姜黄素脂质体(curcumin-liposomes,CUR-LPs)。在DSS 诱导结肠炎动物模型实验中,CUR-LPs 可防止结肠缩短、炎症细胞浸润和黏膜损伤,特别是显著抑制淋巴细胞浸润,从而减少组织病理学损伤。
2.6 小结
姜黄素微纳米递药系统制剂抗UC 研究见表2。

表2 姜黄素制剂微纳米递药系统抗溃疡性结肠炎研究Table 2 Anti-ulcerative colitis studies with curcumin formulation micro-nano drug delivery system
目前,治疗溃疡性结肠炎存在几个关键挑战,主要与结肠定位困难以及药物向疾病部位的无效递送有关,因此,需要寻找靶向递送药物的方法,同时降低靶外毒性、增加药物疗效。微纳米递药系统的开发提供了一种可能性,其选择性地针对结肠的炎症区域,并保护药物在胃肠道内的运转过程中不被降解,具有缓释、控释等方面的作用,目前结肠靶向药物递送系统已被确定为最有前景的药物递送策略。但是,研究者还应考虑溃疡性结肠炎生理和病理条件,其主要与屏障功能丧失、黏膜损伤、细胞/组织损伤和微生物菌群变化有关,表明需要设计更科学的药物传递系统,以达到靶向、高效、特异性递送药物的目的。
3 结语与展望
UC 属于炎症性肠病,是一种以黏液脓血便、腹痛、里急后重为主要临床表现,以结直肠黏膜连续性、弥漫性炎症分布为特点的慢性非特异性肠道炎症性疾病[74]。遗传、免疫、肠道黏膜屏障功能、环境、心理等因素被认为是该病发病机制[75-76],但该疾病的确切机制仍不清楚,由于其发病率不断增加,已成为沉重的社会负担。慢性的肠道炎症将导致免疫系统失调,免疫调节剂经常会在健康组织中产生严重的不良反应,如淋巴瘤的发展。如果没有靶向传递,UC 治疗药物可能会经过体循环到健康组织,导致不良反应增加。目前,微纳米药物递送系统已被广泛应用于疏水药物的装载[77],具有改善药物溶解性、提高药物稳定性等优点,用于治疗UC、结肠癌等疾病,这种新型的靶向给药系统可以将药物直接传递到结肠并释放,具有炎症靶向和提高药效的作用,有望使全身不良反应最小化。
姜黄素是一种毒性较低、安全性较好的天然化合物,也是治疗UC 的潜在候选药物,姜黄素主要通过抑制NF-κB、AP-1、TLR 和MAPK 等信号通路发挥治疗作用;对于UC 细胞因子谱的变化,姜黄素可抑制树突状细胞表达促炎因子、抑制T 细胞介导的免疫功能、增强巨噬细胞的吞噬活性;抑制TNF-α、IL-6 和IL-12 等促炎因子的表达;对于过度氧化应激,姜黄素可以有效清除过量的一氧化氮,防止中性粒细胞募集,从而降低MPO 活性;UC 的特点之一是肠道菌群失调,姜黄素还可以从整体上调节肠道微生物群,维持产生短链脂肪酸细菌的数量,减少细菌移位,从而达到抗UC 的作用。
大量体内外实验研究均表明姜黄素在UC 治疗中的有效性,但由于其溶解性差,结肠部位生物利用度低限制了其应用。对此,研究者可通过将姜黄素封装到纳米、微粒系统中改善其溶解性、生物利用度、稳定性和药效作用。虽然姜黄素微纳米制剂在治疗UC 方面受到越来越多研究者的关注,但还需要进一步的对照临床试验,这些姜黄素制剂的实验研究大多是在临床前动物模型及细胞模型上进行的,并没有在临床中开展研究,由于UC 病理生理学的复杂性,动物模型远不能模拟人类的疾病,比如小鼠和人类的肠道微生物群、pH 值、细胞中受体、黏液通过时间、黏液生长速度和厚度也有所不同,未来还需要开发出模拟人类肠道疾病的精确动物模型,如开发人源化小鼠模型或大型哺乳动物模型。
制备这些纳米制剂所选用的材料与制备过程不尽相同,制备过程中选择的辅料在临床应用前必须对其潜在毒性进行严格评估,在人体中的适应性与安全性应该引起研究者的重视;同时,不同材料的组合可能影响彼此之间的稳定性,应科学的选择辅料组合,以确定此组合材料能够有效递送药物;另一方面尽管这些以UC 症状为靶点的纳米给药系统取得了很好的靶向和治疗结果,但存在个体间和个体内差异,因此,在设计结肠靶向给药系统时,研究人员应考虑个体炎症状态,以便更好地治疗UC。
利益冲突所有作者均声明不存在利益冲突
