地黄多糖的提取纯化及药理作用研究进展
2023-06-08王清泉李亚男魏玉民李晓雨董伟超孙志强
王清泉,宋 景,李亚男,魏玉民,李晓雨,董伟超,孙志强,代 龙*
1. 山东中医药大学药学院,山东 济南 250355
2. 山东禹泽药康产业技术研究院有限公司,山东 德州 251200
地黄是玄参科植物地黄RehmanniaglutinosaLibosch.的新鲜或干燥块根。临床中医用药一般将其分为3 类,一类是采摘清洗后直接入药,称为鲜地黄,功效为清热生津、凉血、止血;一类是将其缓缓烘焙至约八成干,称为生地黄,功效为清热凉血,养阴生津;一类是按酒炖法、蒸法炮制处理,称为熟地黄,功效为补血滋阴、益精填髓[1]。地黄主要生长在辽宁、河北、河南、山东等地,中国各地和国外均有栽培。研究发现,地黄具有补血[2]、抗衰老[3]、抗肿瘤[4]、抑菌[5]、降糖[6]、免疫调节[7]、神经调节[8]等药理活性,在传统中医应用及现代药物有效成分开发等方面应用广泛。地黄含有萜类、黄酮类、多糖类等多种化学成分,现已分离鉴别出200 多种化合物[9]。地黄多糖是地黄的重要生物活性成分之一,在抗炎、抗氧化、糖尿病、神经调节等方面效果显著,且没有明显的毒性研究报道。随着研究进展,地黄多糖受到越来越多的关注,从提取方法到结构特性和给药应用都得到了广泛的研究。天然多糖具有易溶于水、无毒、无免疫原性、易修饰等优点[10],将多糖与载体结合或进行修饰后,更易发挥其疗效。地黄多糖除了具有多种药理作用外,还可与脂质体、纳米等新型给药技术结合给药,扩大其疗效。本文依据地黄多糖的提取、分离等制备工艺,常见化学结构,药理活性以及载体药物种类等方面的应用进行综述,为进一步开发和临床研究提供参考。
1 地黄多糖的提取
多糖的提取是研究多糖性质的前提,地黄多糖是一类由多个单糖组成的复杂结构体系,具有不同的物理特性和化学活性。因此,地黄多糖提取方法的选择要考虑其化学性质,提取条件和干扰物质的影响,以保证在不影响结构,化学性质的前提下达到最大的提取率。目前对地黄多糖常用的提取方法有水提醇沉法、有机溶剂提取法、超声提取法、CO2萃取法和酶解法等。
传统的水提醇沉法是多糖的常用提取工艺,该方法操作简单,应用广泛。赵平鸽等[11]以10 倍量热水提取,95%乙醇沉淀得到地黄多糖粗品,粗多糖占总糖含量的45.5%,提取率为16.02%,效果较好。周加林等[12]在优选的水提醇沉法最佳提取工艺下,得到的地黄多糖提取率为7.09%。水提醇沉法提取多糖的得率较低,属于粗品,需要进一步纯化。孙月川等[13]以60%甲醇为提取溶剂,采用单因素正交实验,得到地黄多糖的最佳回流提取工艺为料液比1∶8,提取时间1.5 h,提取温度90 ℃,多糖得率为总糖含量的66.32%。许海燕等[14]以乙醇为提取溶剂,采用响应面法优选最佳提取工艺为乙醇浓度30%、超声时间16 min、料液比1∶10 时,多糖得率为16.15%。
近年来,超临界CO2萃取法、微波提取法、超声萃取法、酶解提取法等被广泛应用。刘华等[15]优化了超临界CO2萃取法的工艺,多糖得率为30.4%。孔媛芳等[16]优选了微波提取法提取地黄多糖的工艺,即微波提取150 s,料液比1∶10,温度80 ℃下,多糖得率为总糖量的72.10%,得率较高。超声提取法具有能够增加细胞壁和细胞膜的通透性,更有利于多糖成分溶出,节约时间,操作简单等优点。田春莲等[17]以正交试验得出超声提取法提取地黄多糖的最佳工艺,在超声时间30 min,料液比1∶40,温度40 ℃下,地黄根茎叶的多糖得率分别为15.74%、8.36%、4.21%,不同部位的含量有较大差异。酶法是绿色高效的提取技术,酶可以破坏细胞结构,使物质溶出,并且作用条件温和,不会损害多糖的生物活性。李文波[18]以纤维素酶酶解地黄,优化了提取温度、提取时间、提取液pH 值、料液比4 种条件对多糖得率的影响,该方法收率高达21.4%,是一种新的、高效、温和的提取方法。
提取地黄多糖是研究其作用机制的首要步骤,针对多糖结构和生物活性采用的提取方法也多种多样,在表1 中列举了近年来对地黄多糖的提取采用的一些方法、最佳工艺及其相应的生物活性。

表1 地黄多糖提取方法的最佳工艺及生物活性Table 1 Optimum extraction process and biological activity of R. glutinosa polysaccharides
2 地黄多糖的纯化
地黄多糖的纯化目的主要是筛选分子量,去除蛋白质以及脱色等,常用的方法主要有膜分离法,柱层析法、Sevage 法等。多糖去除蛋白的主要原理是使蛋白变性、沉淀,常用的方法主要有加入三氯乙酸[19]、Sevag 试剂[20](氯仿和正丁醇的混合溶液)等。周家林等[12]通过实验测得Sevage 法脱蛋白率为41.40%,且地黄多糖损失较大;三氯乙酸法脱蛋白率为63.57%,多糖损失较小,三氯乙酸法要优于Sevage 法,且经三氯乙酸法纯化后的多糖在波长260 nm 与280 nm 下未见明显吸收峰,这表明该多糖几乎不含蛋白质及核酸,纯度较高。用传统方法提取得到的多糖常常含有色素,目前多糖脱色常用的方法有添加双氧水[25-26]、丙酮[15]、活性炭[18]等。刘冲英等[27]优化了双氧水对地黄多糖脱色的最佳工艺,在体积比1∶2(料液比),脱色温度43 ℃,pH 8.2 的情况下,脱色116 min,脱色率为88.03%,多糖保留率为77.56%。田春莲等[17]认为过多的H2O2会造成地黄多糖结构发生改变,在中性条件下加入1 倍量的10% H2O2溶液,保温60 min 脱色效果最好。大孔树脂纯化法是一种能将蛋白和色素等一并除去的方法,并且能较大程度上减少多糖的损失。刘冲英等[28]以此方法纯化地黄多糖,最佳工艺为树脂质量比(HPD-400∶LS-700B)1.20,上样质量浓度6.0 mg/mL,温度30 ℃,上样速率1.5 BV/h,上柱体积1.5 BV,在此工艺下,多糖的保留率为90.25%,脱色率为83.15%,除蛋白率为79.75%,效果较好。单糖和低聚糖的去除常采用80%乙醇沉淀[11,15,29-30]。
需要注意的是,仅靠单一的方法纯化地黄多糖并不能达到理想的要求,地黄多糖需要经过多种方法和多道工序才能够得到相对分子质量均一的多糖。代国娜等[25]将地黄叶采用95%乙醇脱脂,80 ℃蒸馏水提取,提取液离心,透析,保留相对分子质量(Mw)≥1000 的溶液,上DEAE 柱以H2O 和NaCl溶液分别洗脱,使用葡聚糖凝胶将得到的2 种水洗液进一步分离得到3 种纯化多糖RGLPW、RGLPS1和 RGLPS2。李红霞等[19]对经过水提醇沉法得到的粗多糖进一步除蛋白,透析处理后,用丙酮、无水乙醚依次洗涤杂质,再采用DEAE-Cellulose 柱进行层析处理,得到灰色的地黄多糖。
3 地黄多糖的结构修饰
多糖衍生物的合成是新兴的一种改变多糖性质,增加稳定性和改善疗效的方法。依靠一些化学方法,如改变糖残基上的羟基、羧基、氨基等化学基团,有可能会提高多糖的活性[31]。代国娜等[25]以乙酸为催化剂,将地黄多糖与硒结合,生成一种地黄硒多糖,该多糖能明显促进小鼠巨噬细胞的吞噬能力,促进小鼠脾淋巴细胞增殖,促进Th1 型细胞因子白细胞介素-2(interleukin-4,IL-2)和γ 干扰素(interferon-γ,IFN-γ)的分泌,该实验表明,地黄硒多糖能明显增强小鼠免疫力。多糖乙酰化可显著提高多糖的活性[32],杨颖等[26]优化了地黄多糖乙酰化的工艺,在乙酸酐∶地黄多糖为2.7,反应温度48 ℃条件下,反应3.0 h,地黄多糖乙酰基的取代度为0.327。实验表明,与未经乙酰化的地黄多糖相比,乙酰化地黄多糖的抗氧化能力明显提高。
4 地黄多糖的化学结构
多糖是由单糖通过糖苷键连接而成的一种大分子化合物,其结构特征通常用相对分子质量,单糖的组成,链的构象,分支结构等来定义[33]。不同的提取方法会造成多糖的结构不同,影响药理活性,因此研究结构特征对于修饰其结构组成及探究其药理活性非常重要。多糖的结构鉴定采用的分析方法有高效液相色谱、气相色谱质谱联用、红外光谱等[10]。目前已经鉴定的地黄多糖的结构见表2 和图1。不同的提取和纯化方法得到的多糖的结构也不同,并且多糖结构组成复杂,现有的方法并不能很好的对其进行分析,新的方法研究仍在进行中。

图1 SDH-WA (A) 和SDH-0.2A (B) 的初步结构Fig. 1 Tentative structure of SDH-WA (A) and SDH-0.2A (B)
5 药理作用
5.1 免疫调节
免疫是人体的一种抵抗外来入侵,杀死人体本身损伤、病变细胞的生理活动,免疫涉及特异性免疫和非特异性免疫,现代研究发现,地黄多糖对特异性免疫有很好的调节作用,从细胞水平和免疫因子等机制增强免疫力。地黄多糖能够促进脾淋巴细胞的增殖,且呈一定的浓度相关性[25-26,37]。王小兰等[38]发现,地黄多糖能显著增加免疫抑制模型小鼠中脾脏指数、吞噬指数、白细胞数、和淋巴细胞数,具有调节细胞IFN-γ、IL-4、IL-10 因子的表达,增加CD3+、CD4+T 细胞的表达水平的作用。树突状细胞(dendritic cells,DC)是非常重要的抗原呈递细胞,能激发大多数免疫反应,其功能主要有吸收、处理、呈递抗原、激活T 细胞等,实验发现,地黄多糖对于DC 细胞的激活调控作用非常丰富。地黄多糖能够刺激DC 细胞的Toll 样受体4(Toll-likereceptor4,TLR4),使细胞激活,从而促进CD4+T 和CD8+T 细胞中IFN-γ 的产生,增强免疫力[39-40]。地黄多糖还能够刺激DC 的增殖和细胞因子IL-6、IL-12、IL-1β 的产生,激活小鼠体内的免疫细胞,增加了小鼠血清中抗原特异性免疫球蛋白G(immunoglobulin G,IgG)和Th1-(IFN-γ)、Th2-(IL-4)、Th17-(IL-17、IL-6)细胞因子的含量,增强了小鼠抗原特异性免疫反应[41]。在促进增殖的同时,Zhang 等[42]发现,DC 细胞中CD40、CD80、CD83、CD86 和MHC II 分子的表达量也明显升高,这标志着地黄多糖增加了DC 细胞呈递抗原的能力。Wang 等[43]还发现,地黄多糖激活 DC 细胞中的依赖性细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、丝裂原活化蛋白激酶(p38 MAPK,p38)和c-Jun 氨基末端激酶(c-JunN-terminal kinase,JNK)的磷酸化,该结果表示地黄多糖通过ERK 和JNK 通路发挥免疫调节作用。Zhou 等[34]研究表明,地黄多糖SDHWA 和SDH-0.2A 均可减弱脂多糖诱导的RAW264.7巨噬细胞的溶菌酶、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、IL-1β 和NO 的分泌,是一种潜在的免疫调节剂。通路关系见图2。

图2 地黄多糖通过调节DC 细胞与免疫细胞发挥免疫调节作用的机制Fig. 2 Mechanism of Rehmannia glutinosa polysaccharide on immune regulation by regulating DC cells and immune cells
5.2 神经保护
神经细胞的损伤是引起细胞凋亡、神经系统错乱的重要原因之一,该过程与脑细胞炎症反应,神经元的增殖和修复以及凋亡等基因的表达相关。熟地黄有益精填髓的功效,间充质干细胞(MSCs)是一类存在于骨髓等的成体干细胞,实验研究发现,地黄多糖促进了MSCs 细胞向神经细胞的分化,促进了脑部相关基因Otx2、Hoxb1 的表达[44],并伴随着 MSCs 细胞中骨形态发生蛋白( bone morphogenetic protein-4,BMP4)蛋白量的增加[45]。该过程细胞中的Notch 蛋白胞内片段含量和神经源性基因Notch 同源蛋白1(Neurogenic locus notch homolog protein 1,Notch1)含量明显下降[46],Notch通路中的代表节点分子 Presenilin1、Hes1、Jagged1mRNA 的表达也显著降低[47],这表明抑制Notch 通路是地黄多糖促进MSCs 向神经细胞分化的机制之一,综上,地黄多糖也为中医理论肾主骨,生髓、通于脑提供了现代依据。神经细胞的凋亡与B 淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)和Bcl-2 相关X 蛋白(Bcl-2-associated X protein,Bax)密切相关。伍班名等[48]的实验发现,低、中、高剂量的地黄多糖均能显著逆转缺氧复氧诱导的Bcl-2 和Bax 表达的改变,细胞中circ-0010729 表达降低,miR-326 基因表达升高,这表明地黄多糖通过抑制circ-0010729/miR-326 通路调控神经细胞凋亡,发挥对脑缺血/再灌注损伤的保护作用。此外,地黄多糖还能够改善由于神经损伤引起的记忆障碍、抑郁等神经疾病。研究发现,地黄多糖可上调小鼠海马组织乙酰胆碱转移酶( choline acetyltransferase,ChAT)、超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性和核因子-κB 抑制蛋白α(inhibitor κappa B,IκB-α)表达,下调乙酰胆碱酯酶(anticholinesterase,AChE)活性、丙二醛(malondialdehyde,MDA)、TNF-α、IL-1β 水平及核因子-κB(nuclear factor kappa-B,NF-κB)表达,通过调节胆碱能神经系统功能、抗氧化应激及炎症反应改善东莨宕碱诱发的小鼠认知障碍和行为缺陷[49]。王晓尧等[50]实验发现,地黄多糖升高了大鼠脑组织中的γ-氨基丁酸和多巴胺的含量,降低了降低谷氨酸和5-羟色胺的含量,通过调节神经递质的含量和抑制下丘脑-垂体-甲状腺(HPT)轴和下丘脑-垂体-肾上腺(HPA)轴功能的亢进发挥抗焦虑作用。相关机制通路见图3。

图3 地黄多糖调控神经细胞的作用机制Fig. 3 Mechanism of Rehmannia glutinosa polysaccharide regulating nerve cells
5.3 抗氧化
人体身体机能和器官的衰老以及许多疾病的发生都与人体过度的氧化反应密不可分,氧化过程中产生的有害物质–自由基是造成机体损伤的罪魁祸首之一。现代研究发现,地黄多糖能够直接或间接的参与自由基清除过程。人体中的自由基能够被SOD 催化成过氧化氢,并在谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和CAT 的作用下进一步催化成水和氢[51-52]。地黄多糖能够增加小鼠心肌细胞SOD、GSH-Px、CAT 的活力,恢复氧化应激造成的线粒体功能损伤[53],这与Song 等[54]在研究地黄多糖治疗鸭甲型肝炎病毒造成的氧化损伤得到的结果相同。朱敏丰[55]研究了地黄多糖对于脑缺血小鼠过氧化损伤的影响,地黄多糖显著增加了模型小鼠SOD、Na+-K+-ATPase 和Ca2+-Mg2+-ATPase的含量,降低了MDA 含量,恢复了线粒体功能,对脑缺血造成的氧化损伤小鼠细胞具有明显保护作用。地黄多糖可通过抑制细胞凋亡途径来减轻细胞的氧化损伤,实验发现,地黄多糖减轻了H2O2造成的人晶状体上皮细胞的肿胀程度和死亡率,并伴随着NOD 样受体蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)表达水平和caspase-1/pro-caspase-1、GSDMD-N/GSDMD(地黄多糖组切割消皮素 D)细胞数量比值的降低,NLRP3/caspase 凋亡通路可能是其发挥保护作用的途径[56]。彭辉等[57]也发现经地黄多糖处理后,乳鼠心肌细胞中Bcl-2/Bax 蛋白比率显著升高,半胱氨酸蛋白酶-3(Caspase-3)表达量明显降低,细胞凋亡率显著下降。周艳等[58]比较了熟地黄多糖与生地黄多糖抗氧化能力的优越,熟地黄多糖处理的小鼠体内总抗氧化能力增强,SOD、CAT 蛋白活力要优于生地黄多糖,熟地黄多糖抗氧化效果要优于生地黄多糖。
5.4 抗炎
炎症是机体在应对内在和外来威胁时产生的一种防御反应,适当的炎症反应能够帮助机体恢复健康,维持机体稳态,但机体过度的炎症反应也会大量损伤机体正常细胞,造成机体失衡。地黄多糖是治疗炎症更安全,有效的天然衍生药物之一,对多种炎症反应都有一定的治疗作用。地黄多糖能够抑制结肠炎模型NF-κB/p65 信号通路的激活,通过抑制p65、NF-κB 蛋白表达及炎症因子的产生发挥保护作用。短链脂肪酸(short-chain fatty acids,SCFAs)是一些肠道菌群的产物,能够下调炎症NF-κB 信号通路的表达,地黄多糖可调节炎症性肠病小鼠肠道菌群平衡,改善炎症性结肠损伤,通过调节菌群及其SCFAs 的产生发挥抗炎作用[59]。在糖尿病大鼠模型中,地黄多糖能够降低大鼠血液中炎症标志物TNF-α、IL-6、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的水平,显现出抗炎作用[35]。Lu 等[60]发现蛋白激酶B(protein kinase B,AKT)/ERK/JNK 信号通路是地黄多糖的抗炎作用通路,九蒸处理的地黄多糖RG-B9 显著抑制了RAW264.7 巨噬细胞在脂多糖诱导下的炎症因子TNF-α,IL-6、TGF-β 的分泌,通路上,RG-B9 下调AKT/ERK 的磷酸化水平,抑制了其激活。Wu 等[61]发现,地黄提取物显著降低了肝脏炎症细胞化学吸引和肝纤维化现象,细胞中TNF-α、IL-1β 含量减少,抗炎细胞因子IL-10 含量增加,通过抑制炎症反应预防肝脏纤维化。
5.5 抗肿瘤
肿瘤是指自身细胞在某种因素导致下,发生病变,开始恶性增生形成的新生物,分为良性和恶行。恶行肿瘤的彻底根治是世界医学难题,近年研究发现,地黄多糖对于肿瘤有着很好的疗效。S180荷瘤小鼠腹腔注射地黄多糖液,可明显抑制S180肉瘤的生长,抑瘤率达42%,并且能够提升小鼠的免疫功能,增强杀死癌细胞的能力[36]。吴素珍等[62]发现,地黄多糖能够减少慢性粒细胞中具有高酪氨酸蛋白激酶活性的融合蛋白质的合成和bcr/abl 融合基因mRNA 的表达发挥抗癌作用,他们又还发现,地黄多糖可以调节慢性粒细胞凋亡相关蛋白Bcl-2、Caspase-3 的表达量和酪氨酸蛋白激酶的磷酸化发挥促凋亡作用[63]。自然杀伤细胞(natural killer cell,NK)在激活人体免疫,杀死恶性细胞等方面有重要作用,地黄多糖能够通过激活DC 细胞中TLR4 受体,使其产生IL-2 和IL-12,以此激活NK 细胞,并使其分泌γ-干扰素,抑制CT26 肿瘤细胞在小鼠肺部的生长[64]。
5.6 抗糖尿病
糖尿病现已成为世界普遍性疾病,生活作息紊乱,饮食不规律等均能引发不同类型的糖尿病,并且糖尿病发病率已经表现出青年化趋势。地黄在中医上具有滋阴补肾之功效,其有效成分地黄多糖对于糖尿病的治疗表现出优异的效果。地黄多糖能够改善肥胖型糖尿病小鼠体内空腹血糖、胰岛素、总胆固醇、甘油三酯等指标,促进促胰素(如:胰高血糖素样肽-1、葡萄糖依赖性促胰岛素多肽)的分泌。高血糖造成的糖基化产物与其糖基化终末产物特异性受体( receptor for advanced glycation endproducts,RAGE)结合,会引发蛋白激酶C,蛋白酪氨酸激酶、NF-κB 等多种信号通路的激活,造成细胞多种病理变化[65]。康伟等[66]发现,地黄多糖能够抑制糖尿病肾病模型(NA)大鼠的RAGE 的分泌,从而抑制NF-κB 等下游联级反应的激活,通过RAGE/NF-κB 发挥对NA 的保护作用。地黄多糖还能够逆转糖尿病小鼠肝脏中烯醇丙氨酸磷酸羧激酶(phosphoenol pyruvate carboxykinase,PEPCK)mRNA 表达增加现象,增加糖原的合成,抑制细胞的炎症和氧化反应[35]。寇战利等[67]发现地黄多糖在升高2 型糖尿病小鼠体内胰岛素、糖原含量的同时,β-连环蛋白(β-catenin)、成骨特异性转录因子抗体(runtrelatedtranscription factor2,Runx2)、低密度脂蛋白受体相关蛋白5(low den-sitylipoprotein recept or related-protein,LRP5)蛋白表达量也明显升高,这表明地黄多糖通过激活Wnt/LRP5/β-catenin 通路,改善由2 型糖尿病引起的骨质疏松症。另外,实验发现,地黄寡糖也具有降血糖作用,其作用机制可能与神经内分泌免疫调节网络有关[68-69]。
5.7 其他作用
实验发现,地黄多糖对于生殖系统、骨骼、肾脏、人体衰老等都具有一定的保护作用。仵春云等[70]研究发现,地黄多糖可保护由X 射线照射导致的小鼠精子DNA 的损伤,恢复小鼠生殖功能。另外,地黄多糖对卵巢颗粒细胞的增殖也有一定的促进作用[71],这与田晓宇等[72]得到的结果相同。Ou 等[73]发现,地黄多糖RGP 能显著提高大鼠骨矿化沉积率,SOD、CAT 水平,降低丙MDA 含量,促进叉头框蛋白O1(forkhead box O1,FOXO1)、肌肉萎缩盒F 基因(muscle atrophy F-box,MAFbx)和肌肉环指蛋白-1(muscle RING-finger protein-1,MuRF1)mRNA 的表达,通过抑制FOXO1 介导的泛素-蛋白酶体通路改善骨质疏松。蓝运竞等[74]研究表明,地黄多糖能够降低由慢性肾病引起的肾冠脉硬化,抑制冠脉血管平滑肌细胞中经典瞬时受体电位蛋白的表达并促进受损细胞自噬。李玉琴等[75]观察到妊娠合并甲状腺功能亢进大鼠经ig 给药地黄多糖后,子代小鼠的肾损伤率明显下降,并观察到母代小鼠肾组织中对核因子E2 相关因子(NF-E2-related factor 2,Nrf2)、血红素氧合酶-1(heme Oxygenase,HO-1)表达量降低,NLRP3 表达量升高,Nrf2/HO-1/NLRP3 通路可能是其发挥作用的机制。秀丽隐杆线虫,简称线虫,是一种与人类基因同源性高达80%左右的物种,是一种作为研究抗衰老的理想模型。李玉洁等[76]发现,地黄花多糖可以延长线虫寿命,但随剂量增大,作用效果降低,其作用机制可能与抗氧化有关。Yuan 等[77]研究表明,地黄多糖可以通过促进DAF-16(寿命调控因子)基因的转录,抑制DAF-16蛋白的抑制蛋白DAF-2 mRNA 的表达,持续性的刺激ⅡS(胰岛素/IGF-1 信号通路),提高线虫的应激能力从而延长线虫的寿命。
6 载体新剂型
载体药物具有能够改变药物在体内的分布和药物的释放速度,提高药物的靶向性,避免首过效应等优点,有效提高药物的生物利用度。Huang 等[78]采用响应面法得到一种地黄多糖脂质体(RGPL)的最佳制备条件,大豆磷脂与胆固醇的比例为8∶1,氯仿与甲醇的比例为3∶5,大豆磷脂与吐温80 的比例为10∶1,温度66 ℃下包封率可达(72.753±0.318)%,且包封后较低的地黄多糖剂量就可达到预期的免疫增强作用。他们后发现RGPL 与卵清蛋白共包合后,RGPL 的卵清蛋白释放率要小于空白脂质体,这表明地黄多糖包封脂质体有助于RGPL的稳定性,具有良好的药物保留性[79]。Huang 等[80]后又开发了一种地黄多糖聚乙二醇(PEG)纳米佐剂,该纳米佐剂粒径为(31.98±2.60)nm,对巨噬细胞增殖的促进作用明显优于无PEG 修饰的纳米地黄多糖。
7 结语与展望
多糖是地黄中含量丰富的化学成分,具有广泛的生物活性,又因炮制处理,生地黄和熟地黄中多糖的含量和种类也不相同,这也间接造成了中医上生熟地黄药效的差异。地黄多糖的提取是其研究和应用的基础,目前针对地黄多糖提取方式有水提醇沉法、超声法、酶解法、超临界CO2萃取法、微波提取法等。通过以上所得到的多糖均为粗多糖,常含有蛋白、色素等杂质,可综合利用膜分离法,柱色谱法、Sevage 法等去除,提高地黄多糖的纯度。不同的提取纯化方式得到的多糖含量和结构也不相同,研究人员需注意地黄多糖初步的提取和制备,选择合适的提取方式和溶剂,采用多次提取的方法,以增加多糖的提取率。不足之处在于,目前关于地黄多糖结构鉴定的相关文献较少,还没有鲜地黄,生地黄,熟地黄多糖的结构对比,无法看出差异性,再者针对地黄多糖的研究大都是以粗多糖为主,含有多种多糖成分,从这些结论中很难明确单一成分的多糖的具体结构和药理作用,因此,地黄多糖的纯化和结构鉴定需要进一步的实验研究。
地黄多糖具有多种药理作用,主要包括免疫调节、神经保护、抗氧化、抗炎、抗肿瘤、治疗糖尿病等,不同的药理作用之间是相互关联的。在免疫调节中,地黄多糖主要作用于DC 细胞,促使其分泌相关免疫因子,促进免疫细胞的增殖,激活特异性免疫功能。地黄多糖对于神经系统的保护主要依赖于抑制凋亡蛋白的表达、促进神经细胞的分化以及抗炎和抗氧化作用等。炎症因子的过度合成是导致机体产生炎症的原因,地黄多糖可以通过抑制炎症基因的表达和细胞对于炎症因子的分泌产生抗炎作用,其中对NF-κB 通路有很好的抑制作用。近年来,糖尿病的发病率已趋向于年轻。现代研究发现地黄多糖可增加胰岛素分泌,对糖尿病有一定的治疗作用。在图4 中,总结了目前文献中3 种地黄的地黄多糖药理活性的差异,从中可以看出,熟地黄多糖在神经保护、抗氧化、抗糖尿病方面疗效优越,这也符合熟地黄益精填髓的功效;鲜地黄多糖更有助于提升人体免疫力;生地黄多糖更有利于抵抗炎症,需要注意的是相关文献较少,还需更多的实验加以佐证。将药物与载体结合具有提高利用度,增加靶向性等多种优点,目前地黄多糖已经制成了脂质体、纳米制剂等剂型,提高了其生物活性,但目前的研究很少,不同的地黄多糖具有不同的结构,如何选取合适的载体以符合不同地黄多糖的特点,地黄多糖的新型给药方式和剂型的变化等问题还需进一步研究。
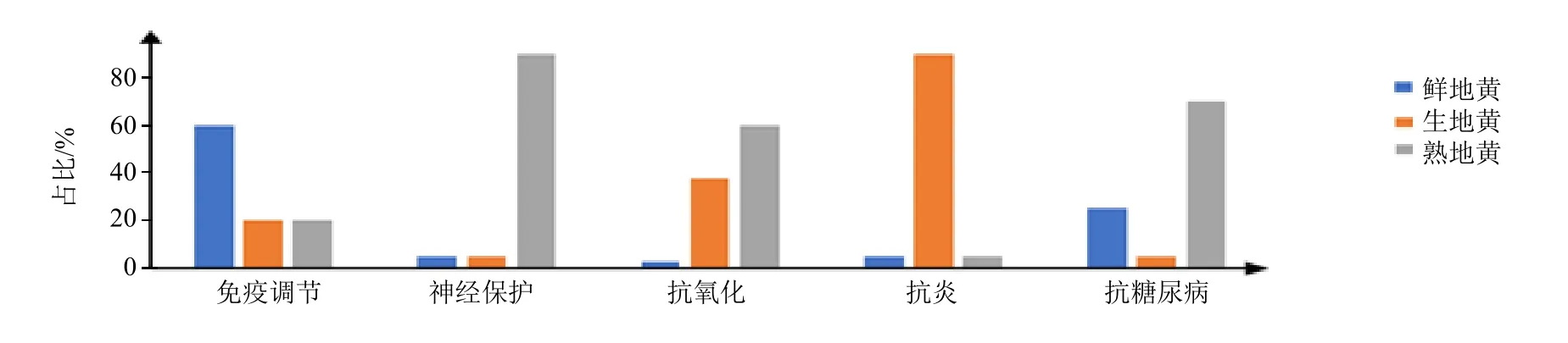
图4 3 种地黄的多糖药理活性差异Fig. 4 Comparison of pharmacological activity of three kinds of Rehmannia glutinosa polysaccharide
利益冲突所有作者均声明不存在利益冲突
