人型猪型和杂交型蛔虫的微卫星多样性
2023-06-07胡锦硕周春花石琴华邓仕标
胡锦硕,刘 鑫,周春花,石琴华,邓仕标
(1.南昌大学生命科学学院,江西 南昌 330031;2.抚州医学院,江西 抚州 344000)
人蛔虫和猪蛔虫是对人类和猪的健康有重要影响意义的小肠寄生性线虫。蛔虫感染估计超过8亿人,蛔虫病是一种被忽视的贫困疾病。轻度感染可能无症状,但中度至重度感染这些大型蠕虫可导致腹部症状,甚至致命的小肠梗阻。幼儿感染可导致营养不良、生长迟缓和认知发展抑制。蛔虫感染也会给养猪行业带来重大的经济损失[1]。
人蛔虫和猪蛔虫具有相似的结构特征,有相同的生活史,学术上有关人蛔虫和猪蛔虫二者的分类学关系始终存在争论。有学者认为两者都是有效的物种,可能来自共同的祖先[2];也有学者认为先出现猪蛔虫再出现人蛔虫[3]或先出现人蛔虫再出现猪蛔虫[4-5];还有学者认为人蛔虫和猪蛔虫是同物异名种,相似的形态学和低的遗传距离似乎支持这一观点[2],但宿主特异性的证据又不支持这一观点[6],人蛔虫和猪蛔虫种群重测序至不同的候选区域,GO富集到不同的条目和KEGG分析富集到不同的通路[5],也不支持这一观点。
人蛔虫和猪蛔虫在流行上基本上具有各自相对独立的传播圈[7-9]。但人、猪蛔虫又显示出相同的基因型,如相同的核酸电泳带型[8-9],相同的G2型(占20%左右)[10],以及相同的人蛔虫的H9序列和猪蛔虫的P9型(占2.5%)[11],这些结果表明两者之间存在交叉感染甚至杂交的可能性。Criscione等首次发现并报道了人源性蛔虫和猪源性蛔虫的杂交个体[12]。随后Zhou等对交叉感染和杂交个体在我国的发生频率及其在人猪宿主之间、南北地区之间和以及不同基因型(G1-G3)之间的分布做了深入的研究,并提出人蛔虫的绝大多数是人型蛔虫,猪型蛔虫是猪蛔虫的主要部分,杂交型蛔虫则是交叉感染的人型蛔虫和猪型蛔虫交配产生的杂交个体,或是交叉感染的猪型蛔虫和人型蛔虫交配产生的杂交个体[13]。
人型、猪型、杂交型蛔虫种群的线粒体系统发育基因组学研究表明杂交型蛔虫和人型、猪型蛔虫存在差异[14]。基于人蛔虫基因组测序表明人、猪蛔虫杂交体能感染人[15]。本研究在前期研究的基础上,运用多个微卫星标记探究3个蛔虫种群的遗传多样性。了解其遗传学差异,以便理清它们生活策略的某些方面,提高我们对疾病流行病学的认识,并设计控制策略。
1 材料与方法
1.1 材料
实验所用的蛔虫样本取自江西省新建县,采集时使用生理盐水将虫体清洗干净,-80 ℃保存。人型、猪型和杂交型蛔虫的鉴定详见Zhou等[13]。人型蛔虫(n=33)来自人体内;猪型(n=33)蛔虫来自猪体内;杂交型蛔虫(n=6)中5条来自猪体内,1条来自人体内。
1.2 基因组DNA的提取
样本解冻后剪下一小段虫体体壁(约50 mg)放入已灭菌的1.5 mL离心管中并剪碎。用蛋白酶K消化过夜,采用Promaga公司试剂盒(Wizard®SV Genomic DNA Purification System)提取基因组DNA。
1.3 微卫星扩增
采用常染色体微卫星引物(GenBank®中检索号为:DQ988845、DQ988847、DQ988848、DQ988849、DQ988857、DQ988859、DQ988860和DQ988863)进行扩增,在上游引物5'端加上荧光标记(FAM或HEX或TAMRE)。引物详细信息见Criscione等[12]。PCR反应体系总积为25 μL,其中包括2x Premix Taq (Takara) 12.5 μL、10 μmol·L-1的上游引物和下游引物各1.5 μL、50 ng·μL-1的DNA模板1 μL以及灭菌双蒸水13.5 μL。扩增反应程序为95 ℃预变性6 m,10次高温PCR循环(95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 m),35次低温PCR循环(95 ℃变性30 s、47 ℃退火30 s、72 ℃延伸1 m),72 ℃延伸5 m。PCR产物经2%琼脂糖凝胶电泳确定扩增产物的长度符合预期的范围后进行毛细管电泳,等位基因的大小由ABI3730xl DNA分析仪确定。引物合成、毛细管电泳均由上海生工生物工程有限公司完成。
1.4 数据分析
使用CERVUS V2.0软件计算每个微卫星标记的遗传多样性指标(观测杂合度、期望杂合度和多态信息含量)、等位基因的频率和数目。通过Arlequin 3.5计算人型、猪型和杂交型蛔虫间的遗传分化程度FST和分子变异方差分析。
2 结果
2.1 3个蛔虫种群的等位基因数及等位基因频率差异
本研究使用的微卫星多态性位点中检测到等位基因数最多的是ALGA20位点,具有33个等位基因;等位基因数最少的是ALGA31位点,具有9个等位基因。人型、猪型和杂交型蛔虫种群检测到的等位基因数分别为130、51、42(表1)。人型、猪型和杂交型蛔虫种群检测到的等位基因数最多的均为ALGA20位点,分别具有27、9、9个等位基因;检测到的等位基因数最少的位点均是ALGA31,等位基因数分别为8、1、2(表1)。人型、猪型和杂交型蛔虫均具有各自种群的特有等位基因,其中特有等位基因数最多的是人型蛔虫种群,最少的是杂交型蛔虫种群(表1)。
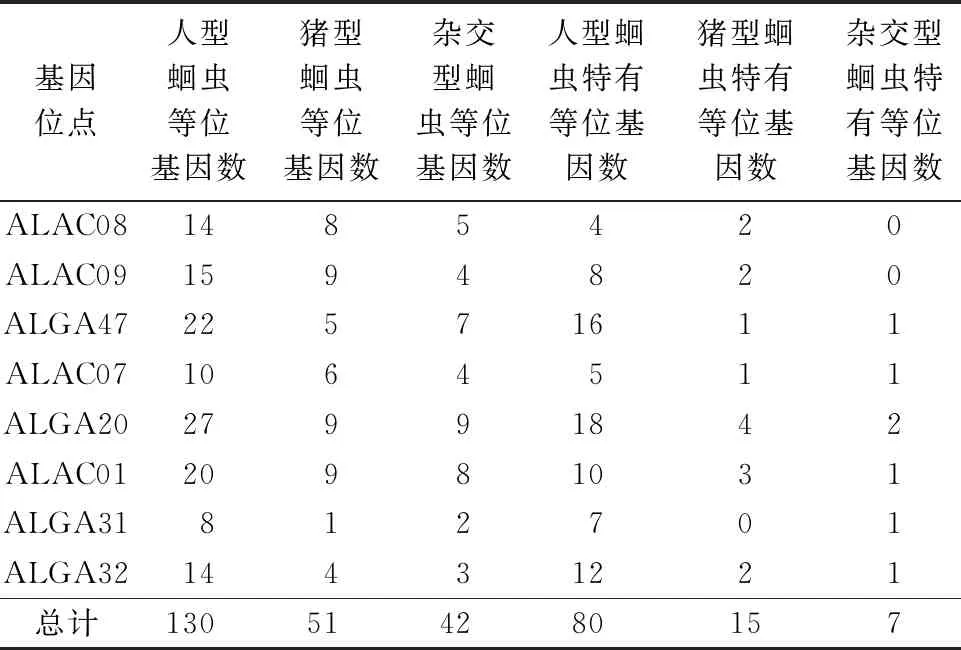
表1 3个蛔虫种群在8个微卫星位点的等位基因数及特有等位基因Tab.1 Alleles and specific alleles at eight microsatellite loci in three Ascaris populations
人型、猪型和杂交型蛔虫种群中不同位点的等位基因频率有所不同,人型、猪型和杂交型蛔虫种群的等位基因频率范围分别为0~0.767 9、0~1.00、0~0.583 3。微卫星位点ALGA20在人型蛔虫种群中多态性最高,在杂交型蛔虫种群中也是如此。微卫星位点ALAC09、ALGA20和ALAC01在猪型蛔虫种群中均为最高的多态性。微卫星位点ALGA32在人型、猪型和杂交型蛔虫中具有相同的优势等位基因。微卫星位点ALGA47在人型与杂交型蛔虫中具有相同的优势等位基因。微卫星位点ALAC07、ALGA20、ALGA31、ALGA32在人型和猪型蛔虫中具有一致的优势等位基因,其他4个微卫星位点的优势等位基因则存在差异。
2.2 人型、猪型和杂交型蛔虫种群遗传多样性分析
人型、猪型和杂交型蛔虫种群的平均等位基因数分别为16、6和5;期望杂合度分别为0.84、0.60和0.70;多态信息含量分别为0.81、0.55和0.61。3个蛔虫种群均有较高的遗传多样性,人型蛔虫种群的遗传多样性最高,而猪型蛔虫的遗传多样性最低。
2.3 3个蛔虫种群的基因流与遗传分化
人型、猪型和杂交型蛔虫种群间存在基因流,基因流最大的在杂交型和人型蛔虫种群间,为7.42;最小在杂交型和猪型蛔虫种群间,为2.54(表2)。人型与猪型、人型与杂交型、猪型与杂交型蛔虫种群间的遗传分化分别为0.12、0.06、0.16(表2)。进一步的分子变异方差分析显示,绝大部分的变异(17.22%+71.21%)来自个体间,而只有小部分的变异来自种群间(表3)。F统计量即FIT、FIS和FST值分别为0.29、0.19和0.12,且P值均为0.00,说明蛔虫的变异主要来自个体间(表3)。

表2 3个蛔虫种群间的基因流与遗传分化(右三角为基因流,左三角为遗传分化)Tab.2 Gene flow and genetic differentiation among three Ascaris populations (gene flow in the right triangle and genetic differentiation in the left triangle)

表3 人型、猪型和杂交型蛔虫种群的分子变异方差分析Tab.3 Analysis of molecular variance and variance in human-type Ascaris,pig-type Ascaris,and hybrid Ascaris
3 讨论
本研究选用的微卫星位点遗传多态性水平较高,承载着较多的遗传信息,能反映出种群的进化历史。在这些位点中,人型、猪型和杂交型蛔虫种群均存在各自的优势等位基因和特有等位基因,等位基因频率分布不均匀。优势等位基因通常为一个种最原始和最保守的,在进化过程中会受到DNA突变等机制的影响而变成其他的等位基因,微卫星标记的多态性水平可以很好地体现一个物种的进化历程[16]。人型蛔虫、猪型蛔虫和杂交型蛔虫在寄主选择上的差异可能与优势等位基因和特有等位基因的差异有关。
从人型、猪型和杂交型蛔虫种群的期望杂合度和多态信息含量来看,它们都存在较大的遗传变异,这反映了人型、猪型和杂交型蛔虫种群的遗传多样性水平的差异,究其原因可能与寄主差异有关[17];也可能是因为基因渐渗过程中被整合的基因通过重组被分解并等待选择,有害的等位基因会被清除,而有利的等位基因通过漂移来避免丢失,其基因频率可能会增加[18]。
本研究得出猪型与杂交型蛔虫种群间的遗传分化较大(处于0.15~0.25),而人型与猪型、人型与杂交型蛔虫种群间的遗传分化中等(处于0.05~0.15)。进一步的分子方差分析显示,人型、猪型和杂交型蛔虫种群间的FST=0.12,种群间的遗传分化水平中等,并且种群间遗传变异只占11.57%,个体间遗传变异占88.43%,说明3个蛔虫种群间遗传分化水平与种群内相比较弱,这可能与种群间的基因交流有关。3个蛔虫种群间的基因流值(2.54~7.42)较大,说明蛔虫种群间都存在较为普遍的基因交流,即基因渐渗。其中人型和杂交型蛔虫种群间基因交流(值最大)比其他种群间都要普遍,这与基因组测序得出的人、猪蛔虫的杂交体感染人的结果相一致[15]。基因渐渗在种群水平意味着某一个种群的遗传信息被转移至另一个种群[19]。基因渐渗的前提是杂交,在寄生虫中普遍存在,如杂交常见于埃及血吸种与其他血吸种[18]。人蛔虫和猪蛔虫杂交的数据已被人陆陆续报道。有采用单个分子标记的限制性片段长度多态性聚合酶链反应技术在非流行区和流行区均发现了杂交型蛔虫[20-21]。也有采用多个微卫星标记结合贝叶斯分析在流行区发现了杂交个体[12-13]。渐渗杂交因为编码生物医学重要性状(包括毒力、宿主特异性或耐药性)的基因在物种间转移提供了潜在途径而备受关注[22]。
本研究的杂交型蛔虫大多来自猪的体内,而先前的研究大多是来自人的体内[12-13]。新近基于基因组测序也发现了人蛔虫和猪蛔虫杂交复合体感染人的分子证据[15]。这反映了蛔虫传播动力学的变化的事实,提醒我们有必要对蛔虫病的防治制定新的策略,对当地猪蛔虫感染的治疗同时也要加强对人蛔虫病的治疗,以减少猪群受到来自人群蛔虫的感染。此外,杂交本身可能产生新的寄生虫基因型组合,通过宿主免疫逃逸或寄生虫致病力增强扩大宿主范围,这种重新组合的寄生虫基因型可以从杂交区逃逸。这些杂交个体的存在需要引起关注。基于杂交可能在蛔虫种群的进化动态中发挥的作用,应该重新评估蛔虫病的长期控制措施。
人、猪蛔虫除了存在有宿主特异性寄生的人型蛔虫和猪型蛔虫外,还可能存在无宿主特异性寄生(即能同时感染人和猪)的类型,而且人型蛔虫或猪型蛔虫能够在一定的条件下(比如信号通路发生改变、去甲基化或者免疫驱动等)转化成无宿主特异性寄生的类型,这就产生了交叉传播,进而产生了杂交个体。杂交个体可能无宿主特异性。
4 结论
本研究将微卫星标记技术应用于人型、猪型和杂交型蛔虫的遗传多样性研究,为蛔虫的遗传结构、分子流行病学提供多角度的信息。本研究得出3个蛔虫种群的遗传多样性水平均较高,且人型蛔虫种群的最高,而猪型蛔虫的最低,遗传变异主要来自种群个体间,人型和杂交型蛔虫种群间的基因交流更频繁,3个蛔虫种群间存在差异。人型、猪型、杂交型蛔虫的核基因组信息应该进一步研究,因为它可以更深入地阐明两者的分类地位和演变。
