放射学孤立综合征4例临床分析
2023-06-06李敏杜芳
李敏 杜芳
放射学孤立综合征(radiological isolated syndrome,RIS)是近年来神经免疫学领域的研究热点,头颅或脊髓磁共振存在多发T2高信号病灶,满足空间多发性(dissemination in space,DIS),影像强烈提示多发性硬化(multiple sclerosis,MS),但缺乏临床症状和体征,且不能用其他疾病明确解释,定义为RIS[1-2]。从2009年RIS首次被提出[1],到2017年MS国际诊断小组制定RIS改良Mcdonald诊断标准[2],RIS的研究取得长足进展,但国内文献目前对该疾病的研究报道很少。现报道作者医院2021年10月至2022年9月收治的4例RIS患者,以提高临床医生对该病的认识。本研究为回顾性系列病例研究,所有患者均签署知情同意书。
1 临床资料
病例1:患者男,14岁。2021年11月因头痛就诊,行头颅MRI检查显示双侧脑室旁脱髓鞘改变,增强扫描未见病灶强化(图1),自身抗体系列、抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibodies,ANCA)、抗磷脂抗体、头颅磁共振血管成像(magnetic resonance angiography,MRA)、经颅多普勒超声(transcranial doppler sonography,TCD)发泡试验、视觉诱发电位(visualevoked potential,VEP)、脑干听觉诱发电位(brainstem auditory evoked potential,BAEP)、体感诱发电位(somatosensory evoked potential,SEP)检查均未见明显异常,查体无神经系统阳性体征,未行腰穿检查。给予止痛对症处理后头痛缓解,建议观察并定期复诊。2022年8月1日,患者晨起出现头晕、复视、右侧肢体麻木无力,症状逐渐加重,第2天达高峰,右上肢持物不稳,行走时右下肢拖曳。头颅MRI检查提示左侧脑桥下段新发病灶(图1H),以“脑白质脱髓鞘”收入院。既往史、个人史、家族史无特殊。入院查体:水平左相眼震,右侧肢体肌力4级,双下肢腱反射对称活跃,右下肢病理征阳性,余查体(高级智能、脑神经、感觉系统、脑膜刺激征、自主神经)均未见异常。入院后行头颅MRI增强扫描未见颅内病灶强化,颈椎+胸椎MRI检查未见异常。风湿三项、免疫五项、淋巴细胞亚群、免疫球蛋白等免疫筛查均未见异常;甲状腺功能检查正常。腰穿脑脊液(CSF)细胞学、生化、免疫检测结果均正常,血+CSF水通道蛋白4(aquaporin 4,AQP4)抗体、髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体均阴性,未见CSF寡克隆带(CSF oligoclonal band,CSF-OB),免疫球蛋白 G(immunoglobulin G,IgG)指数正常。诊断为MS。给予甲强龙1 g冲击5 d后改为口服泼尼松片60 mg/d,甲强龙冲击后序贯利妥昔单抗200 mg 静脉泵入,治疗后患者症状基本恢复,遗留右下肢病理征阳性。

注:A、B:皮层下病灶,累及U型纤维(箭头所示);C、D、E、F:深部白质病灶,呈圆形、卵圆形,垂直于侧脑室并与侧脑室相连(箭头所示);G:脑桥下段未见病灶;H:脑桥下段偏左侧新发病灶(箭头所示)
病例2:患者女,33岁。2022年2月因产后抑郁(表现为情绪低落、夜眠差)就诊当地医院,行头颅MRI检查提示双侧侧脑室周围多发脑白质脱髓鞘改变,弥散加权成像(diffusion weighted imaging,DWI)未见弥散受限,考虑脱髓鞘疾病。为求进一步诊治,遂就诊作者医院。既往史、个人史、家族史无特殊。神经系统查体未见明显异常。头颅MRI检查:双侧脑室旁及半卵圆中心多发脱髓鞘改变,病变垂直于脑室分布,符合MS影像学特点(图2)。头颅MRA+颈胸椎MRI检查未见明显异常。头颅MRI增强未见病灶强化,头颅SWI检查可见病灶内中心静脉征(central vein signs,CVS)(图2)。TCD发泡试验阴性,SEP、BAEP、VEP检测正常。视力、视野、眼底检查结果正常,光学相干断层成像(optical coherence tomography,OCT)未查。腰穿CSF检查:颅压正常,白细胞计数2×103/mL,淋巴细胞93%,单核细胞7%,CSF生化、免疫均正常。血及CSF AQP4、MOG、GFAP抗体阴性,CSF-OB阴性。简易精神状态检查量表(mini-mental state examination,MMSE)30分,汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)13分,汉密尔顿抑郁量表(Hamilton depression scale,HAMD)13分。自身抗体系列检测显示抗核抗体(anti-nucleic antibody,ANA)阳性(1∶100);抗磷脂抗体、ANCA、红细胞沉降率、C反应蛋白、风湿系列、免疫球蛋白系列、补体系列、淋巴细胞亚群、甲状腺抗体检测结果均大致正常。甲状腺功能检测显示促甲状腺激素5.1 uIU/mL(参考值:0.27~4.2 uIU/mL)。性激素十项检测结果正常。诊断RIS。经患者知情同意后给予利妥昔单抗200 mg静脉泵入。3个月后随访,患者病情稳定。

注:A:皮层下线性病灶,累及U型纤维(圆圈所示),深部白质病灶垂直于侧脑室,与脑室相连(箭头所示);B:基底节区卵圆形病灶(箭头所示);C:垂直于侧脑室的线样病灶与侧脑室相连,呈“Dawson手指征”(箭头所示),顶叶皮层下病灶累及U型纤维(圆圈所示);D:右侧脑室后角旁卵圆形病灶,呈中心静脉征(CVS;圆圈所示);E:为D图圆圈部位放大图,箭头所示为CVS;F:CVS病灶(圆圈及方框所示);G:为F图圆圈区域放大图,箭头所示为CVS,中心静脉呈线样(箭头所示);H:为F图方框区域放大图,箭头所示为CVS,中心静脉呈点状(箭头所示)
病例3:患者女,60岁。2022年5月中旬因“疲乏半年”就诊作者医院。患者情绪及睡眠稳定,查体无神经系统阳性体征。行头颅MRI提示双侧基底节区及半卵圆中心多发脱髓鞘改变。既往高血压史3年,血压控制良好。查体未见明显阳性体征。入院后行头颅SWI检查可见CVS(图3),头颅MRI增强+头颅MRA检查均未见明显异常,颈胸椎MRI未见髓内异常信号,TCD及TCD发泡试验未见明显异常。颈部动脉超声提示:无名动脉、双侧颈总动脉内-中膜局限性增厚。血脂正常。HAMA、HAMD、焦虑自评量表(self-rating anxiety scale,SAS)、抑郁自评量表(self-rating depression scale,SDS)、MMSE检测均正常。自身抗体等免疫相关筛查未见异常。患者拒绝腰穿检查。诊断RIS。未行疾病修正治疗(DMT),建议观察病情。3个月后随访患者,颅内病灶无明显变化。
病例4:患者男,42岁。2022年6月底因“体检时发现颅内多发病灶”收住入院。患者无特殊症状,睡眠可,情绪稳定。既往高血压史2年,规律口服降压药,血压控制良好。神经系统查体未见阳性体征。入院后行头颅MRI平扫+Flair+3D-双反转恢复序列(double inversion recovery,DIR)序列检查显示颅内多发脱髓鞘改变(图4),头颅MRI增强、头颅MRA及颈胸椎MRI检查均未见明显异常。TCD及TCD发泡试验未见异常。颈部动脉超声大致正常。SEP、VEP、BAEP均正常。视力、视野、眼底、OCT检查正常。HAMA、HAMD评分正常。腰穿CSF细胞学、生化、免疫检测正常,血及CSF AQP4、MOG、GFAP抗体均阴性,CSF-OB阴性,CSF IgG指数正常。血脂及血生化正常。自身抗体等免疫筛查均大致异常。诊断RIS。未行DMT,建议密切观察病情并定期随访。出院3个月后随访临床无新发症状,未复查影像学。
2 讨论
2017年改良Mcdonald诊断标准要求,诊断RIS必须满足:在以下4个区域(皮层/近皮层、脑室周围白质、小脑幕下、脊髓)中至少2个区域存在≥1个T2高信号病灶,排除基于既往症状或客观体征提示MS的神经功能障碍,且MRI的异常不能由其他疾病解释(尤其是考虑到年龄、血管、毒物或药物相关的因素)[2]。RIS是排他性诊断,详细的病史询问和严格的体格检查对查找MS临床发作的证据是必要的。
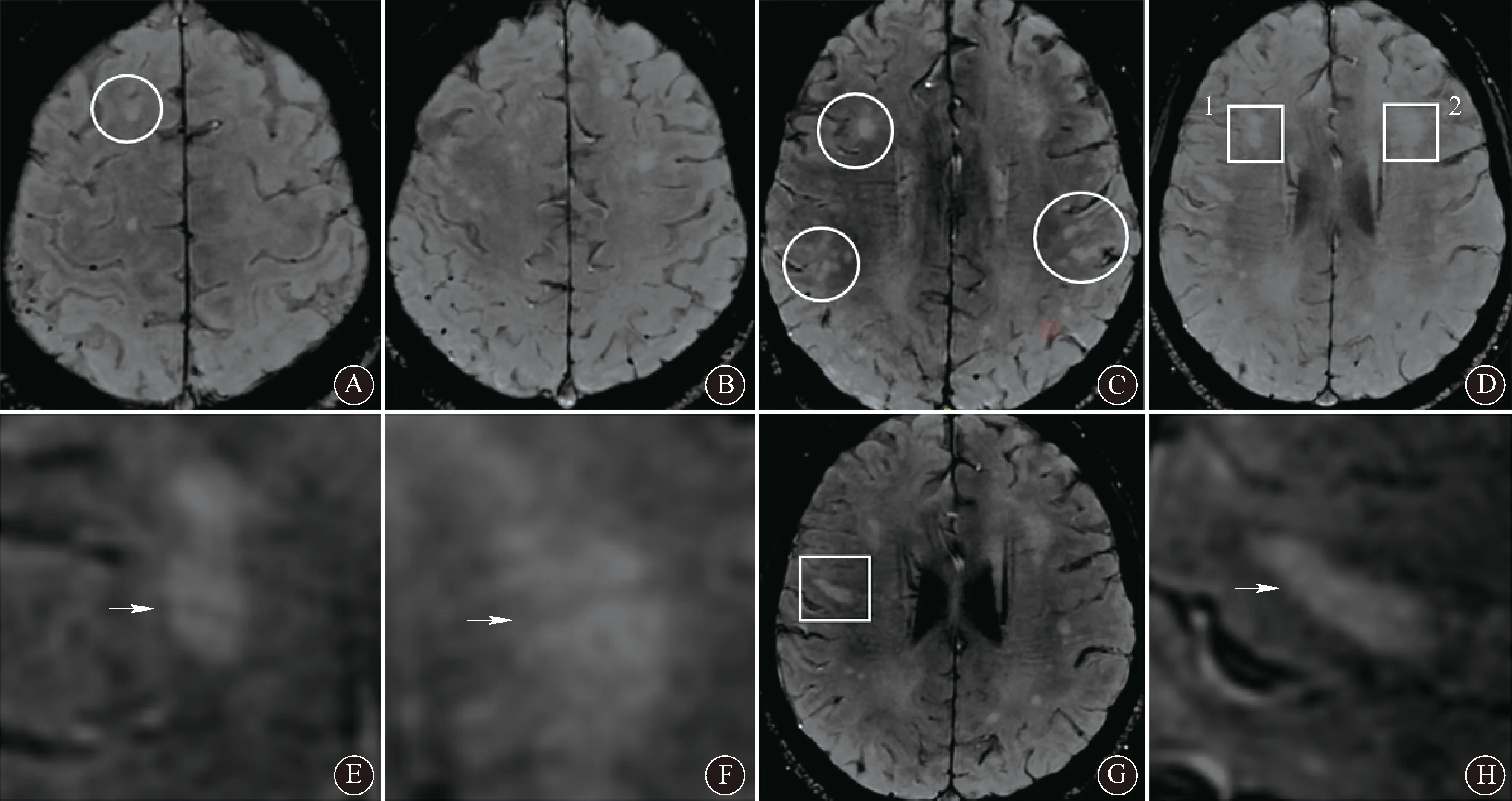
注:A:皮层下圆形病灶,累及U型纤维(圆圈所示);B:皮层下多发圆形病灶,部分累及U型纤维;C:皮层下及白质多发线形、圆形病灶,部分累及U型纤维(圆圈所示);D:双侧脑室旁病灶,呈中心静脉征(CVS;方框区域所示);E:为D图1号方框区域放大图,可见CVS(箭头所示);F:为D图2号方框区域放大图,可见CVS(箭头所示);G:额叶皮层下线样病灶,可见CVS(方框区域所示);H:为G图方框区域放大图,可见CVS(箭头所示)

注:A:皮质下圆形病灶,累及U型纤维(圆圈所示);B、C:脑室旁线样、圆形、卵圆形病灶,垂直于侧脑室(椭圆所示);D:左侧桥臂卵圆形病灶(幕下)(圆圈所示);E:皮质下圆形病灶,累及U型纤维(箭头所示);F、G、H:垂直于侧脑室线样、圆形、卵圆形病灶,并与侧脑室相连(箭头所示)
RIS需要与所有可能被误诊为MS的MRI异常进行鉴别,尤其是脑小血管病。从病灶分布来看,脑小血管病多表现为深部脑白质损伤,常合并腔隙性脑梗死或脑微出血,因脑近皮层部位血供丰富,故早期不累及U型纤维[3-4];而RIS的皮层/近皮层病灶早期多累及U型纤维[4]。从病灶形态来看,典型RIS脑室旁病灶分布于深髓静脉周围,垂直于侧脑室并与侧脑室相连,呈圆形、卵圆形或线性,部分呈“Dawson手指征”[4];而脑小血管病白质病变多融合后成片,边界不清,部分患者呈典型的“脑室额角帽征”[3-4]。从是否存在钆强化来看,脑小血管病不强化,而部分RIS可能存在2~8周的短暂强化(一般小于4周)[4-5]。从功能影像学来看,CVS是MS中反映静脉周围脱髓鞘的影像学标志物,CVS对于RIS诊断以及与其他脑白质病(包括脑小血管病白质病变)的鉴别,均有肯定价值[6-7]。在MRI序列选择上,显示白质病灶的优势序列除了Flair和T2-快速自旋回波(fast spin echo,FSE)外,还包括DIR。此外,DIR还可以提高皮质和深部灰质病变的检出率,而T2梯度回波序列和SWI序列可明确CVS。
依据RIS诊断标准,本研究4例患者首诊均符合RIS诊断:病灶累及区域≥2个,无特异性神经功能缺损症状及体征,且不能用其他疾病解释MRI异常。4例患者中,病例1、2为中青年,无脑血管病高危因素,且存在典型RIS影像学表现,无神经系统症状和体征,诊断RIS明确。病例3为老年女性,有3年高血压史,需与脑小血管病白质病变鉴别,但患者影像学改变无法用脑小血管病白质病变解释,更符合RIS特征,如病灶多呈圆形、卵圆形或线性,边界相对清晰,累及U型纤维,脑室旁白质沿深髓静脉分布,且存在CVS。病例4为中年男性,除2年高血压史外,无其他脑小血管病高危因素,结合患者影像学特征,病灶累及皮层下U型纤维、深部白质(与脑室相连)以及幕下桥臂,病灶形态(尤其是典型Dawson手指征)符合RIS影像学特征,最终诊断为RIS。除病例4为体检时发现病灶外,余3例患者均有非特异性症状,如头痛、产后抑郁和疲乏感。一般认为RIS不存在临床症状,但头痛、轻微认知损伤和焦虑抑郁等精神症状比例较高[1,8-10]。因临床症状难以被精准识别,RIS的诊断和鉴别诊断大多依据影像学。
功能磁共振研究支持RIS存在早期中枢神经退行性变,尤其是在大部分RIS患者影像研究中发现了CVS和铁环征(paramagnetic rim lesions,PRL),证实RIS并非简单的亚临床影像改变[6-7]。PRL是MS的新兴影像学标记物,反映了小静脉周围慢性阴燃病灶(smouldering lesions,SELs),SELs边缘聚集巨噬细胞和活化的小胶质细胞,活化的小胶质细胞吞噬铁,在磁共振T2梯度回波加权序列表现为PRL,提示炎症病灶的慢性活动性进展[7,11]。RIS患者脑或脊髓损伤范围有时比MS患者更大,却并未出现临床症状,造成了所谓的“临床静默”,推测RIS患者可能具有更强的神经修复能力和/或承受脱髓鞘损害的能力,但具体发生机制尚未阐明[12]。
RIS究竟是一种疾病实体,还是MS的前驱期,是目前临床面临的困惑和挑战。Tremlett等[13]认为没有证据否认RIS患者是MS的前驱期,但更多学者认为,除非RIS的前瞻性研究提供更多疾病信息,否则RIS不应认为是MS的独特表型[14-16]。基于人群的RIS发病率数据很少,瑞典RIS的发病率仅为0.8/万,远低于MS的发病率[17]。RIS存在向MS临床转化的风险,研究表明,2年、5年、10年内RIS向MS的临床转化率分别为13.8%、34%、51.2%[18-20]。对于RIS,尤其是临床转化风险较高者,应该观察随访还是积极治疗,目前临床上仍有争议。早期识别RIS向MS临床转化的高风险因素具有重要临床意义。4项纳入病例数较多(>300例)的回顾性临床研究发现,低龄(<37岁)、男性、脊髓病灶、钆增强病灶、CSF-OB(+)、幕下病灶可能是RIS临床转化为MS的高风险因素[18-21]。一项10年随访研究证实,年龄<37岁、CSF-OB(+)、幕下病灶、脊髓病灶作为RIS临床转化危险因素,至少有1个危险因素的RIS患者临床转化的概率为29%,有2个、3个、4个危险因素者转化概率分别为54%、68%、87%[20]。Makhani等[22]发现儿童RIS更易进展和复发。妊娠期RIS临床转化的概率更高,平均转化时间缩短[23],而针对MS的研究则认为,妊娠是MS的保护性因素[24]。
尽管RIS患者在临床症状出现前应用DMT药物缺乏科学数据支持,但已有患者于症状出现前接受DMT治疗的研究报道。RIS联盟(radiologically isolated syndrome consortium,RISC)一项回顾性研究纳入451例RIS患者,其中73例(16.2%)接受DMT治疗,早于首次临床发作,平均治疗持续时间为3.2年,治疗药物包括干扰素、醋酸格拉默、芬戈莫德和纳他珠单抗,少数RIS患者接受了1种以上DMT药物治疗,结果显示,接受DMT的RIS受试者5年内发生临床转化的风险为45%,而未接受DMT者为31%,并未显示DMT可使患者获益[19]。因治疗决策由接诊医师与RIS患者共同决定,决策过程并不透明,不除外选择偏倚[19]。Alshamrani等[15]认为,经仔细甄选的高风险患者,DMT治疗可能改善长期预后,但需要告知患者接受DMT治疗的风险,即在不符合MS诊断的情况下行DMT的疗效还未被充分证实。本文病例1为青少年男性,1年内出现临床转化,进展为MS后行DMT;病例2为妊娠后青年女性,影像学符合典型MS特征,脑室旁病灶负荷较大,考虑存在一定的临床转化风险,征得患者同意后,给予DMT;病例3、4因年龄大、临床转化高危因素少,未行DMT,建议随访观察。
RIS概念已提出10余年,目前仍无具体的、普遍采用的指南用于临床管理。神经免疫学专家提出分层管理的理念[25],按RIS临床转化风险的高低进行分层管理,制定风险分级系统,有助于患者个体化治疗方案的制定。MAGNIMS研究小组提出[25]:临床推荐对患者进行持续的临床和影像学评估RIS结构和功能损伤,建议定期(每6~12个月)对患者进行临床及影像学随访,动态监测可能处于MS前驱期的RIS患者;RIS患者具有知情权,在首次诊断RIS后,有必要让患者决定是否想要进一步随访。
RIS的诊断对于MS专家也存在挑战,RIS宽松的诊断标准,容易造成过度诊断。基于对RIS过度诊断、DMT昂贵价格和DMT潜在副作用等方面的过度担忧,在RIS患者中超适应证应用DMT并未获得专家广泛认可[26]。目前RIS诊疗及管理存在困境,亟待颁布专家共识或治疗指南以利于规范治疗。
综上所述,RIS缺乏特异性临床症状和体征,颅内病灶符合空间多发性,部分患者可进展为MS,经严格评估后高风险RIS可考虑行DMT治疗。本文研究不足:样本量少,随访时间短,缺乏脊髓受累的RIS,部分临床资料欠缺。
