酒炙广地龙的炮制工艺优选及HPLC特征图谱分析
2023-06-06关水清周改莲钱力文建军王乃斌谢雪婷
关水清 周改莲 钱力 文建军 王乃斌 谢雪婷

【摘 要】 目的:探讨酒炙广地龙的最佳炮制工艺,建立其HPLC特征图谱。方法:采用正交试验,以次黄嘌呤、肌苷、蛋白质及水溶性浸出物含量为评价指标,优选酒炙广地龙的炮制工艺;再按最优炮制工艺制备酒炙广地龙样品,建立其特征图谱。结果:酒炙广地龙饮片炮制过程中,4个因素影响程度依次为:炒制温度>闷润时间>炒制时间>加酒量,最佳炮制工艺为加酒量每100 kg广地龙,黄酒量为15 kg,闷润时间30 min,炒制温度80 ℃及炒制时间10 min。建立以SETSAIL II AQ-C18柱,流动相甲醇(A)-5 mmol/L磷酸二氢钾溶液(B)梯度洗脱的指纹图谱检测方法,15批酒炙广地龙确定了17个共有峰,指认了次黄嘌呤、尿苷、 肌苷、尿嘧啶4个共有峰,相似度为0.974~0.999。结论:次黄嘌呤、肌苷、蛋白质及水溶性浸出物含量4个指标可作为广地龙饮片酒炙炮制过程中的质量评价指标,中试验证评判所得最优炮制工艺合理可行;建立的HPLC特征图谱方法准确可靠,为酒炙广地龙的质量控制和现代研究提供了科学依据。
【关键词】 广地龙;酒炙;多指标评价;正交试验;炮制工艺
【中图分类号】R283.3 【文獻标志码】 A 【文章编号】1007-8517(2023)09-0029-07
Abstract:Objective Investigate the best processing technology of Pheretima aspergillum (E. Perrier) Processed with rice wine, and establish its HPLC characteristic chromatogram. Methods Orthogonal test was adopted, and the contents of hypoxanthine, inosine, protein and water-soluble extract were used as evaluation indicators, and the processing technology of Pheretima aspergillum (E. Perrier) Processed with rice wine was optimized; Then prepare 15 batches of Pheretima aspergillum (E. Perrier) Processed with rice wine according to the optimal processing technology, and Build its characteristic map.Results In the process of processing Pheretima aspergillum (E. Perrier) Processed with rice wine decoction pieces, the order of influence of four factors is: frying temperature>simmering time>frying time>amount of wine added.The best processing technology is that the amount of wine added is 100kg of Pheretima aspergillum (E.Perrier), and the amount of yellow wine is 15 kg,the moisturizing time is 30 min, the frying temperature is 80 ℃ and the frying time is 10min.A fingerprint detection method using SETSAIL II AQ-C18 column and mobile phase methanol (A)-5mmol/L potassium dihydrogen phosphate solution (B) gradient elution was established. 17 common peaks were identified in 15 batches of Pheretima aspergillum (E. Perrier) Processed with rice wine. Four common peaks of hypoxanthine, uridine, inosine, and uracil were identified, and the similarity ranged from 0.974 to 0.999.Conclusion The four indexes of hypoxanthine, inosine, protein and water-soluble extract content can be used as quality evaluation indexes in the process of wine processing of Pheretima aspergillum (E.Perrier) Processed with rice wine decoction pieces,The pilot test proves that the optimal processing technology obtained is reasonable and feasible; the established HPLC characteristic chromatogram The method is accurate and reliable, and provides a scientific basis for the quality control and modern research of Pheretima aspergillum (E. Perrier) Processed with rice wine.
Keywords:Pheretima Aspergillum(E.Perrier);Wine Roasting;Multi-index Evaluation; Orthogonal Test; Processing Technology
广地龙为钜蚓科动物参环毛蚓Pheretima aspergillum(E.Perrier)的干燥体[1],具有清热定惊、通络、平喘、利尿的功效[1]。历代记载诸多炮制方法[2-5],如蛤粉制、酒制、滑石粉炒制、砂炒法等[2-5],随时代变迁今多以生品、酒制品为主[6-10],中医认为“药材经酒炙后能引药上行,能增强其活血止痛”的作用[9-10]。
2020年版《中国药典》中未收载酒炙广地龙,饮片炮制仅描述“除去杂质,洗净,切段,干燥”,未见具体炮制参数、质量控制无指纹图谱等内容[1]。当前市场销售的广地龙质量的良莠不齐[11-16],全国的地方炮制规范方法混杂不一,对其缺少相应的符合现代标准化、产业化的质量标准,如依赖工人经验来决定辅料的用量、加工时间和炒制温度,缺乏生产规范和技-术标准,质量不稳定且不可控,不利于现代企业传承和规模化加工生产。现今对酒炙品的工艺研究较多,但多以地龙中(次黄嘌呤、肌苷、蛋白质、水溶性浸出物)单个或两个为指标优选工艺,未发现将这4种指标同时纳入工艺评价,缺乏整体性评价优化工艺[7-10];已有学者[17-19]建立地龙指纹图谱对其质量控制提供参考,但鲜有报道酒炙广地龙的指纹图谱。
本研究建立了酒炙广地龙的HPLC指纹图谱,采用正交试验对次黄嘌呤、肌苷、蛋白质、水溶性浸出物4种指标综合考察,综合评价优选酒炙广地龙的炮制工艺,并借助药企进行炮制工艺验证,旨在为酒炙广地龙质量控制和现代研究提供科学依据。
1 仪器与材料
1.1 仪器 高效液相色谱仪,美国安捷伦1200,美国安捷伦1260;UV检测器-1780[岛津仪器(苏州)有限公司];FeiniGen AQ- C18色谱柱(菲尼根有限公司),SETSAIL II AQ- C18色谱柱(赣州科飞仪器有限公司);CTDC640型智能炒药机;电子分析天平SQP型[赛多利斯科学仪器(北京)有限公司];KQ5200B型超声波清洗仪(昆山市超声仪器有限公司)、TGL-16G离心机(上海安亭科学仪器厂)、CW2002-Z红外炉(艾美特电器有限公司)、HWS-26型电热恒温水浴锅(上海齐欣科学仪器有限公司)、SHB-B95型循环水式多用真空泵(郑州长城科工贸有限公司)、DHG-9140A型电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司)、DFT-200型手提式高速粉碎机(温岭市大机械有限公司)。
1.2 材料 生广地龙:广地龙药材采自广西、广东的15个产地,经暨南大学马志国教授、广西中医药大学周改莲副教授鉴定为钜蚓科动物参环毛蚓Pheretima aspergillum(E.Perrier )的干燥体,具体见表1。酒炙广地龙:按每100g药材加入15g黄酒,拌匀,闷润30min,80℃炒制获得。广地龙及酒炙广地龙的粉末制备:将药材切片、打粉,打过60目筛,即可。
对照品次黄嘌呤(批号:wkq19021804)、肌苷(批号:wkq19012205 )、尿苷(批号:wkq17100902)、鸟苷(批号:wkq17092012),质量分数均≥98%,均购自四川维克奇生物科技有限公司;对照品考马斯亮蓝G250(批号:20190117)、牛血清白蛋白BSA(批号:20190117),均购自南京建成生物工程研究所。
甲醇(色谱纯,Fesher公司)、黄酒(浙江古越龙山绍兴酒股份有限公司)、浓盐酸(批号:20151288,廉江市爱廉化试剂有限公司)、磷酸(批号:20190108,成都金山化学试剂有限公司)、乙醇(批号:2018020201,成都市科隆化学品有限公司)。
2 方法与结果
2.1 酒炙广地龙的制备 按2020年版《中国药典》酒炙法(通则0213)方法进行。
2.2 广地龙中次黄嘌呤和肌苷的含量测定
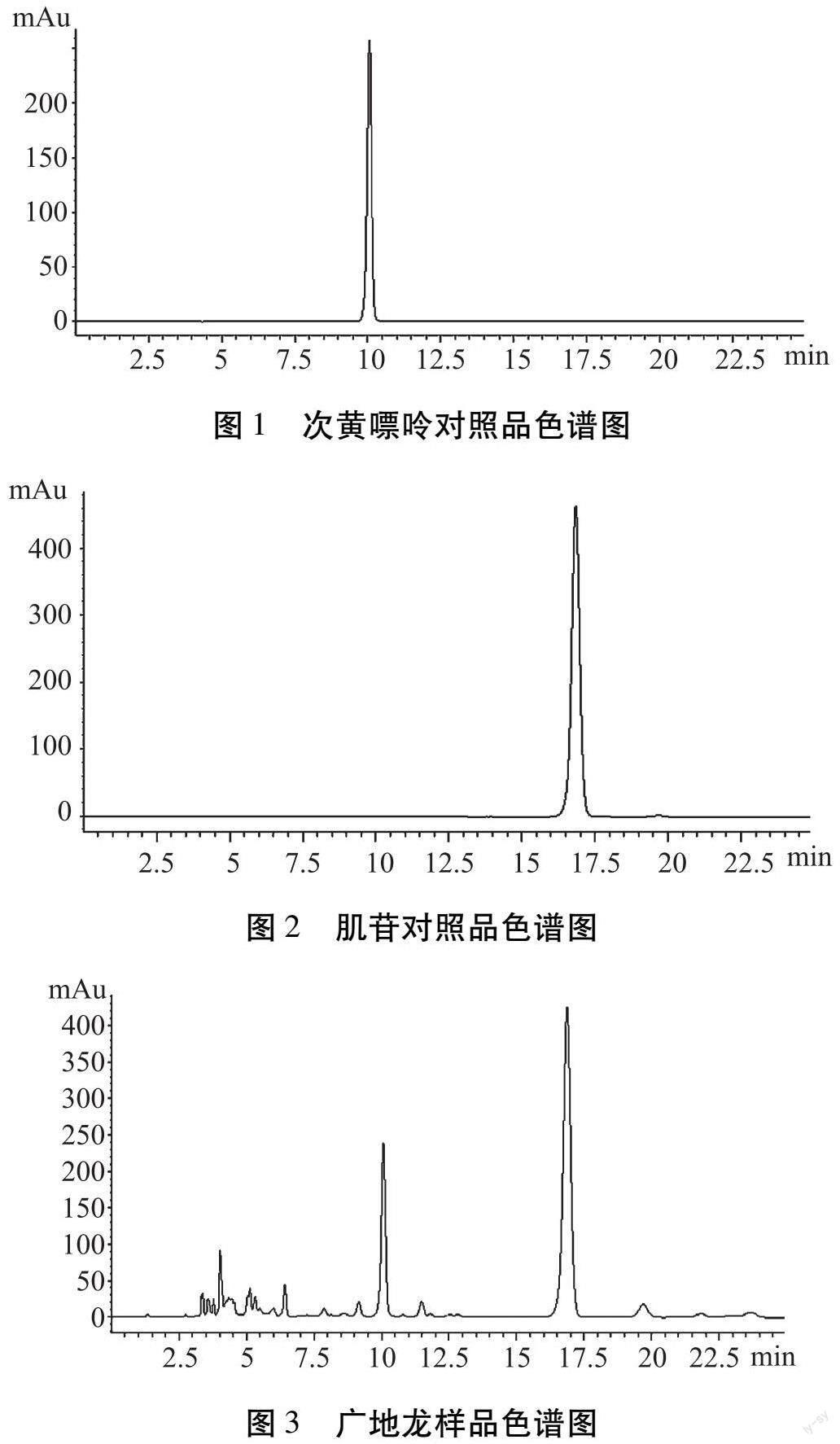
2.2.1 色谱条件 色谱柱:FeiniGen AQ-C18柱(250 nm×4.6 nm,5 μm);流动相:甲醇-水(5∶95);检测波长:250 nm;流速:0.8 mL/min;柱温:25 ℃;进样体积:10 μL;检测时间:25 min。按上述色谱条件进行检测,广地龙中各成分分离度良好,次黄嘌呤及肌苷对照品、供试品色谱图分别如图1~3所示。
2.2.2 溶液的制备 对照品溶液的配置:精密称取次黄嘌呤2.56 mg和肌苷10.19 mg,分别置于10 mL容量瓶中,加入适量纯水,超声溶解,加纯水定容至刻度,即得。
供试品溶液的制备:取经粉碎过筛的广地龙粉末,精密称定1 g,置于25 mL具塞锥形瓶中,加10 mL纯水,摇匀,称重,静置30 min后,超声1 h,用纯水补足失重,摇匀倒入10 mL离心管中,然后以13000 r/min,常温离心15 min,精密取上清液2 mL,过0.45 μm微孔滤膜,即得。
2.2.3 线性關系考察 分别吸取次黄嘌呤标准品备用溶液0.05 mL、0.10 mL、0.40 mL、0.60 mL、0.90 mL、1.20 mL、1.40 mL,分别置2 mL容量瓶中,各自加超纯水定容摇匀,配成7个次黄嘌呤浓度溶液;再分别吸取肌苷标准品备用溶液0.10 mL、0.20 mL、0.40 mL、0.60 mL、0.80 mL、1.00 mL,分别置2 mL容量瓶中,各自加超纯水定容摇匀,配成6个肌苷浓度溶液,按上述“2.1.1”色谱条件检测,以次黄嘌呤、肌苷的峰面积为纵坐标(Y),相应标准品的浓度为横坐标(X)绘制标准曲线图,获得线性回归方程。得回归方程:次黄嘌呤Y=55198X-17.363,r = 0.9999;肌苷Y=29396X+184.42,r=0.9996;表明次黄嘌呤浓度在0.0064~0.1792 mg/mL与肌苷浓度在0.0510~0.5095 mg/mL范围内,两种对照品的进样浓度与峰面积均呈良好的线性关系。
2.2.4 方法学考察 精密移取“2.2.2”项下的对照品备用溶液适量,稀释次黄嘌呤浓度为0.0512 mg/mL,肌苷浓度为0.3057 mg/mL,按“2.2.1”项下色谱条件各测定6次,获得次黄嘌呤平均峰面积为2829.9(RSD=0.05%),肌苷平均峰面积为9222.0(RSD=0.08%),表明检测的仪器精密度良好;取同一批广地龙供试品溶液6份,进样测定,计算得到次黄嘌呤含量的RSD为1.10%,肌苷含量的RSD为0.30%,表明该方法重复性良好;取同一广地龙供试品溶液,分别在0 h、2 h、4 h、6 h、8 h、10 h、12 h进样测定,计算得到次黄嘌呤峰面积的RSD为2.80%,肌苷峰面积的RSD为1.20%,结果表明供试品溶液12 h内检测稳定;取已知含量的广地龙粉末6份,精密称定,分别加入“2.2.2”项下的标准品备用溶液(0.09 mL次黄嘌呤溶液和0.3 mL肌苷溶液),按“2.2.2”项下供试品制备方法提取样品,经测定得到次黄嘌呤平均回收率为99.66%(RSD=0.10%),肌苷平均回收率为100.20%(RSD=1.10%),表明测定方法满足实验要求。
2.3 广地龙中蛋白质的含量测定
2.3.1 蛋白质标准溶液的制备 从4 ℃冰箱中取出储存的牛血清白蛋白,精密称定1 g,移至25 mL烧杯,加入适量纯水充分溶解,移至100 mL洁净容量瓶中,定容至刻度线,得到1.001g/mL的蛋白质标准溶液,放4 ℃冰箱中存储备用。
2.3.2 考马斯亮蓝溶液的制备 取考马斯亮蓝G-250,精密称定100 mg,移至100 mL烧杯中,精确量取50.0 mL 95.0%乙醇溶液充分溶解,加入100.0 mL 85.0%磷酸溶液混匀,转移至1000 mL容量瓶进行定容,摇匀后滤过,放4 ℃冰箱存储备用。
2.3.3 样品溶液的制备 取广地龙粗粉约0.5 g,精密称定。置25 mL锥形瓶中,移入纯水(10 mL)浸泡30 min后,超声30 min,摇匀倒入10 mL离心管中,然后以4200 r/min,常温离心10 min,精密取1 mL广地龙上清液,于10 mL容量瓶中,经过定容,放于4 ℃冰箱中存储备用。
2.3.4 最大吸收波长的确定 精密量取“2.3.1”项下的蛋白质标准溶液及“2.3.3”项下的样品溶液各0.5 mL,转移到10mL具塞试管中,然后精密量取“2.3.2”项下的考马斯亮蓝溶液5.0 mL,摇匀,再静置5 min,空白溶液同法制备。分别用紫外可见分光光度计在400~900 nm范围进行全波长扫描,发现在595 nm处两者均有最大吸收峰,选取595 nm作为最大吸收波长。
2.3.5 线性关系考察 分别精确移取“2.3.1”项下蛋白质标准溶液适量,依次稀释为0.02 mg/mL、0.04 mg/mL、0.07 mg/mL、0.11 mg/mL、0.14 mg/mL,按“2.3.4”项下方法操作和分析,以蛋白浓度作为横坐标X,吸光度值作为纵坐标Y,得到回归方程为Y=3.2149X+0.0458(r=0.9990),即浓度在0.02~0.14 mg/mL范围内,蛋白质浓度与吸光度呈现良好线性关系。
2.3.6 方法学考察 精密取0.5 mL“2.3.1”项下蛋白质标准溶液,转移到10 mL具塞试管中,按“2.3.4”项下蛋白质显色测定方法检测6次,平均吸光度为0.3725(RSD=0.18%),表明仪器精密度良好;取0.5 mL已制备好的广地龙供试品溶液,转移到10 mL具塞试管中,分别在0 h、0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h,按“2.3.4”项下蛋白质显色测定方法,吸光度值的RSD为2.73%,表明广地龙溶液3.5h内稳定性良好;取同一批广地龙供试品溶液6份,按“2.3.3”项下供试品制备方法,按“2.3.4”项下蛋白质显色测定方法,测定广地龙生品蛋白质平均含量为19.53 mg/g(RSD=1.30%),表明该方法重复性较好;取已知含量的广地龙粉末6份,加入蛋白质标准溶液适量,按“2.3.3”项下供试品方法制备,按“2.3.4”项下蛋白质显色测定方法,经测定平均回收率为97.85%(RSD=1.42%),表明上述方法回收率较好。
2.4 水溶性浸出物含量测定 照水溶性浸出物测定法(《中国药典》2020年版四部附录“2201”浸出物测定法)项下的热浸法测定。
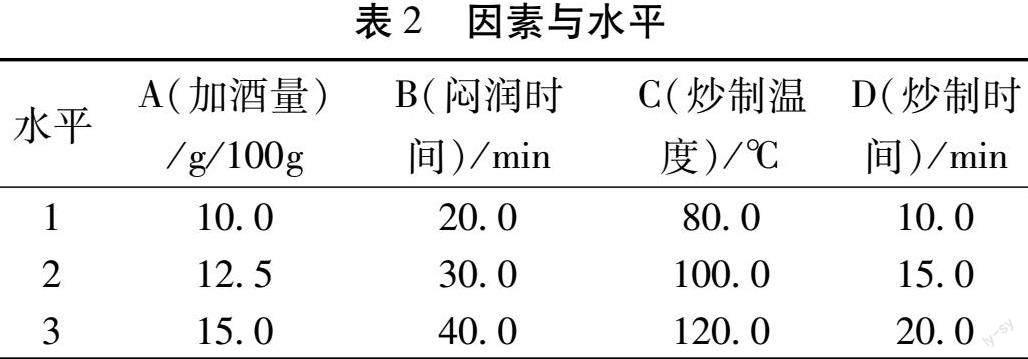
2.5 酒炙广地龙炮制工艺的优化 通过对地龙相关文献查阅及结合前期预实验结果,选择以加酒量(A)、闷润时间(B)、炒制温度(C)、炒制时间(D)为4个考察因素,以次黄嘌呤、肌苷、蛋白质及水溶性浸出物含量的综合评分为评价指标,优化酒炙广地龙的炮制工艺。依据其药理作用和研究进展[17-18]进行各个指标的权重分配,综合得分(Z)=次黄嘌呤得分×40%+肌苷得分×20%+蛋白质得分×20%+水溶性浸出物得分×20%,即指标得分=该指标含量/该指标所在组中最高含量。因素与水平见表2,结果见表3,方差分析见表4。
由表3可知,4个因素对工艺影响程度依次为C(炒制溫度)>B(闷润时间)>D(炒制时间)>A(加酒量),而各个因素不同水平的影响程度依次为C1>C2>C3、B2>B3>B1、D1>D3>D2、A3>A2>A1。由表4可知,4个因素对酒炙广地龙工艺测定指标的综合性评分没有显著性影响(P>0.05)。结合结果分析,最佳酒炙工艺应为:A3B2C1D1,即加入黄酒量为15%,密封好闷润30 min,放置于温度80 ℃炒制,炒制时间10 min。
2.6 中试验证 在酒炙广地龙小试的工艺基础上,课题组于广东康美药业股份有限公司普宁二期厂房生产车间进行中试,以最佳炒制时间对应的产品外观色泽和质地等作为把控指标,根据实际生产需求,取净广地龙10 kg,加入黄酒(每100 kg地龙,加入黄酒12.5 kg)拌匀,在密闭容器内闷润30 min,置智能电磁炒药机中,250 ℃加热,炒制一定程度时,取出,摊开,放凉。
将酒炙广地龙扩大到6批次进行生产,次黄嘌呤、肌苷、蛋白质及水溶性浸出物均相对稳定,见表5。查阅古今炮制书籍可知研究饮片的炮制工艺条件,保证其性状合格是最基本的,观察中试产品的外观表面色泽焦黄色,偶见焦斑,闻之具较浓酒香气,且各指标含量结果均符合企业生产要求,故评判该酒炙工艺合理。
2.7 酒炙广地龙的HPLC特征图谱分析
2.7.1 色谱条件 色谱柱:SETSAIL II AQ-C18色谱柱(250 mm×4.6 mm,5 μm);甲醇(A)-5 mmol/L磷酸二氢钾溶液(B);梯度洗脱(0~15 min,0%A;15~25 min,5%A;25~50 min,15%A);检测波长:254 nm;流速:0.6 mL·min-1;柱温:30 ℃;进样体积:10 μL;检测时间:50 min。
2.7.2 溶液的制备 对照品溶液制备:精密称取5种核苷类对照品,分别加纯水配制成浓度为0.1152 mg/L次黄嘌呤溶液、0.3057 mg/L肌苷溶液、0.0125 mg/L尿嘧啶溶液、0.013 mg/L尿苷溶液、0.0225 mg/L黄嘌呤溶液、0.018 mg/L鸟苷溶液。
供试品溶液制备:精密称取广地龙饮片粉末约1.0 g,放入8 mL纯水,静置20 min后,密塞并称重,超声40 min,待放冷至室温,补足失重,离心13000 r/min,时间15 min,过0.45 μm滤膜,即可。
2.7.3 方法学考察 取同一批广地龙供试品溶液,按“2.7.1”色谱条件连续重复进样6次,以次黄嘌呤为参照峰计算各共有峰相对保留峰面积,结果表明共有峰整体相似度在0.999~1.000之间,相对保留时间RSD﹤1%,表明仪器性能良好;取同一批广地龙饮片6份,按“2.7.2”方法制备溶液,按“2.7.1”色谱条件连续进样,结果表明共有峰的整体相似度为1.000,共有峰相对保留时间RSD﹤1%,表明方法重复性良好;取同一批广地龙供试品溶液,分别在0 h、2 h、4 h、6 h、8 h、10 h、12 h进样测定,以次黄嘌呤为参照峰,计算各共有峰相对保留时间,结果表明各共有峰的相对保留时间RSD﹤1%,表明本供试品在12h内检测数据稳定。
2.7.4 特征图谱的构建和解析
2.7.4.1 色谱峰的指认 取同一批广地龙供试品溶液,“2.7.2”项下5种对照品溶液,按“2.7.1”项色谱条件依次进样,记录HPLC色谱图。利用“中药色谱指纹图谱相似度评价系统(2012A版本)”分析,得到酒炙广地龙与对照品指纹图谱,如图4所示。确认酒炙广地龙指纹图谱中峰7为次黄嘌呤,峰9为尿苷,峰13为肌苷,峰14为尿嘧啶。
2.7.4.2 特征图谱的构建 将15批酒炙广地龙(J1~J15)供试品溶液,依次按“2.7.1”項色谱条件测定,记录HPLC色谱图。酒炙广地龙分别以J1色谱图为参照图谱,以时间宽度0.4 min、时间范围7~50 min,经处理得到酒炙广地龙指纹图谱共有峰17个。如图5所示。
2.7.4.3 特征图谱相似度分析 以J1样品的HPLC色谱图为参照图谱,以时间宽度0.4 min、时间范围7~50 min,利用“中药色谱指纹图谱相似度评价系统(2012A版本)”分析处理,15批酒炙广地龙指纹图谱共有峰整体相似度在0.974~0.999之间,结果表明酒炙广地龙饮片群体特征的一致性较高。
2.7.4.4 特征指纹图谱的制定 对15批酒炙广地龙饮片及次黄嘌呤等4种对照品的特征图谱的出峰时间比对,制定出酒炙广地龙饮片特征图谱。如图6所示。
3 讨论
蛋白质属于地龙干品中占比最大的主要成分之一[20-21],具有抗血栓、溶栓和舒缓平滑肌[22-25]等多方面的药理作用;以次黄嘌呤、肌苷为代表的核苷类成分,可作为广地龙药材质量评价的指标[14,17-19];水溶性浸出物作为地龙质量评价的重要指标[20,26-27],考虑以浸出物含量与特定活性成分含量组成的复合指标,可更好地控制饮片质量。因此,以酒炙广地龙中次黄嘌呤、肌苷、蛋白质和水溶性浸出物含量的综合评分为评价指标,重点考察了闷润时间、炒制温度、炒制时间、烘制温度等因素,筛选获得了酒炙广地龙的炮制工艺。随后课题组在中药饮片企业生产车间进行中试验证该酒炙炮制工艺合理性。
研究前期对流动相系统及色谱条件进行优选,建立了酒炙广地龙饮片的HPLC指纹图谱方法,制定酒炙广地龙的特征图谱。结果分析发现,15批不同产地酒炙广地龙饮片标定的共有色谱峰为17个,指认了次黄嘌呤、尿苷、 肌苷、尿嘧啶4个共有峰。比较15批不同产地的酒炙广地龙的色谱图后发现,虽然各批样品中成分的含量存在一定的差异,但色谱图概貌相对一致,整体分离度较好且稳定性强,特征图谱是其内在化学成分种类与数量的表里反映,可对酒炙广地龙饮片组分群体特征的相关性作出判断,能充分反映酒炙广地龙饮片的质量特征,为该饮片标准的制定和质量评价提供了新的依据。
参考文献
[1]中华人民共和国药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2020.
[2]谭玲龙,钟凌云.地龙的炮制研究进展[J].江西中医药,2017,48(10):75-77,80.
[3]黄庆,李志武,马志国,等.地龙的研究进展[J].中国实验方剂学杂志,2018,24(13):220-226.
[4]关水清,周改莲,周文良,等.地龙的本草考证及现代研究概况[J].中国实验方剂学杂志,2020,26(10):205-212.
[5]马存德,常晖,杨祎辰,等.经典名方中地龙的本草考证[J].中国实验方剂学杂志,2022,28(10):184-192.
[6]李焕平.正交试验优选酒炙广地龙炮制工艺[J].中医临床研究,2011,3(9):98-99.
[7]熊颂强,钟凌云,宋嬿,等.地龙的采收加工、炮制和质量标准的研究进展[J].江西中医药大学学报,2018,30(1):111-113.
[8]谭玲龙.地龙炮制工艺、药效及辅料研究[D].南昌:江西中医药大学,2019.
[9]熊颂强,谭玲龙,钟凌云,等.地龙酒制工艺优化及炮制前后成分比较[J].中成药,2019,41(12):2953-2957.
[10]刘晓梅,张存艳,刘红梅,等.基于电子鼻和HS-GC-MS研究地龙腥味物质基础和炮制矫味原理[J].中国实验方剂学杂志,2020,26(12):154-161.
[11]魏银贵,李建,程培秀.掺伪地龙的质量分析[J].中国中医药现代远程教育,2013,11(17):160-161.
[12]李鑫禹,索绪斌,张涵.地龙药物质量的研究现状及展望[J].黑龙江中医药,2014,43(5):70-72.
[13]季倩,张汉明,陈维荣,等.从地龙研究看如何破解中药资源与品质困局[J].世界科学技术-中医药现代化,2014,16(11):2308-2313.
[14]关水清,周改莲,董婧婧,等.HPLC同时测定广地龙中5种核苷类成分含量[J].广西师范大学学报(自然科学版),2020,38(3):85-91.
[15]谷仙,房慧勇,王乾,等.河北省蚯蚓养殖产业现状研究及发展对策分析[J].中药材,2021,44(12):2743-2746.
[16]陈林明,林晓坤,王智民,等.两广地区地龙中22种无机元素量变规律研究[J].中南药学,2021,19(12):2622-2627.
[17]黄帅,徐凤,杨平,等.地龙的HPLC特征图谱研究[J].中国药房,2015,26(21):2971-2974.
[18]谭玲龙,钟凌云,宋嬿,等.地龙炮制品HPLC指纹图谱的建立及5种成分测定[J].中成药,2018,40(10):2238-2243.
[19]孙洁,田芳,毛润乾,等.广地龙饮片的HPLC特征图谱及5个核苷类成分的测定[J].药物分析杂志,2019,39(11):2010-2019.
[20]贺葵邦,王英姿,张春泥,等.正交试验优选地龙水提取工艺[J].中国实验方剂学杂志,2013,19(6):33-35.
[21]李婷,杨骏,张彤.多指标综合评分法优选地龙水提纯化工艺[J].中国新药杂志,2016,25(19):2255-2261.
[22]王春玲.中药地龙的活性成分与药理作用研究[J].亚太传统医药,2015,11(7):53-54.
[23]黃敬文,宏伟,段剑飞.地龙的化学成分和药理作用研究进展[J].中医药报,2018,24(12):104-107.
[24]商烨,齐丽娜,金华,等.地龙化学成分及药理活性研究进展[J].药物评价研究,2022,45(5):989-996.
[25]李思维,郝二伟,杜正彩,等.广地龙化学成分和药理作用的研究进展及其质量标志物(Q-Marker)的预测分析[J].中草药,2022,53(8):2560-2571.
[26]王东,唐志书,李倩,等.地龙活性物质的提取及对创伤修复效应的研究进展[J].中药材,2021(8):2007-2011.
[27]李舒雨,杨启鑫,左安娜,等.鲜广地龙纯化蛋白的制备及其体外抗肺纤维化活性评价[J].南方医科大学学报,2022,42(4):618-625.
(收稿日期:2022-09-01 编辑:陶希睿)
基金项目:2022年度广西高校中青年教师科研基础能力提升项目 (2022KY0543);右江民族医学院2021年度校级科研课题项目(yy2021sk041)。
作者简介:关水清(1993—),女,汉族,硕士,助教,研究方向为中药质量标准及炮制机制研究。E-mail:554981031@qq.com
通信作者:周改莲(1981—),女,汉族,博士,副教授,研究方向为中药质量标准及炮制机制研究。E-mail:zhgllhw@126.com
