m6A调控非编码RNA在生殖泌尿系统肿瘤中的研究进展*
2023-06-04李张晖尚禹行吕巧怡王荟赵杨静邵启祥江苏大学医学院江苏镇江2203江苏护理职业学院江苏淮安223005
李张晖,尚禹行,吕巧怡,王荟,赵杨静,邵启祥,2(.江苏大学医学院,江苏镇江 2203;2.江苏护理职业学院,江苏淮安 223005)
近年来泌尿生殖系统肿瘤的发病率逐年攀升,已成为研究关注的热点问题。信使RNA(mRNA)内部修饰包括腺苷甲基化、胞嘧啶修饰和核糖修饰等,其中N-甲基腺苷(m6A)是真核mRNA中最常见的修饰[1]。m6A的修饰依赖于一系列酶,包括催化mRNA的m6A修饰的甲基转移酶即写入蛋白(Writers)、去除m6A修饰的去甲基化酶即擦除蛋白(Erasers)和识别m6A修饰位点m6A结合蛋白即阅读蛋白(Readers)[2]。它们在肿瘤发生、发展中各自发挥重要作用(图1)。

图1 m6A修饰相关分子组成示意图
非编码RNA(non-coding RNA,ncRNA)存在众多种类,且具有不同功能。目前研究最多的有微小RNA(microRNA,miRNA)、长链非编码RNA(long noncoding RNA,LncRNA)、环状RNA(circular RNA,circRNA)和PIWI相互作用RNA(PIWI-interacting RNA,piRNA)等[3]。既往m6A修饰的研究多集中在mRNA领域,而ncRNAs和mRNA均为转录后产物,存在相似的修饰方式。近年来的研究表明,m6A修饰调控ncRNA参与了个体发育,且在多种肿瘤进展中发挥重要作用。本文重点阐述了m6A修饰调控ncRNA在泌尿生殖系统肿瘤中的诊断价值,并简要概述应用于m6A甲基化检测的新技术及生物信息学统计方法。
1 女性生殖系统肿瘤
1.1宫颈癌(cervical cancer,CCA) 通常CCA的早期筛查有巴氏涂片(pap smear)与人乳头瘤病毒(human papilloma virus,HPV)检查。虽然HPV的感染被认为是CCA的主要致病因素,但许多研究发现HPV感染本身并不足以导致癌症,约60%的HPV感染在1年内自发消退,约90%在2年内消退[4]。截至目前,CCA的致病因素仍然不明确。
近年来,随着测序技术发展和表观遗传研究的深入,有研究发现在CCA中m6A修饰的甲基转移酶(METTL3)高表达增强了HK2mRNA的稳定性,加速糖酵解或有氧糖酵解(Warburg效应),从而促进CCA细胞的增殖。在此过程中,METTL3可招募m6A修饰中的阅读蛋白YTHDF1,增强转录本的稳定性,并协助METTL3与HK2mRNA结合[5]。m6A修饰通过调控ncRNA,影响下游靶基因或者信号通路,从而促进或抑制肿瘤的发生、发展。对于CCA中miR-193b表达下调的原因可能是METTL3改变了pri-miR-193b的m6A水平,影响了miR-193b的成熟过程[6]。METTL3通过结合m6A阅读蛋白和调控ncRNA两种途径调控CCA的发生、发展,有望成为CCA新的诊断标志物。
1.2子宫内膜癌(endometrial cancer,EC) EC最常见的症状是异常子宫内出血,宫腔镜下的活检仍然是诊断EC的“金标准”。近年来,EC的发生与甲基化研究多与DNA甲基化调控miRNA基因启动子密切相关,研究表明miR-192-5p启动子甲基化水平与FIGO分期呈显著正相关,而其启动子区域高甲基化会导致miR-192-5p沉默,并诱导ALX1(aristaless-like homeobox l)过表达,从而促进EC进展[7]。
最近研究发现m6A阅读蛋白YTHDF2在EC中的表达显著上调,YTHDF2与IRS1转录本P3 m6A修饰结合,抑制IRS1表达,从而抑制AKT/MMP9信号通路,进而降低EC细胞的侵袭和迁移能力[8]。在另一项研究中,Shen等[9]发现YTHDF2可调控LncRNA FENDRR在EC组织中的表达,其经RNA免疫沉淀(RNA immunoprecipitation,RIP) 试验与RNA pull down试验证实LncRNA FENDRR可被m6A阅读蛋白YTHDF2特异性识别,敲低YTHDF2有效降低了LncRNA FENDRR的降解,进而减缓了肿瘤细胞的增殖。综上,YTHDF2在EC中对AKT/MMP9信号通路和LncRNA FENDRR的调控有望成为EC治疗的新靶点。
1.3卵巢癌(ovarian cancer,OC) OC是女性生殖系统中第三大常见癌症,其早期诊断标志物匮乏,临床上多采用CA125和HE4联合检测,但特异性不高,寻找新的诊断标志物迫在眉睫。一项体外试验证明,沉默METTL3可上调miR-126-5p表达,并可通过抑制PTEN蛋白的表达,从而阻断PI3K/Akt/mTOR通路,减缓OC的进展[10]。Cui等[11]研究发现METTL3不仅影响了LncRNA RHPN1-AS1的稳定性,而且可上调LncRNA RHPN1-AS1的表达,增强其在顺铂耐药卵巢癌细胞中的m6A修饰水平。在卵巢癌中,将METTL3作为诊断标志物或可提高诊断特异性。
2 男性生殖器官肿瘤
前列腺癌(prostate cancer,PCa) 是我国老年男性发病率最高的恶性肿瘤,血清前列腺特异性抗原(prostate specific antigen,PSA)筛查是目前我国使用最广泛、临床认可度较高的筛查PCa方法之一,但PSA存在检测灰区(4~10 ng/mL),良性增生及外因损伤同样会导致其升高,进而降低检测准确性。
Jiang等[12]研究发现,LINC00673与Krueppel样因子4(Kruppel-like factor 4,KLF4)基因启动子区域结合,将甲基转移酶招募到KLF4基因启动子区,沉默LINC00673可降低KLF4基因启动子甲基化,从而提高KLF4蛋白的表达,抑制前列腺癌细胞的增殖和化疗抵抗。表明LINC00673作为促进PCa增殖的LncRNA,可被视为未来PCa治疗的靶点。
3 泌尿系统肿瘤
3.1膀胱癌(bladder cancer,BCA) BCA是最常见的泌尿道恶性肿瘤,目前缺乏早期的诊断标志物是BCA防治遇到的困境。研究证实甲基化转移酶METTL14介导m6A修饰,并可通过促进LncRNA DBET的表达,使其与FABP5相互作用,激活PPAR信号通路,促进了BCA的恶性进展[13-14]。在另一项研究中,研究者通过荧光素酶报告基因测定和m6A RIP检测发现,METTL3调控miR221/222的成熟,导致PTENmRNA和蛋白质表达水平降低,在膀胱癌中发挥致癌作用[15]。METTL14和METTL3的出现有望成为BCA诊断标志物。
3.2肾细胞癌(renal cell adenocarcinoma,RCC) RCC好发于60~70岁的男性,同样RCC缺乏早期的特异性诊断标志物。MiR-501-3p是肾细胞癌的潜在抑制因子,在癌性肾细胞和组织中通常被下调。既往研究表明,肾母细胞瘤1相关蛋白(Wilms tumor 1 associated protein,WTAP)是miR-501-3p的靶基因。敲低WTAP基因与miR-501-3p过表达类似,均可有效抑制RCC的发生,在此情况下RCC细胞中m6A修饰的水平均降低[16]。亦有研究发现miR-155直接结合至脂肪量和肥胖相关蛋白质(fat mass and obesity-associated protein,FTO) mRNA的3′-UTR上,并且降低了肾细胞癌细胞中FTO蛋白的水平,过表达miR-155可增强肿瘤细胞增殖和整体mRNA m6A修饰水平,同时以FTO依赖的方式抵抗凋亡[17]。miR-501-3p和miR-155或许可以成为RCC的特异性诊断标志物。
4 其他生殖泌尿系统肿瘤
4.1外阴癌(vulvar cancer,VC) VC按组织学形态可分为鳞状上皮细胞癌、疣状癌、腺癌、恶性黑色素瘤、基底细胞癌及外阴佩吉特病(paget disease of vulva,PDV)。其中外阴鳞状上皮细胞癌(vulvar squamous cell carcinoma,VSCC)占比为80%~90%,其好发于60岁以上的女性群体中。VSCC的发病因素主要有高危HPV依赖途径、非HPV依赖途径、地衣硬化和TP53基因突变。VSCC发病率仅为0.02‰,属于罕见病,目前关于VSCC预后生物学标志物的研究非常有限[18-19]。
目前病理检测尚无法解析VSCC与外阴硬化苔藓病(vulvar lichen sclerosus,VLS)、高级别外阴上皮内瘤变(vulvar intraepithelial neoplasia,VIN)之间的风险因素。意大利费拉拉大学的一项研究表明,干扰素调节因子6(interferon regulatory factor 6,IRF6)调节VLS向VSCC的发展,IRF6启动子的甲基化可能是VLS患者癌症风险的标志之一。在另一项关于视黄酸受体β(retinoic acid receptor β,RARβ)介导VLS向VSCC转化的研究中发现,高甲基化诱导的RARβ表达下调与VLS-VSCC相关,并与c-Jun上调相关。RARβ启动子甲基化程度随VLS-VSCC恶性程度的增加而增加。因此,RARβ基因异常可能在VLS-VSCC的进展中发挥作用,RARβ启动子甲基化状态可作为VLS-VSCC患者临床治疗的预后标志物[20]。
4.2睾丸癌(testicular cancer,TC) TC现有的血清肿瘤标志物包括α胎蛋白(α feta protein,AFP)、人绒毛膜促性腺激素β链(β chain human chorionic gonadotrophin,β-HCG)和乳酸脱氢酶(lactate dehydrogenase,LDH)等,均对TC的检测敏感性较低,在精原细胞瘤中的敏感性仅为20%。现阶段,基于TC均质性样本中ncRNA的检测分析有望成为其潜在的生物学标志物,部分前瞻性多中心临床研究发现,miR-371a-3p、miR-302/367在睾丸肿瘤和健康睾丸组织中的表达水平存在显著差异,且敏感性和特异性均超过传统的肿瘤标志物[21-22]。
睾丸生殖细胞瘤(germinal cell tumor of testis,TGCT)占TC病例的90%以上,TCGT的发病具有显著的地域差异,因放化疗产生的生殖毒性可导致患者生殖功能受损,所以获得了较高的关注度。TCGT表观遗传学方面的研究主要集中在DNA甲基化领域,特别是近年来关于ncRNA与生殖细胞分化相关基因调控有关的报道日趋增多,有望成为TGCT病程进展及治疗敏感性的监测指标[23]。
4.3阴茎癌(penile carcinoma,PeCa) PeCa较为罕见,治疗及检测方法在过去20年间的发展有限,其表观遗传机制相关的报道则更为少见,目前针对小样本范围内特定基因的研究显示ncRNA具有诊断潜能[24]。
张嘉宜等[25]通过回顾性分析发现miRNA-107是阴茎保留术预后的独立风险因素,可作为阴茎保留术预后的重要分子标志物,组织学分级与miRNA-107高表达的阴茎保留患者预后较差。miRNA-107具有成为PeCa诊断标志物的潜力。表1汇总了泌尿生殖系统肿瘤有关的m6A-ncRNA。
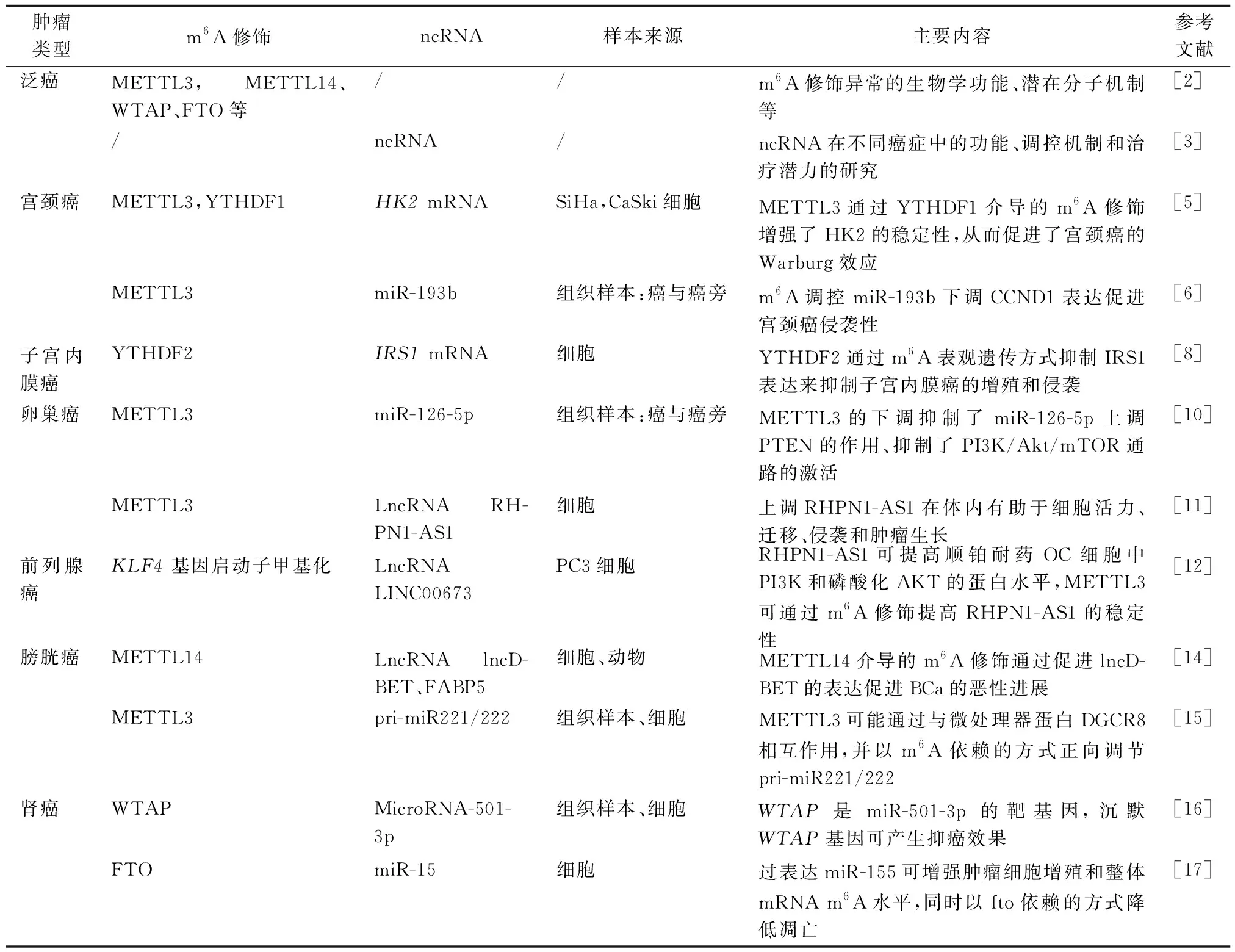
表1 泌尿生殖系统肿瘤m6A-ncRNA文献汇总
5 m6A检测技术及生物信息学应用
5.1m6A检测技术的研究进展 目前检测m6A的技术主要包括以下4大类型:基于抗体鉴定m6A位点,基于酶法鉴定m6A位点,基于化学法确定m6A位点和基于直接RNA测序鉴定m6A位点。
5.1.1基于抗体鉴定m6A位点原理的技术 主要包括甲基化RNA免疫沉淀测序(methylated RNA immunoprecipitation sequencing,MeRIP-seq)和m6A单核苷酸分辨率紫外交联沉淀(m6A individual-nucleotide-resolution cross-linking and immunoprecipitation,miCLIP-seq)。二者前期RNA富集步骤与免疫沉淀试验(Immunoprecipitation,IP)类似,相比于miCLIP-seq,MeRIP-seq只能检测到100~200个核苷酸长度的m6A修饰区,而miCLIP-seq的分辨率可达到单核苷酸,并且miCLIP-seq可以在同一峰值内检测多个m6A位点,重复性也比MeRIP-seq要高[26]。
5.1.2基于酶法鉴定m6A位点原理的技术 主要包括m6A敏感的RNA内切酶促进测序(m6A-sensitive RNA-endoribonuclease-facilitated sequencing,m6A-REF-seq)和MAZFER-seq。二者利用核大肠埃希菌毒素和RNA内切核糖核酸酶MazF的能力,特异性切割5′末端未甲基化的ACA基序,从而保留甲基化ACA基序完整。该方法具有精度高和RNA起始需求量少的特点,但是由于MazF酶在5′-UTR只对ACA基序有特异性,因此只能识别出16%~25%的甲基化位点[27]。
5.1.3基于化学法确定m6A位点原理的技术 主要包括m6A-label-seq和m6A-SEAL-seq(m6A selective chemical labelling sequencing)。m6A-label-seq通过标记整个转录组RNA的m6A位点,并将其转化为N6-烯丙基腺嘌呤(N6 allyl adenine,a6A),在逆转录过程中引入碱基突变,可以实现m6A的单碱基分辨率检测。m6A-SEAL-seq通过去甲基酶FTO将m6A转化为N6-羟甲基腺嘌呤(N6 hydroxymethyladenine,dm6A),在m6A位点标记生物素,通过链霉亲和素珠捕获,用高通量测序技术对富集m6A修饰的RNA片段进行m6A检测[28]。
5.1.4基于直接RNA测序鉴定m6A位点原理的技术 主要指第三代测序,包括Oxford公司的Nanopore和Pacific Biosciences公司的 Single Molecule Real-Time(SMRT)技术。SMRT技术的原理是将DNA聚合酶和模板结合,用荧光标记4种碱基,在碱基配对阶段,根据荧光的波长与峰值可判断碱基类型。Nanopore的原理是基于电信号而不是光信号的测序技术,该技术采用一种特殊的纳米孔,当DNA碱基通过纳米孔时,电荷发生变化,因每种碱基所影响的电流变化幅度不同,通过检测到电流变化,从而鉴定所通过的碱基。SMRT技术的原理是将DNA聚合酶和模板结合,用荧光标记4种碱基,在碱基配对阶段,根据荧光的波长与峰值可判断碱基类型[29]。
综上所述,基于化学法确定m6A位点的技术虽然不需要与抗体结合直接识别m6A位点,并且可以以更高的分辨率鉴定m6A位点,但缺乏化学计量信息;第三代测序成本过高;基于酶法鉴定m6A位点的技术虽然效率高,但特异性低。综合考虑成本和效率,与其他方法相比,尽管MeRIP-seq具有重复性低的缺点,但它仍然被大多数研究机构采用[26]。
5.2生物信息学的应用 随着生物信息学分析方法日趋成熟,越来越多的研究者贡献了包括基因组学、表观基因组学、cistromics、转录组学、蛋白质组学和代谢组学等具有研究价值的临床数据,各具特色的肿瘤数据库逐步完善,促进了泌尿生殖系统肿瘤领域的开拓探索。Dasgupta等[30]通过二代测序发现VSCC中存在195个高甲基化状态基因,且证实多数高甲基化基因参与转录调节活性。Singh等[31]通过生物信息学分析发现,LncRNA-H19在神经内分泌前列腺癌(neuroendocrine prostate cancer,NEPC)中丰度增加,沉默LncRNA-H19可恢复NEPC对雄激素剥夺疗法(androgen deprivation therapy,ADT)的敏感性,LncRNA-H19水平与接受ADT患者的复发、转移相关。Thuijs等[32]采用定量多重甲基化特异性PCR(quantitative multiple methylation-specific PCR,M-MSP)检测了患者VSCC、癌旁VIN组织、VIN随访期无进展及正常外阴组织的12个甲基化相关标志物,结果发现甲基化水平随病程进展显著升高,外阴癌变与DNA甲基化水平呈正相关,具备预测VIN向VSCC发展的潜能。Cheng等[33]在前列腺癌组织与癌旁组织间筛选出48个与总生存(overall survival,OS)相关的甲基化CpG位点,采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)进一步缩小至16个CpG位点并建立了风险评分公式,为PeCa预后生物学标志物的选择提供了新的研究思路。
6 结语
泌尿生殖系统肿瘤的研究受限于癌症种类、发病率及样本数量,出现了明显的两极分化现象,对于泌尿道罕见恶性肿瘤,其表观遗传学的研究不足,导致潜在诊断标志物的筛选困难。对于常见泌尿生殖系统肿瘤而言,例如AFP、PSA、β-hCG及LDH等经典生物学标志物在临床应用广泛,但它们的敏感性和特异性并不理想,导致在癌种的覆盖范围上仍然较为局限。CCA、EC的相关研究已经初步揭示了表观遗传变化,如DNA甲基化、m6A甲基化调控ncRNA等,均具有诊断、监测肿瘤发生、耐药及远端转移的潜能;在PCa的相关研究中,m6A相对比经典生物学标志物的准确性更高,这些研究或有望颠覆该领域现有的诊断路径和方法。但总体生殖泌尿系统肿瘤的m6A RNA修饰研究还处于探索阶段,未来应对m6A的作用机制进行深入研究,将m6A与临床经典生物学标志物联合分析患者的预后,开发探索特异性和灵敏度更高的m6A检测技术,为临床的精准诊断和治疗提供更多更可靠的依据。
